Nerve Growth Factor
Nerve Growth Factor (NGF)
Scoperta e proprietà del Nerve Growth Factor
di Pietro Calissano
Un organismo è costituito da miliardi di cellule, organizzate in tessuti e organi. Ognuna di queste cellule deve essere regolata in modo tale che la sua funzione si armonizzi con quella delle cellule vicine e di quelle più o meno lontane. Questa modulazione fine, necessaria sia nelle fasi di formazione di un organismo sia nell'adulto, viene esplicata da molecole che circolano nel sangue o nei fluidi che irrorano ogni distretto dell'organismo. In senso lato queste molecole vengono denominate messaggeri extracellulari in quanto la loro funzione è quella di portare segnali altamente specifici ad altrettanto specifiche popolazioni cellulari. I messaggeri extracellulari, in sostanza, svolgono il ruolo che in qualunque organizzazione sociale è svolto da tutte le maestranze addette alle comunicazioni all'interno di una struttura di lavoro più o meno estesa e organizzata. La loro quantità e il loro numero, quindi, sono anche in diretta funzione della dimensione di un organismo e della sua collocazione evolutiva.
La storia della scoperta di questi messaggeri extracellulari può essere riassunta in poche, grandi tappe: per primi sono stati identificati ormoni e vitamine, poi sono venuti i mediatori chimici che svolgono il ruolo specifico di neurotrasmettitori nell'ambito del sistema nervoso, infine sono stati identificati, dagli anni Cinquanta in poi, i fattori di crescita e le citochine. Ciascuna di queste sostanze svolge di solito funzioni così importanti che la mancanza di una di esse può essere la causa di malattie invalidanti e talvolta mortali. L'individuazione del primo fattore di crescita, denominato Nerve Growth Factor o NGF, si deve al lavoro pionieristico di R. Levi-Montalcini, che nel 1986 ha ricevuto il premio Nobel per la fisiologia o la medicina (v. oltre il suo contributo nei termini di autobiografia scientifica), alla quale si unì S. Cohen, che portò a termine la caratterizzazione del NGF e isolò un nuovo fattore denominato Epidermal Growth Factor o EGF. Da allora numerosi altri fattori di crescita sono stati identificati e isolati in forma pura. Non è azzardato affermare che la scoperta di questi fattori costituisce un avanzamento nelle nostre conoscenze nel campo biologico paragonabile a quello che si è verificato con l'identificazione del primo ormone o del primo neurotrasmettitore.
Il ruolo biologico di molti fattori di crescita, inoltre, è fortemente interconnesso con l'insorgenza di vari tipi di tumori; una mutazione nel gene che codifica la sintesi del fattore di crescita o del recettore corrispettivo può indurre una proliferazione incontrollata della cellula bersaglio con conseguente trasformazione da normale a neoplastica.
Se da un lato la scoperta del NGF ha aperto la strada alla ricerca e all'identificazione di fattori di crescita che agiscono su cellule non nervose, dall'altro ha suggerito che esistono proteine analoghe al NGF ma dotate di azione su altre popolazioni nervose. I fattori di crescita che appartengono alla famiglia del NGF, ma se ne distinguono per la diversità delle cellule bersaglio nervose, sono collettivamente denominati neurotrofine. La funzione del NGF e di altre neurotrofine consiste principalmente nel promuovere il differenziamento delle cellule bersaglio e nel garantirne la sopravvivenza una volta che abbiano raggiunto la piena maturazione strutturale e funzionale. Questa azione viene generalmente denominata con il termine trofismo. Nell'ultimo decennio gli studi sul NGF hanno dimostrato che il concetto di azione trofica deve essere interamente rivisto e inserito in una nozione che non è improprio definire rivoluzionaria nel campo biologico. Il termine trofico, infatti, era stato coniato numerosi decenni orsono e, come si è accennato, veniva attribuito ogniqualvolta una determinata sostanza si dimostrava capace di permettere la sopravvivenza di una popolazione di cellule. Numerosi ormoni, vitamine e altri messaggeri extracellulari di varia natura, compresi i fattori di crescita, sono dotati di questa azione. L'azione trofica, in sostanza, secondo questa concezione, consisteva nel 'far stare bene' le cellule bersaglio permettendone la sopravvivenza. Il termine vitamine, cioè amine vitali, per es., sottintendeva in modo esplicito questa funzione. Nell'ultimo decennio è emerso in modo inequivocabile che questa funzione trofica o vitale non sempre si esplica in modo per così dire 'attivo' ma, al contrario, consiste in un'azione inibitoria, nel tenere cioè sotto controllo un programma di morte che è presente nel DNA di ogni cellula: se questo programma viene attivato, perché viene a mancare il segnale inibitorio, numerosi geni e le corrispettive proteine intracellulari vengono attivati e in breve la cellula va incontro a morte per apoptosi (v. cellula, in questa Appendice). La funzione apparentemente contro natura di questo programma di morte è in realtà fondamentale per la vita di tutti gli organismi pluricellulari. Non appena, infatti, una cellula dimostra segni di anarchia, come la tendenza a proliferare senza controllo (primo e inequivocabile segno di una tendenza neoplastica), oppure di invecchiamento irreversibile, di solito in essa si attiva questo programma di morte che porta alla sua eliminazione senza che questo evento provochi danni al resto delle cellule vicine, come si verifica nel caso di morte cellulare per necrosi conseguente, per es., a un trauma o ad altre cause.
Anche nel sistema nervoso, che è formato da cellule che non possono più replicarsi, il programma di morte per apoptosi svolge un ruolo fondamentale sia nello sviluppo sia nell'adulto. Nei primi anni di vita postnatale il cervello è costituito da un numero circa doppio di neuroni rispetto a quelli presenti al termine dell'adolescenza: non tutti i neuroni, infatti, riescono a formare circuiti utili e funzionali con le cellule bersaglio; quelli che falliscono in questa fondamentale impresa debbono essere eliminati per evitare l'eccedenza numerica. A questo scopo provvede il programma di morte per apoptosi che si attiva in queste cellule tramite segnali di natura diversa. Tra quelli regolatori vi è anche il NGF, il quale inibisce l'attivazione del programma apoptotico che si scatena non appena questo fattore viene a mancare. Secondo un'ipotesi condivisa da molti neurobiologi, una delle cause di numerose malattie degenerative, fra le quali si annoverano anche le demenze senili, è la carenza, per motivi vari, di una o più neurotrofine come il NGF. La scoperta del NGF, in sostanza, ha aperto alcune strade di fondamentale importanza nella moderna neurobiologia: ha portato alla luce l'esistenza di una classe di molecole dotate di un'azione specifica nel promuovere il differenziamento e la sopravvivenza delle cellule bersaglio.
Questa scoperta, a sua volta, ha permesso di identificare alcuni dei meccanismi molecolari che provocano la trasformazione di cellule da normali a neoplastiche e ha contribuito in modo altrettanto essenziale a delucidare il meccanismo trofico di molti messaggeri extracellulari.
I precedenti scientifici
di Rita Levi-Montalcini
Nella seconda metà dell'Ottocento il sistema nervoso dei Vertebrati era una specie di terra inesplorata che incoraggiava e rendeva plausibili le più svariate ipotesi sulla sua struttura e funzione. La mancanza di specifiche tecniche istologiche che permettessero di porre in evidenza le cellule nervose incluse nella densa matrice dell'asse cerebro-spinale e i fasci di fibre che interconnettono le popolazioni stesse era uno dei motivi, se non il solo, del persistere del concetto mistico di un'organizzazione reticolare, acellulare, del sistema stesso, in un periodo nel quale invece la struttura cellulare degli altri tessuti animali non era più posta in dubbio. La scoperta di C. Golgi di un metodo di impregnazione selettiva delle cellule nervose con sali cromoargentici, e l'utilizzazione di questa tecnica da parte di S. Ramón y Cajal aprirono la strada allo studio della struttura del sistema nervoso. Si rivelò così quella che può considerarsi come la caratteristica essenziale di questo sistema, e cioè di essere costituito da migliaia di popolazioni cellulari, differenti nella ontogenesi, struttura e ruolo funzionale. Ogni aggregato cellulare (designato come nucleo di forma ovoidale o circolare, quando consiste di cellule addensate le une vicino alle altre in formazioni ben distinte da quelle di cellule limitrofe, o come strato se le cellule sono delineate a spalliera, le une in prossimità delle altre come nella corteccia cerebellare dei Vertebrati) si sviluppa secondo un programma genetico che è singolarmente simile per la stessa popolazione appartenente a individui di specie differenti. È perciò possibile ottenere informazioni sulla neurogenesi e sul piano strutturale di determinati centri nervosi in forme filogeneticamente più evolute studiando le stesse popolazioni cellulari in Vertebrati inferiori. Dato che in questi ultimi il piano strutturale è assai più semplice, le stesse popolazioni si prestano all'indagine morfologica e funzionale meglio che in organismi più complessi.
L'introduzione, dalla fine del secolo 19°, da parte di grandi maestri quali W. Roux e H. Driesh di tecniche sperimentali utilizzate nella manipolazione di embrioni di Vertebrati inferiori (pesci e anfibi) apriva nuovi approcci alla conoscenza dei fattori preposti allo sviluppo dei differenti tessuti e organi degli organismi oggetto di studio dal periodo prenatale a tutti gli stadi successivi. Un esperimento condotto da H. Spemann dimostrava che il cristallino oculare in larve di anfibi si formava grazie all'azione esercitata dalla vescicola ottica sovrastante il tessuto epidermico. Il fenomeno, che divenne noto come induzione, si sarebbe tuttavia imposto all'attenzione della comunità scientifica con il secondo esperimento di H. Mangold e H. Spemann eseguito nel 1924. Gli autori dimostrarono che la formazione della placca neurale è indotta dal tessuto mesodermico sottostante definito in seguito come organizzatore. Una placca neurale così indotta dà origine a un secondo embrione formato dal tessuto dell'ospite. La speranza di identificare la natura chimica dell'organizzatore non venne tuttavia realizza- ta. In questo stesso periodo l'embriologia sperimentale diede origine al ramo collaterale della neuroembriologia che si avvalse delle stesse tecniche e degli strumenti introdotti da Spemann. L'obiettivo di tali ricerche era quello di elucidare il ruolo dei tessuti periferici nello sviluppo dei centri nervosi deputati alla loro innervazione.
Le larve di anfibi, già utilizzate nell'embriologia sperimentale, diventarono materiale d'elezione per questo tipo di ricerca grazie alla loro facile reperibilità. Con l'esecuzione di trapianti omo- ed eteroplastici in esemplari di questa specie, i neuroembriologi si proponevano di saggiare la capacità del sistema nervoso in via di sviluppo e di stabilire connessioni con tessuti differenti da quelli dell'ospite e, allo stesso tempo, determinare se, e in quale misura, i centri nervosi e le fibre in via di accrescimento si sarebbero adeguati alle differenti dimensioni geometriche e configurazione somatica di questi tessuti e organi di diversa provenienza. I risultati misero in luce la notevole flessibilità da parte del sistema nervoso larvale di adattarsi alle nuove situazioni ideate dallo sperimentatore. L'eminente embriologo americano R.G. Harrison riportò i risultati conseguiti nella Cronian Lecture nel 1935, suscitando le speranze dei neuroembriologi di poter elucidare i meccanismi intrinseci ed estrinseci che intervengono nello sviluppo del sistema nervoso.
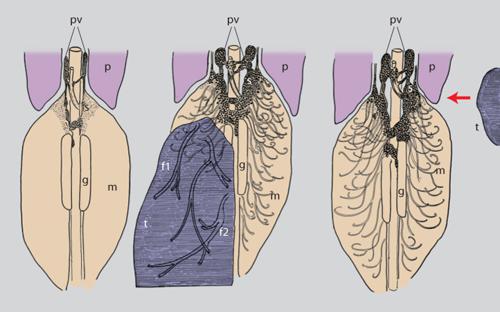
Un allievo di Spemann, V. Hamburger, sostituì alle larve di anfibi gli embrioni di pollo, che presentavano il vantaggio di una maggiore definizione delle varie componenti di questo sistema nervoso in via di sviluppo. In un articolo pubblicato nel 1934 descrisse gli effetti provocati dall'ablazione dell'abbozzo di uno dei due arti inferiori in embrioni di tre giorni. Le sue ricerche ebbero come oggetto lo studio della colonna motoria nel midollo spinale che innerva l'arto. L'esame istologico eseguito cinque giorni dopo l'intervento mise in evidenza una pressoché totale assenza di cellule motorie che in condizioni normali innervano l'arto. L'autore interpretò tali risultati come conseguenti a una mancata induzione da parte delle prime fibre nervose che avevano stabilito un contatto con i tessuti periferici sulle cellule indifferenziate del centro motorio. Venuta a conoscenza, nel 1940, di questo articolo, chi scrive decise di studiare il fenomeno avvalendosi della sua esperienza neurologica e competenza delle tecniche istologiche all'argento ridotto, che permettono di evidenziare le cellule nervose e le loro fibre durante tutte le fasi dello sviluppo, da quello embrionale allo stadio adulto. L'esperimento consisteva nell'amputazione della gemma dell'arto superiore o inferiore tra il secondo e il terzo giorno di incubazione dell'embrione di pollo. L'illustrazione riportata in un articolo pubblicato nel 1942 dimostrava che il nervo misto sensitivo motore, privato del territorio di innervazione (l'arto), formava a livello dell'amputazione un grosso gomitolo di fibre (neuroma) (fig. 1).
Negli embrioni sezionati serialmente ed esaminati al microscopio ottico dopo l'intervento, si era potuto osservare che la colonna motoria era estremamente ridotta e i gangli spinali sensitivi destinati all'innervazione dell'arto amputato erano di volume molto inferiore a confronto di quelli controlaterali che innervano l'arto (fig. 2).
L'esame istologico condotto ogni 3÷4 ore dopo l'intervento dimostrava che le cellule nervose andavano incontro a un inizio di differenziamento come quelle preposte all'innervazione dell'arto controlaterale. Seguiva un arresto dei processi differenziativi e atrofia che culminava nella morte delle cellule private del tessuto di innervazione. La morte era causata dunque dalla mancanza di un fattore trofico e non, come aveva ipotizzato Hamburger, da un mancato fattore di natura induttiva. I risultati riportati in articoli pubblicati negli anni 1942-44 dall'Accademia Pontificia e in prestigiose riviste scientifiche svizzere e belghe (le leggi razziali impedivano la pubblicazione da parte di autori non appartenenti alla razza definita 'ariana' su riviste italiane) vennero a conoscenza di Hamburger. In questi lavori si prospettava l'ipotesi che i tessuti periferici rilasciassero fattori umorali necessari allo sviluppo delle cellule nervose preposte alla loro innervazione. In successive ricerche (condotte a Torino, poi nel laboratorio di Hamburger alla Washington University di St. Louis, Missouri) chi scrive estendeva lo studio del fenomeno migratorio di intere popolazioni cellulari e allo stesso tempo dimostrava che la morte di un imponente numero di cellule nervose in stadi precoci del loro differenziamento non è soltanto la conseguenza della deprivazione del territorio di innervazione, ma si attua anche in popolazioni di cellule nervose di embrioni non sottoposti ad ablazione chirurgica. La componente del sistema nervoso centrale in embrioni in fase precoce di sviluppo, cioè in embrioni di pollo al quarto giorno di incubazione, è stata l'oggetto di studio, effettuato ricorrendo alla tecnica mutuata dalla cinematografia che consiste nella ricostruzione di una sequenza di fotogrammi che nel loro complesso permettono di visualizzare il movimento degli oggetti in esame. Nel caso in questione si trattava dell'analisi di sezioni istologiche di intere popolazioni nervose che, se esaminate singolarmente e a lunga distanza temporale, non permettevano la ricostruzione di fenomeni dinamici nei processi caratteristici dei periodi precoci della neurogenesi. Si evidenziava l'intensa attività migratoria di cellule nervose ai primi stadi di sviluppo e la drammatica degenerazione e morte, nell'arco di poche ore, di intere popolazioni nervose. I processi migratori sia nell'uno sia nell'altro caso sono programmati in modo così preciso nello spazio e nel tempo da rendere possibile predire il giorno e l'ora nei quali una determinata popolazione nervosa inizierà la sua migrazione, gli stadi intermedi e quando sarà portata a termine.
Le migrazioni avvengono secondo due modalità: lungo traiettorie lineari e ben definite o in massa. Le prime si verificano in popolazioni costituite da un numero limitato di cellule quali i nuclei dei nervi encefalici o di nervi motori della colonna spinale, viscerali e somatici (fig. 3). Questi movimenti si attuano lungo linee singole come eserciti di formiche o termiti, l'uno dietro l'altro. Gli altri consistono nella migrazione di centinaia di migliaia di cellule nella corteccia cerebellare e altri centri cefalici, e richiedono un lasso di tempo che va dai tre ai quattro giorni. Le cellule si muovono in massa coprendo anche grandi distanze, simili alla migrazione di uccelli o di locuste.
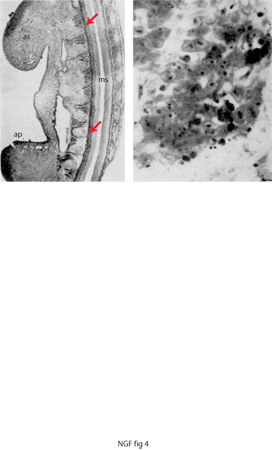
Il fenomeno della morte cellulare naturale, interpretato all'atto della sua scoperta come di natura degenerativa, sarà poi considerato come un processo programmato da geni che verranno identificati molti decenni più tardi. Tale osservazione scaturì dallo studio dei processi neurogenetici nell'embrione di pollo al quarto giorno di incubazione. Circa due terzi delle cellule della colonna motoria del midollo spinale a livello cervicale, che sino a quel momento non differivano dalle cellule della stessa colonna motoria ad altri livelli spinali, denotavano segni di alterazioni morfologiche, quali la scomparsa della membrana delineante il nucleo e la diminuzione del volume del corpo cellulare, quest'ultima definita di natura picnotica. Le cellule in via di degenerazione assumevano un colore intenso che le differenziava dalle poche residue intatte. La loro eliminazione, per opera di macrofagi, poteva essere osservata attraverso gli oculari qualche ora dopo e faceva pensare alla rimozione di cadaveri a opera di reparti di addetti ai lavori di ripulitura. Poche ore più tardi, non vi era più traccia di detriti cellulari (fig. 4).
Studi condotti molti decenni dopo, utilizzando le tecniche della biologia molecolare molto più sofisticate di quelle allora a disposizione, hanno messo in evidenza che la morte cellulare non è un fenomeno passivo, ma attivo, e cioè un suicidio programmato e attuato in base all'attivazione di geni preposti all'autodistruzione. Sull'importanza di questo fenomeno, noto come apoptosi, e sul suo significato biologico, v. oltre.
La scoperta che il prodotto finito è la risultante dell'eliminazione di popolazioni eccedenti il fabbisogno e della migrazione di altre, alle quali erano assegnate funzioni differenti da quelle di popolazioni derivate da una comune matrice, rivelava la dinamica dei processi neurogenetici del sistema nervoso.
Dal grembo di tessuti maligni la nascita del fattore nervoso di crescita (NGF)
"Le cellule normali sono programmate sia per rispondere in modo organizzato e preciso a una larga varietà di stimoli, sia per non rispondere a altri stimoli [...]. Le cellule del cancro sono come dei disperati nella società dell'organismo, e rispondono in modo sbagliato" (Luria 1987, p. 55). Ai 'disperati', come definiti in senso antropomorfico da S. Luria, dobbiamo due inestimabili doni:
1) la scoperta che certi virus provocano tumori, in quanto portano in sé degli oncogeni, che possono essere considerati come "geni andati a male". Questi oncogeni trasformano la cellula normale in cellula cancerosa, modificando la loro risposta agli stimoli che ne regolano la crescita. Come espresso dallo stesso Luria: "Studiando gli oncogeni si cominciano a esplorare le reti di comando che in ogni cellula controllano la funzione dei vari geni. Durante lo sviluppo dell'organismo queste reti di comando decidono quali geni funzionano e quando, e così decidono che posto ciascuna cellula e i suoi discendenti prenderanno nel piano dell'intero organismo" (Luria 1987, p. 58);
2) la scoperta che cellule maligne di topo del tipo noto come Sarcoma 180 (S 180) sintetizzano e rilasciano in circolo una molecola che svolge un ruolo essenziale nel differenziamento e nella funzionalità di due stipiti di cellule nervose sensitive e simpatiche.
Si apriva così in modo del tutto fortuito e imprevedibile un nuovo capitolo della biologia. Comune a entrambi i 'doni' è non soltanto il fatto che né l'uno né l'altro potevano essere previsti, ma che tutti e due hanno svelato quanto non sarebbe mai venuto alla luce dall'esplorazione dei processi normali alla base dello sviluppo e funzione delle cellule di tutti gli organismi viventi.
I modici effetti provocati da innesti di arti od organi soprannumerari sui gangli e sul sistema nervoso centrale dell'embrione ai primi stadi di sviluppo sembravano giustificare il concetto espresso da uno dei più noti neuroembriologi di quei decenni, P.A. Weiss, che "i fattori estrinseci non esercitano un'azione determinante sullo sviluppo e grandezza dei neuroni in senso assoluto, ma si limitano a stimolare o deprimere questi processi entro limiti notevolmente circoscritti" (in Analysis of development, 1955, pp. 346-401). Negli stessi anni un fenomeno scoperto per puro caso portava a una revisione del punto di vista sopra espresso e apriva allo stesso tempo un nuovo settore di ricerca. Questo fenomeno venne descritto in un articolo pubblicato nel 1948 dal biologo americano E.D. Bueker.
L'autore innestò cellule del tipo Sarcoma 180, prelevate da differenti tumori di topo, alla base della gemma di uno degli arti in embrioni al terzo giorno di incubazione. Gli embrioni di pollo portatori del trapianto neoplastico furono fissati ed esaminati istologicamente qualche giorno più tardi. Bueker notò che il frammento tumorale era innervato da fibre sensitive provenienti dai gangli spinali adiacenti al trapianto. Poiché i gangli stessi apparivano di volume poco maggiore di quelli controlaterali, ne dedusse che l'effetto era dovuto alla rapida espansione del tumore che metteva a disposizione delle fibre nervose sensitive un territorio più ampio e quindi favorevole alla ramificazione delle fibre nervose.
L'esperimento ripetuto da chi scrive confermò quanto riportato dall'autore, ma allo stesso tempo mise in evidenza altri aspetti del fenomeno che prospettavano un'interpretazione differente rispetto a quella da lui suggerita. L'applicazione delle tecniche istologiche all'argento ridotto e l'estensione dell'analisi all'intero periodo di sviluppo in embrioni portatori dell'innesto di Sarcoma 180 e sezionati serialmente rivelarono la straordinaria atipicità degli effetti provocati dall'innesto del tessuto neoplastico.
Questo esperimento era stato motivato da due considerazioni. La prima verteva sul fatto che, a differenza di un abbozzo d'arto formato da differenti stipiti cellulari, il tumore consta di cellule omogenee e a rapida proliferazione. La seconda si basava sulla scoperta della possibilità di trapiantare i tumori di mammiferi sulla membrana corio-allantoidea di embrioni di pollo, avvalendosi del fatto che il sistema immunitario non è ancora sviluppato e non si verifica il rigetto di tessuti normali o neoplastici di specie differenti. Questo aveva incoraggiato lo studio dello sviluppo dei tumori e della possibile inibizione mediante trattamento con agenti chimici (fig. 5).
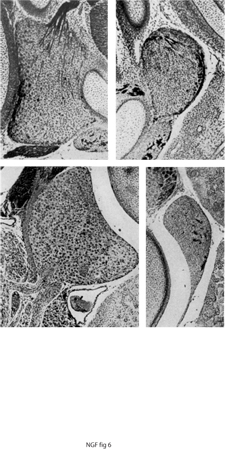
All'esame istologico degli embrioni portatori degli innesti di natura neoplastica, si poté osservare attraverso gli oculari del microscopio un fenomeno che apparve subito di eccezionale interesse. Tra le cellule tumorali, che si erano sviluppate in una formazione nodulare che protrudeva nella cavità addominale dell'embrione portatore dell'innesto, si intrecciavano in ogni direzione fasci di fibre nervose che spiccavano per la loro colorazione. I fasci di fibre si dividevano e si ramificavano tra le cellule scorrendo tra queste come rivoli d'acqua tra i ciottoli di un greto pietroso. Le fibre originavano dai gangli simpatici della catena paravertebrale e dai gangli prevertebrali deputati all'innervazione dei visceri e in misura minore dai gangli sensitivi adiacenti al tessuto neoplastico. Le fibre nervose sia sensitive sia simpatiche vagavano distribuendosi in modo casuale tra le cellule neoplastiche senza tuttavia stabilire contatti sinaptici con nessuna di esse (fig. 6).
L'aumento numerico delle cellule nervose dei gangli sensitivi e simpatici fu inizialmente ritenuto conseguente all'aumentata attività proliferativa. Soltanto molti anni dopo si sarebbe realizzato che tale fenomeno era conseguente non a un fatto proliferativo, ma alla inibizione di un processo di morte programmata, anche noto come morte naturale, che in condizioni fisiologiche determina l'eliminazione di un'alta percentuale di cellule nervose prodotte in numero eccedente il fabbisogno dell'organismo. L'effetto iperplastico, e cioè l'aumento in volume di ogni cellula nervosa, fu interpretato e confermato in seguito come dovuto all'attivazione da parte di un fattore rilasciato dalle cellule neoplastiche. Il modo caotico di ramificazione e la distribuzione atipica delle cellule nervose tra le cellule maligne denunciavano l'anormalità del fenomeno e smentivano l'ipotesi, prospettata da Bueker, che l'effetto osservato derivasse dal fatto che il tessuto neoplastico metteva a disposizione delle fibre un'area da innervare di maggiore estensione della gemma d'arto. Si poté formulare l'ipotesi che i tessuti neoplastici rilasciassero un fattore umorale responsabile dell'effetto osservato.
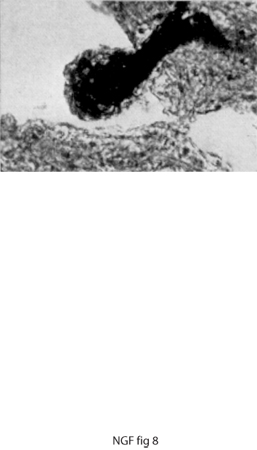
In una serie di esperimenti successivi, chi scrive innestò, con la stessa tecnica utilizzata in precedenza, frammenti di un tumore di origine simile al Sarcoma 180, ma notevolmente più invasivo, noto come Sarcoma 37 (S37). Quest'ultimo provocava gli stessi effetti del S180, tuttavia negli embrioni si verificò un fatto nuovo e stupefacente: gangli simpatici a notevole distanza dal tumore e nell'impossibilità di stabilire contatto con il tessuto neoplastico andavano incontro a uno straordinario aumento in volume, simile a quello dei gangli che innervavano il tumore stesso. Le fibre soprannumerarie prodotte dai gangli simpatici invadevano in modo caotico e anomalo gli organi che, in condizioni normali, a questo stadio dello sviluppo embrionale non erano ancora innervati e non stabilivano rapporti sinaptici con le cellule degli organi, infrangendo il principio basilare che stabilisce di norma un contatto diretto tra fibre nervose e cellule innervate. L'atipicità dell'effetto provocato dall'innesto del S37 era messa in evidenza dal fatto che le fibre simpatiche non solo invadevano i visceri, ma perforavano la tunica dei vasi sanguigni penetrando all'interno di piccole e grandi vene. Superata la parete vascolare essi protrudevano come grossi gomitoli fibrosi (definiti, in termini neuropatologici, neuromi) che fluttuavano all'interno dei vasi (figg. 7 e 8).
Questo effetto era una prova irrefutabile che le cellule neoplastiche rilasciavano un fattore umorale che alterava i normali processi differenziativi delle cellule nervose simpatiche recettive alla sua azione. Allo stesso tempo il reperto di fibre simpatiche entro il lume delle vene dell'embrione parve indicativo di un'azione neurotropica esercitata dalla sostanza rilasciata dalle cellule neoplastiche nel circolo. Ai fini di ottenere una definitiva conferma dell'ipotesi che i tumori producessero e rilasciassero una sostanza umorale responsabile degli effetti descritti, venne innestato il tumore non nel tessuto embrionale, ma sulla membrana corio-allantoidea. Com'è noto le sostanze nutritive del tuorlo d'uovo pervengono all'organismo in via di sviluppo tramite il circolo sanguigno che decorre nella membrana extraembrionale (corio-allantoidea) e, attraverso i vasi convergenti verso l'embrione a livello ombelicale, porta ai tessuti il sangue ricco degli elementi nutritivi. In questa serie di esperimenti il tessuto neoplastico e quelli embrionali condividevano la circolazione, ma non avevano alcun rapporto diretto con l'uno e con l'altro (fig. 9).
Nel dicembre del 1951, questi risultati furono oggetto di una relazione alla New York Academy of Sciences in un simposio dal titolo The chick embryo in biological research (Levi-Montalcini 1952), ma non suscitarono nella comunità scientifica particolare interesse, in quanto il fenomeno non poteva essere interpretato in base ai dogmi correnti.
Dopo aver scoperto che i tumori maligni S180 e S37 rilasciavano un fattore umorale che provocava gli effetti descritti, si trattava ora di affrontare la difficoltà di identificare il fattore stesso. Presa la decisione di ricorrere al metodo di coltura dei tessuti in vitro appreso a Torino dal grande istologo G. Levi, fu necessario trasferire le ricerche a Rio de Janeiro, all'Istituto di biofisica diretto da C. Chagas. Esperimenti condotti nel reparto di colture in quella sede diedero risultati di eccezionale interesse.
Frammenti di questi tumori, previo il loro innesto in embrioni di pollo, venivano trapiantati in mezzi di coltura semisolidi in prossimità di gangli sensitivi e simpatici di embrioni di otto giorni. Dalle cellule di questi gangli, coltivati per 24 ore in vitro, in prossimità, ma non a diretto contatto, di frammenti di S180 o S37, si diramava un fittissimo alone di fibre nervose a forma di raggiera. Gangli coltivati soli o in presenza di altri tessuti normali o neoplastici danno origine in questo breve periodo a un alone di cellule fibroblastiche con pochissime fibre nervose.
Dopo la conferma insperata dell'ipotesi, chi scrive così riportò l'effetto illustrandolo con disegni a penna a margine della lettera inviata, in data 15 dicembre 1952, a Hamburger: "Le fibre dal lato prospiciente il tumore sono così fitte e numerose da apparire come parte di un tessuto in cui non è possibile distinguere le singole componenti. Anche più interessante il fatto che un simile effetto, sebbene meno clamoroso, è prodotto dall'aggiunta al mezzo di coltura dell'estratto dei tumori cresciuti nell'embrione di pollo". Nei gangli coltivati per un periodo più lungo, due o tre giorni anziché ventiquattro ore, le fibre dal lato prospiciente il frammento di tumore non soltanto erano molto più dense che dal lato opposto, ma era ben evidente il loro orientamento verso il tessuto neoplastico (fig. 10).
Tale reperto venne interpretato come indicativo di un effetto neurotrofico e neurotropico. I risultati conseguiti furono tuttavia turbati da un dubbio. Quale era la prova che questo effetto in vitro, così diverso da quello indotto dai due tumori maligni in embrioni di pollo, fosse provocato dallo stesso fattore rilasciato in vivo dalle cellule neoplastiche? Non rimaneva che ricorrere a due prove indirette:
1) controllare se tumori innestati in embrioni che non producevano l'effetto ipertrofico e iperplastico nei gangli sensitivi e simpatici non inducevano la formazione dell'alone fibrillare in vitro;
2) verificare la possibilità che altri tessuti, oltre a quelli di S180 e S37, inducessero in vitro la formazione dell'alone fibrillare pur essendo destituiti della capacità di promuovere la crescita di fibre nervose dagli stessi gangli in embrioni in via di sviluppo.
I risultati della prima serie di esperimenti furono conformi alle speranze: adenocarcinomi di topo, il sarcoma Rous di ratto e altri tumori che attecchivano e crescevano rigogliosamente in embrioni di pollo, non erano innervati da fibre provenienti dai gangli dell'embrione ospite né determinavano un aumento di volume dei gangli stessi. Il loro abbinamento in vitro con gangli sensitivi o simpatici non provocava la formazione di aloni fibrillari attorno a questi. Chi scrive decise allora, come ulteriore prova, di coltivare in vitro frammenti di tessuti normali di topo: tessuto cardiaco o sottocutaneo in prossimità degli stessi gangli. I tessuti di topolino, in modo meno pronunciato ma sostanzialmente simile ai frammenti di S180 e S37, inducevano la crescita dai gangli di fibre nervose particolarmente fitte dal lato prospiciente questi tessuti. L'effetto indotto da trapianti di sarcoma di topo era considerato da chi scrive non soltanto del tutto atipico, ma presumibilmente prodotto da un virus liberato dalle cellule neoplastiche che avrebbe trasformato le cellule nervose normali in cellule cancerose (figg. 11 e 12).
Le ricerche condotte nelle settimane seguenti furono dirette a paragonare gli effetti in vitro dei due tumori e quelli dei tessuti normali prelevati da topolini. Gli esperimenti condotti in quei mesi dimostrarono in modo irrefutabile che gli effetti indotti dai due tumori in vitro erano provocati dallo stesso fattore umorale descritto negli embrioni di pollo in via di sviluppo.
Al ritorno a St. Louis nel febbraio 1953, la collaborazione del giovane chimico S. Cohen con il nostro gruppo consentì l'identificazione chimica della frazione tumorale attiva estratta dai tumori in una molecola nucleoproteica. Questa frazione nel 1954 fu denominata Nerve Growth Promoting Factor e in seguito, con la forma tuttora in uso, Nerve Growth Factor (o NGF) per via delle sue proprietà di stimolare la crescita di due stipiti di cellule nervose embrionali. Rimaneva da accertare se l'attività fosse esplicata dall'intera frazione nucleoproteica o da una delle due componenti: nucleica o proteica.
Macro e micro sorgenti
In biologia, forse in misura maggiore che in qualsiasi altro settore scientifico, il caso e la buona sorte esplicano un ruolo importante; non è solo questione, come spesso si dice, di serendipità, o della percezione di una verità che è lì da sempre ma non viene afferrata fino a che la mente dell'osservatore improvvisamente non ne prende coscienza. Si tratta piuttosto di una fortuita scoperta di una cava di pietre preziose che non ci si aspettava di trovare.
Quando Cohen utilizzò il veleno di serpente per purificare ulteriormente il fattore tumorale non prevedeva, né avrebbe potuto, l'esito di questo esperimento. Il veleno consiste di un numero notevole di sostanze citolesive e altamente tossiche. La presenza nel veleno dell'enzima fosfodiesterasi, che degrada gli acidi nucleici, suggerì a Cohen l'utilizzo del veleno. Se gli acidi nucleici fossero stati una componente essenziale del NGF, la loro degradazione enzimatica avrebbe dovuto annullare l'attività biologica del fattore neoplastico identificato in una sostanza nucleoproteica; se al contrario l'attività fosse persistita, avrebbe significato che responsabile dell'effetto sulla crescita doveva essere la componente proteica e non quella nucleoproteica. Né la prima, né la seconda ipotesi furono convalidate dagli esperimenti condotti. L'esame delle colture di gangli coltivati in un mezzo contenente sia l'estratto tumorale ad azione NGF sia il veleno di serpente svelò un effetto del tutto imprevedibile. L'alone di fibre nervose che irradiava dai gangli era centuplicato a paragone di quelli coltivati in presenza del solo fattore tumorale. Si prospettavano due possibili spiegazioni del fenomeno: il veleno aveva rimosso un inibitore e in tal modo aveva enormemente potenziato l'effetto prodotto dalla frazione tumorale, o il fattore NGF era presente in alta quantità nel veleno di serpente. Ventiquattro ore più tardi era confermata la seconda ipotesi. In colture contenenti quantità minime di veleno si era prodotto un densissimo alone di fibre nervose attorno ai gangli. Da questa insperata e imprevedibile nuova sorgente di NGF Cohen isolò il fattore NGF che risultò presente in misura di gran lunga maggiore che nell'estratto dei due tumori di topo. Iniezioni del NGF, estratto e purificato dal veleno di serpenti, in embrioni di pollo tra il quarto e l'ottavo giorno di vita provocavano un effetto identico a quello ottenuto innestando frammenti di S180 e S37 in embrioni di pollo al terzo giorno di incubazione. L'identità degli effetti provocati dal sarcoma e dal veleno di serpente sia in esperimenti in vitro che in vivo dimostravano che il fattore estratto dal veleno e dal tumore erano della stessa natura. Venivano refutate allo stesso tempo due ipotesi: la prima che la proprietà di sintetizzare e rilasciare il fattore NGF fosse una prerogativa di tessuti neoplastici; la seconda che il fattore potesse essere di natura virale.
La scoperta tanto fortunata quanto accidentale che due tumori maligni di topo e il veleno di serpente fossero dotati della proprietà così singolare di stimolare il differenziamento di cellule nervose provenienti da una comune matrice, la cresta neurale, e di promuovere la crescita delle loro fibre faceva ritenere del tutto improbabile che questa proprietà fosse limitata a tessuti e fluidi così distanti l'uno dall'altro quali quelli citati.
Le ghiandole salivari sottomascellari dei topi maschi adulti furono le prime a essere saggiate come presunte sorgenti del fattore NGF. Queste ghiandole sono le sole tra quelle dei mammiferi a esercitare un'azione tossica paragonabile a quella del veleno di serpente.
Al di là di ogni aspettativa le ghiandole salivari di topo dimostrarono di essere la terza e di gran lunga la più cospicua sorgente di NGF. La scoperta di imponenti quantità di NGF nelle ghiandole salivari sottomascellari del topo maschio adulto diede un eccezionale impulso alle ricerche.
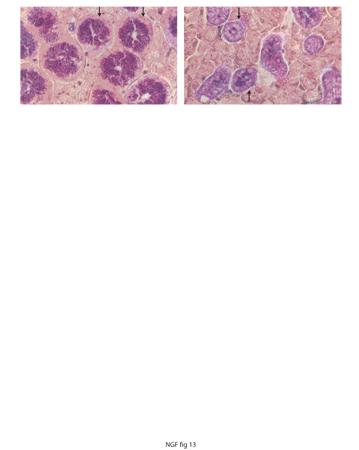
Tra i molti problemi che si prospettavano tre apparivano prioritari: identificare la natura chimica del NGF ed elucidarne il meccanismo d'azione; analizzare il suo spettro di azione in organismi in via di sviluppo e adulti; chiarire se e quale funzione svolgesse il NGF in quantità così ingente nelle ghiandole salivari di topo. Il NGF estratto dalle ghiandole salivari permise inoltre di identificare questo fattore in una molecola proteica di peso intorno a 44.000. Nel 1971 altri autori definirono la struttura della molecola NGF. L'alta quantità di NGF estratto dalle ghiandole salivari murine rese possibile saggiare l'effetto non soltanto nell'embrione di pollo, ma in animali neonati e adulti. Il topo per le sue minute dimensioni e facilità di allevamento in laboratorio divenne l'oggetto favorito di questi esperimenti. Come già evidenziato da altri autori la ghiandola salivare murina presenta un forte dimorfismo sessuale nella componente tubulare della ghiandola salivare di topo maschio adulto che prospettò una duplice natura di queste ghiandole. Studi condotti nel nostro laboratorio misero in evidenza che il NGF viene sintetizzato in questa componente tubulare (fig. 13). Nei roditori tale componente durante la pubertà va incontro a uno sviluppo assai più marcato nel maschio piuttosto che nella femmina e la differenza si accentua nei periodi successivi fino a raggiungere il massimo nell'animale adulto.
La scoperta della sintesi di NGF in piccole quantità nel sarcoma di topo, in grande quantità nel veleno di serpente e nelle ghiandole salivari di topi maschi adulti, suggerì di saggiare altri tessuti in colture in vitro, come possibili micro o macro sorgenti del NGF. Il significato di tale scoperta sarebbe stato elucidato trent'anni dopo, quando si comprese l'azione esplicata dal NGF nei processi patologici di infiammazione (fig. 14).
Attività neurotrofica
Sin dalla sua scoperta la molecola NGF, estratta e purificata dalla ghiandola salivare di topo maschio adulto, fu a disposizione dei biochimici e dei biologi in quantità dell'ordine di milligrammi e cioè in quantità migliaia di volte maggiore rispetto a quella estratta dai tumori S180 e S37. Divenne quindi possibile estendere le ricerche sull'attività neurotrofica di questo fattore non soltanto agli embrioni di pollo, ma anche ai mammiferi, in prevalenza neonati e adulti.
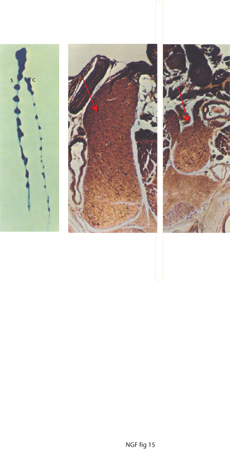
L'iniezione sottocutanea di NGF purificato (dosi da 15 a 20 μg per grammo di peso di NGF) per un periodo di 10 giorni provocava un aumento dei gangli simpatici delle catene para e prevertebrali anche più imponente di quello che avveniva negli embrioni di pollo. I gangli raggiungevano un volume pari a 10-12 volte quello dei gangli di controllo in animali neonati (roditori) (fig. 15).
L'ipertrofia e iperplasia delle cellule simpatiche in roditori neonati e in altre specie trattati con NGF è a sua volta causa di un'imponente iperinnervazione degli organi e dei tessuti periferici. Sembrava che gli animali trattati non traessero alcun vantaggio da questo eccezionale aumento del sistema di controllo della vita vegetativa, anzi, i risultati conseguiti nella prima serie di esperimenti nel 1958 fecero sospettare un effetto nocivo. Si notò, infatti, una forte riduzione nella crescita degli animali da esperimento concomitante a curiose aberrazioni somatiche quali l'apertura precoce della rima palpebrale e l'eruzione precoce degli incisivi. Una iperinnervazione, questa, che tuttavia non rivestiva carattere di anormalità, al contrario di quanto riscontrato in embrioni di pollo sottoposti all'azione del NGF (fig. 16).
La funzione vitale del NGF nel sistema nervoso periferico
La prova del ruolo chiave svolto dalla molecola NGF fu ottenuta nel 1959 in base a esperimenti diretti a saggiare l'azione di antisiero specifico contro il NGF sullo strato delle cellule nervose simpatiche. L'antisiero preparato da Cohen con le consuete tecniche immunologiche fu iniettato in topolini tra il primo e il terzo giorno di vita. L'ispezione istologica, eseguita giorni, settimane e mesi dopo il trattamento, dimostrò che i gangli simpatici erano ridotti a noduli sclerotici consistenti di cellule gliali e di un numero esiguo di cellule nervose in avanzato stato atrofico.
Il fenomeno, reso noto nel 1960 con il termine immunosimpatectomia, fu introdotto nella letteratura scientifica per designare l'effetto della distruzione delle cellule nervose simpatiche ottenuta con la somministrazione di un anticorpo specifico contro il NGF ad animali neonati. Una conferma di questo ruolo venne dall'osservazione che il NGF prodotto nei tessuti e negli organi periferici viene trasportato per via retrograda fino ai neuroni innervanti, che vanno incontro a morte qualora questo trasporto sia impedito. Questi studi segnarono l'inizio del periodo più fertile e produttivo delle ricerche sul NGF, sul suo ruolo e spettro d'azione.
La rapidità del fenomeno e l'entità dei processi regressivi, che culminano nella morte delle cellule nervose, furono interpretate all'atto della scoperta di questo fenomeno come prova irrefutabile della proprietà del NGF di esplicare un ruolo essenziale per la vita delle cellule stesse. La carenza di questa molecola provocava un processo fatale nelle cellule bersaglio. Molti anni più tardi il fenomeno sarebbe stato interpretato in modo differente e cioè non come un fattore essenziale per la vita delle cellule, ma come effetto dell'innesco del processo attivo di morte programmata, designato dal 1972 con il termine di apoptosi.
Nel caso descritto, la morte cellulare elimina le cellule prodotte in sovrannumero ed è la conseguenza dell'attivazione di un programma suicida presente in tutte le cellule degli organismi viventi. Il suicidio può essere inattivato dalla recezione di segnali inviati da cellule diverse o da altre cause. A livello istologico e ultrastrutturale la morte per apoptosi è caratterizzata dalla diminuzione del nucleo. Un altro processo di morte cellulare, noto come necrosi, differisce sostanzialmente da quello di natura apoptotica ed è sempre causato da un danno patologico. Quest'ultimo, istologicamente è caratterizzato dal rigonfiamento della cellula e dalla fuoriuscita del contenuto citoplasmatico che a sua volta provoca un'infiammazione locale. Altri esempi di morte apoptotica sono stati solo recentemente riconosciuti come tali e si verificano come sopra accennato: a seguito della eliminazione di un organo o tessuto innervato (amputazione di un arto), o durante lo sviluppo fisiologico dell'organismo come morte naturale (un esempio tipico si attua con l'eliminazione di tre quarti di cellule della colonna motoria spinale a livello cervicale).
Il processo apoptotico attualmente oggetto di molti studi è di carattere universale dal più basso al più alto gradino filogenetico. La morte apoptotica si verifica anche per somministrazione di farmaci, quali la vinblastina o la 6-idrossidopamina (6-OHDA), che con meccanismi differenti bloccano la captazione e il trasporto retrogrado del fattore NGF prodotto dalle cellule bersaglio dalla periferia lungo il nervo al corpo cellulare.
In tutti i casi descritti e designati con i termini di immunosimpatectomia, simpatectomia chimica (farmacologica) e assotomia chirurgica, benché i processi dell'apoptosi si verifichino in modo differente, il comune denominatore è lo stesso, e cioè il suicidio cellulare o morte programmata conseguente alla deprivazione del NGF da parte delle cellule dipendenti da questa molecola proteica per il loro sviluppo e differenziamento. Negli animali adulti gli stessi processi non culminano nella morte delle stesse cellule, ma in una modica atrofia cellulare e in un severo deficit funzionale.
Attività neurotropica
Esperimenti condotti in vivo e in vitro su colture di cellule di gangli sensitivi e simpatici non solo avevano ulteriormente dimostrato la funzione essenziale che il NGF svolge nella vita e nel differenziamento delle cellule bersaglio, ma avevano messo in evidenza una funzione non meno importante di questo fattore: la proprietà di guidare il percorso delle fibre nervose in via di accrescimento lungo il proprio gradiente di concentrazione. Quest'azione direttiva era stata definita con il termine di tropismo o chemiotassi, prospettato per la prima volta da Ramón y Cajal, che riteneva che questo processo nella neurogenesi intervenisse nella formazione delle giunzioni tra i nervi e gli organi innervati con cui essi stabiliscono connessioni morfologiche e funzionali. Un'ipotesi confutata dalla comunità scientifica per l'impossibilità di identificare il presunto fattore neurotropico. Spettava al NGF dare la prima prova dell'esistenza di questi fattori in base ai risultati di esperimenti condotti sia in organismi viventi che in sistemi isolati in vitro. NGF iniettato a mezzo di un microcapillare nel pavimento del quarto ventricolo in roditori neonati provocava ipertrofia dei gangli simpatici, ai quali aveva accesso tramite il flusso del liquido lungo il midollo e le radici dei gangli spinali (fig. 17).
La presenza di questo fascio di fibre ectopico e aberrante e la sua scomparsa a seguito della sospensione dell'iniezione del NGF fornivano la prima prova della proprietà del NGF di dirigere fibre nervose simpatiche lungo il suo gradiente di diffusione. Una prova anche più rigorosa della proprietà chemiotattica del NGF fu ottenuta, da parte di altri autori (come, per es., Gundersen), in esperimenti eseguiti in vitro che dimostrarono che il cono di crescita di fibre nervose prodotto da cellule sensitive embrionali si orienta, come attratto da una calamita, nella direzione di un capillare che rilascia in continuo quantità in dosi minime di NGF.
Modulazione fenotipica
Una terza proprietà del NGF è quella di determinare la scelta nel programma differenziativo di cellule che hanno origine da un comune precursore. Tipico esempio è quello delle cellule nervose simpatiche e delle cellule ghiandolari cromaffiniche che derivano da una comune cellula progenitrice della cresta neurale.
L'iniezione di NGF in embrioni di pollo o in feti e neonati di roditori determina la sequenza di processi differenziativi in direzione della cellula nervosa simpatica anziché quella cromaffinica da parte di un comune precursore delle cellule ghiandolari adrenaliniche e di quelle di natura nervosa: simpatiche e adrenergiche. La modificazione della componente corticale della ghiandola surrenale, ben evidente nella fig. 18, è provocata dall'ammasso di fibre nervose originate dalle cellule nervose della componente midollare.
Sia in embrioni sia in roditori neonati l'iniezione del NGF salivare provocava la deviazione fenotipica delle cellule della componente midollare, che assumevano tutte le proprietà morfologiche e funzionali delle cellule simpatiche. La stessa alterazione fenotipica era stata notata in piccoli raggruppamenti di tipo ghiandolare scaglionati nell'organismo.
La struttura del NGF e il suo gene
Nel 1971 P. Angeletti e R. Bradshaw, avvalendosi della molecola del NGF estratta dalla ghiandola salivare murina, ne elucidarono la struttura (fig. 19).
La molecola NGF è costituita da due catene polipeptidiche: ciascuna ha peso molecolare di 13.250 ed è formata da 118 aminoacidi. Ciascuna catena o monomero possiede tre ponti disolfuro che formano legami covalenti tra due residui dell'aminoacido cisteina che conferiscono una forte stabilità alla struttura tridimensionale della proteina. Una proprietà strutturale, questa, comune alla maggior parte di ormoni e fattori di crescita. I due monomeri del NGF uniti l'uno all'altro da legami deboli formano un dimero di peso molecolare di 26.500. È stato dimostrato che il dimero è dotato dell'attività biologica NGF; non è noto se questa sia presente anche nel monomero.
Le tecniche dell'ingegneria genetica permisero negli anni Ottanta di identificare il gene umano che codificava la molecola NGF. Il gene NGF è localizzato nel braccio corto del cromosoma 1 e codifica per la sintesi di una molecola molto più grande di quella di peso molecolare di 26.500 che costituisce il NGF circolante e biologicamente attivo. Il gene NGF invia perciò istruzioni per la sintesi di un precursore NGF o pro-NGF di grandi dimensioni. Quali componenti cellulari siano deputate al processamento del pro-NGF, dove e quando esse operino e quale sia la loro natura rimane da precisare. È stato dimostrato che il gene NGF è altamente conservato in specie differenti, dagli uccelli all'uomo. Un reperto che convalida l'ipotesi che questo gene svolga un ruolo essenziale nella vita e nello sviluppo delle cellule recettive alla sua azione.
Il ruolo del NGF nella scacchiera delle neuroscienze
La scoperta del fattore NGF e del ruolo svolto da questa molecola endogena di natura proteica nel sistema nervoso periferico ha svelato l'attività stimolante di questo fattore in cellule simpatiche adrenergiche e in cellule dei gangli sensoriali che trasmettono sensazioni dolorifiche note come nocicettive. Nel 1975 così si poteva definire il ruolo del NGF: "Il Nerve Growth Factor, come è stata sua abitudine sin da quando è venuto alla luce, ha condotto i suoi inseguitori in nuovi terreni [...]. La laboriosa ricerca per l'identificazione del NGF iniziata sotto il sole di Rio de Janeiro nel 1952 si concluse quando il Nerve Growth Factor posò con fierezza davanti al fotografo e agli ammiratori, con il suo pacchetto di aminoacidi, attorcigliati in un denso viluppo. I successi ottenuti tuttavia non segnarono la fine di questa lunga avventura scientifica. Nonostante tutte le sue straordinarie prodezze, il NGF non ha ancora trovato un'esatta collocazione tra i pezzi in continuo movimento nella scacchiera delle neuroscienze. È questo forse il migliore segno della sua vitalità e dell'impatto non soltanto già attuato, ma potenziale in un'area che è attualmente nella fase più rigogliosa del suo sviluppo" (Levi-Montalcini 1975).
Oggi, mezzo secolo dopo la sua scoperta, questo fattore ha trovato non soltanto la collocazione nella scacchiera delle neuroscienze, ma allo stesso tempo ha portato anche al riconoscimento del ruolo di altri fattori che rientrano nella classe dei 'pedoni', come elementi considerati di secondo ordine della scacchiera ludica.Una deregolazione del loro ruolo nella scacchiera delle neuroscienze può essere tuttavia non soltanto difensiva, come in quella ludica, ma offensiva a seconda del complesso dei fattori che intervengono nei processi in cui sono coinvolti. Quando attivati in eccesso possono esercitare effetti nocivi nei confronti dei 'pezzi' al più alto livello gerarchico. L'azione dei pedoni si esplica direttamente sui pezzi, come si verifica nel caso emblematico del NGF, o indirettamente tramite l'attivazione esercitata a cascata di altri pedoni, che a loro volta modulano la funzione delle componenti gerarchicamente superiori. I pedoni esplicano una potente azione modulatrice sull'attività di tutti i pezzi della scacchiera. Di particolare importanza, quella esercitata sulle componenti nervose preposte alle funzioni di natura cognitiva ed emotiva come riferito in seguito.
Sulla scacchiera delle neuroscienze l'elucidazione della capacità di autoregolazione dei pedoni ha aperto un nuovo capitolo nella conoscenza dei meccanismi in atto; non soltanto nel coordinamento delle funzioni omeodinamiche, ma anche nei processi che coinvolgono altre linee cellulari.
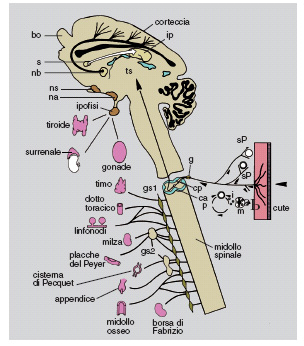
La prima dimostrazione di questa affinità pleiotropica si è avuta nel 1981 in esperimenti consistenti nell'iniezione di anticorpi al NGF in singoli feti di ratti esposti, a seguito di taglio cesareo, nella settimana prenatale. Questo intervento intracerebrale non impediva che la gestazione venisse portata a termine. I neonati sottoposti a questo trattamento nei controlli non differivano dagli altri, tuttavia nella prima settimana di vita un numero rilevante moriva a causa di un progressivo decadimento di tutte le funzioni vitali. I sopravvissuti andavano incontro a un notevole arresto della crescita e a uno sviluppo fortemente deficitario del sistema neuro-endocrino, come dimostrato dall'imponente riduzione in volume dell'ipofisi, della tiroide e del surrene.
L'ipotesi che l'inattivazione della molecola NGF da parte degli anticorpi si esercitasse a livello di determinati nuclei cerebrali (ipotalamici) preposti allo sviluppo dell'asse neuroendocrino è stata confermata ed estesa da studi condotti in collaborazione con altri istituti di ricerca. È stato rilevato che in condizioni normali la molecola NGF è sintetizzata e rilasciata nei nuclei suddetti. Inoltre, studi condotti in parallelo da altri ricercatori dimostravano che popolazioni endocrine, in condizioni fisiologiche normali, sono dotate della proprietà di sintetizzare e rilasciare la molecola NGF. I risultati di questi studi confermavano un'ulteriore estensione dell'attività svolta dalla molecola NGF non ristretta al sistema nervoso periferico e centrale, né ai centri nervosi preposti alle funzioni dell'asse neuroendocrino, ma comune anche alle cellule che fanno parte di questi organi indipendentemente dall'azione esplicata su di loro dall'asse ipotalamo-ipofisi-surrene.
NGF e neuroni del sistema nervoso centrale
Negli ultimi due decenni è stato chiaramente dimostrato che il NGF e il suo RNA messaggero (mRNA) sono presenti in determinati settori cerebrali durante lo sviluppo e le fasi successive. Inoltre, i risultati di ricerche eseguite in altri laboratori dimostrarono che il NGF è sintetizzato in notevole quantità nella neocorteccia, nell'ippocampo e nel talamo. Il NGF radiomarcato, iniettato nell'ippocampo o nella corteccia cerebrale di ratto, è assunto selettivamente dalle terminazioni colinergiche e trasferito per trasporto assonale retrogrado ai neuroni colinergici magnocellulari del prosencefalo. Il significato biologico di questa molecola proteica nel sistema nervoso centrale (SNC) è stato confermato dall'osservazione che la somministrazione di NGF esogeno determina un aumento dell'attività della colina-acetiltransferasi (ChAT). Inoltre, il NGF favorisce la sopravvivenza dei neuroni del prosencefalo basale danneggiati a seguito della transezione delle vie setto-ippocampali.
NGF: da specifico fattore di crescita a modulatore dei tre fondamentali sistemi omeodinamici
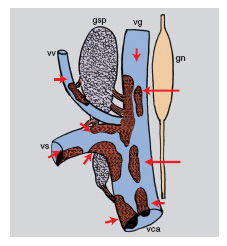
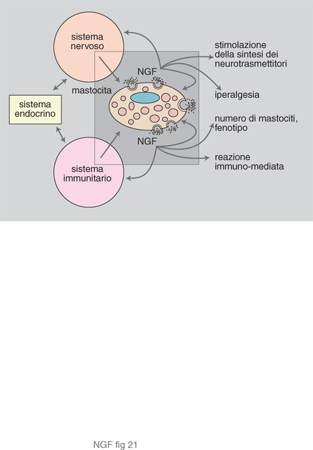
I risultati sopra descritti hanno rivelato altre attività dello spettro d'azione del NGF, che suggeriscono un ruolo della massima importanza, consistente nella modulazione sinergica dei sistemi nervoso, endocrino e immunitario (fig. 20).
È stato dimostrato che le cellule bersaglio del NGF non si trovano soltanto in alcune linee cellulari del sistema nervoso periferico e centrale, ma sono presenti anche in linee cellulari dei tre sistemi.
Nel 1977 gli studi condotti nel nostro laboratorio avevano evidenziato che iniezioni di NGF in roditori neonati provocavano uno straordinario aumento numerico di cellule appartenenti al sistema immunitario, note come mastociti. L'importanza di questo reperto, descritto per la prima volta, non era stata immediatamente colta né da parte nostra, né da quella di quanti ne vennero a conoscenza. Il ruolo assegnato alle cellule che rivelarono questa nuova attività del NGF era quello di difendere l'organismo da agenti nocivi quali i vermi e i parassiti di diversa natura. Si riteneva, infatti, che la loro attività consistesse esclusivamente nel sintetizzare e rilasciare sostanze che delimitavano il danno causato dall'invasione di microrganismi o agenti nocivi, provocando allo stesso tempo processi infiammatori locali e reazioni generalizzate di diversa gravità, sia in condizioni definite allergiche, sia in quelle note come di ipersensibilità immediata. Il coinvolgimento dei mastociti in altri processi fisiopatologici era stato del tutto ignorato. L'azione attivante del NGF su queste cellule in roditori neonati rivelò un'imprevedibile proprietà esplicata da questa molecola sui mastociti ritenuti in passato una sorta di 'cenerentola' del sistema immunitario.
Ricerche condotte in seguito in altri e nel nostro laboratorio rilevarono la stimolazione da parte del NGF della proliferazione, del differenziamento e della funzionalità non soltanto di queste cellule considerate secondarie, ma anche di altre che esplicano un'azione primaria nel sistema immunitario, note come linfociti B e T.
Si ripeteva a distanza di tre decenni il fenomeno che inizialmente aveva portato il NGF alla nostra conoscenza, cioè che una cellula considerata di seconda categoria, quale la cellula simpatica, aveva svelato la proprietà che popolazioni neuronali del sistema nervoso centrale fossero a loro volta recettive all'attività di questo fattore umorale. Anche nel caso del sistema immunitario, che consiste di una vasta costellazione di cellule classificate in base a un criterio antropologico, di maggiore o minore valenza, le cellule reputate di secondo ordine (mastociti) svelavano una proprietà estesa a tutte le altre componenti del sistema immunitario. Le cellule 'cenerentola' che avevano rivelato la loro recettività alla molecola NGF venivano inoltre alla ribalta per un altro ruolo, che consisteva nella capacità di rispondere sia a stimoli di natura immunitaria sia ad altri di natura nervosa.
L'iniziale denominazione di Mastzellen, coniata da Erlich alla fine dell'Ottocento, indica cellule ripiene di granuli a valenza nutritiva, e viene oggi decodificata da alcuni autori in termini di cellula 'master', cioè principale o importante, data la capacità del mastocita di sintetizzare e immagazzinare all'interno dei propri granuli una grande varietà di mediatori che, sotto le più svariate stimolazioni, vengono rilasciati per andare a influenzare un numero straordinario di processi biologici (fig. 21).
Ricerche condotte precedentemente nel nostro e in altri laboratori hanno evidenziato la presenza di mastociti in stretta vicinanza a terminazioni di fibre sensitive nocicettive e nella compagine di organi dei sistemi endocrino e immunitario. La loro associazione con il tessuto nervoso deponeva per un'interdipendenza morfofunzionale, ipotesi confermata da rilevamenti istologici ed elettrofisiologici. Questi e altri studi hanno messo in evidenza che il mastocita, che si trova al centro di complesse interazioni nell'ambito del network neuro-immunitario, è dotato della proprietà di rispondere a input di varia origine e di liberare mediatori a valenza plurisistemica. Il NGF è infatti in grado non soltanto di stimolare il differenziamento e la funzionalità di determinati stipiti neuronali e di cellule appartenenti ai sistemi immunitario ed endocrino, ma anche, nel caso dei mastociti, di potenziare la loro degranulazione e di intervenire indirettamente nella loro attivazione neurogenica, esercitando i noti effetti sullo sviluppo e funzionamento dei neuroni contenenti sostanza P, potente attivatore dei mastociti. L'immediata risposta mastocitaria costituisce una caratteristica essenziale della fisiopatologia di queste cellule, che deriva dalla loro proprietà di sintetizzare e liberare molecole ad alto potere biologico, quali l'istamina, l'eparina e la serotonina e lo stesso NGF.
Di notevole attività citotossica è la citochina nota come Tumor Necrosis Factor (TNF). Queste e altre molecole liberate dai mastociti sono alla base dei fenomeni infiammatori di differente eziopatogenesi. È oggi noto che i mastociti sono corredati di recettori a bassa e ad alta affinità al NGF, che sintetizzano la stessa molecola e che a seguito della loro attivazione liberano il contenuto dei granuli. Queste cellule hanno, oltre la proprietà di captare il NGF, le proprietà di sintetizzarlo e rilasciarlo simultaneamente o in tempi differenti con altre sostanze ad alta attività biologica quali l'istamina, la prostaglandina, il TNF e altre.
Il mastocita si rivela, dunque, come target e sorgente di NGF. Questa proprietà, che a prima vista lo accomuna ad altre cellule NGF-responsive e NGF-secernenti (per es. cheratinociti), assume in realtà nel mastocita potenzialità fisiopatologiche ben più rilevanti. Ciò dipende dalle caratteristiche cellulari del mastocita stesso, una cellula a elevatissima reattività, a multipotenzialità di effetto, a prontezza di risposta e a localizzazione strategica. Da un lato, quindi, sorgente immediata di NGF, dall'altro effettore immediato e multipotente dei segnali NGF-mediati.
In base all'attività esplicata dal NGF sulle componenti dei sistemi citati si svelava una proprietà di questa molecola che non rientrava in quella che gli era stata attribuita nei tre decenni successivi alla sua scoperta, designata con il termine di neurotrofina, ma si inseriva nella categoria più ampia di sostanze umorali, note con il termine generico di citochine, sintetizzate e rilasciate dalle cellule appartenenti ai sistemi della rete omeodinamica.
Il NGF e i suoi due recettori
Un elemento di cruciale importanza per comprendere i meccanismi alla base dell'azione neurotrofica del NGF è rappresentato dai suoi recettori. Negli anni Novanta sono stati identificati due recettori per il NGF, uno a bassa affinità, p75, e una chinasi tirosinica, indicata come il recettore ad alta affinità TrkA. Ognuno di essi è separatamente collegato a specifici meccanismi di trasduzione del segnale. Le cellule neuronali sensibili alla neurotrofina esprimono entrambi i recettori, ma, per quanto concerne gli effetti neurotrofici, non è stato ancora chiarito con certezza il ruolo svolto dal recettore p75. Si è dimostrato che la sovraespressione del recettore TrkA in cellule neuronali è in grado di potenziare gli effetti differenziativi del NGF. Inoltre è stato evidenziato che il recettore p75 è in grado di regolare positivamente il segnale trasdotto dal TrkA.
Come già accennato, il NGF può essere prodotto in molti tipi di cellule residenti nei tessuti periferici, nel sistema nervoso centrale e da cellule circolanti. Anche i recettori della neurotrofina sono presenti, oltre che sui neuroni sensibili (neuroni sensoriali, simpatici e neuroni colinergici del SNC), in molti altri tipi di cellule. Attraverso l'attivazione di questi recettori extraneuronali il NGF è in grado di esercitare attività specifiche assolvendo a diversi ruoli a seconda del bersaglio cellulare. Questa proprietà di indurre effetti così diversificati mette in evidenza l'attività pleiotropica del NGF. Il ruolo di questa molecola nei processi flogistici, nei quali i meccanismi di regolazione reciproca dei sistemi omeodinamici svolgono una funzione molto chiara, mette in evidenza lo stabilirsi di un complesso cross-talk operativo, nel quale molti messaggi molecolari sono interscambiabili e polivalenti. La pleiotropicità della neurotrofina NGF è inoltre dimostrata dalla diffusione dei recettori NGF e delle loro variazioni in funzione delle condizioni fisiopatologiche nelle varie cellule tissutali. La funzione del NGF nell'infiammazione è di: a) segnalare il danno e potenziare i sistemi di allerta tissutale; b) adiuvare la risposta immunitaria; c) favorire la riparazione dei tessuti lesi.
Se da un lato questi effetti svolgono un ruolo indispensabile al buon funzionamento dei meccanismi di difesa e riparativi dei tessuti, dall'altro la loro stessa persistenza o entità può portare all'instaurarsi di condizioni morbose. In tali circostanze l'attività riparativa del NGF può assumere rilievi patologici quale l'iperalgesia. Inoltre la neurotrofina potrebbe giocare un ruolo importante nella cronicizzazione degli stessi processi infiammatori, soprattutto nella loro componente neurogenica, sia per la sua attività autocrina sui mastociti, sia per il suo ruolo di potenziamento dei livelli di sostanza P rilasciabili antidromicamente dalle fibre sensoriali (fig. 22).
Sono stati identificati numerosi meccanismi di trasduzione attivati dall'interazione tra il NGF e i suoi recettori. L'attivazione del recettore TrkA è necessaria per l'induzione degli effetti neurotrofici del NGF, mentre l'attivazione del p75 sembra potenziarne gli effetti. È stato dimostrato che l'induzione di alcuni degli effetti extraneuronali del NGF è mediata esclusivamente dall'attivazione del recettore TrkA, mentre un'autonomia funzionale del recettore p75 è stata associata all'induzione della morte apoptotica in vari tipi di cellule, determinando durante questi processi un antagonismo funzionale tra i due recettori. Anche l'attivazione del recettore TrkA è in grado di indurre apoptosi, sebbene fino a oggi tale fenomeno sia stato riscontrato solo su cellule tumorali di medulloblastoma, appositamente trasfettate con TrkA. Queste cellule non esprimono il p75 e il loro trattamento con NGF ne provoca una massiccia morte apoptotica. Il malfunzionamento dei meccanismi che regolano l'espressione del NGF potrebbe portare a una carenza di neurotrofina e quindi contribuire ai fenomeni neurodegenerativi.
Un dato interessante che emerge dalla complessità dei meccanismi cellulari attivati dai recettori del NGF è la loro capacità di interagire e di modularsi a vicenda. I due recettori sembrano possedere punti di contatto diretto e indiretto, la cui regolazione differenziata è probabilmente responsabile della vastità e diversità degli effetti mediati dalla neurotrofina. Un ulteriore elemento di diversificazione degli effetti è dato dall'espressione combinata, alternata o singola di p75 e di TrkA nelle cellule bersaglio. Tra l'altro i recettori del NGF possono esercitare una funzione anche in assenza di neurotrofina, come durante la sua deprivazione. L'eterogeneità degli effetti del NGF, quindi, non è solo tessuto-specifica, ma anche cellulo-specifica. Questo si riflette nel pleiotropismo della neurotrofina, ma anche nella varietà degli effetti endocellulari indotti nei diversi stadi di sviluppo, come in diverse condizioni epigenetiche o biochimiche della cellula.
La sinergia tra il NGF e i suoi recettori viene diversificata e ampliata, fino a rappresentare, più che un segnale neurotrofico, un fattore di discernimento sul percorso che deve essere seguito dalla cellula.
Aumento del NGF circolante in stato di stress e di ansia
Un aspetto del tutto nuovo dell'attività biologica del NGF è venuto alla ribalta nel 1986, quando è stata ripresa in esame una delle osservazioni più interessanti emerse dallo studio del NGF, e cioè la sintesi di grandi quantità di questo polipeptide nei tubuli convoluti delle ghiandole salivari sottomascellari di topo maschio adulto.
I risultati ottenuti nel corso degli ultimi trent'anni avevano dimostrato che questo prodotto delle ghiandole salivari era trasportato attraverso il condotto escretore fino alla saliva, sia nei topi non trattati che in quelli stimolati con mezzi farmacologici. L'impossibilità di rivelare il NGF nel siero sembrava militare contro l'ipotesi che questa molecola svolgesse una qualche funzione fisiologica non correlata a quella ipotizzata nel sistema digerente. Il potente effetto stimolatore sulla crescita nervosa esercitato da questo polipeptide era stato quindi provvisoriamente incluso nella grande categoria degli effetti collaterali 'bizzarri' di molecole prodotte per scopi totalmente differenti, osservabili in organismi appartenenti sia al regno vegetale sia a quello animale. Non rassegnati ad accettare quest'interpretazione, si è ricorsi a un approccio sperimentale differente, suggeritoci da considerazioni basate sul comportamento specifico del topo allo stato selvatico. In condizioni naturali, i topi maschi mostrano un comportamento aggressivo nei riguardi dei maschi della loro stessa colonia, ingaggiando combattimenti intraspecifici che finiscono con gravi morsicature e talvolta con l'uccisione di uno dei due contendenti. Un comportamento aggressivo del tutto simile si osserva in topi maschi allevati in laboratorio, mantenuti in isolamento sociale per un periodo di 4÷6 settimane e posti quindi con un altro maschio nella stessa gabbia. L'osservazione di elevati livelli di NGF nel sangue di entrambi i contendenti immediatamente dopo ogni episodio di aggressione suggeriva che questo rilascio di NGF dalle ghiandole salivari potesse avere un ben definito ruolo fisiologico, attivato e/o potenziato da specifiche condizioni di stress.
Indagini precedenti, dalle quali risultava che il NGF esogeno induce ipertrofia del surrene e stimola l'attività funzionale sia della sezione midollare sia di quella corticale di questa ghiandola, suggerivano che quest'organo rappresentasse il bersaglio più probabile del polipeptide. Quest'ipotesi ricevette una conferma dalla dimostrazione che prolungati episodi di combattimenti determinano un'ipertrofia sia della componente corticale sia di quella midollare del surrene.
Un'ulteriore significativa osservazione riguardo al ruolo del NGF nell'interazione antagonista nel topo si riferisce al fatto che il suo livello nel sangue circolante raggiunge costantemente un valore più elevato nel partner subordinato che in quello dominante. In altri termini, il massivo rilascio di NGF dalle ghiandole salivari nel sangue circolante è espressione non solo dell'attivazione di un comportamento aggressivo, ma anche dell'ansia, che è ovviamente più grave nel topo subordinato. Questi risultati hanno posto il problema se anche nella specie umana lo stato ansioso provochi un aumentato livello di NGF. A questo scopo sono stati analizzati i livelli ematici in giovani reclute che per la prima volta si lanciavano con il paracadute. I risultati hanno messo in evidenza un aumento di NGF nel sangue sia nel momento in cui veniva notificato alle reclute che si sarebbero dovute lanciare (ventiquattro ore prima del lancio) sia immediatamente dopo il lancio stesso (stress fisico ed emotivo).
Studi condotti con la tecnica della immunofluorescenza hanno dimostrato un aumento dei recettori a bassa affinità sui linfociti circolanti sia prima (stress emotivo) sia immediatamente dopo il lancio. Prima del lancio il livello ematico del NGF era aumentato dell'84%; venti minuti dopo l'atterraggio il livello NGF era ulteriormente salito al 107% in un gruppo di 26 individui. Gli studi condotti hanno inoltre dimostrato che i livelli ematici di linfochine strettamente connesse con il NGF, e cioè linfochina IL-1β e Tumor Necrosis Factor (TNF-α), non vanno incontro ad aumento a seguito dello stress emotivo e fisico-emotivo.
Due dati di notevole interesse emergono da questi reperti: lo stress di natura emotiva e/o fisico-emotiva provoca un aumentato rilascio in circolo di NGF da sorgenti al presente non identificate, senza tuttavia alterare il livello di altre interleuchine intimamente associate al NGF, quali l'interleuchina IL-1β e il TNF-α; l'immediato aumento del NGF circolante e quello simultaneo dei recettori NGF sui linfociti nel sangue dei soggetti sottoposti al duplice stress emotivo e fisico prospettano l'ipotesi che la molecola NGF non soltanto agisca in modo sinergico sui tre sistemi (nervoso, endocrino e immunitario), ma svolga un ruolo di attivazione dei sistemi preposti a mettere in atto meccanismi di difesa.
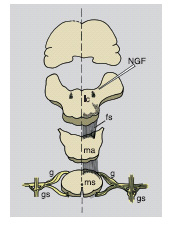
Sono proseguiti gli studi per identificare le cellule nervose e satelliti che esprimono il messaggero del NGF e del suo recettore a bassa affinità nel sistema nervoso centrale di roditori, studi che avevano dimostrato un rilevante aumento sia della proteina sia del suo messaggero in nuclei ipotalamici di topi maschi adulti in stato di aggressività intraspecifica. Gli studi condotti con tecniche immuno-istochimiche di alta precisione su nuclei ipotalamici di ratti adulti e sui sistemi di fibre emergenti da questi hanno permesso di ottenere una configurazione esatta dei neuroni e delle cellule non neuronali (glia e taniciti) che esprimono RNA del recettore a bassa affinità del NGF e della molecola stessa. Da queste ricerche è risultato che le cellule nervose sia di nuclei ipotalamici preposti alla modulazione di aggregati cellulari dell'ipofisi anteriore (asse ipofisi-tiroide-surrenale) sia della neuroipofisi godono della proprietà di sintetizzare il NGF e/o il suo recettore.
Tali ricerche evidenziano l'attivazione di meccanismi autocrini in questi aggregati neuronali e convalidano l'ipotesi che il NGF intervenga nella regolazione di funzioni neuroendocrine e comportamentali.
Ruolo del NGF nelle deregolazioni del sistema immunitario, nelle neuropatie periferiche e nelle lesioni corneali
L'assegnazione del NGF alla vasta categoria delle citochine delucidava il ruolo che questa molecola esplica non soltanto nelle condizioni fisiologiche di interazione dei tre sistemi, ma metteva in risalto il suo ruolo in condizioni morbose e particolarmente in quelle di deregolazione del sistema immunitario e di altra natura.
La scoperta dell'attività stimolante della molecola NGF su differenziamento e funzione di linee cellulari appartenenti al sistema immunitario (mastociti e linfociti B e T) ha prospettato la possibilità che il NGF possa esercitare un ruolo preminente nell'instaurarsi e nel decorso delle patologie sopra indicate.
I risultati conseguiti da ricerche condotte in questi ultimi anni hanno, inoltre, messo in evidenza la funzione del NGF e quella esplicata dal mastocita, cellula fondamentale nell'interazione dei tre sistemi omeodinamici. Le malattie autoimmuni che insorgono quando lo stesso sistema si rivolge non contro agenti esterni, ma contro componenti cellulari del proprio organismo sono state oggetto di estesi studi nel nostro laboratorio, diretti a elucidare il ruolo svolto dal NGF e dai mastociti nell'insorgenza e nel decorso di malattie autoimmuni quali la sclerosi multipla, l'artrite reumatoide e altre.
Avvalendoci del modello sperimentale della sclerosi multipla, l'encefalite sperimentale allergica, provocata mediante iniezione della componente proteica della mielina in roditori, è stato osservato che nella fase iniziale della malattia, a livello delle zone demielinizzate, caratterizzate da processi infiammatori, si verifica un aumento dei mastociti e del livello NGF a paragone delle zone non colpite dall'affezione. Studi più recenti hanno evidenziato che tali fenomeni non permangono nelle fasi sucessive, nelle quali, anzi, si può verificare un diminuito livello NGF. Tali effetti si verificano nella fase iniziale di altre malattie autoimmuni quali il Lupus eritematoso e la sclerosi sistemica. In un'altra forma morbosa di uguale natura, l'artrite reumatoide (AR), si è rilevata la stessa aumentata presenza di mastociti e NGF nelle cavità e nelle membrane sinoviali delle articolazioni colpite.
Nell'ambito del network neurocutaneo il NGF gioca un ruolo assolutamente determinante. Questa molecola proteica, infatti, non solo presiede allo sviluppo e al differenziamento dei neuroni sensoriali e simpatici ma è anche in grado di modulare nell'adulto l'arborizzazione terminale delle fibre amieliniche, nonché la sensibilità termica e traumatica dei nocicettori afferenti che nell'epidermide formano un complesso network tridimensionale.
I suoi effetti cutanei sono stati recentemente messi in evidenza da studi effettuati su topi transgenici che sovraesprimono NGF nella pelle. In questi animali si è dimostrato un aumento del 100% del numero di neuroni sensoriali presenti nei gangli delle radici dorsali, nonché un forte incremento di fibre contenenti CGRP (Calcitonin Gene Related Peptide) nel corno dorsale del midollo spinale.
A livello cutaneo, inoltre, la sovraespressione (over-expression) locale di NGF sbilancia il rapporto tra fibre simpatiche colinergiche (innervazione ghiandole sudoripare), noradrenergiche (innervazione vascolare) e sensoriali (plesso nervoso dermo-epidermico). Tale squilibrio determina un netto prevalere delle terminazioni sensoriali e una localizzazione aberrante degli assoni simpatici che si concentrano a canestro intorno ai neuroni sensoriali, analogamente a quanto accade in condizioni di dolore cronico.
Come già delineato, il network neuroimmunocutaneo è organizzato attraverso interrelazioni tra innervazione, sistema immunitario e cellule residenti nei tessuti cutanei e sottocutanei.
Elemento cutaneo per eccellenza, il cheratinocita è la cellula maggiormente presente nella pelle, dove la sua organizzazione stratificata e il suo specifico turnover determinano le proprietà di rinnovamento e cheratinizzazione epidermica, nonché le fondamentali caratteristiche della barriera cutanea. Si considera che questa cellula partecipi nell'omeostasi dermo-epidermica e ancor più nelle alterazioni disreattive e iperattive del distretto cutaneo. Inoltre, è in grado di produrre e liberare numerose citochine, attraverso le quali influenza i processi infiammatori cutanei, ed è in grado di sintetizzare e rilasciare localmente NGF. Mediante modalità paracrine e autocrine lo stesso NGF regola la sopravvivenza, la proliferazione e il differenziamento dei cheratinociti. Anche i fibroblasti, particolarmente abbondanti a livello dermico, rappresentano fonti cutanee di NGF; sotto stimolo citochinico (TNF e IL-1β in particolare) producono e liberano quantità discrete di questo fattore, che andrà a esercitare i propri effetti a livello cheratinocitario, ovvero su quelle cellule dermo-immunitarie da molti definite spazzini tissutali - i macrofagi - nei quali il NGF è in grado di stimolare la fagocitosi, l'espressione recettoriale, la produzione e il rilascio di citochine, come l'IL-1β. È infine importante considerare anche quelle cellule immunitarie che, pur non essendo resistenti a livello cutaneo, vengono attivate in numerose condizioni fisiologiche o patologiche e particolarmente in quelle di natura flogistica di varia natura. Monociti, linfociti T, linfociti B, neutrofili, eosinofili, basofili rappresentano le braccia mobili del sistema immunitario, capaci di migrare sotto stimolo chemiotattico dal letto circolatorio al tessuto cutaneo che ne richieda l'intervento. Tutte queste cellule rispondono in maniera attiva al NGF, ne esprimono il recettore e alcune sono in grado di sintetizzare e rilasciare questa neurochina.
Nel microambiente locale in vivo il NGF gioca un ruolo fondamentale nel differenziamento mastocitario. La differenziazione connettivale dei mastociti che migrano nella cute sarebbe da ascrivere al NGF liberato dai fibroblasti locali, come già dimostrato in vitro. È oggi noto che tali effetti dipendono dall'espressione del recettore ad alta affinità per il NGF da parte dei mastociti, ed è anche noto che, attraverso tale recettore, il NGF inibisce l'apoptosi dei mastociti connettivali e ne induce uno stato di ipersensibilità, potenziandone la degranulazione.
In base alle sue proprietà il NGF è coinvolto in meccanismi dermo-epidermici di difesa. Tra questi, uno dei principali sistemi difensivi è rappresentato dall'iperalgesia, cioè dalla percezione dolorifica di stimolazioni cutanee normalmente non risultanti in sensazioni dolorose.
Si tratta di un meccanismo messo in atto dalla natura per proteggere tessuti lesi o in via di riparazione. Un esempio classico è l'iperalgesia della cute ferita e/o in via di cicatrizzazione, dove la sensibilità dolorifica a stimoli meccanici e termici è notevolmente amplificata. I meccanismi neurobiologici dell'iperalgesia vedono il NGF giocare un ruolo cruciale.
È del 1960 la prima evidenza che l'infiammazione provoca aumenti dei livelli locali di NGF, ma ci sono voluti più di tre decenni per definire che tale aumento è responsabile dell'iperalgesia dei tessuti infiammati. Il NGF è in grado di aumentare la sintesi di neuropeptidi, come CGRP e SP (Substance P), con conseguente abbassamento della soglia nocicettiva.
Quanto finora riportato delinea il NGF come iniziatore di due fasi cardinali della fisiopatologia cutanea: l'iperalgica e l'infiammatoria. Queste stesse fasi sono assolutamente cruciali in uno dei più noti fenomeni di riparazione cutanea: la cicatrizzazione delle ferite.
Indipendentemente dall'origine cellulare, gli aumenti di NGF in sede di ferita possono stimolare la cicatrizzazione anche attraverso modalità diverse da quelle nervose. La sua capacità di influenzare le cellule cutanee rende, infatti, il NGF un ottimo candidato al ruolo di orchestratore delle fasi cicatriziali, prima fra tutte quella infiammatoria. L'induzione e il potenziamento della degranulazione mastocitaria è senza dubbio il meccanismo fondamentale tramite il quale il NGF attiva il processo infiammatorio. L'azione proliferativa sui cheratinociti rende conto del ruolo del NGF nella riepitelizzazione, evento chiave della cicatrizzazione cutanea, attraverso il quale i cheratinociti migrano dai margini della ferita e proliferano fino a ricoprire completamente la soluzione di continuo. Esami di laboratorio condotti sia su topi normali sia su topi diabetici hanno confermato che l'applicazione topica di NGF su ferite a tutto spessore accelera la velocità di cicatrizzazione. In particolare, il trattamento ha aumentato il grado di riepitelizzazione, lo spessore del tessuto di granulazione e la densità della matrice extracellulare.
Se da un lato il difetto di NGF comporta deficit a più livelli nei processi cicatriziali, dall'altro un suo eccesso potrebbe avere conseguenze di natura iper-reattiva e ipertrofica. Ai fini di evitare che un eccesso di NGF provochi un eccesso di cicatrizzazione (cheloidi) si è ricorsi all'utilizzazione di sostanze endogene, note come N-aciletanolamidi, che si accumulano nei tessuti in seguito a danno e che, attraverso uno specifico meccanismo recettoriale, down-modulano l'attivazione mastocitaria, esercitando un'azione locale 'anti-lesiva', recentemente definita ALIA (Autacoid Local Injury Antagonism).
Alterazioni di natura neurologica sono provocate da compressione da trauma di nervi sensoriali o da neuropatie, quali per es. il diabete, le complicazioni insorgenti durante la chemioterapia antitumorale (per es. da cisplatino o da taxolo), in seguito a terapie antivirali, come complicazioni dell'alcolismo o del fumo, o nel decorso dell'AIDS.
Una prima comunicazione sull'effetto positivo del trattamento con NGF fu lo studio di C.S. Apfel e collaboratori dell'Albert Einstein College of Medicine di New York nel 1991, eseguito come d'uso su un modello di neuropatia da cisplatino indotta nei topolini e che simulava la neuropatia nei pazienti. Incoraggiati da tali risultati sperimentali, veniva lanciato negli Stati Uniti, nel 1993, uno studio multicentrico su pazienti che, nel corso della chemioterapia da cisplatino, avevano perduto la sensazione periferica del tatto e della vibrazione in seguito a lesione di fibre nervose sensoriali; queste fibre infatti trasportano tali informazioni dalla periferia (pelle e articolazioni dei piedi) al cervello. Più recentemente è stato condotto uno studio su un altro gruppo di pazienti, i diabetici.
La sofferenza dei nervi periferici rappresenta nei diabetici una complicazione relativamente frequente (10% circa) non sempre correlabile alla gravità e alla durata della malattia. La causa non è ancora stata chiarita, ma fattori quali appunto un danno alle fibre nervose che innervano i vasi capillari degli stessi nervi sono stati chiamati in causa. La perdita graduale della sensibilità cutanea provoca nel paziente ferite e lesioni, talvolta anche gravi, alle estremità, aumentando così il danno iniziale. Il peggioramento progressivo di ulcere e piaghe può portare talvolta alla necessità di amputare. La terapia delle neuropatie diabetiche si è indirizzata finora al controllo del diabete mediante mantenimento del tasso di glucosio del sangue a livelli accettabili: l'iniezione sottocutanea di NGF in microgrammi determina un significativo miglioramento della sensibilità al caldo e al freddo nel 75% dei pazienti e un effetto positivo anche a carico di altri tipi di sensibilità.
Un'altra imprevedibile attività del NGF è stata recentemente evidenziata dall'azione svolta da questa molecola in ulcere corneali di qualunque natura che provocano lesioni causando la perdita della vista per la mancata riparazione dei tessuti lesi con terapie farmacologiche.
La scoperta di recettori ad alta affinità nelle cellule epiteliali della cornea, realizzata grazie a studi in vitro condotti in precedenza, ha suggerito la sperimentazione in vivo in modelli animali (conigli) ai quali era stata inflitta una lesione dell'epitelio corneale. I risultati conseguiti hanno dimostrato che l'aggiunta al mezzo di coltura del NGF portava al ripristino delle cellule lese e hanno incoraggiato lo studio dell'attività del NGF sulla cornea di pazienti affetti da lesioni di differente natura. Di queste, la più frequente è quella provocata dall'infezione del tessuto corneale da Herpes simplex, seguita, dal punto di vista numerico, dalle lesioni provocate da infezioni batteriche, virali o conseguenti ad alterazioni traumatiche (lenti a contatto, oggetti ecc.). Il NGF è stato somministrato per via topica (collirio) e nel 100% dei pazienti trattati (a tutt'oggi una cinquantina) si è verificata una completa riparazione del tessuto corneale, che si evidenzia poche settimane dopo i primi trattamenti e perdura nei periodi successivi. Ulcere corneali possono anche essere provocate da mancata innervazione per lesioni del nervo trigemino. Si tratta in questo caso di ulcere corneali di origine neurogena, come dimostrato dall'alterazione dell'epitelio corneale a seguito della sezione della componente oculare del nervo trigemino in modelli animali. Lesioni di questo nervo riducono il metabolismo e la vitalità del tessuto corneale, probabilmente a causa della mancata funzione di un non identificato fattore trofico.
L'effetto riparativo, studiato a livello istologico nel modello animale, ha dimostrato che questo è dovuto sia al fatto che le cellule corneali possiedono i recettori ad alta affinità e sono quindi in grado di captare il fattore NGF, sia al fatto che il NGF determina la reinnervazione del tessuto leso. Le patologie, alle quali si è accennato, pur essendo eterogenee tra di loro, sia come eziologia sia come localizzazione, potendo interessare livelli distrettuali diversi, sono unificate nel segno dei processi infiammatori che ne sostengono il danno patologico.
Le ricerche citate e tuttora in corso aprono un nuovo capitolo con enormi potenzialità di ulteriore sviluppo nello studio dei circuiti neuroendocrinoimmunitari coinvolti nell'equilibrio omeodinamico del vivente. Il sistema nervoso, il sistema endocrino e il sistema immunitario, come unità operanti autonomamente tra loro e integrate attraverso relazioni morfologiche e funzionali, sono parti di un unico network omeodinamico regolato dalla mutua comunicazione tra i sistemi, anziché da complessi cellulari indipendenti l'uno dall'altro, come si riteneva in passato. L'evidenza che il NGF circoli senza limitazioni di organo o strutture, né confini di sistema, conferisce a questa molecola ruoli chiave nel processo omeodinamico globale dell'organismo.
I risultati conseguiti in questi ultimi decenni hanno portato a enormi passi avanti nel cammino verso la comprensione dei meccanismi fisiopatologici preposti alla salute dell'uomo. A questi si è pervenuti integrando il metodo analitico con quello olistico, che si avvale dello studio delle singole parti per ottenere una visione globale. Non si contempla un mosaico concentrando l'attenzione sulle singole tessere: infatti, l'analisi più minuziosa delle parti non può fornire l'idea dell'insieme. Da questa filosofia di base nasce un nuovo approccio sperimentale, volto a collegare, integrare, associare, così come sono collegati, integrati e associati i sistemi che operano per mantenere l'equilibrio dell'organismo. Le fasi di sviluppo delineate per sommi capi non devono essere considerate 'un inventario di fatti', indipendenti l'uno dall'altro, ma una sequenza logica di fenomeni collegati tra loro da un filo conduttore.
Gli studi che avrebbero portato alla scoperta del NGF si ponevano al loro inizio l'obiettivo di indagare quale ruolo giocassero i tessuti e gli organi periferici sui centri nervosi del midollo spinale da loro innervati. Era un problema che si apriva a quei tempi, nella vasta panoramica delle neuroscienze, come periferico nel doppio senso di questo termine: nel primo perché le cellule attive avevano una locazione e funzione periferica, nel secondo perché queste cellule sono preposte a funzioni di scarsa rilevanza a paragone di quelle del sistema nervoso centrale, implicate nelle funzioni cognitive (elaborazione del pensiero, memoria, creatività e nel complesso delle funzioni psico-emotive).
L'attività esplicata da questa molecola, venuta alla luce mezzo secolo fa, è paragonabile alla scoperta dell'area sommersa dell'iceberg NGF, di gran lunga più estesa di quella emergente sulla superficie, come espresso nella relazione presentata in occasione del conferimento del premio Nobel per la fisiologia o la medicina nel 1986.
bibliografia
R. Levi-Montalcini, G. Levi, Les conséquences de la destruction d'un territoire d'innervation périphérique sur le développement des centres nerveux correspondants dans l'embryon de poulet, in Archives de biologie, 1942, p. 537-45.
E.D. Bueker, Implantation of tumors in the hindlimb field of the embryonic chick and developmental response of the lumbosacral nervous system, in Anatomical record, 1948, 102, pp. 369-90.
R. Levi-Montalcini, V. Hamburger, Selective growth-stimulating effects of mouse sarcoma on the sensory and sympathetic system of the chick embryo, in The journal of experimental zoology, 1951, 116, pp. 321-36.
R. Levi-Montalcini, Effects of mouse tumor transplantation on the nervous system, in The chick embryo in biological research, ed. D.A. Karnofsky, The Annals of New York Academy of Sciences, 1952, 55, pp. 330-43.
R. Levi-Montalcini, H. Meyer, V. Hamburger, In vitro experiments on the effects of mouse sarcomas 180 and 37 on the spinal and sympathetic ganglia of the chick embryo, in Cancer research, 1953, 14, pp. 49-57.
Analysis of development, ed. B.H. Willier, P.A. Weiss, V. Hamburger, Philadelphia 1955, pp. 346-401.
R. Levi-Montalcini, S. Cohen, In vitro experiments on the effects of a nerve growth-stimulating agent isolated from snake venom, in Proceedings of the National Academy of Sciences USA, 1956, 42, pp. 695-99.
R. Levi-Montalcini, Chemical stimulation of nerve growth, in A Symposium on the chemical basis of development, ed. W.D. McElroy, B. Glass, Baltimore 1958, pp. 645-64.
R. Levi-Montalcini, S. Cohen, Effects of the extract of the mouse submaxillary salivary glands on the sympathetic system of mammals, in The Annals of New York Academy of sciences, 1960, 85, pp. 324-41.
R. Levi-Montalcini, Growth control of nerve cells by a protein factor and its antiserum, in Science, 1964, 143, pp. 105-10.
R. Levi-Montalcini, Events in the developing nervous system, in Growth and maturation of the brain, ed. D.P. Purpura, J.P. Shade, Amsterdam-New York 1964, pp. 1-29.
R. Levi-Montalcini, The nerve growth factor: its mode of action on sensory and sympathetic nerve cells, in The Harvey lectures, S. 60, 1965, pp. 217-59.
P.U. Angeletti, R. Levi-Montalcini, Sympathetic nerve cell destruction in newborn mammals, in Proceedings of the National Academy of Sciences USA, 1970, 65, pp. 114-21.
R. Levi-Montalcini, P.U. Angeletti, Ultrastructure and metabolic studies on sensory and sympathetic nerve cells treated with the nerve growth factor and its antiserum, in Hormones in development, ed. M. Hamburgh, E.J.W. Barrington, 1971, 56, pp. 719-30.
R. Levi-Montalcini, NGF: an uncharted route, in The Neurosciences, paths of discovery, ed. F.G. Worden, J.P. Swazey, G. Adelman, Cambridge (Mass.) 1975, pp. 245-65.
L. Aloe, R. Levi-Montalcini, Mast cells increase in tissues of neonatal rats injected with the nerve growth factor, in Brain research, 1977, 133, pp. 358-66.
R. Levi-Montalcini, P. Calissano, The nerve growth factor, in Scientific American, 1979, 240, pp. 67-77.
R. Levi-Montalcini, Aggression and violence: a psycho-biological and clinical approach, in Views on human aggressive behaviour and wars, ed. L. Valzelli, L. Morgese, Saint-Vincent 1981, pp. 21-30.
R. Levi-Montalcini, Il Nerve growth factor. Cenni storici sulla scoperta, risultati conseguiti e prospettive, in Cultura e scuola, 1981, 80.
Molecular aspects of neurobiology, ed. R. Levi-Montalcini, P. Calissano, E.R. Kandel, A. Maggi, Berlin-New York 1986.
S.E. Luria, Storie di biologia molecolare, Milano1987.
R. Levi-Montalcini, L. Aloe, E. Alleva, A role for nerve growth factor in nervous, endocrine and immune systems, in Progress in neuroendocrinimmunology, 1990, 3, pp. 1-10.
R. Levi-Montalcini, R. Dal Toso, F. Della Valle et al., Update of the NGF saga, in Journal of neurological sciences, 1995, 130, pp. 119-27.
R. Levi-Montalcini, S.D. Skaper, R. Dal Toso et al., Nerve growth factor: from neurotrophine to neurokine, in Trends in neurosciences, 1996, pp. 514-20.