Molecole
Molecole
La pubblicazione nel 1808 del New system of chemical philosophy di John Dalton riconfermò ‒ ma in un nuovo contesto ‒ l'idea lavoisieriana che tutti i corpi fossero riducibili a un certo numero di sostanze elementari, che a quell'epoca non superava la trentina. Tutto ciò avveniva all'interno dell'ipotesi ‒ già avanzata dai filosofi greci Leucippo e Democrito e ripresa in epoca romana da Lucrezio nel De rerum natura ‒ che i costituenti ultimi, invisibili, di tali elementi fossero oggetti indivisibili chiamati atomi, opportunamente classificati e identificati da Dalton con ideogrammi. Questi, poi, vennero sostituiti da Jöns Jacob Berzelius con i simboli tratti dalle prime lettere (una o due) del nome latino degli elementi, nomenclatura ancora in vigore. Dalton distingueva gli atomi in semplici e composti, e questi ultimi si può dire corrispondessero alle attuali molecole.
Nel XIX sec., tuttavia, regnò una certa confusione sulla terminologia utilizzata per denotare questi enti e i concetti a essa sottostanti. Fu solo nel 1858, infatti, con il Sunto di un corso di filosofia chimica di Stanislao Cannizzaro, che si ebbe la definizione rigorosa dei concetti di atomo e di molecola (e il calcolo preciso dei pesi atomici e molecolari relativi). Ciò fu possibile grazie all'elaborazione di una nuova teoria atomica e molecolare fondata ‒ più che sulle idee di Dalton ‒ sul principio di Avogadro (1811), riscoperto poi da André-Marie Ampère, Rudolf Clausius, James C. Maxwell e altri studiosi della teoria cinetica dei gas.
Nella prima metà del XX sec., i dubbi vennero gradualmente dissipati, e gli atomi e le molecole acquisirono importanza sempre maggiore nella fisica e nella chimica, con ampie ricadute successive anche su altre discipline, incluse le scienze della vita. Attualmente, infatti, si pensa che tutta la materia che ci è familiare sia costituita da atomi, mentre le molecole sono formate dall'unione degli atomi.
In seguito, grazie allo sviluppo degli studi sulle interazioni delle radiazioni elettromagnetiche con la materia, è stato possibile conferire alle molecole una ben definita struttura e caratterizzare la natura dei loro diversi stati energetici. L'avvento della meccanica quantistica ha offerto le basi concettuali per interpretare la complessa e variegata fenomenologia molecolare. Le nozioni acquisite erano destinate a giocare un ruolo determinante nella ricerca scientifica e tecnologica, fino a investire la nostra quotidianità, tanto che il termine molecolare ricorre frequentemente nel nostro linguaggio. I chimici sono oggi in grado di sintetizzare molecole con strutture sempre più diversificate e di costruire non solo le sostanze e gli oggetti presenti in natura, ma anche prodotti e materiali che non esistono in natura e hanno un vasto campo diapplicazione.
Tipologia molecolare
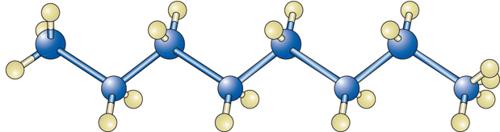
Con il suo enorme repertorio di composti, la chimica organica ci offre la possibilità di illustrare la grande varietà delle strutture molecolari, da quelle che costituiscono gli organismi viventi a quelle presenti in molti prodotti di largo impiego, quali i carburanti, i composti farmaceutici e i materiali polimerici. I capostipiti di tale ampia gamma di molecole sono gli idrocarburi, ovvero i composti fra carbonio e idrogeno. Negli idrocarburi saturi i legami fra gli atomi di carbonio danno origine a catene lineari, come nel n-ottano:
[1] formula
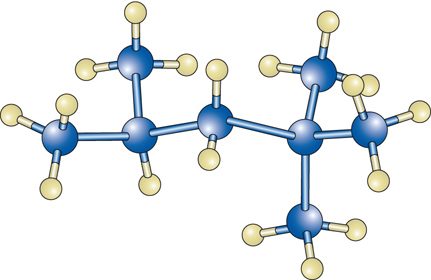
o ramificate, come nell'isoottano:
[2] formula
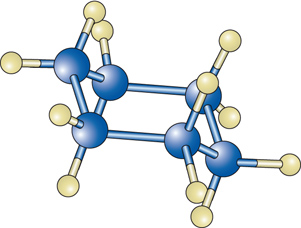
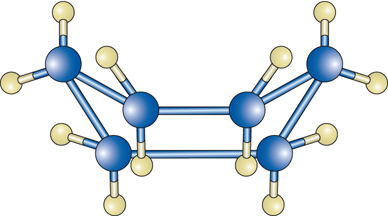
Queste strutture tridimensionali sono mutuate da quella del metano per cui ogni atomo di carbonio si trova al centro di un tetraedro i cui vertici sono occupati dagli atomi di carbonio o di idrogeno cui è legato. Se si uniscono gli estremi di una catena si ottengono composti ad anello, il più tipico dei quali è il cicloesano C6H12: che può assumere due configurazioni spaziali, dette rispettivamente a sedia [3a] e a tino [3b]:
[3a] formula[3
b] formula
Dalla fusione di molecole anulari diverse si possono ottenere nuove molecole dotate di curiose strutture poliedriche, come appare dagli scheletri strutturali di alcune di esse chiamate rispettivamente propellane (poiché ha la forma di un'elica), birdcage (poiché ha la forma di una gabbia) e twistane (poiché è attorcigliato):
[4] formula
Ancora più curiosi sono i cosiddetti catenani, i cui anelli sono infilati uno nell'altro, tanto da mettere in dubbio la stessa definizione di molecola:
[5] formula
Una molecola che ha acquistato particolare interesse a partire dalla metà degli anni Ottanta è il fullerene, costituito da 60 atomi di carbonio connessi fra di loro in una compagine di 20 anelli esagonali e 12 anelli pentagonali:
[6] formula
Si tratta di una grande molecola cava, con una configurazione sferica, che trae il suo nome da quello dell'architetto Richard B. Fuller, che ha disegnato famose cupole dotate di tale struttura.
Gli idrocarburi aromatici hanno come capostipite il benzene, la cui molecola è particolarmente stabile. La sua formula di struttura è stata proposta da August Kekulé nel 1866, il quale evidenziò che il benzene è un idrocarburo ciclico insaturo costituito da 6 atomi di carbonio collegati fra loro. Sembra che l'idea gli sia stata suggerita da un sogno nel quale erano presenti tre scimmiette che si tenevano per mano a formare un anello. La formula si rivelò molto efficace per lo studio di tutti i composti aromatici e di quelli poliaromatici, ottenuti per condensazione di due o più molecole di benzene.
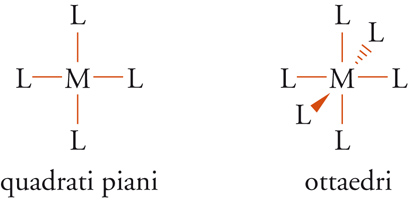
Gli atomi metallici, in particolare quelli di transizione (ferro, cobalto, platino), tendono a formare composti detti complessi di coordinazione, le cui molecole hanno particolari strutture nelle quali l'atomo metallico è circondato da 4 o 6 sostituenti genericamente indicati con L, anche se possono essere diversi fra di loro e chiamati leganti. Essi hanno le configurazioni spaziali definite dalle direzioni dei legami ai cui estremi si trovano i leganti stessi, quali per es.:
[7] formula
Un esempio tipico di complesso ottaedrico è costituito dal cloruro di esammino platino o [Pt(NH3)6]4+Cl4−.
Ovviamente, nel caso in cui i sostituenti siano diversi si può formare un elevato numero di stereoisomeri. In altri casi, invece, si possono formare composti pentacoordinati nei quali 5 gruppi sono uniti all'atomo centrale, formando così molecole che hanno strutture trigonali bipiramidali.
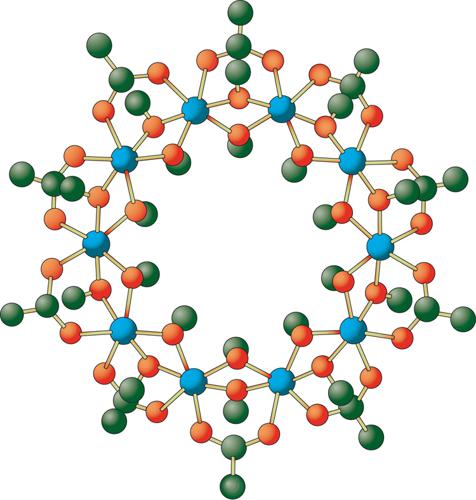
Nell'ampio e articolato panorama delle strutture molecolari alcune, come la ruota ferrica, sono molto particolari. Essa ha formula bruta [Fe(OCH3)2(O2CCH2Cl)]10 e possiede l'elegante struttura simmetrica illustrata nella fig. 2. Nonostante la sua apparente complessità, la molecola si prepara facilmente facendo reagire acetato basico di ferro con nitrato di ferro, che si autoassemblano attraverso una serie di stadi sino all'ottenimento del prodotto finale. È comunque interessante ricordare che le molecole più complesse esistenti in natura sono le macromolecole biologiche, come le proteine o il DNA, i cui atomi sono organizzati in modo tale da conferire loro una particolare funzionalità o un ben definito contenuto informativo.
Energetica molecolare
L'esistenza di strutture molecolari stabili è dovuta alla formazione di legami covalenti fra le diverse coppie di atomi. Questi legami si formano grazie alla tendenza degli atomi ad acquisire la configurazione elettronica stabile, che compete al gas raro che si trova sulla loro stessa riga del sistema periodico degli elementi. In tale configurazione sono presenti 8 elettroni nello strato esterno. Il merito di avere interpretato in questo modo la formazione dei legami covalenti, ipotizzando che essa potesse avvenire attraverso la messa in compartecipazione di 2, o più, elettroni di atomi diversi, spetta a Gilbert N. Lewis (1916). In questo modo si introduceva il concetto di coppia elettronica, anticipando l'idea della tendenza degli elettroni ad accoppiarsi. È curioso osservare che, per giustificare la sua ipotesi, Lewis postulò in un primo tempo la non validità della legge di Coulomb per distanze interelettroniche molto piccole. Solo successivamente, egli avrebbe abbandonato questa posizione, riconoscendo il ruolo della meccanica quantistica nella soluzione dei problemi della chimica.
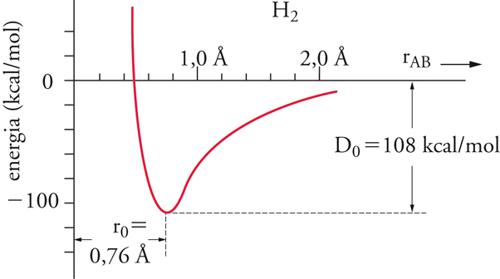
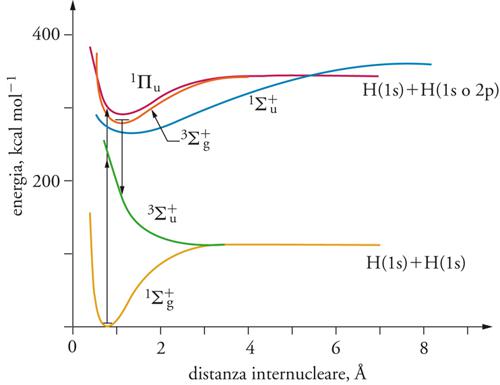
In una molecola biatomica l'energia del legame covalente si identifica con l'energia di dissociazione necessaria per formare i due atomi separati e coincide quindi con il lavoro richiesto per portare questi a distanza infinita. L'andamento dell'energia potenziale U(r) in funzione della distanza r fra gli atomi è illustrato nella fig. 3 per il caso specifico della molecola di idrogeno. L'energia di legame, a meno di un termine correttivo, dovuto all'energia di punto zero, è data dalla differenza fra il valore minimo ‒U0 dell'energia potenziale corrispondente a r0 , e il valore alla distanza infinita, che viene assunto convenzionalmente uguale a zero.
L'energia di atomizzazione Ea di una molecola poliatomica AaBbCc è l'energia richiesta per dissociarla, in fase gassosa, negli atomi separati gassosi alla temperatura di 298 K e alla pressione di 1 atm:
[8] AaBbCc(g) → aA(g) + bB(g) + cC(g)
dove (g) indica la fase gassosa.
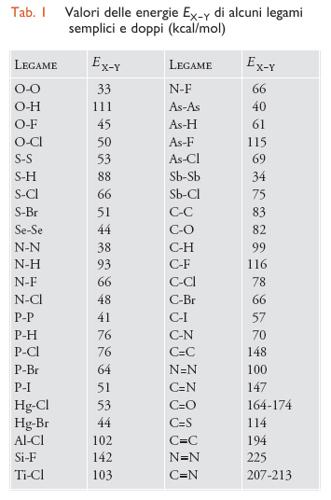
Combinando opportunamente i valori delle energie di atomizzazione dei composti coinvolti in una reazione chimica, è possibile calcolare la quantità di energia che viene liberata o assorbita dalla reazione. Si può attribuire a ciascun legame un valore medio caratteristico di energia EX−Y, ottenuto sperimentalmente da misure diverse, principalmente di carattere calorimetrico. Alcuni di tali valori sono riportati nella tab. 1. Da essi si ottiene:
[9] Ea = ∑nXYEX−Y.
La somma è estesa a tutti i tipi di legami presenti nella molecola, mentre nXY indica il numero di legami del tipo X−Y. Questa regola di additività va applicata con cautela poiché l'energia di un legame dipende, sebbene in piccola misura, dal contorno molecolare degli atomi in gioco. Inoltre, nel caso di molecole contenenti doppi e tripli legami adiacenti, si deve tenere conto dell'effetto stabilizzante dovuto alla coniugazione fra tali legami.
Le molecole biatomiche ci offrono la possibilità di evidenziare la natura e le caratteristiche dei legami chimici, e una posizione privilegiata spetta ovviamente a quella dell'idrogeno che, in virtù della sua semplicità, ha costituito la palestra per gli studi intesi ad approfondire la natura del legame covalente.
La sua interpretazione risale a un lavoro di Walter H. Heitler e Fritz W. London del 1927, che traeva spunto da una proprietà peculiare degli elettroni, ovvero la loro indistinguibilità. Questo fatto, come era già stato osservato da Werner Heisenberg in uno studio sull'atomo di elio, ha conseguenze più profonde di altre proprietà quali la forma, la massa e la carica. Se consideriamo 2 atomi di idrogeno, che indicheremo con A e B, a una distanza alla quale abbia luogo la formazione di un legame, in virtù della indistinguibilità degli elettroni si devono considerare due 'stati degeneri', ovvero aventi la stessa energia, derivanti dallo scambio dei due elettroni fra i due orbitali atomici in gioco, del tipo rispettivamente 1sA(1)1sB(2) e 1sA(2)1sB(1). La meccanica quantistica ci impone di utilizzare per la descrizione del sistema un'autofunzione costruita dalla combinazione lineare di quelle relative ai due stati considerati poiché si riferiscono a due situazioni indistinguibili, ovvero:
[10] ψ+=1sA(1)1sB(2)+1sA(2)1sB(1) ψ−=1sA(1)1sB(2)−1sA(2)1sB(1)
La ψ+ è una combinazione simmetrica poiché resta inalterata se si scambiano gli elettroni fra gli orbitali atomici mentre la ψ− è antisimmetrica poiché cambia di segno se si scambiano gli elettroni. È ora interessante osservare che se si valuta la probabilità di trovare i 2 elettroni nell'intorno dei 2 nuclei, risulta che nello stato simmetrico gli elettroni sono essenzialmente localizzati nella zona compresa fra i 2 protoni, mentre per lo stato antisimmetrico essi si trovano nella zona esterna. Per completare l'analisi, è necessario tenere conto di quella caratteristica degli elettroni chiamata spin, derivante dal fatto che essi si comportano come se fossero delle piccole trottole il cui asse risulta orientato in una direzione o nella direzione opposta. Se i 2 elettroni della molecola di idrogeno hanno gli spin orientati in senso diverso, ovvero sono antiparalleli, risultano descritti da una funzione di spin antisimmetrica, ovvero tale che se si scambiano le coordinate di spin dei 2 elettroni essa cambia di segno. In base al principio di esclusione di Pauli, gli elettroni devono essere descritti da un'autofunzione antisimmetrica; poiché l'autofunzione globale è espressa dal prodotto di quella di spin per quella orbitale, ne consegue che allo stato con i 2 spin antiparalleli si deve associare la funzione orbitale che porta a un accumulo di elettroni nella zona internucleare. Tale carica negativa scherma la repulsione coulombiana dei 2 nuclei e agisce come una colla, giustificando sia la formazione del legame covalente sia il ruolo delle coppie elettroniche preconizzato da Lewis. I calcoli condotti da Heitler e London portavano a un valore approssimato dell'energia di legame, ammontante a circa il 60% del valore sperimentale. Attraverso lavori successivi i calcoli sono stati migliorati sino ad arrivare in breve tempo, con un lavoro di Hubert M. James e Albert S. Coolidge del 1933, a un valore molto accurato dell'energia di legame, confermando definitivamente la validità dell'approccio seguito.
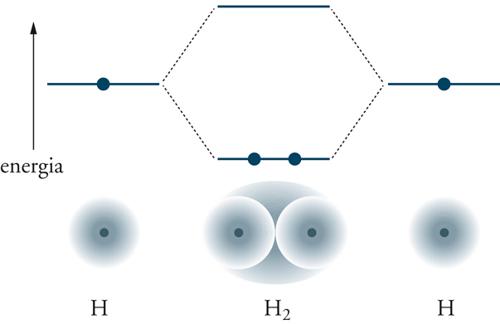
Nel modello degli orbitali molecolari, sviluppato da Friedrich Hund e Robert Mullikan, il comportamento degli elettroni viene descritto da funzioni monoelettroniche, che solitamente vengono espresse mediante una combinazione lineare degli orbitali atomici da cui provengono gli elettroni. Nella molecola di idrogeno, dalla combinazione degli orbitali atomici 1s si ottengono 2 orbitali molecolari che hanno le forme illustrate nella fig. 4. In sostanza da tale combinazione ha luogo una rottura di simmetria del sistema poiché da 2 stati atomici aventi la stessa energia, si ottengono 2 stati molecolari aventi diversa energia, rispettivamente con un valore minore e uno maggiore di quello degli stati atomici. Infatti, dalla simmetria sferica degli orbitali atomici si ottengono 2 configurazioni diverse, entrambe con simmetria cilindrica rispetto all'asse della molecola, e di riflessione rispetto al piano che passa perpendicolarmente nel punto centrale di tale asse. L'orbitale a energia più bassa, chiamato legante e indicato con la sigla σg1s, ha la forma di una palla ovale. Nello stato fondamentale della molecola esso ospita due elettroni a spin antiparallelo il cui moto è sostanzialmente localizzato nella regione internucleare. L'altro orbitale, caratterizzato con la sigla σu1s ha energia più elevata e viene chiamato antilegante. I pedici g (da gerade) e u (da ungerade) specificano se la funzione d'onda orbitale è rispettivamente simmetrica o antisimmetrica rispetto all'inversione.
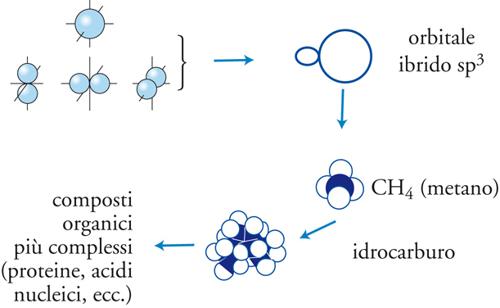
Ovviamente si possono costruire orbitali molecolari anche per combinazioni di orbitali atomici di tipo p e d. Studi di questa natura sono stati estesi a molte molecole biatomiche omonucleari ed eteronucleari e hanno rivelato che i legami chimici si manifestano nella direzione in cui risulta più elevata la sovrapposizione fra i lobi degli orbitali atomici in essi coinvolti. Per esempio nella molecola d'acqua, H2O, i 2 legami O−H fra l'atomo di ossigeno e 1 atomo di idrogeno coinvolgono 2 orbitali px e py dell'atomo di ossigeno e pertanto dovrebbero formare un angolo di 90°. In realtà la repulsione fra i 2 protoni aumenta tale valore a 104°. Di particolare interesse risulta ovviamente l'atomo di carbonio che, come dimostrato da Linus Pauling, può formare legami con altri atomi coinvolgendo 4 orbitali, detti ibridi sp3, che si dipartono dal centro di un tetraedro in cui è localizzato il nucleo dell'atomo stesso. Questa interpretazione permette di giustificare la struttura dei composti organici, come gli idrocarburi saturi, insaturi e aromatici (fig. 5).
Nel 1931 Edmund Hückel affrontò il problema della struttura elettronica del benzene, ipotizzando che 3 valenze di ciascun atomo di carbonio fossero impegnate sia per formare lo scheletro ciclico esagonale della molecola, sia per legarsi con gli atomi di idrogeno, coinvolgendo orbitali ibridi sp2 disposti su un piano a 120° fra loro. Il comportamento dei 6 elettroni rimanenti, ospitati in orbitali pz perpendicolari al piano della molecola, viene descritto mediante il metodo degli orbitali molecolari. In questo approccio i 6 elettroni coinvolti nella formazione dei doppi legami, detti π, risultano delocalizzati perché liberi di muoversi lungo 2 anelli a forma di ciambella che si trovano sopra e sotto il piano esagonale formato dagli atomi di carbonio. Recentemente, questa descrizione ha ricevuto una conferma dalle indagini ottenute con il microscopio a scansione a effetto tunnel. I dati sperimentali confermano chiaramente la presenza della nube di elettroni π. Per le molecole poliaromatiche i calcoli sono più complessi, ma è stato possibile formulare una semplice regola in base alla quale un composto ciclico insaturo risulta particolarmente stabile quando il numero di elettroni π è uguale a (4n+2) con n=1,2,3,… Con n=1 si ottiene il benzene, avente un sestetto di elettroni π che può essere interpretato come uno strato chiuso analogo all'ottetto di elettroni dei gas nobili.
Molecole eccitate
Una molecola isolata, per esempio presente in un gas a densità relativamente bassa è soggetta, oltre che a un movimento di traslazione, a un insieme di moti interni. L'energia ε dei moti interni può essere espressa come somma di tre termini:
[11] ε = εrot + εvib + εel
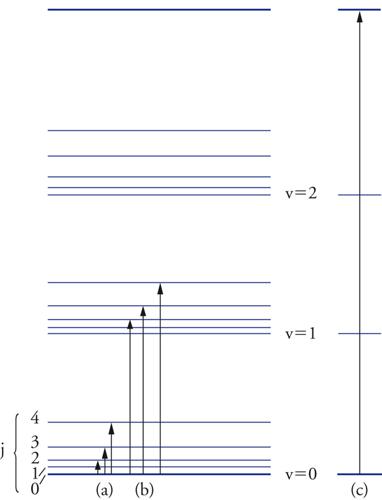
che si riferiscono rispettivamente alle rotazioni attorno al suo centro di massa, alle vibrazioni dei singoli atomi rispetto alle loro posizioni di equilibrio e infine all'energie che competono agli elettroni nei loro diversi stati. Queste energie sono quantizzate, ovvero possono assumere solo valori discontinui. Riferendoci a una molecola biatomica, nella tab. 2 sono riassunte le espressioni delle energie dei moti interni in funzione dei tipici parametri molecolari, quali il momento di inerzia, che si calcola dalla massa degli atomi e dalla distanza di legame r0, e la frequenza ν del moto di vibrazione. Le variazioni di energia fra due successivi moti interni dello stesso tipo seguono l'ordine seguente: Δεel > Δεvib > Δεrot. Pertanto ci si trova di fronte a una vera e propria gerarchia di livelli energetici, che ha le caratteristiche illustrate nella fig. 6: a ciascun stato elettronico corrispondono più stati vibrazionali, a ognuno dei quali corrispondono più stati rotazionali.
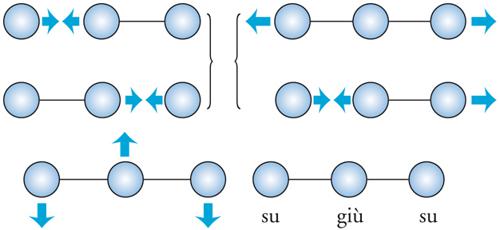
Anche per le molecole poliatomiche esistono diversi stati energetici associati sia ai moti elettronici sia ai moti interni rotazionali e vibrazionali. Ovviamente, questi ultimi risultano più difficili da descrivere a causa della maggiore complessità delle molecole. I moti di vibrazione coinvolgono l'intera struttura molecolare in movimenti collettivi che vengono chiamati modi normali; il caso della molecola lineare dell'anidride carbonica è illustrato nella fig. 7. Se le molecole sono formate da n atomi esistono 3n−6 (3n−5 se la molecola è lineare) modi di vibrazione normali, a ciascuno dei quali corrisponde una frequenza di vibrazione armonica.
Quando una molecola assorbe energia diviene più calda poiché viene eccitata ai livelli energetici più elevati. L'eccitazione avviene sia per effetto delle collisioni con altre molecole, sia per assorbimento di radiazioni elettromagnetiche, o fotoni, la cui energia dipende dalla loro frequenza attraverso la semplice relazione ε=hν. L'interazione di un fotone con una molecola può essere descritta come un urto fra particelle. L'urto si può considerare di tipo elastico, se nel processo non varia l'energia associata ai moti interni della molecola e sono semplicemente alterate le direzioni di moto dei due oggetti che collidono e l'energia cinetica traslazionale della molecola. Questi processi, come vedremo, riguardano i metodi di indagine diffrattometrici. Viceversa l'urto è anelastico se varia l'energia associata ai moti interni di una molecola e queste collisioni riguardano specificamente la spettroscopia molecolare.
L'assorbimento del fotone, quindi, è condizionato dal fatto che la sua energia eguagli la differenza fra l'energia della molecola nel suo stato fondamentale, non eccitato, e quella di uno dei suoi livelli più elevati, per cui si deve avere Δε=hν. Questo fatto pone in relazione lo spettro delle radiazioni con i diversi tipi di moti molecolari (fig. 6). Infatti le microonde sono calibrate sugli stati rotazionali, le radiazioni infrarosse su quelli vibrazionali, e, infine, quelle visibili e ultraviolette sulle transizioni elettroniche. In quest'ultimo caso, l'eccitazione può portare a uno stato elettronico non legante con conseguente dissociazione della molecola, come illustrato nella fig. 8 per la molecola d'idrogeno. L'interazione di una molecola con un fotone è di natura elettrica, per cui si esercita fra il campo elettromagnetico oscillante e la nuvola elettronica molecolare. La molecola, per assorbire o emettere un fotone, deve generare un campo elettrico che oscilla alla sua stessa frequenza, e affinché ciò si verifichi, è necessario che sia presente un'asimmetria nella distribuzione delle cariche elettriche positive dovute ai nuclei e quelle negative dovute agli elettroni, tale da produrre un dipolo avente un ben definito momento elettrico. Le transizioni fra livelli energetici, quindi, sono permesse o proibite sulla base di opportune regole di selezione che riflettono il fatto che esista o meno un cambiamento nella distribuzione della carica elettrica nello spazio.
Alcuni gruppi di atomi presenti in una molecola mostrano transizioni vibrazionali caratteristiche nella zona infrarossa dello spettro, indipendentemente dalla molecola in cui sono presenti. In virtù di questo fatto la spettroscopia infrarossa costituisce un importante mezzo diagnostico, poiché la presenza di bande di assorbimento corrispondenti a particolari frequenze permette di identificare le caratteristiche strutturali di un determinato composto.
I colori, invece, sono determinati dalle transizioni fra stati elettronici che avvengono nella zona del visibile dello spettro. Per esempio, il colore verde delle foglie è dovuto all'assorbimento dei fotoni blu e rossi da parte della molecola della clorofilla e alla riflessione di quelli verdi.
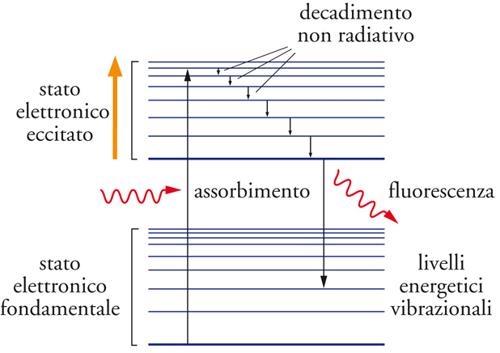
Le molecole che si trovano in uno stato elettronico eccitato tendono a dissociarsi, a isomerizzarsi o a interagire con altre molecole, partecipando così a particolari reazioni chiamate fotochimiche. Se ciò non si verifica decadono nuovamente nello stato fondamentale emettendo un fotone attraverso un processo chiamato fluorescenza, che può avere luogo gradualmente attraverso una successione di stadi, alcuni dei quali, come illustrato nella fig. 9, avvengono attraverso perdite di energia senza emissione di radiazione, per esempio attraverso collisioni con altre molecole.
Infine, ricordiamo che la luce diffusa da una molecola non contiene solo la frequenza della radiazione incidente rimbalzata in modo elastico, detta di Rayleigh, ma sono presenti, con più debole intensità, anche frequenze addizionali, tipiche delle oscillazioni molecolari. Questo fenomeno − messo in evidenza per la prima volta dal fisico indiano Chandrasekara Venkata Raman nel 1928 − è dovuto a una collisione anelastica fra il fotone e la molecola, in seguito alla quale questa subisce una transizione verso uno stato eccitato. L'effetto è particolarmente importante per condurre indagini sulle molecole, perché permette di evidenziare le frequenze delle loro vibrazioni mediante misure condotte nella più accessibile zona del visibile e dell'ultravioletto. Se il fotone incidente con frequenza νin possiede un'energia sufficientemente elevata, ne trasferisce una parte Δε=hν alla molecola, che passa dallo stato fondamentale a uno stato eccitato per cui l'energia del fotone diffuso con frequenza νout risulta espressa da
[12] hνout = hνin − Δε
da cui consegue che
[13] νout = νin − ν.
Ciascuno stato eccitato, quindi, può dare luogo a uno spostamento misurabile della frequenza della radiazione dispersa, dal quale si può risalire alla determinazione delle energie degli stati molecolari.
Lo studio dei moti che le molecole subiscono in seguito alle collisioni reciproche oppure alle interazioni con le radiazioni costituisce l'oggetto della dinamica molecolare, che in un certo senso rappresenta il punto di arrivo per la comprensione e il controllo delle trasformazioni che la materia subisce.
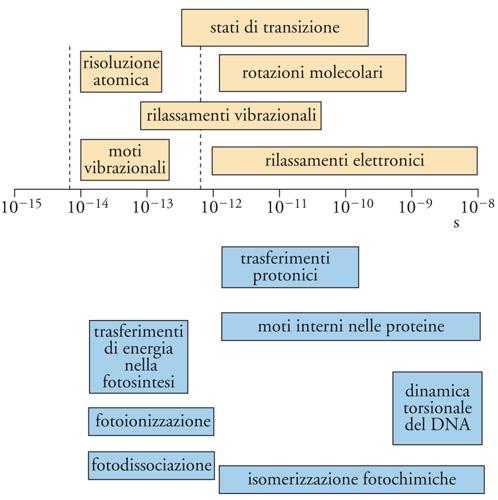
Negli ultimi anni, queste indagini si sono arricchite grazie all'impiego dei laser, con i quali è possibile ottenere impulsi di radiazione di durata molto breve, dai picosecondi (10−12 s) ai femtosecondi (10−15 s). Si tratta di una forma di spettroscopia ultrarapida che ha aperto la possibilità di esplorare i processi più rapidi che interessano le molecole, le cui scale temporali sono illustrate nella fig. 10. In essa vengono contemplati diversi tipi di processi molecolari che riguardano non solo i moti interni, ma anche i fotoeffetti indotti dalle radiazioni, oltre alla possibilità di esplorare le caratteristiche geometriche e dinamiche degli stati di transizione. Questi rappresentano il punto critico di una reazione chimica, quando, in seguito a una collisione, si forma un complesso molecolare che si trova in una situazione di incertezza fra la formazione di un nuovo legame e la rottura di uno preesistente.
Struttura e configurazione delle molecole
La struttura di molte molecole − caratterizzata dalle distanze fra gli atomi legati e dai valori degli angoli fra i corrispondenti legami − è attualmente nota grazie alle indagini sperimentali condotte mediante metodologie molto accurate.
Anzitutto, come abbiamo visto, per ottenere informazioni sulle dimensioni molecolari si possono utilizzare i dati spettroscopici ottenuti nella regione delle microonde, ovvero con lunghezza d'onda compresa nell'intervallo 1÷1200 cm. Infatti, le transizioni di energia Δεrot che condizionano l'assorbimento di tali radiazioni, come riportato nella tab. 2 per il caso specifico delle molecole biatomiche, dipendono dal momento d'inerzia della molecola che, a sua volta, dipende dalla massa degli atomi e dalla loro distanza. Pertanto, noti i valori sperimentali della frequenza della radiazione assorbita, è possibile risalire a Δεrot e, quindi, al momento d'inerzia, dal quale si valuta facilmente il valore della distanza internucleare. Si tratta di una tecnica accurata, ma che può essere applicata solo a molecole semplici in fase gassosa dotate di un momento dipolare.
I metodi più efficaci per la determinazione delle strutture molecolari sono basati sulla diffrazione di onde, in particolare di quelle elettromagnetiche. Infatti, se un raggio parallelo di luce monocromatica viene inviato su un reticolo di punti materiali aventi distanze confrontabili con la lunghezza delle onde incidenti, una parte della radiazione passa attraverso il reticolo indisturbata, mentre un'altra parte viene rimbalzata in modo elastico, o diffratta in altre direzioni. Si generano così delle macchie brillanti dovute agli effetti di interferenza che si manifestano fra i raggi che vengono rimbalzati, oppure riflessi, dai diversi piani del cristallo. La diffrazione è dovuta agli elettroni extranucleari degli atomi del solido, per cui ci offre un'immagine codificata della loro distribuzione all'interno delle celle unitarie del solido stesso. Poiché le distanze fra gli atomi in una molecola sono dell'ordine di 1 Å, ne consegue che i raggi X si rivelano particolarmente adeguati, considerato che le loro lunghezze d'onda ricadono in tale intervallo. Inoltre, poiché queste radiazioni sono in grado di penetrare nei solidi cristallini, la tecnica ha un'ampia potenzialità applicativa.
Ciascun atomo presente in un cristallo appartiene a una disposizione regolare tipica dovuta o alla struttura intrinseca del solido o a quella delle molecole di cui è costituito. Infatti, per un cristallo molecolare, il gruppo di atomi presente nella cella elementare − che rappresenta l'unità ripetitiva fondamentale − può essere costituito da una o più molecole. Dalla sovrapposizione coerente delle onde diffratte da tutti gli elettroni della sostanza irradiata, si ottengono così delle tipiche figure di interferenza che rispecchiano la disposizione regolare presente nel cristallo. L'analisi cristallografica mediante i raggi X fu introdotta nel 1912 da Max von Laue e in seguito perfezionata da Lawrence Bragg e dal figlio William. Oggi viene applicata comunemente grazie all'elevato e sofisticato grado di perfezionamento raggiunto. Non si deve però dimenticare che ciò è dovuto ad alcuni successi, letteralmente epici, realizzati durante lo sviluppo di questa tecnica: la determinazione della struttura delle molecole della vitamina B12 da parte di Dorothy Hodgkin, quella della mioglobina da parte di John Kendrew e quella della emoglobina da parte di Max Perutz. Tutti e tre questi scienziati, della Scuola di strutturistica di Cambridge diretta da John D. Bernal, sono stati insigniti del premio Nobel.
In alternativa all'impiego delle radiazioni, i metodi diffrattometrici possono utilizzare particelle materiali come gli elettroni e i neutroni, che hanno un comportamento ondulatorio compatibile con la relazione di de Broglie, in base alla quale a una particella di massa m e velocità v è associata un'onda di lunghezza λ=h/mv. Se si opera con un fascio di elettroni, esso viene fatto passare attraverso un campione di una determinata sostanza presente in fase gassosa, perché ciascuna molecola si possa considerare isolata. In questo caso il campione offre al fascio incidente tutte le sue possibili orientazioni delle distanze interatomiche diffondenti, per cui la corrispondente figura di diffrazione è data dalla loro sovrapposizione. Pertanto, essa va attribuita non solo alle distanze fra gli atomi direttamente legati, ma anche a quelle di tutte le possibili coppie esistenti. Ne consegue che l'analisi dello spettro di una molecola ricca di atomi si presenta di particolare complessità.
I neutroni generati da un reattore nucleare, in virtù della loro massa elevata, hanno lunghezze d'onda dell'ordine di 1 Å, e quindi un potere penetrante molto superiore a quello degli elettroni. Per questa ragione, se essi vengono impiegati per determinare la struttura di sostanze condensate, si ottengono mappe di densità elettronica più uniformi di quelle ottenute con i raggi X, dalle quali risulta possibile individuare anche la posizione degli atomi di idrogeno. Sfortunatamente un fascio neutronico della dovuta intensità si può ottenere solo mediante un reattore nucleare, per cui l'applicazione della tecnica resta limitata a particolari laboratori.
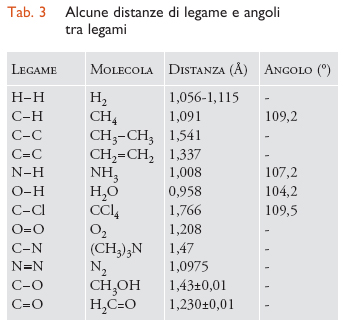
I molteplici studi sulle strutture molecolari condotti sinora hanno permesso di individuare alcuni valori medi delle distanze e degli angoli di legame ricorrenti nelle comuni molecole (tab. 3). Questi dati possono essere impiegati per effettuare ragionevoli ipotesi sulle strutture molecolari non note.
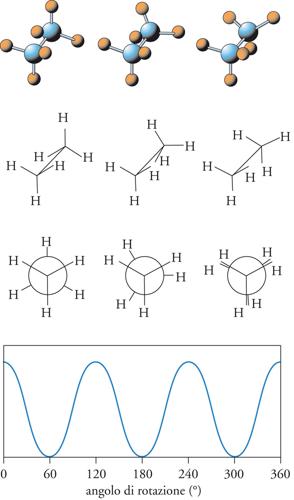
In realtà, per caratterizzare quella che viene chiamata la conformazione di una molecola, non è sufficiente assegnare le distanze interatomiche e gli angoli di legame, ma è necessario individuare anche gli angoli di torsione, che specificano le posizioni relative degli atomi appartenenti a due gruppi legati fra di loro da un legame covalente semplice, come illustrato nella fig. 11 per la molecola dell'etano. Se la rotazione attorno al legame C−C fosse completamente libera questo problema non sus-sisterebbe; in realtà le interazioni fra gli atomi di idrogeno limitano tale rotazione e finiscono per favorire le conformazioni, che risultano di energia più bassa, nelle quali essi non sono direttamente affacciati.
Il caso delle molecole polimeriche è ovviamente più complicato ed è interessante illustrarlo prendendo in considerazione il caso specifico, di grande importanza, dei polipeptidi, le cui catene sono i costituenti delle proteine.
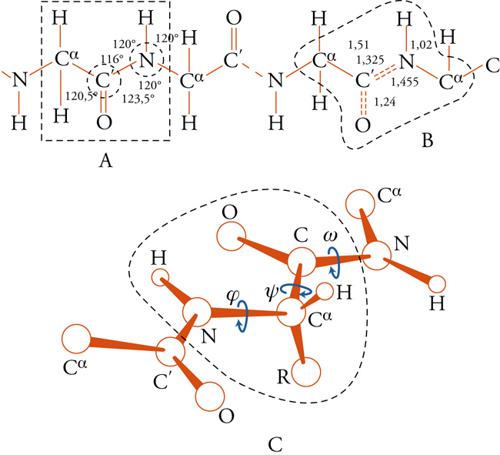
Le proteine hanno la composizione chimica riportata nella fig. 12. Il legame peptidico si ottiene per eliminazione di 1 molecola d'acqua da 2 molecole di amminoacidi. Nelle proteine naturali sono presenti circa 20 amminoacidi che differiscono per le caratteristiche del gruppo che sostituisce l'idrogeno nel carbonio Cα. Esistono tre angoli di torsione, indicati con φ,ψ e ω, che portano ovviamente a un'amplissima varietà di conformazioni, ciascuna con una diversa energia Φ, con una distribuzione compatibile con il fattore di Boltzmann espresso dalla relazione exp(−Φ/kT).
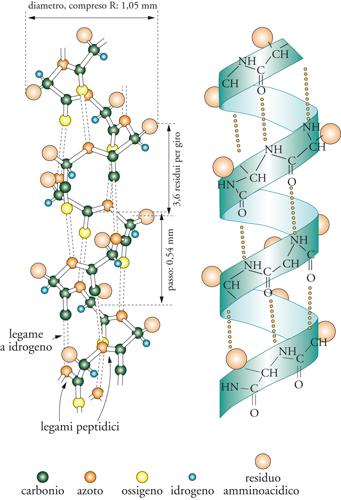
Talora nelle macromolecole si possono formare dei legami fra gli atomi di idrogeno dei gruppi ossidrilici e un atomo di ossigeno adiacente del tipo −O−H∙ ∙ ∙O. Pur avendo un'energia di legame relativamente bassa, circa 5 kcal/mole, questi legami a idrogeno possono contribuire in modo significativo alla determinazione della conformazione delle molecole, come si riscontra nel caso dei polipeptidi, che nella forma cristallina assumono la conformazione dell'α-elica di Pauling (fig. 13).
Molecole e supermolecole della vita
Il biologo John B. S. Haldane sosteneva che la vita è un intreccio di processi chimici che si autoregolano e alla cui base stanno particolari molecole che hanno la capacità di esercitare ben definite funzioni. In forma diversa, Francis Crick − lo scopritore insieme a James Watson della struttura a doppia elica del DNA − ha affermato che quasi tutti gli aspetti della vita sono gestiti a livello molecolare e, pertanto, se non si capiscono le molecole si può aver solo una grossolana comprensione della vita. In realtà, anche se il chiarimento dei meccanismi sottostanti ai processi vitali contribuisce sicuramente alla loro comprensione, è però ancora dubbio se essi si possano semplicemente ridurre a interazioni fra molecole. Infatti, allo stato attuale, non è possibile stabilire se la conoscenza delle caratteristiche delle molecole e delle loro interazioni ci possa offrire una risposta ai seguenti quesiti: in che modo un insieme di molecole può dare origine alla varietà di comportamenti che caratterizzano le cellule? In che modo le molecole possono assemblarsi così da avere la capacità di dissipare energia, di autoreplicarsi e di adattarsi all'ambiente?
Le molecole presenti nei sistemi viventi danno origine a una gerarchia di strutture sempre più complesse la cui funzionalità acquisisce un livello sempre più elevato. Può essere interessante descrivere lo sviluppo di tale complessità confrontandola con quella del linguaggio, secondo lo schema illustrato nella tab. 4, in cui le lettere dell'alfabeto vengono assimilate agli atomi, le parole alle molecole e così via. L'analogia, ovviamente, può essere estesa sino alle strutture cellulari, ma è opportuno essere consapevoli che la logica con la quale sono costruite le molecole e le supermolecole dagli atomi è quella riduzionistica. La stessa logica, cioè, che partendo dai nuclei e dagli elettroni − e applicando la meccanica quantistica − consente di risalire agli atomi, alle molecole e quindi alla materia massiva nei suoi diversi stati. Il linguaggio, invece, ha origini connesse con la psiche umana.
Ciò premesso, è indiscutibile che le molecole coinvolte nei sistemi viventi siano in grado di esercitare funzioni specifiche e fra di esse una particolare posizione spetta alle proteine, che sono polimeri naturali aventi la struttura chimica illustrata in precedenza. È stato detto che è improbabile che, nell'intero Universo, possa esistere un qualunque tipo di molecola con proprietà più notevoli di quelle delle proteine. Negli organismi viven-ti esiste un'ampia varietà di proteine, che differiscono per la sequenza degli amminoacidi, i quali a loro volta si distinguono per la natura del gruppo che sostituisce l'atomo di idrogeno nel carbonio Cα presente nella catena. Le proteine esercitano diverse funzioni, in particolare di sostegno, ma soprattutto catalitiche, poiché in qualità di enzimi sono in grado di aumentare la velocità di particolari reazioni biochimiche. Questa azione catalitica viene esercitata da particolari centri (siti attivi), la cui configurazione locale deriva da un processo di ripiegamento, o folding, della macromolecola, mediante il quale, con un meccanismo non ancora del tutto compreso, la macromolecola si avvolge su se stessa acquisendo la struttura di un gomitolo compatto. Viene così raggiunta una particolare configurazione tridimensionale, unica fra le molte possibili che differiscono molto poco in energia, che determina le funzioni della molecola.
In realtà, nelle proteine esistono 4 livelli strutturali. Il primo indica semplicemente la successione degli amminoacidi (struttura primaria); il secondo (struttura secondaria) è per esempio, ma non solo, rappresentato dall'α-elica illustrata nella fig. 13, l'α-elica avvolgendosi su se stessa porta al terzo livello (struttura terziaria); a loro volta le unità terziarie unendosi assieme portano alla struttura più complessa (struttura quaternaria) che costituisce una supermolecola dotata di una specifica attività biologica. Nel caso specifico dell'emoglobina 4, strutture terziare (costituite principalmente da α-eliche) si assemblano formando una supermolecola che contiene globalmente 3000 atomi e ha un peso molecolare di 65.000. L'emoglobina, come è noto, è contenuta nel sangue ed è in grado di fissare ossigeno nei polmoni, dove la pressione parziale di ossigeno è relativamente elevata, e di rilasciarlo nei tessuti dove la sua concentrazione è bassa. L'emoglobina, la cui struttura è illustrata nella fig. 14, contiene quattro gruppi prostetici detti emi, che sono composti di coordinazione del ferro con le porfirine, ciascuno dei quali ha la proprietà di fissare una molecola di ossigeno contribuendo così al suo trasporto negli organismi. L'emoglobina, come è stato osservato per la prima volta da Perutz, aumenta di volume e cambia di forma quando contiene ossigeno, per cui è stata anche battezzata la molecola che respira.
La capacità delle molecole di associarsi è alla base della formazione in natura anche di strutture che operano mediante movimenti meccanici rotatori o lineari. Uno degli esempi più significativi è quello preposto alla trasformazione, per reazione con l'acido fosforico ed eliminazione di acqua, dell'adenosindifosfato (ADP) ad adenosintrifosfato (ATP), una molecola importante che agisce da vettore energetico nei processi biochimici, liberando energia attraverso la reazione inversa a quella con cui si forma.
Bibliografia
Atkins 1992: Atkins, Peter W., Molecole, Bologna, Zanichelli, 1992 (ed. orig.: Molecules, New York, Scientific American Library, 1987).
Ball 1994: Ball, Philip, Designing the molecular world, Princeton, Princeton University Press, 1994.
Balzani 2002: Balzani, Vincenzo - Credi, Alberto - Venturi, Margherita, The bottom-up approach to molecular-level devices and machines, "Chemistry", 8, 2002, pp. 5524-5532.
Califano 1979: Califano, Salvatore, Molecole. Metodi di indagine strutturale, in: Enciclopedia del Novecento, Roma, Istituto della Enciclopedia Italiana, 1979, IV, pp. 369-377.
Carrà 1990: Carrà, Sergio, Termodinamica, Torino, Bollati-Boringhieri, 1990.
Durand, Favard 1970: Durand, Michel - Favard, Pierre, La cellula, struttura e anatomia molecolare, Milano, Mondadori, 1970 (ed. orig.: La cellule, Paris, Hermann, 1967).
Hoffmann 1990: Hoffmann, Roald, Molecular beauty, "Journal of aesthetics and art criticism", 48, 1990, pp. 191-204.
Hoffmann 1993: Hoffmann, Roald, Come dovrebbero ragionare i chimici?, "Le scienze", aprile, 1993, p. 72.
Lehn 1995: Lehn, Jean-Marie, Supramolecular chemistry, Weinheim, VHC, 1995.
Natta, Farina 1968: Natta, Giulio - Farina, Mario, Stereochimica, Milano, Mondadori, 1968.
Schellman, Schellman 1979: Schellman, John A. - Schellman, Charlotte G., Molecole. Analisi conformazionale delle grandi molecole, in: Enciclopedia del Novecento, Roma, Istituto della Enciclopedia Italiana, 1979, IV, pp. 388-413.
Wheatley 1958: Wheatley, Peter J., The determination of molecular structure, Oxford, Clarendon, 1958.
Zewail 2000: Zewail, Ahmed H., Femtochemistry: atomic scale dynamics of the chemical bond using ultrafast laser, "Angewandte Chemie. International edition", 39, 2000, pp. 2586-2631.