Molecola
Molecola
(XXIII, p. 548; App. II, ii, p. 338)
Molecole messaggere gassose
Nell'organismo vivente, ordini e informazioni percorrono una rete nella quale le fibre nervose e gli ormoni veicolati dal sangue trasmettono a lunga distanza messaggi che vengono selezionati, smistati, rinforzati o attenuati dai messaggeri, m. biologicamente attive che operano nelle stazioni intercalate su questa rete. Agiscono come messaggeri i neurotrasmettitori che, nella catena di eventi che porta un impulso nervoso ad attivare una risposta biologica, occupano la prima posizione; ad essi fanno seguito i secondi messaggeri e gli autacoidi od ormoni locali, che agiscono in prossimità del sito dal quale vengono liberati. A partire dal 1994, all'ossido d'azoto (NO) e, con ragionevole evidenza, al monossido di carbonio (CO), due gas fino a quel momento noti per la loro elevata tossicità, sono state riconosciute proprietà di messaggeri nettamente distinte da quelle dei classici neurotrasmettitori. Questi, presenti in depositi inattivi intracellulari e veicolati all'esterno da complessi meccanismi di estrusione, attivano recettori specifici che ne riconoscono la conformazione molecolare e vengono successivamente inattivati per rifissazione nei depositi o per demolizione a opera di enzimi specifici. I messaggeri gassosi entrano in azione non appena sintetizzati all'interno della cellula e si diffondono liberamente nelle strutture circostanti ove, reagendo con molteplici substrati biologici, evocano risposte funzionali fino al momento in cui la loro concentrazione non scende al di sotto dei limiti di efficacia.
Ossido d'azoto
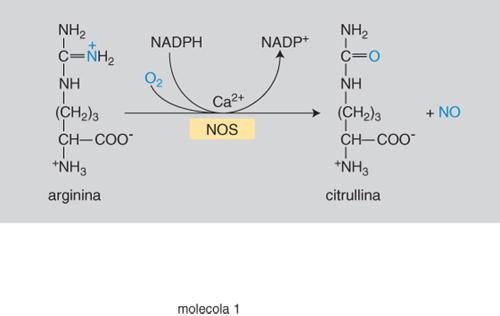
Biosintesi. - L'ossido d'azoto deriva dall'aminoacido arginina che un processo ossidativo trasforma nell'aminoacido citrullina con liberazione di NO (fig. 1). La reazione è catalizzata dalla nitrossidosintetasi (NOS), enzima di cui si distinguono due fondamentali categorie: quella costitutiva (cNOS) e quella inducibile (iNOS). Della prima, presente nel sistema nervoso, in quello cardiovascolare, gastrointestinale e urogenitale, in diversi elementi del tessuto connettivo e nel surrene, si conoscono due isoforme di cui è stata identificata la struttura: la NOS neuronale (nNOS o di tipo i) e la NOS endoteliale (eNOS o di tipo iii). Le cNOS entrano in azione quando si verifichi un aumento del calcio intracellulare per azione di agenti chimici (in particolare neurotrasmettitori) o fisici (attrito di scorrimento del sangue sull'endotelio dei vasi). Ne deriva una produzione fasica di NO nella quale minime quantità del messaggero (al disotto dei decimilionesimi di milligrammo) vengono prodotte in fugaci anche se ripetute fasi della durata di qualche frazione di secondo.
La iNOS, la cui struttura è nota per l'isoforma estratta dai macrofagi (macNOS o di tipo ii), è normalmente assente dai tessuti, ma viene sintetizzata da un'ampia varietà di cellule nel corso dei processi infiammatori e immunitari (fig. 2). L'attività della iNOS non è soggetta al controllo del calcio intracellulare, ma dipende esclusivamente dalla quantità di iNOS sintetizzata. In questo caso la produzione di NO si avvia lentamente ma dura a lungo, raggiungendo a distanza di ore dall'inizio della sintesi dell'enzima valori anche mille volte superiori a quelli prodotti dalla cNOS.
Reazioni con i substrati biologici. - La molecola di NO ha la configurazione elettronica dei radicali liberi (v. radicali liberi, App. V) e di questi condivide l'instabilità (la sua emivita è di pochi secondi) e l'elevata reattività. NO interagisce con enzimi contenenti ferro sotto forma di complesso ferroporfirinico (eme) o ferrosolforato, con enzimi dotati di gruppi essenziali solforati, con le basi della doppia elica del DNA o con altri radicali liberi che possono formarsi nel corso della respirazione cellulare.
Le conseguenze biologiche di queste reazioni sono molteplici, talora contrastanti e spesso non ben definite per l'ampia gamma di processi che NO può attivare o inibire e per la variabilità degli effetti che l'attivazione o l'inibizione di un medesimo meccanismo determina sia in strutture biologiche diverse, sia in una medesima struttura quando questa si trovi in differenti stati biochimico-funzionali.
I legami di NO con i diversi substrati portano non solo allo smaltimento della m. attiva ma, in qualche caso, alla formazione di complessi dotati di azione più duratura (nitrosotioli derivanti dalla reazione con composti solforati sono presenti nelle vie aeree dell'uomo, dove eserciterebbero azione broncodilatatrice) o capaci di trasferire NO liberandolo a distanza dal luogo di sintesi (l'emoglobina, potente fissatore di NO, può cederlo ai tessuti insieme all'ossigeno che trasporta).
Aspetti funzionali. - È ormai accertato il ruolo che l'ossido d'azoto svolge in diversi processi sui quali si articola, dai celenterati ai vertebrati, la fisiologia animale. Tuttavia il quadro più completo di quella che può definirsi la funzione nitrergica emerge dagli studi sperimentali sui mammiferi e dalla loro integrazione con i dati della fisiologia e della fisiopatologia umana.
Numerosi effetti biologici dell'ossido d'azoto sono legati alla caduta del calcio intracellulare indotta dall'attivazione NO-dipendente dell'enzima ferroporfirinico guanililciclasi; questa attivazione porta alla sintesi di guanosinmonofostato ciclico (cGMP) dotato di azione moderatrice sul livello del calcio intracellulare. È cGMP-dipendente l'azione rilasciante sulla muscolatura liscia: ne è espressione la dilatazione dei vasi arteriosi che ha portato a identificare nell'ossido d'azoto il fattore precedentemente noto come rilasciante di origine endoteliale (EDRF, Endothelial Derived Relaxing Factor), contribuendo, insieme agli studi sulla fagocitosi, a definirne il ruolo fisiologico.
L'azione vasorilasciante nitrergica opera in modo discreto sull'intero sistema circolatorio esercitando un controllo moderatore continuo sulla pressione arteriosa; questo spiega l'ipertensione che accompagna il deficit della funzione nitrergica indotta sperimentalmente (topi geneticamente privi di eNOS), ma anche documentata in alcune casistiche di ipertensione umana. Circoscritta a un singolo distretto vascolare (cerebrale, polmonare, renale), la vasodilatazione nitrergica collabora con altri sistemi di controllo nell'adeguare il flusso ematico alle esigenze funzionali e alle richieste nutritizie degli organi irrorati.
Nel sistema nervoso NO agisce con meccanismi in parte da chiarire, non solamente associati all'attivazione della guanililciclasi. A livello periferico la presenza di nNOS nelle fibre nervose in precedenza genericamente definite non adrenergiche non colinergiche (NANC) le ha fatte identificare come nervi nitrergici dotati di azione rilasciante cGMP-dipendente sui bronchi e sul tratto gastrointestinale e di attività vasodilatatrice sui distretti cerebrale, retinico e urogenitale, ove integra quella dell'ossido d'azoto di origine endoteliale. L'intervento della funzione nitrergica sul sistema nervoso centrale è sostenuto dai dati biochimici (presenza di nNOS in regioni discrete dell'encefalo, stimolazione della produzione di NO da parte dell'acido glutammico, ben noto mediatore dell'attivazione neuronale) e da osservazioni funzionali condotte su una serie di modelli sperimentali che, dalle colture in vitro, si estende fino ai paradigmi comportamentali dell'animale integro. Ne è uscita suffragata l'esistenza di una componente nitrergica nei processi dell'apprendimento, della memoria e dell'alternanza sonno-veglia, nella funzione visuale retinica, in quella nocicettiva delle vie dolorifiche e nel controllo centrale di varie funzioni autonome (circolazione, lacrimazione, salivazione).
Agli effetti cGMP-dipendenti che NO esercita sulle piastrine circolanti nel sangue e sulla mucosa gastroenterica si associa una componente sostenuta dalla prostaciclina sintetizzata dalla ciclossigenasi, altro enzima ferroporfirinico attivato dall'ossido d'azoto.
Entrambe le componenti inibiscono l'aggregazione piastrinica e quindi mediano gli effetti antiaggreganti piastrinici con cui l'ossido d'azoto di origine endoteliale evita, in condizioni fisiologiche, il verificarsi di una coagulazione intravasale. Allo stesso sinergismo deve attribuirsi l'accentuata resistenza agli agenti lesivi indotta dalla funzione nitrergica sulla mucosa gastroenterica.
Sul versante fisiopatologico gli effetti vascolari nitrergici assumono un ruolo dominante negli stati di collasso da shock settico.
In questi casi la massiccia produzione di NO da parte della iNOS indotta dagli agenti tossinfettivi porta non solo a vasoparalisi ma anche a insufficienza cardiaca per l'emergere dell'attività deprimente sul miocardio, latente in condizioni normali, che l'ossido d'azoto esercita con meccanismo cGMP-dipendente. Alcuni quadri di patologia polmonare e gastrointestinale sono riferibili a deficit localizzati dell'attività miorilasciante nitrergica. Nell'ipertensione primitiva del piccolo circolo, dovuta a un abnorme stato di costrizione delle arterie polmonari, risulta ridotto il contenuto in NOS del tessuto polmonare. A livello gastrointestinale, l'ipertrofia pilorica congenita del neonato si associa a un deficit locale di NOS cui è imputabile l'eccessivo sviluppo e l'anormale stato di contrazione dello sfintere che ostacolano il passaggio del contenuto gastrico all'intestino.
Ai limiti tra fisiologia e patologia, i processi immunitari e infiammatori attivano una componente nitrergica, sostenuta in modo preponderante dalla iNOS e mediata da meccanismi di trasduzione non sempre ben definiti ma in parte non trascurabile indipendenti dal cGMP. Critico è l'intervento nitrergico nell'attività fagocitaria dei macrofagi: se la sintesi di NO è bloccata, i macrofagi non riescono ad aggredire e ad avviare a smaltimento gli agenti tossinfettivi e gli elementi biologici estranei all'organismo (cellule derivanti da trapianti eterologhi o da processi neoplastici). L'alterata funzione macrofagica si riconduce all'assenza degli effetti citotossici che NO esercita inibendo gli enzimi ferro-solforati e quelli solforati della respirazione e della nutrizione cellulare. Di questi effetti citotossici, essenziali per l'attacco macrofagico agli elementi estranei, sarebbero vittime in un secondo tempo i macrofagi stessi che vedrebbero concludersi con la morte il ciclo funzionale avviato dalla loro attivazione. Non è questo l'unico esempio di apoptosi (morte cellulare programmata; v. cellula, in questa Appendice) in cui sia coinvolta la funzione nitrergica; pur con un meccanismo diverso (liberazione di aminoacidi eccitatori) NO risulta capace di indurre apoptosi in alcuni neuroni del cervelletto.
Nei processi immunitari e infiammatori che accompagnano e seguono l'attivazione macrofagica, l'intervento dell'ossido d'azoto non è altrettanto univoco, ma risulta in realtà coerente con la complessità dei meccanismi che ora attivano, ora tengono a freno questi processi. L'ossido d'azoto di origine macrofagica esercita infatti azione pro-infiammatoria promuovendo la sintesi di prostaglandine per attivazione della ciclossigenasi, ma agisce anche in senso moderatore non solo inibendo l'attività ciclossigenasica in alcuni elementi del sistema nervoso centrale ma anche rallentando la proliferazione di alcune linee cellulari del sistema immunitario dotate di azioni citotossiche. D'altra parte, fra i mediatori dell'infiammazione (citochine) alcuni avviano l'induzione di iNOS, altri la inibiscono.
La partecipazione della funzione nitrergica ai meccanismi di difesa infiammatori e immunitari ne rende implicito l'intervento anche quando questi meccanismi operino al di là dei fini utili che a essi si riconoscono, dando origine alle manifestazioni infiammatorie e degenerative della patologia immune e autoimmune. Si collocano in quest'area non solo la malattia articolare reumatica e alcune forme di anemia o di severa insufficienza renale per le quali non si esclude l'intervento degli effetti citotossici dell'ossido d'azoto, ma anche alcuni quadri di cirrosi epatica e di diabete dei quali esistono modelli sperimentali ove le componenti nitrergiche operano in gran prevalenza in senso lesivo ma talora anche in senso protettivo, almeno in alcuni modelli sperimentali di cirrosi.
Nella patologia infiammatoria e degenerativa del sistema nervoso centrale si ipotizza l'intervento di fenomeni citotossici NO-dipendenti nella patogenesi della malattia di Parkinson e nella sclerosi multipla. Più dettagliati ma non conclusivi sono i dati sui rapporti fra funzione nitrergica e proteina virale gp 120 dello HIV, alla cui azione neurotossica si è sostenuto debbano in parte ricondursi le manifestazioni demenziali dell'AIDS. In questo campo l'intervento dell'ossido d'azoto varia, col variare delle condizioni sperimentali, da un sinergismo a un antagonismo, confermando l'ambivalenza degli effetti nitrergici, già osservata nei modelli sperimentali di cirrosi e ancor più evidente nella patologia cerebrale e cardiaca di origine vascolare.
A livello cerebrale le lesioni prodotte dall'ostruzione di un vaso arterioso vengono contenute e ridotte dalla vasodilatazione e dall'aumento dell'apporto ematico che ne deriva, per attivazione della eNOS e della nNOS, nelle zone circostanti a quella compromessa. Viceversa la contemporanea induzione di iNOS a opera dei prodotti di disgregazione dei tessuti sofferenti innesca e aggrava i fenomeni regressivi con la mediazione di ancora incerti meccanismi di trasduzione. Nel cuore colpito da infarto, la vasodilatazione da NO di origine endoteliale e nervosa esercita analoghi effetti protettivi; la concomitante depressione nitrergica dell'attività meccanica del cuore, se contenuta, può essere benefica in quanto riduce le richieste energetiche di un miocardio poco irrorato, ma diventa deleteria se innesca una profonda ipodinamia cardiaca per eccessiva induzione di iNOS.
Aspetti farmacoterapeutici. Si collegano alla funzione nitrergica i farmaci mimetici, che riproducono gli effetti biologici dell'ossido d'azoto, e quelli antagonisti che li bloccano. Fra i primi si annovera lo stesso NO che, somministrato in concentrazioni minime con l'aria inspirata, penetra in circolo a livello polmonare ma non raggiunge in forma attiva la circolazione generale in quanto si lega rapidamente all'emoglobina. Ne deriva un'azione ipotensiva arteriosa esclusivamente localizzata a livello polmonare, alla quale si è fatto ricorso, con qualche beneficio, in alcune forme congenite del neonato e in diverse affezioni dell'adulto dominate da ipertensione polmonare con deficit dell'ossigenazione del sangue.
I nitrovasodilatatori o donatori di NO (nitrati e nitriti) introdotti in terapia prima ancora che ne fosse chiarito il meccanismo d'azione, sono tuttora utilizzati nel trattamento dell'angina pectoris e in quello delle crisi ipertensive arteriose. La ricerca farmacologica tende, in questo campo, a superare alcuni aspetti sfavorevoli dell'azione dei nitrovasodilatatori, in particolare la fugacità dei loro effetti e i fenomeni di assuefazione che accompagnano il loro ripetuto e prolungato impiego.
Capostipite degli inibitori della funzione nitrergica è un analogo dell'arginina (la N-monometil-L-arginina o LNMMA) che occupa sulla m. della NOS il sito di riconoscimento del substrato e impedisce all'enzima di operare sull'arginina, precursore naturale di NO. Sul piano sperimentale questo e altri analoghi inibitori hanno avuto un peso determinante nell'identificazione del ruolo fisiologico e fisiopatologico dell'ossido d'azoto. Sul piano terapeutico l'impiego di questi composti appare ricco di incognite per il possibile associarsi al blocco degli effetti indesiderati quello delle funzioni utili dell'attività nitrergica. Così nell'impiego orientativo degli antagonisti della NOS nello shock settico, agli effetti vantaggiosi dell'inibizione della iNOS, la cui iperattività è responsabile del collasso circolatorio, si sono accompagnate le conseguenze sfavorevoli del blocco della nNOS e della eNCS cui competono importanti funzioni di sostegno della circolazione in organi di importanza vitale quali il cervello, il rene e il fegato. La ricerca in questo campo tende quindi a identificare composti capaci di agire sulle singole isoforme di NOS con efficacia ben più preferenziale, se non selettiva, di quella finora osservata per alcuni antagonisti.
Posizione peculiare fra gli antagonisti occupano gli ormoni glucocorticoidi del surrene (cortisone e analoghi) che, senza interferire sull'azione della NOS, inibiscono agli agenti induttori di avviare la sintesi dell'enzima. Dato l'importante ruolo pro-infiammatorio della iNOS, tale azione è certamente coinvolta negli effetti antinfiammatori dei glucocorticoidi; resta incerto quanto a essa debbano ascriversi gli effetti favorevoli che si imputano alla somministrazione di massicce dosi di questi ormoni nel trattamento dello shock settico.
Monossido di carbonio
Il capitolo dei messaggeri gassosi, aperto dagli studi sull'ossido d'azoto, sembra potersi estendere a comprendere il monossido di carbonio (CO), che del primo condivide non poche proprietà biochimiche e funzionali. Si tenga presente che il monossido di carbonio, già alla concentrazione dello 0,1-0,2% nell'aria inspirata risulta altamente tossico.
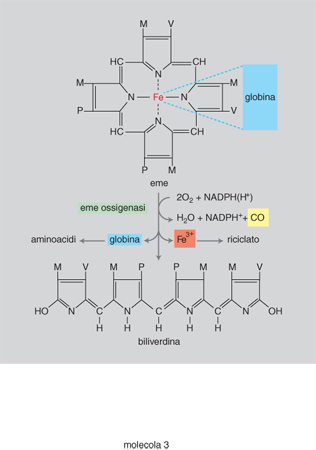
Il CO prende origine nell'organismo dalla reazione catalizzata dall'emeossigenasi (HO) che avvia la degradazione a pigmenti biliari del gruppo ferroporfirinico dell'emoglobina. L'ossidazione dell'eme a biliverdina operata dall'HO si accompagna a liberazione di CO e di ferro che viene riutilizzato nella sintesi di nuova emoglobina (fig. 3). Dell'HO sono state isolate e definite nella loro struttura una forma inducibile (HO1) e una forma costitutiva (HO2). La sintesi della prima viene indotta in diversi organi e tessuti (fegato, milza, rene, surrene, intestino, cuore, muscolatura liscia vasale, macrofagi) da agenti chimici fra i quali le m. contenenti il gruppo ferroporfirinico e le tossine batteriche, e da agenti fisici (raggi X, ipertemia). La forma costitutiva è presente nel cervello, nel rene e nei testicoli.
Nel fegato e nella milza l'inducibilità di HO1 a opera del gruppo ferroporfirinico dell'emoglobina è coerente con l'intervento dei due organi nel ricambio dell'emoglobina e nella sintesi, a livello epatico, dei pigmenti biliari. Più problematica è apparsa la presenza di HO costitutiva in zone discrete del cervello (vie olfattorie, ippocampo, cervelletto). Da questa constatazione è nata l'ipotesi che CO agisca come messaggero. Tale ipotesi ha trovato sostegno nei dati biochimici (co-localizzazione di HO2 e della guanililciclasi, sua attivazione a opera di CO) e in quelli funzionali che documentano l'intervento di CO nell'attivazione delle vie olfattorie, nel potenziamento a lungo termine considerato, a livello ippocampale, l'equivalente elettrofisiologico dei processi della memoria, nella modulazione della secrezione di neurormoni ipotalamici che controllano la funzione surrenale e quindi le reazioni di allarme in risposta a situazioni di emergenza (stress) e, inoltre, le funzioni renali, uterine, ovariche e testicolari. CO sembra d'altra parte svolgere un ruolo fisiologico anche in sedi extracerebrali: la capacità di CO di aumentare il flusso ematico del fegato è controversa, ma appare suggestiva in quanto farebbe di questo gas l'agente capace di adeguare l'apporto ematico all'entità del processo di sintesi degli acidi biliari di cui il CO è un prodotto collaterale; sulla circolazione CO agirebbe come vasodilatatore e antiaggregante piastrinico al pari di NO e modulerebbe infine la funzione del glomo carotideo che, come sensore del contenuto in ossigeno del sangue, regola l'attività respiratoria.
Sul piano fisiopatologico, l'aumentata attività emeossigenasica cerebrale osservata in modelli sperimentali di infarto cerebrale e, in campo clinico, in casi di malattia di Alzheimer o di emorragia subaracnoidea giustifica l'ipotesi di un intervento di CO in queste forme di patologia cerebrale. Le analogie fra gli effetti imputabili a CO e quelli più consolidati riferibili a NO hanno posto il problema dei rapporti fra i due messaggeri. In diversi casi è stato possibile discriminare gli effetti di CO da quelli di NO sui processi presi in considerazione (neurosecrezione ed elettrofisiologia ippocampale), per altri si è evidenziata una funzione collaborativa (nella protezione cardiaca che NO e CO esercitano in modelli di infarto miocardico) o, infine, una funzione sostitutiva (in condizioni di emergenza la regolazione del flusso epatico passerebbe da CO a NO).
Fatta salva la funzione relativa al ricambio dell'emoglobina, l'incognita fondamentale che grava sul significato fisiologico di CO riguarda la regolazione dell'attività della forma costitutiva di HO dalla quale dipendono le funzioni centrali ipotizzate per questo possibile messaggero.
bibliografia
T.M. Dawson, S.H. Snyder, Gases as biological messengers. Nitric oxide and carbon monoxide in the brain, in Journal of neuroscience, 1994, pp. 5147-59.
C. Ladecola, D.A. Pelligrino, M.A. Moskowitz et al., Nitric oxide synthase inhibition and cerebrovascular regulation, in Journal of cerebral blood flow and metabolism, 1994, pp. 175-92.
E.M. Conner, M.B. Grisham, Nitric oxide. Biochemistry, physiology and pathophysiology, in Methods in enzymology, 1995, 7, pp. 3-13.
M. Suematsu, N. Goda, T. Sano et al., Carbon monoxide. An endogenous modulator of sinusoidal tone in the perfused rat liver, in Journal of clinical investigation, 1995, 96, pp. 2431-37.
K. Bhagat, P. Vallance, Nitric oxide 9 years on, in Royal society of medicine. Journal, 1996, 89, pp. 667-73.
N. Maulik, D.T. Engelman, M. Watanabe et al., Nitric oxide/carbon monoxide. A molecular switch for myocardial preservation during ischemia, in Circulation, 1996, 94, II suppl., pp. 398-406.
T. Mizutani, A.J. Layon, Clinical applications of nitric oxide, in Chest. The cardio pulmonary and critical care journal, 1996, 110, pp. 506-24.
E. Clementi, J. Meldolesi, The cross-talk between nitric oxide and Ca2+. A story with a complex past and a promising future, in Trends in pharmacological sciences, 1997, 18, pp. 266-69.
B.R. Crane, A.S. Arvai, R. Gachhui et al., The structure of nitric oxide, synthase oxygenase domain and inhibitor complexes, in Science, 1997, 278, pp. 425-31.
M.J. Curtis, R. Pabla, Nitric oxide supplementation or synthesis block. Which is the better approach to treatment of heart disease?, in Trends in pharmacological sciences, 1997, 18, pp. 239-44.
P. Nicotera, B. Bruno, G. Bagetta, Nitric oxide. Inducer or suppressor of apoptosis?, in Trends in pharmacological sciences, 1997, 18, pp. 189-90.
J.D. Roberts jr., J.R. Fineman, F.C. Morin III et al., Inhaled nitric oxide and persistent pulmonary hypertension of the newborn. The inhaled nitric oxide study group, in New England journal of medicine, 1997, 336, pp. 605-10.
P. Ascenzi, A. Bellelli, M. Colasanti et al., Monossido d'azoto, in Enciclopedia Medica Italiana, 1973², Aggiornam. ii (1998), coll. 3765-98.
P. Preziosi, Monossido di carbonio, in Enciclopedia Medica Italiana, 1973², Aggiornam. ii (1998), coll. 3798-805.
L. Minghetti, G. Levi, Microglia as effector cells in brain damage and repair. Focus on prostanoids and nitric oxide, in Progress in neurobiology, 1998, 54, pp. 99-125.
S. Moncada, Nitric oxide: discovery and impact on clinical medicine, in Journal of the Royal Society of Medicine, 1999, pp. 164-69.