mioglobina
mioglobina
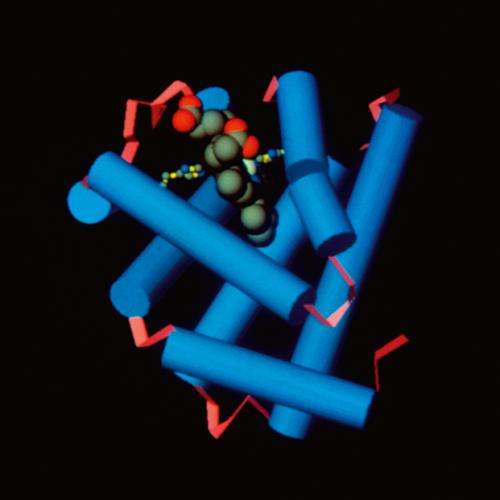
Proteina presente nelle fibre muscolari dei Vertebrati. Il suo compito è di immagazzinare ossigeno e di aumentarne la velocità di diffusione nelle cellule muscolari. È una proteina globulare coniugata a un gruppo eme, identico a quello presente nell’emoglobina. È costituita da una sola catena polipeptidica di 153 amminoacidi e ha un peso molecolare di 17.000; la molecola è ripiegata su sé stessa in modo molto compatto; circa il 75% della catena polipeptidica si trova in una conformazione ad α-elica destrogira. Il gruppo eme, contenente l’atomo di ferro ferroso, è situato in una tasca della molecola. È possibile distinguere 3 forme fisiologiche, con conformazione molto simile tranne che per il legame che l’atomo di ferro intraprende con diverse sostanze. Infatti, nella ferrimioglobina il sito di legame per l’ossigeno è occupato dall’acqua e l’atomo di ferro è allo stato di ossidazione superiore (ferrico), nella desossimioglobina è vuoto, mentre nell’ossimioglobina è occupato dall’ossigeno. Rispetto all’emoglobina, la m. ha una diversa affinità per l’O2; per questo è in grado di accettare ossigeno dall’emoglobina e immagazzinarlo nelle cellule muscolari. Durante la contrazione muscolare, quando la richiesta di ossigeno è massima e la pressione parziale di ossigeno intracellulare diminuisce, l’O2 si dissocia dalla m. e diviene disponibile per le reazioni di ossidazione del metabolismo cellulare. Nell’uomo, la m. è particolarmente abbondante nei muscoli scheletrici e nel muscolo cardiaco.