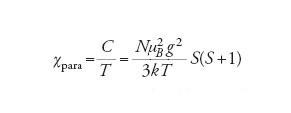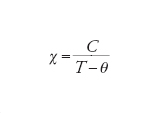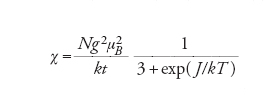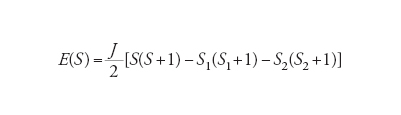Magnetochimica
Magnetochimica
La magnetochimica si interessa dello studio della relazione tra le proprietà chimiche e quelle magnetiche delle sostanze. Queste ultime sono legate essenzialmente al moto degli elettroni negli atomi, quindi la misurazione delle proprietà magnetiche fornisce alcune informazioni sugli stati degli elettroni e, in ultima analisi, sulla struttura delle sostanze e sulla loro reattività chimica. Anche i nuclei hanno un piccolo momento magnetico, che viene messo in evidenza attraverso tecniche spettroscopiche, come la risonanza magnetica nucleare o NMR (Nuclear magnetic resonance), che è diventato uno strumento fondamentale per l'analisi chimica delle sostanze. La sua trattazione, comunque, esula da questa voce e non verrà ulteriormente considerata.
L'inizio della magnetochimica è associato ai primi sviluppi dell'introduzione delle tecniche quantomeccaniche nella descrizione del legame chimico. Il ruolo di Linus Pauling in questo settore è stato d'importanza fondamentale, perché ha cominciato a tradurre in un linguaggio comprensibile per i chimici la nascente teoria dei quanti. Nel 1954 Pauling ricevette il premio Nobel per la chimica per le sue ricerche sulla natura del legame chimico e la sua applicazione alla delucidazione della struttura di sostanze complesse. Nella sua Nobel lecture, infatti, egli osservava che le "conclusioni sull'utilizzazione degli orbitali atomici possono essere estratte dai valori sperimentali dei momenti magnetici". Quest'idea è alla base del cosiddetto criterio magnetico del legame chimico, che ha destato l'interesse di intere generazioni di studiosi per la magnetochimica. Fu ancora Pauling, per esempio, a mostrare che i complessi tetracoordinati di nichel(II), se vengono respinti da un campo magnetico esterno, hanno una geometria quadrato planare, mentre se vengono attratti hanno una geometria tetraedrica. Una semplice misura magnetica a temperatura ambiente, quindi, può rivelare una struttura molecolare.
Negli anni più recenti, per ottenere informazioni strutturali sono state sviluppate tecniche d'indagine più potenti e la magnetochimica si è orientata molto più verso lo studio delle relazioni tra struttura e proprietà magnetiche delle sostanze, con lo scopo di progettare e preparare nuove classi di materiali magnetici basate su strutture molecolari determinate od ottenute con tecniche di chimica molecolare. Contemporaneamente, la ricerca si è molto più aperta verso discipline confinanti come la fisica dello stato solido e si è sviluppato un nuovo settore di ricerca, profondamente interdisciplinare, che viene comunemente indicato come magnetismo molecolare.
I fondamenti
Alla base della magnetochimica c'è la descrizione delle proprietà magnetiche delle sostanze. Se un campo magnetico viene applicato a un dato materiale, l'induzione magnetica B misurata è la somma di due termini:
[1] B=μ0(H+M)
dove H è il campo magnetico applicato, M è la magnetizzazione che traduce la risposta del materiale al campo applicato e μ0=4π∙10−7 H/m è la permeabilità del vuoto. L'induzione magnetica è espressa in Tesla (T), mentre il campo magnetico e la magnetizzazione sono espressi in Ampère/metro (A/m). Comunque, nella letteratura magnetochimica è molto più frequente esprimere le grandezze magnetiche nel sistema CGS. In questo caso la [1] diventa:
[2] B=H+4πM
dove B e H hanno le stesse dimensioni, ma per ragioni storiche B si esprime in gauss e H in oersted (ovviamente 1 gauss=1 oersted).
Una grandezza di notevole importanza in magnetochimica è la suscettività magnetica per unità di volume, c, definita come il rapporto tra la magnetizzazione del sistema e il campo magnetico applicato. Dal punto di vista chimico si usa la suscettività magnetica molare che è data da χmol=χM/ϱ, dove ϱ è la densità del materiale e M è la massa molare della sostanza. La suscettività molare nel sistema CGS si indica in emu mol−1 (emu=electromagnetic units, ma in realtà χ è un numero). Il valore di χ fornisce una prima classificazione sulle proprietà delle sostanze: se è minore di zero la sostanza, respinta dal campo magnetico applicato, è detta diamagnetica; se è positiva ma vicina a zero, la sostanza è detta paramagnetica; se è molto diversa da zero la sostanza è ferromagnetica oppure ferrimagnetica. Forti effetti di repulsione in un campo magnetico applicato si osservano negli antiferromagneti e nei superconduttori. Il diamagnetismo e il paramagnetismo sono proprietà associate alle molecole isolate, mentre il ferromagnetismo, il ferrimagnetismo e l'antiferromagnetismo hanno origine da fenomeni cooperativi originati da interazioni tra le molecole.
Come si è detto l'origine delle proprietà magnetiche va ricercata nel moto degli elettroni. Un elettrone, che ha una carica elettrica negativa, ha due moti possibili: quello orbitale intorno al nucleo e quello di spin. In molti casi di composti in fase condensata si verifica che il moto orbitale degli elettroni è smorzato e le proprietà magnetiche sono legate essenzialmente al moto di spin. In questo caso è relativamente semplice esprimere la suscettività magnetica. Il moto di spin, come si sa, è associato al numero quantico S=1/2 per un elettrone, quindi, un elettrone isolato ha un momento magnetico.
Negli atomi e nelle molecole un gran numero di elettroni tendono a occupare a coppie un dato orbitale appaiando i loro spin. Il diamagnetismo è associato a sistemi che contengono coppie di elettroni. L'applicazione di un campo magnetico esterno genera dipoli magnetici nella sostanza che si oppongono al campo stesso. Il risultato è che la sostanza diamagnetica viene respinta dal campo magnetico esterno. Siccome tutte le sostanze presentano coppie di elettroni, il diamagnetismo è una caratteristica di tutta la materia: in effetti, le sostanze diamagnetiche sono la grande maggioranza. Il valore della suscettività diamagnetica molare è piccolo e indipendente dalla temperatura. In genere si assume che i contributi di diversi atomi o di diversi ioni alla suscettività diamagnetica siano additivi e possano essere calcolati usando tabelle che riportano le cosiddette costanti di Pascal. In linea di principio, la suscettività diamagnetica contiene informazioni sulla struttura molecolare, ma in modo molto sottile e in genere non viene utilizzata.
Il paramagnetismo, invece, è associato alla presenza di elettroni spaiati. Vale la pena di far notare che sostanze come l'ossigeno, che ha 2 elettroni spaiati, hanno sempre anche coppie di elettroni con gli spin appaiati (5 per la molecola di ossigeno). Quindi, la risposta di una sostanza a un campo magnetico esterno è la somma di un contributo diamagnetico, dovuto alle coppie di elettroni, e di uno paramagnetico, dovuto agli elettroni spaiati. Siccome, in genere, la suscettività paramagnetica positiva è più grande in valore assoluto di quella diamagnetica, il materiale paramagnetico verrà attratto da un campo magnetico esterno. In pratica si assume che la suscettività magnetica misurata sia la somma di due contributi:
[3] χ=χpara+χdia.
La componente diamagnetica si calcola tramite le costanti di Pascal, come indicato sopra, e la [3] fornisce χpara. Per composti normali, quelli cioè in cui il contributo diamagnetico è comparativamente piccolo rispetto a quello paramagnetico, la misura della componente paramagnetica è relativamente facile. Le cose sono diverse per quei sistemi in cui la componente paramagnetica è molto piccola rispetto a quella diamagnetica. Esempi tipici sono le metalloproteine che contengono un centro paramagnetico, come gli ioni ferro(III), rame(II), ecc., annegati in un mare proteico diamagnetico. La suscettività misurata è fortemente diamagnetica. La componente paramagnetica, ottenuta per differenza tra due numeri molto grandi, è affetta da un grande errore sperimentale. In effetti, le misure di suscettività magnetica su metalloproteine sono state scarsamente sviluppate a causa di questa difficoltà sperimentale e, quindi, si è preferito usare tecniche spettroscopiche, come la risonanza paramagnetica elettronica o EPR (Electronic paramagnetic resonance), e la risonanza magnetica nucleare che sono sensibili ai centri paramagnetici.
Le tecniche di misurazione
Le tecniche di misurazione delle proprietà magnetiche si possono dividere in due grandi categorie: quelle effettuate in corrente continua e quelle effettuate in corrente alternata. La seconda fornisce la suscettività dinamica del sistema che, in alcuni casi, può fornire informazioni molto importanti.
I sistemi più diffusi al momento sono i magnetometri a SQUID (Superconducting quantum interference device) e a campione vibrante o VSM (Vibrating sample magnetometer). Lo SQUID è un dispositivo molto sensibile basato su due anelli di materiale superconduttore separati da un dielettrico (le cosiddette giunzioni di Josephson) capace di misurare magnetizzazioni molto piccole (la sensibilità permette di misurare differenze di energia che sono 100 miliardi di volte più piccole dell'energia elettromagnetica richiesta per muovere l'ago di una bussola). Entrambe le tecniche misurano la magnetizzazione del sistema e la suscettività viene ottenuta dividendo la magnetizzazione per il campo di misura. Questa è una buona approssimazione alla suscettività per campi bassi e temperature alte.
Il principio alla base della misurazione è la rivelazione induttiva del momento magnetico. Secondo la legge di Faraday, un flusso magnetico variabile nel tempo fa passare una corrente in un circuito chiuso. Questo, quindi, è sensibile al flusso generato dal campione magnetizzato. Molto spesso è utile effettuare misurazioni a temperature diverse. In generale, per raffreddare si adopera l'elio liquido ed è quindi possibile eseguire misurazioni in un intervallo di temperatura tra 1,5 e 300 K.
La suscettività paramagnetica ha una forma particolarmente semplice per il caso di un sistema in cui il contributo orbitale del moto elettronico sia inesistente:
[4] formula
dove N è il numero di Avogadro (6,0221367∙1023 molecole per grammomole), μB=4,66864374∙10−5 cm−1G−1, k è la costante di Boltzmann (=0,69503877 cm−1 K−1), S è il numero quantico di spin. L'equazione [4] è la legge di Curie, ricavata assumendo che le interazioni tra i centri magnetici siano inesistenti. Quindi la legge di Curie è l'equivalente magnetico della legge dei gas perfetti.
Per un elettrone spaiato S=1/2 mentre per n elettroni spaiati S=n/2. Inoltre C è la costante di Curie, il cui valore si ricava dal confronto dei due termini nella [4]:
[5] C=0,125g2S(S+1)
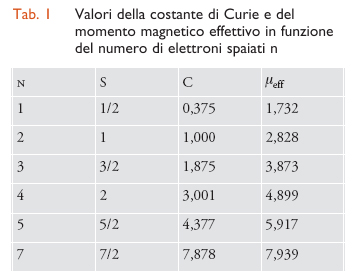
dove g è una costante che dipende dal sistema, uguale a 2,0023 per il moto di spin dell'elettrone. In genere, in un sistema reale in cui il moto orbitale dell'elettrone non è completamente smorzato, il valore di g è diverso da quello dell'elettrone libero ge=2,0023. I valori di C per diversi valori di S, nell'assunzione che il moto orbitale dell'elettrone sia smorzato completamente, quindi g=ge, sono dati nella tab. 1 dove sono riportati anche i va-lori del cosiddetto momento magnetico effettivo, μeff=(8χT)1/2, che è stato ampiamente adoperato nella letteratura chimica.
Una misura della suscettività magnetica a temperatura ambiente riesce a fornire direttamente il numero di elettroni spaiati. Per esempio, per il composto (NH4)Fe(SO4)2∙12H2O si osserva un valore di C=4,39 emu K mol−1, praticamente uguale al valore di C calcolato per S=5/2 riportato nella tab. 1. Il composto contiene ioni Fe3+ che hanno una configurazione elettronica esterna 3d5, con 5 elettroni spaiati negli orbitali 3d. L'indicazione che deriva dalle misure magnetiche è che lo ione libero Fe3+ e lo ione legato non differiscono molto, suggerendo così un'interazione di legame abbastanza debole con le molecole di acqua direttamente legate allo ione.
Se si misura la suscettività magnetica di un altro composto che ancora contiene uno ione ferro con numero di ossidazione 3+, come K3Fe(CN)6 , si trova C=0,8 emu K mol−1, molto più piccolo del valore osservato nell'altro composto di ferro. In effetti, il valore osservato per il ferricianuro può essere giustificato assumendo che ci sia un solo elettrone spaiato con un contributo orbitale non nullo. Usando l'espressione per la costante di Curie data nella [5], assumendo un valore di S=1/2 , i dati sperimentali richiedono un valore di g=2,9, che indica come il contributo orbitale nel ferro(III) sia solo parzialmente smorzato.
La teoria del campo cristallino e del funzionale di densità
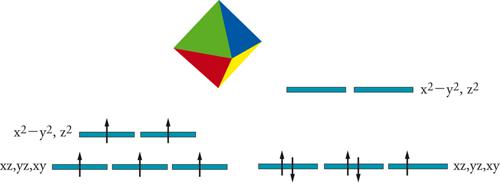
Per razionalizzare questo comportamento è conveniente sviluppare alcune considerazioni semiquantitative a livello di teoria del campo cristallino. Secondo questa teoria, infatti, le energie degli orbitali d degli ioni metallici vengono modificate dall'interazione con le cariche negative dei leganti. In coordinazione ottaedrica, che si osserva sia nell'acquoione che nel ferricianuro, gli orbitali d si raggruppano in due sottostrati, corrispondenti agli orbitali x2−y2 e z2 da una parte e xz, xy e yz dall'altra (fig. 2). Gli elettroni tenderanno a evitare gli orbitali che puntano direttamente sui leganti (x2−y2 e z2) e preferiranno quelli che sono sfalsati relativamente alle direzioni metallo legante (xz, yz e xy). La separazione dei due sottostrati dipende dalla forza dell'interazione con i leganti: più forte sarà l'interazione, di conseguenza più forte sarà la separazione tra i due sottostrati.
L'occupazione degli orbitali segue le stesse regole sviluppate per il riempimento degli orbitali negli atomi. Se la separazione tra i due sottostrati è piccola, gli elettroni preferiranno occupare il maggior numero di orbitali con i loro spin paralleli per guadagnare energia di scambio. Al contrario, quando la separazione è grande sarà più conveniente occupare gli orbitali di più bassa energia, appaiando parzialmente gli spin. I composti del ferro(III) con 5 elettroni spaiati vengono denominati ad alto spin, mentre gli altri vengono detti a basso spin. La possibilità di avere forme ad alto e a basso spin è presente anche per ioni con configurazioni d4, d6, d7.
I dati magnetici, quindi, suggeriscono che il legame tra il ferro(III) e il cianuro sia molto più forte di quello con l'acqua. Queste conclusioni sono confermate da tutti i modelli teorici usati per interpretare la natura del legame chimico nei composti di coordinazione dei metalli di transizione, partendo dall'originale teoria del campo cristallino per finire ai recenti sviluppi con i metodi della teoria del funzionale di densità o DFT (Density functional theory).
In alcuni casi la forza esercitata dal campo dei leganti è al limite del valore per passare dalla configurazione ad alto spin a quella a basso spin. Si può avere, quindi, la forma ad alto spin coesistente con quella a basso spin in quello che si dice equilibrio di spin. Il fenomeno fu scoperto negli anni Trenta del XX sec. da Livio Cambi all'Università di Milano.
La forma ad alto spin è favorita alle alte temperature perché ha un'entropia più alta di quella a basso spin. Prendiamo di nuovo in considerazione gli ioni ferro(III): la forma ad alto spin ha 5 elettroni spaiati, che corrispondono a un valore S=5/2, mentre quella a basso spin ha un solo elettrone spaiato con S=1/2. Gli stati associati a un dato stato di spin S sono 2S+1, corrispondenti ai valori della componente M compresi tra −S≤M≤+S. Quindi ci sono 2 stati per il ferro a basso spin e 6 per quello ad alto spin e l'entropia è più alta per la forma ad alto spin. Un altro contributo importante all'entropia della forma ad alto spin è portato dall'energia vibrazionale. D'altra parte la forma a basso spin è favorita entalpicamente perché ha interazioni di legame più forti. Al variare della temperatura si osserverà una transizione, detta transizione di spin, caratterizzata da un cambiamento della magnetizzazione del campione.
Lo ione più studiato per le transizioni di spin è il ferro(II). Lo ione libero ha una configurazione elettronica esterna 3d6 e lo ione coordinato ottaedricamente nella forma ad alto spin ha 4 elettroni spaiati, S=2, mentre in quella a basso spin non ha elettroni spaiati, S=0 (fig. 2). Il modo migliore per osservare la transizione da alto a basso spin è quello di misurare la suscettività magnetica del composto che subisce la transizione di spin. Per un sistema che segue la legge di Curie il valore del prodotto χT=C (come richiesto dalla [4]) deve rimanere costante al variare della temperatura. Nel caso di una transizione di spin in un composto dello ione ferro(II) ad alta temperatura, il valore di C di solito è ∼3,6 emu K mol−1, mentre la forma a basso spin è diamagnetica e quindi ha χT=0. Le proprietà magnetiche cambiano al variare della temperatura, così come cambia la quantità di forma ad alto spin in equilibrio con quella a basso spin. La transizione tra i due stati può essere graduale o improvvisa. L'origine della diversità è associata alle interazioni tra le molecole nel solido. In effetti le dimensioni della molecola a basso spin sono più piccole di quella ad alto spin, di conseguenza la trasformazione comporta tensioni strutturali. Se le molecole possono comprimersi o dilatarsi senza disturbarsi, la transizione sarà graduale, nel caso opposto sarà improvvisa. In alcuni casi, addirittura, la transizione è accompagnata da irreversibilità che fanno sì che la temperatura di transizione sia diversa se misurata scaldando o raffreddando il campione. In altre parole, si osserva un'isteresi magnetica che consente di immagazzinare informazioni.
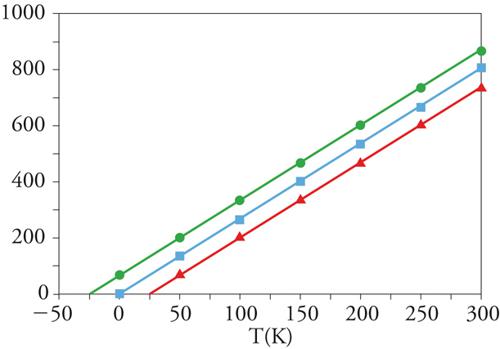
La legge di Curie, riportata nella [4], richiede che la suscettività magnetica sia inversamente proporzionale alla temperatura. Un diagramma in cui si riporti χT in funzione di T deve essere una retta parallela all'asse delle ascisse, mentre in un grafico χ−1 in funzione di T si ha una retta passante per l'origine, con pendenza 1/C, come mostrato nella fig. 3 per uno spin 1/2. Sperimentalmente si osservano deviazioni da questo comportamento ideale che possono avere diverse origini. Una è associata alla possibilità di interazioni tra centri magnetici, mentre l'altra è legata alla presenza di contributi orbitali non smorzati. In entrambi i casi è possibile descrivere il comportamento magnetico di sistemi paramagnetici imperfetti usando la cosiddetta equazione di Curie-Weiss:
[6] formula
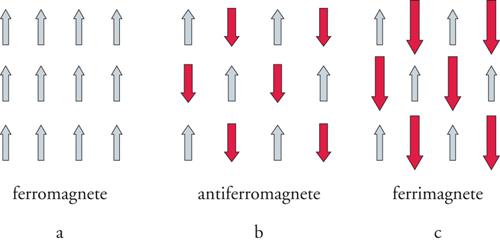
dove θ è detta costante di Weiss. Se è positiva la suscettività cresce più rapidamente del caso paramagnetico perfetto e diverge a TC=θ, dove TC è detta temperatura di Curie e corrisponde alla temperatura alla quale gli spin di tutti i centri presenti nel composto si ordinano paralleli gli uni agli altri, come schematicamente mostrato nella fig. 4A. In altre parole alla temperatura di Curie il sistema passa da paramagnetico a ferromagnetico, caratterizzato dalla presenza di una magnetizzazione permanente.
Il comportamento ferromagnetico è associato alla presenza di interazioni tra i centri magnetici che dipendono dalla natura degli orbitali che contengono gli elettroni spaiati, detti orbitali magnetici, e dalla sovrapposizione tra orbitali magnetici di centri diversi. Se la sovrapposizione tra gli orbitali magnetici è nulla, ma gli orbitali hanno ampie zone in comune, allora gli spin degli elettroni tenderanno a stare paralleli tra di loro per guadagnare energia di scambio (in questo caso si ha la cosiddetta interazione ferromagnetica). Se i centri magnetici sono a contatto diretto si parla di interazione di scambio. Se, invece, l'interazione è trasmessa attraverso gruppi formalmente diamagnetici, come, per esempio, ioni ossido, allora si parla di interazione di superscambio.
Se la sovrapposizione tra gli orbitali magnetici è diversa da zero, allora si formerà un legame chimico debole tra i due centri e gli spin tenderanno ad appaiarsi. L'interazione è allora detta antiferromagnetica e lo stato ordinato sarà quello di un antiferromagnete, indicato schematicamente nella fig. 4B. Ad alta temperatura sarà ancora valida l'equazione di Curie-Weiss con la costante θ negativa, che prende il nome di temperatura di Néel. Un diagramma che esprime χ−1 in funzione di T mostra una retta che estrapola a zero a temperatura negativa. Nello stato ordinato si hanno 2 sottoreticoli: 1 con lo spin su e 1 con lo spin giù. Le magnetizzazioni dei due sottoreticoli si elidono a vicenda, anche se localmente si avranno campi interni diversi da zero.
Supponiamo di avere un reticolo formato da due tipi diversi di centri magnetici, come mostrato nella fig. 4C. Se l'interazione tra gli spin diversi è antiferromagnetica il sistema ordinato avrà due sottoreticoli, come nel caso dell'antiferromagnete discusso sopra. Siccome, però, i due spin hanno valori diversi le magnetizzazioni dei due sottoreticoli non si elideranno a vicenda e il sistema avrà una magnetizzazione permanente come un ferromagnete. Per distinguerlo da quest'ultimo, è stato coniato il nome di ferrimagnete. Anche per i ferrimagneti ad alta temperatura vale la legge di Curie-Weiss. Anche in questo caso, come per un antiferromagnete, χ−1 in funzione di T mostra una curva che estrapola a zero a temperatura negativa, e poi devia andando a zero a temperatura maggiore di zero.
Bisogna notare che deviazioni dalla legge di Curie sono possibili anche se non si hanno interazioni estese come quelle descritte sopra. Per esempio, se gli stati del multipletto S non hanno tutti la stessa energia in assenza di un campo magnetico per la cosiddetta scissione a campo nullo o ZFS (Zero field splitting), allora si avranno deviazioni dalla legge di Curie e la legge di Curie-Weiss sarà una buona approssimazione all'andamento sperimentale della suscettività in funzione della temperatura.
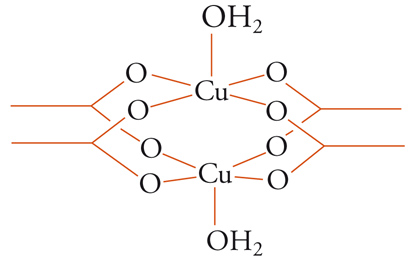
Deviazioni dalla legge di Curie si possono osservare anche quando l'interazione tra centri magnetici non è estesa a tutto il cristallo, ma limitata, per esempio, a coppie. Per fissare le idee si può far riferimento a un composto in cui l'uso di tecniche magnetiche è stato fondamentale per la determinazione strutturale, come l'acetato di rame idrato, Cu(CH3COO)2(H2O). Il rame(II) è uno ione con configurazione elettronica esterna 3d9 che corrisponde a un elettrone spaiato. Il valore di χT osservato per l'acetato di rame a temperatura ambiente è più basso del valore aspettato per il momento di solo spin (0,2 emu K mol−1 contro il valore atteso di 0,375 emu K mol−1). Inoltre, la suscettività magnetica procede attraverso un massimo molto largo intorno alla temperatura ambiente, invece di crescere come richiesto dalla legge di Curie. Il comportamento anomalo fu giustificato con una struttura dimerica, che fu poi confermata da misure di risonanza paramagnetica elettronica e soprattutto dall'analisi ai raggi X che mostrò la ben nota struttura riportata schematicamente qui di seguito.
I due ioni rame a distanza di circa 2,7 Å l'uno dall'altro, ciascuno con S=1/2, interagiscono antiferromagneticamente tra sé, dando luogo a uno stato fondamentale
[7] formula
di singoletto, S=0, e a uno stato di tripletto, S=1, che giace circa 300 cm−1 (∼430 K) al di sopra. A temperatura ambiente entrambi gli stati sono popolati, ma al diminuire della temperatura il tripletto gradualmente si spopola e il sistema diventa diamagnetico. Ad alta temperatura, la suscettività cresce al diminuire di T per seguire la legge di Curie per un tripletto, mentre a bassa T la suscettività paramagnetica deve annullarsi in accordo con lo stato fondamentale di singoletto. Quantitativamente la dipendenza dalla temperatura della suscettività per ione rame viene descritta usando la cosiddetta equazione di Bleaney-Bowers:
[8] formula
dove J è un parametro che descrive l'interazione di scambio (o superscambio) tra i due centri magnetici. Per una coppia di spin S1 e S2 l'interazione dà luogo a una serie di livelli caratterizzati da un valore dello spin totale S pari a
[9] ∣S1−S2∣≤S≤S1+S2.
Le energie degli stati corrispondenti sono date da:
[10] formula.
Per S1=S2=1/2, S può assumere i valori 0 e 1. Per S1=S2=5/2, S può assumere i valori 0, 1, 2, 3, 4 e 5. Il parametro J può essere positivo o negativo: se è positivo lo stato fondamentale del sistema è quello con S più piccolo (accoppiamento antiferromagnetico), mentre se è negativo lo stato fondamentale è quello in cui S è massimo (accoppiamento ferromagnetico).
Composti come l'acetato di rame sono il primo scalino per un cammino verso la complessità, che in linea di principio prevede la sintesi di composti con un numero crescente di centri magnetici interagenti. In effetti, la sintesi di sistemi molecolari che contengono un gran numero di centri magnetici accoppiati fornisce un importante approccio dal basso (bottom-up) per lo studio di sistemi magnetici di struttura mesoscopica. L'interesse per questi sistemi risiede nella possibilità di osservare la transizione dal campo della meccanica quantistica, necessaria per descrivere sistemi non accoppiati con valori di spin piccoli, e la fisica classica che vale per descrivere sistemi con valori molto grandi dello spin.
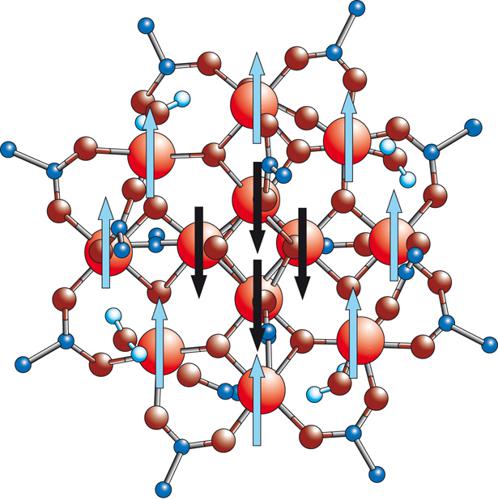
Un esempio importante è rappresentato da una molecola detta Mn12, di formula [Mn12O12(CH3COO)16(H2O)4], e la cui struttura è riportata nella fig. 5. Se guardiamo gli ioni metallici si riconoscono 8 ioni manganese(III) con configurazione d4, S=2, che formano un anello e 4 ioni manganese(IV), configurazione d3, S=3/2, che sono ai vertici di un tetraedro. Gli ioni metallici sono connessi da ponti di ioni ossido, per cui la molecola può essere considerata un frammento di un ossido di manganese. La presenza di ioni acetato blocca la crescita dell'ossido, dando luogo a una molecola di dimensioni finite.
Le proprietà magnetiche, determinate misurando la suscettività magnetica in funzione della temperatura, indicano che lo stato fondamentale per la molecola ha S=10. Un modo semplice per giustificarlo è quello di assumere che nello stato fondamentale gli spin individuali interagenti siano orientati come mostrato nella fig. 5: gli 8 spin S=2 sono paralleli tra loro, a dare uno spin intermedio S=2∙8=16, e antiparalleli ai 4 spin S=3/2 (S intermedio=4∙(3/2)=6). La molecola può essere considerata un ferrimagnete.
A bassa temperatura, la magnetizzazione del sistema tende a orientarsi lungo l'asse tetragonale della molecola. Per passare dall'orientazione 'su' a quella 'giù' deve superare una barriera che rende il processo estremamente lento. A 2 K il tempo di rilassamento della magnetizzazione (cioè il tempo necessario a invertire la direzione della magnetizzazione) diventa di alcuni mesi, per cui la molecola diventa un minuscolo magnete. In effetti, a queste temperature la magnetizzazione dell' Mn12, misurata in funzione dell'intensità del campo magnetico applicato lungo l'asse quaternario, mostra un'isteresi che è dovuta al rilassamento lento della magnetizzazione. In questo senso, quindi, l'Mn12 si comporta come un magnete classico, ma alcuni particolari, come la presenza di gradini nella curva di isteresi, suggeriscono che ci siano anche effetti quantistici, come il rilassamento tramite effetto tunnel.
Dalla magnetochimica al magnetismo molecolare
Molecole come l'Mn12 hanno attirato notevole attenzione, da parte di numerosi ricercatori, per la possibilità di sfruttare l'isteresi magnetica per immagazzinare informazione in una singola molecola. Questo comportamento viene comunemente ricordato come magnetismo di una sola molecola o SMM (Single molecule magnets). Va notato che, tecnicamente, non si tratta di magneti, perché per parlare di magnete è necessario che la correlazione tra spin vicini si estenda all'infinito, mentre negli SMM si può estendere solo al numero finito di centri magnetici della molecola. Ma il termine è suggestivo ed è ampiamente usato.
Un altro sistema magnetico mesoscopico è la ferritina, la proteina usata dagli esseri viventi per immagazzinare il ferro necessario al loro metabolismo. La ferritina è costituita da un involucro polipeptidico, l'apoferritina, con una cavità di ∼7 nm che ospita un nocciolo inorganico di composizione vicina a FeOOH. Gli ioni ferro(III), S=5/2, entrano ed escono nella cavità uno per volta fino a un massimo di circa 4000 ioni. Il nocciolo della ferritina, dunque, è un magnete mesoscopico, con la magnetizzazione che, come nel caso dell' Mn12, può essere orientata 'su' o 'giù'. Il riorientamento della magnetizzazione avviene tramite un processo termicamente attivato che dipende da una barriera proporzionale al numero di ioni presenti nel nocciolo. La barriera diventa confrontabile all'energia termica a temperatura ambiente, per cui l'interconversione tra le due orientazioni è rapida e il sistema non è permanentemente magnetizzato. L'applicazione di un campo magnetico esterno orienta selettivamente la magnetizzazione del sistema che si comporta come un paramagnete caratterizzato da uno spin S molto elevato. Questo comportamento viene detto superparamagnetico.
E' possibile introdurre anche altri noccioli inorganici all'interno dell'apoferritina come la magnetite, Fe3O4, ossidi di manganese, di uranio e anche sistemi non magnetici come il solfuro di cadmio ottenendo particelle di dimensioni nanometriche.
Lo studio di sistemi come quelli sopra descritti ha portato a un allargamento di interessi rispetto all'uso strumentale di misure magnetiche per ottenere informazioni strutturali. Capovolgendo l'impostazione mentale ci si è progressivamente orientati verso la progettazione, la sintesi e la caratterizzazione di sistemi molecolari, oppure ottenuti con tecniche di chimica molecolare, che possono dar luogo a nuovi tipi di proprietà magnetiche. In altri termini, si è passati dalla magnetochimica al magnetismo molecolare, un'area di ricerca fortemente interdisciplinare in cui le competenze chimiche vanno integrate da competenze fisiche e, negli ultimi anni, anche biologiche.
La sintesi dei magneti molecolari
Oltre allo studio di molecole come gli SMM descritti sopra, un tema di grande rilevanza, anche teorica, consiste nella sintesi dei veri magneti, cioè dei sistemi a base molecolare (sia corrispondenti a reticoli molecolari sia ottenuti con tecniche di chimica molecolare) che al di sotto di una certa temperatura critica sono magneticamente ordinati e possiedono una magnetizzazione permanente.
Va ricordato che tutti i magneti sfruttati dall'uomo sono basati su reticoli metallici (per es., il ferro) o ionici (per es., la magnetite). Fino a qualche anno fa, tutti i magneti conosciuti erano quelli basati sulla presenza di elettroni spaiati di tipo d e f : i magneti organici erano completamente sconosciuti e si dubitava della possibilità stessa di ottenerli.
Le difficoltà nella progettazione dei magneti molecolari sono legate intrinsecamente alla natura delle molecole. Infatti, l'ordine magnetico richiede un reticolo tridimensionale di interazioni forti che difficilmente si costruiscono con mattoni molecolari che intrinsecamente tendono a favorire strutture monodimensionali (catene) o bidimensionali. I migliori successi in termini di temperature critiche sono stati raggiunti con due classi di composti, uno basato sul radicale anione del tetracianoetilene, TCNE−, e un altro basato su un derivato del blu di Prussia. Entrambi sono dei ferrimagneti con temperature critiche superiori alla temperatura ambiente.
Il V(TCNE)x∙yS, dove x∼2 e S è un solvente, è un composto amorfo, di difficile caratterizzazione, che sembra
[11] formula
avere una struttura in cui ogni TCNE− può legare fino a 4 ioni vanadio(II). Il composto si comporta come un ferrimagnete disordinato a causa dell'accoppiamento antiferromagnetico tra vanadio(II), S=3/2 e i due radicali. La temperatura critica è stimata intorno ai 400 K (non è possibile misurarla direttamente perché il composto si decompone per riscaldamento).
L'altro composto a base molecolare che ordina come un ferrimagnete al di sopra di temperatura ambiente è un derivato del blu di Prussia, di formula VII/III[CrIII(CN)6]0,86∙2,8 H2O, in cui si hanno legami −M−C−N−M′−N−−C−M− che si ripetono regolarmente nelle tre direzioni dello spazio. L'interazione tra ioni cromo e ioni vanadio è antiferromagnetica e il sistema ordina come ferrimagnete. La temperatura critica più alta raggiunta è di 376 K, giocando sulla composizione in vanadio(II)/vanadio(III) e solvente.
Un aspetto importante delle proprietà dei magneti molecolari è che, a differenza dei magneti classici, essi sono isolanti e parzialmente trasparenti nel visibile e nel vicino ultravioletto. Quindi, dovrebbe essere possibile modularne le proprietà magnetiche irradiandoli con una radiazione elettromagnetica di frequenza adatta. I primi risultati interessanti furono osservati in un sistema contenente ioni cobalto(III), S=0, e ferro(II), S=0. Irradiandolo con luce rossa si induce un trasferimento elettronico dal ferro(II) al cobalto(III) con la formazione di coppie cobalto(II), S=3/2, ferro(III), S=1/2. Il risultato dell'irraggiamento, quindi, è quello di cambiare drasticamente le proprietà magnetiche, suggerendo l'uso di questi materiali come interruttori magnetici da essere attivati con luce visibile. In effetti è possibile ripristinare lo stato iniziale irraggiando di nuovo con radiazione blu.
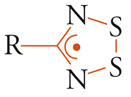
In tutti i casi mostrati sopra, le proprietà magnetiche sono determinate o fortemente influenzate dalla presenza di ioni metallici. Una domanda che ci si può porre è se è possibile avere un magnete completamente organico. In effetti il problema è stato a lungo dibattuto sia teoricamente che sperimentalmente fino a che, agli inizi degli anni Novanta del Novecento, Minoru Kinoshita riportò che un radicale organico ‒ la cui formula è mostrata di seguito ‒ ordina come un ferromagnete a 0,7 K. Se la temperatura critica non è interessante per possibili applicazioni, gli si deve riconoscere il merito di aver dimostrato che è possibile preparare magneti usando sistemi in cui gli elettroni di valenza sono s e p: tutti i magneti naturali, invece, adoperano solo gli orbitali d o f.
Sono in corso molti tentativi di accrescere la temperatura critica dei magneti organici, inclusi alcuni risultati
[12] formula
interessanti usando il fullerene C60. Un approccio alternativo, che ha dato alcuni buoni successi, è quello di perseguire la sintesi dei cosiddetti ferromagneti deboli, caratterizzati dalla presenza di due sottoreticoli accoppiati antiferromagneticamente in cui le due magnetizzazioni non formano un angolo di 180° ma uno leggermente diverso. I due vettori non si compensano esattamente, ma daranno luogo a una risultante, come mostrato nella fig.6, tanto più grande quanto più grande è la deviazione dell'angolo da 180°. Questa deviazione è determinata dall'accoppiamento spin-orbita che diventa importante in presenza di atomi pesanti. I più promettenti usano la strategia di cercare di preparare sistemi in cui l'interazione tra i centri attivi sia antiferromagnetica, ma l'appaiamento avvenga con un angolo diverso da 180°. Per far questo è necessario aggiungere ai radicali organici alcuni atomi più pesanti, allo scopo di sfruttare l'accoppiamento spin-orbita, come delineato sopra. Un risultato molto interessante è stato raggiunto con il radicale mostrato qui di seguito:
[13] formula.
L'accoppiamento tra radicali è antiferromagnetico, ma la presenza di atomi di zolfo fa sì che l'angolo tra gli spin sia diverso da 180°. Il sistema ordina come ferromagnete debole alla temperatura di 37 K.
Le tecniche sofisticate di misurazione
Lo studio di proprietà magnetiche sofisticate richiede lo sviluppo di tecniche magnetiche altrettanto sofisticate. Se all'inizio degli sviluppi della magnetochimica ci si poteva basare su misure di suscettività a temperatura ambiente (o tuttalpiù alla temperatura dell'azoto liquido) è diventata ormai routine effettuare misure fino alla temperatura dell'elio liquido (4,2 K con possibilità di scendere sotto i 2 K pompando sull'elio). Misurazioni a temperature più basse vengono effettuate usando criostati a 3He o anche criostati a diluizione 3He−4He con cui si scende fino a 70 mK.
In genere, le proprietà magnetiche vengono misurate sfruttando la rivelazione induttiva del momento magnetico. Viene sfruttata la legge di Faraday per la quale un flusso magnetico variabile nel tempo genera una corrente in un circuito chiuso. La corrente può essere rilevata in diversi modi, ma quelli più comunemente usati sono i rivelatori e i rivelatori sensibili alla fase.
Il principio di funzionamento dello SQUID è basato sulla quantizzazione del flusso in una spira di superconduttore e sull'effetto tunnel di Josephson. Lo SQUID è una spira di superconduttore che è interrotta da una giunzione in materiale non superconduttore (giunzione di Josephson). Il dispositivo è molto sensibile e consente di effettuare misure di magnetizzazione in campi non troppo elevati. Recentemente sono stati messi a punto rivelatori a micro-SQUID che consentono di effettuare misure su campioni di dimensioni di qualche nanometro che hanno aperto prospettive molto eccitanti nel campo del nanomagnetismo.
In alternativa agli SQUID sono molto diffusi i magnetometri a rivelazione sensibile alla fase. In questo caso il campione viene fatto oscillare all'interno di una bobina. Generalmente questi magnetometri vengono indicati come VSM (Vibrating sample magnetometer ossia magnetometro a campione vibrante). Essi sono meno sensibili degli SQUID ma consentono di operare con facilità in presenza di campi magnetici applicati maggiori di 10 T.
Accanto a queste tecniche che misurano staticamente la magnetizzazione è utile in qualche caso misurare la suscettività dinamica, che corrisponde alla derivata della magnetizzazione rispetto al campo magnetico. Per far questo si applica un campo magnetico oscillante a una bobina attraverso una corrente alternata (ac) misurando il rilassamento della magnetizzazione. Tecniche di questo tipo sono state ampiamente usate nello studio degli SMM.
Bibliografia
Carlin 1986: Carlin, Richard L., Magnetochemistry, Berlin, Springer, 1986.
Kahn 1993: Kahn, Olivier, Molecular magnetism, New York, VCH, 1993.
Orchard 2003: Orchard, Anthony F., Magnetochemistry, Oxford, Oxford University Press, 2003.