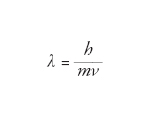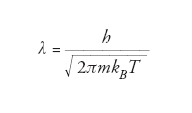lunghezza d'onda di de Broglie
lunghezza d’onda di de Broglie
Grandezza che caratterizza il comportamento ondulatorio di una particella. Agli inizi del Novecento, con la nascita della meccanica quantistica, si afferma il principio di dualità onda-particella, secondo il quale la materia, così come la radiazione elettromagnetica, può essere descritta sia in termini di particella sia in termini di onde. Nel 1924 il fisico francese Louis de Broglie postulò che a una particella di massa m che si muove con velocità ν debba essere associata una lunghezza d’onda
dove h è la costante di Planck. Nel caso di un insieme di particelle in equilibrio termodinamico, si può definire una lunghezza d’onda di de Broglie termica, che dipende dal valore quadratico medio della velocità, quindi dalla temperatura del sistema, secondo la relazione
dove kB è la costante di Boltzmann. Al diminuire della temperatura, la velocità media diminuisce e λ aumenta. Si deve notare che il comportamento ondulatorio delle particelle non viene osservato in oggetti macroscopici, per i quali la lunghezza d’onda di de Broglie è piccolissima. Il comportamento ondulatorio della materia può essere osservato nelle proprietà delle particelle elementari, che hanno una massa molto piccola. In un microscopio elettronico, per es., si sfrutta la natura ondulatoria degli elettroni, che si comportano come un fascio di luce di lunghezza d’onda molto minore della luce visibile, e consentono dunque di avere una risoluzione ‘ottica’ migliore di quella ottenibile con microscopi convenzionali. Il comportamento ondulatorio di un insieme di atomi (particelle composte più pesanti, quindi con λ più piccola) si può osservare raffreddando la materia a temperature molto basse, utilizzando tecniche di raffreddamento laser. In particolare, quando λ diventa grande quanto la separazione fra due particelle, si può entrare nel regime di degenerazione quantistica: nel caso dei bosoni (particelle con spin semiintero), si ha il fenomeno della condensazione di Bose-Einstein, in base al quale le particelle di un gas cessano di comportarsi come particelle indipendenti ed esibiscono un comportamento collettivo occupando tutte lo stato a energia più bassa del sistema.