Logica genetica della morfogenesi nel metazoi: l'esplosione cambriana
Logica genetica della morfogenesi nel metazoi: l'esplosione cambriana
I metazoi presentano un'enorme varietà di forme, tipi di sviluppo e caratteristiche fisiologiche. L'analisi comparata tra le specie esistenti e i loro antenati fossili ha consentito di suddividere questa varietà in taxa e di stabilirne i rapporti filogenetici. I recenti studi di genetica dello sviluppo e l'analisi comparata delle sequenze di DNA in molte specie dimostrano la conservazione dei geni coinvolti nei processi generativi da antenati precedenti il Cambriano. In un periodo di tempo brevissimo (20 ÷ 30 milioni di anni) organismi diploblastici hanno dato luogo a organismi triploblastici: protostomi e deuterostomi. Questa conservazione vale sia per i geni sia per le funzioni a essi correlate. Molti aspetti dei meccanismi alla base del comportamento cellulare durante lo sviluppo sono controllati da geni ereditati addirittura da antenati ancora più antichi: eucarioti monocellulari e persino procarioti. Questa straordinaria conservazione dei geni e delle loro funzioni sembra dovuta alle costrizioni imposte dal riconoscimento molecolare. Ciò significa che l'evoluzione di nuove forme risulta da modifiche nella regolazione dei geni, che determinano combinazioni geniche differenti nelle cellule durante lo sviluppo.
La morfogenesi è un fenomeno sincrono e il suo studio ci consente di comprendere le leggi che intercorrono, nel corso dei processi ontogenetici, tra il livello atomico-molecolare, quello dei geni, quello delle cellule, sino a quello degli organismi. Tuttavia, benché la maggior parte degli organismi abbia origine da uno zigote, la morfogenesi non inizia all'atto della fecondazione; infatti le uova, nel corso della maturazione, modificano il loro contenuto di informazione (prodotti dei geni materni e organizzazione spaziale). Inoltre, esaminando l'aspetto sorprendente della conservazione dei geni, il problema morfogenetico diviene un fenomeno diacronico. La piena comprensione della morfogenesi richiede un'analisi comparativa e un esame puntuale dei prodotti genici conservati, i quali determinano i diversi piani strutturali delle specie attuali e spiegano come questi si siano modificati nel corso dell'evoluzione. La sfida diventa ancor più evidente se si pensa che i piani strutturali fondamentali e le modalità di sviluppo dei metazoi erano già presenti nella fauna cambriana (fig. 1; tab. I). In meno di 50 milioni di anni (da 580 a 530 milioni di anni fa), i metazoi diploblastici di Ediacara (fauna diffusa su tutta la Terra e costituita per intero da animali dal corpo molle che prende il nome dall'affioramento roccioso che si trova a Ediacara, in Australia, ed è l'unica prova della vita pluricellulare prima della grande divisione che separa Precambriano e Cambriano) hanno dato origine ai principali phyla di organismi triploblastici: i protostomi, tra cui anellidi, molluschi e artropodi, e i deuterostomi, cioè echinodermi e cordati (fig. 2). Un 'big bang' che ha determinato un incredibile aumento della diversità morfologica (Erwin, 1991; Valentine, 1994). Gli organismi fossili dei primi phyla triploblastici sono rappresentati da poche specie, morfologicamente discontinue, con organizzazione e morfologia degli adulti altrettanto complesse di quelle delle specie tuttora esistenti (v. figura 1). La documentazione fossile cambriana, costituita da pochi campioni, ci mostra come questa fauna occupasse habitat marini piuttosto omogenei (Conway Morris, 1993; 1994). Pertanto le novità evolutive si sono generate nonostante l'apparente omogeneità e continuità degli habitat che allora esistevano. Quanto segue vuoI essere una disamina delle modalità attraverso cui queste forme cambriane si possono essere generate quale conseguenza di processi di natura genetica. Tali processi si realizzano tuttora nel corso della morfogenesi dei loro discendenti attuali che oggi possiamo studiare sia da un punto di vista molecolare sia genetico.
Struttura modulare degli elementi genetici
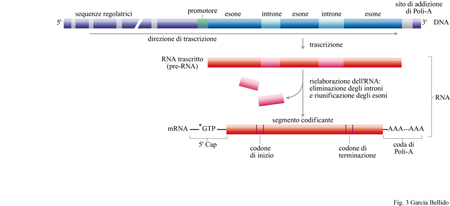
La ricostruzione della filogenesi tramite molecole ci permette di dedurre quale dovesse essere l'organizzazione genetica degli organismi metazoici cambriani (545 ÷ 500 milioni di anni fa). Questi organismi avevano ereditato tutti quei meccanismi di produzione e conversione dell' energia (fotosintesi, biosintesi e metabolismo ossidativo) già perfezionati a livelli ottimali di efficienza dai loro progenitori: batteri procariotici, 3000 milioni di anni fa; protisti eucariotici, 1600 ÷ 2000 milioni di anni fa; metazoi, 700 ÷ 600 milioni di anni fa (Darnell e Doolittle, 1986). Per la maggior parte i geni dovevano essere già tripartiti, essendo costituiti da una parte non trascritta, regolatrice dell'espressione genica - rappresentata dal promotore, con le sue diverse sequenze regolatrici, nonché dagli attivatori - e da due parti trascritte (fig. 3). Queste ultime sono costituite da introni non tradotti e da esoni tradotti, che codificano i domini attivi nelle proteine e che si trovano dispersi tra gli introni. Il tum aver del DNA, inteso come modificazione dei geni a seguito del riarrangiamento del genoma, era già attivo, rendendo possibile il rimescolamento degli esoni (da cui derivano nuove combinazioni dei domini proteici) e lo spostamento dei promotori (per cui, di conseguenza, i geni sono soggetti al controllo di proteine regolatrici diverse). La duplicazione dei geni e la loro ulteriore diversificazione dovevano avere già generato famiglie di geni correlati, favorendo la modulazione diversificata di un'unica funzione genetica di base. Ulteriori diversificazioni e modulazioni dell' espressione dei geni si generarono in seguito a un processo di maturazione differenziale e alternativo dell 'RNA messaggero (splicing), con ulteriori combinazioni diverse di esoni appartenenti a un medesimo gene; tutte modalità, queste, che portano alla sintesi di proteine funzionali differenti. Gli elementi dei domini proteici specifici per il riconoscimento molecolare, combinandosi adeguatamente tra proteine diverse, permisero sia la formazione di insiemi stabili (quali i ribosomi, i complessi di trascrizione e quelli di splicing, nonché le membrane cellulari) sia le interazioni transitorie tra ligandi e recettori, così come avviene per il riconoscimento cellulare e per le vie di trasduzione del segnale. Le interazioni transitorie tra le proteine regolatrici e i promotori dei loro geni bersaglio (target) resero possibile la coordinazione dell'espressione di gruppi di geni, i sintagmi, per svolgere processi specifici di sviluppo (García-Bellido, 1985). Le combinazioni di sintagmi in cellule di discendenza diversa hanno fatto sì che si definissero modelli funzionali e di differenziamento selettivi per i differenti tipi di cellule. Da questi comportamenti cellulari specifici derivano i vari processi di natura genetica correlati con lo sviluppo e che sono attivi negli organismi tuttora esistenti.
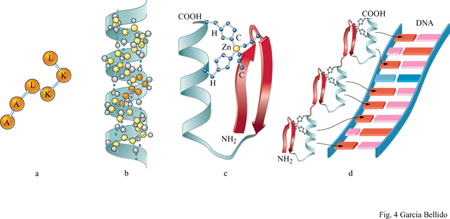
Nel corso dell'evoluzione la conservazione delle sequenze geniche codificanti è ascrivibile all'inerzia imposta dal riconoscimento molecolare, che conferisce specificità alle funzioni geniche. Questa specificità si basa sulle differenti configurazioni steriche delle strutture tridimensionali delle proteine e consente che esse si combinino con brevi sequenze regolatrici del DNA (fig. 4), o con i substrati nel corso delle reazioni enzimatiche oppure, infine, con domini di altre proteine. Il numero stimato di questi domini nelle proteine degli organismi attuali, basato sulla sequenza amminoacidica e sulla comparazione cristallo grafica, rientra nell' ordine di 1000 ÷ 2000, rispetto alle decine di migliaia stericamente possibili (Chothia, 1992). l geni che codificano proteine costituite da più domini consentono così alla stessa proteina di svolgere funzioni differenti. Enzimi fisiologicamente correlati, in quanto partecipi di una data successione di reazioni biochimiche, sono codificati da geni diversi nei batteri o nei lieviti, mentre negli organismi superiori possono essere presenti in sequenza, entro la medesima unità di trascrizione. Tuttavia il riconoscimento molecolare, tramite la formazione di legami sia tra proteine uguali sia tra proteine diverse (omo- ed eteromeri), può aver limitato a poche dozzine il numero dei singoli domini funzionali delle proteine. La duplicazione genica, seguita dal rimescolamento dei domini in seguito a ricombinazione intragenica oppure a un accumulo di mutazioni successive e che comporta una sequenza codificante diversa da quella originaria, ha reso possibile la comparsa di famiglie di geni capaci di svolgere funzioni diverse ma correlate tra loro. Nonostante vi sia la possibilità teorica di aumentare all'infinito il numero di geni differenti, questo rimane ancora circoscritto a 4000 ÷ 5000 nei batteri, a 6000 nei lieviti, a 10.000 ÷ 20.000 nei nematodi e negli insetti, e soltanto a circa 60.000 nei cordati, inclusi i membri della stessa famiglia genica (Micklos e Campbell, 1992). Il limite alla diversità genetica può essere dovuto a inerzia evolutiva, a causa dei limiti imposti dalla necessità del riconoscimento molecolare.
Le estrapolazioni sulla struttura del genoma dei metazoi ancestrali, dedotte dall'analisi del genoma dei metazoi attuali, rivelano quello che possiamo definire come il primo paradosso dell'evoluzione morfologica: la grande varietà di forme e di piani strutturali presenti nel Cambriano è associata a un repertorio di geni veramente limitato. Dalla comparazione tra i diversi genomi si può dedurre, con ragionevole sicurezza, che tale repertorio fosse costituito da un numero di geni non superiore a 10.000.
Inoltre la comparazione delle sequenze del DNA di specie attuali filogeneticamente molto distanti indica che gli stessi geni dovevano essere già presenti negli organismi ancestrali. D'altronde la diversità genetica tra membri di differenti ordini del Cambriano doveva rientrare nello stesso ordine di grandezza della diversità fra specie attuali di uno stesso genere (Patterson et al., 1993).
Si può pertanto affermare che la crescente complessità morfologica è scarsamente correlata con il contenuto informativo e la diversità dei genomi. Allo stesso modo, si può dedurre che l'aumento della diversità morfogenetica risulta in gran parte da associazioni combinatorie di moduli genetici - quali, per esempio, i domini genici, i geni medesimi e la rete di segnali di regolazione che tra loro intercorre nei sintagmi - che si sono conservati in larga misura nel corso dell'evoluzione in seguito ai limiti imposti dal riconoscimento molecolare.
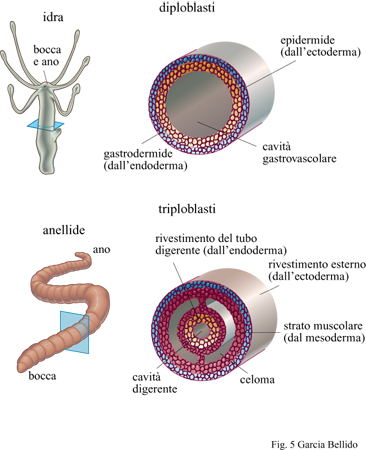
L'analisi molecolare comparativa di geni appartenenti a phyla molto distanti rivela come molti di essi condividano alcune sequenze di DNA e le funzioni a esse associate (evidenziando interazioni tra sequenze e funzioni) che vengono svolte durante lo sviluppo dell'organismo. Ciò significa che questi geni dovevano essere già operativi, seppure con modalità meno complesse, nei metazoi triploblastici del Cambriano (Shenk e Steele, 1993; Erwin, 1993). Come eucarioti, questi metazoi cambriani ereditarono già risolti dai loro progenitori archeobatteri tutti i problemi relativi al metabolismo energetico e alla bio sintesi proteica, alla catalisi e alla respirazione ossidativa (Knoll, 1992). Non è possibile accertare oggi quale fosse la funzione dei sintagmi originari, ma si può supporre che, in un modo o nell'altro, tutte quelle famiglie di geni specializzati che si formavano possano aver ereditato dai metazoi diploblastici la capacità di legare i ligandi ai rispettivi recettori (capacità propria dei batteri quando mostrano sensibilità chimica) durante la trasmissione dei segnali da una cellula all'altra e durante il riconoscimento e l'adesione delle cellule tra loro. La trasduzione del segnale ai bersagli nucleari doveva pertanto essere già operativa nelle sue varie forme. La divisione e la proliferazione cellulare sono ancora oggi sotto il controllo di geni che si sono conservati inalterati durante l'evoluzione a partire dai protisti, progenitori dei metafiti e dei metazoi. La polarità e la forma delle cellule, determinate dalla presenza di citoscheletri anisotropi e dalle diverse specializzazioni proprie delle membrane cellulari - come la capacità per cellule adiacenti di comunicare attraverso canali di membrana (gap junctions) e la capacità di formare specifiche associazioni di recettori (receptor capping) - dovevano essere caratteristiche già presenti e funzionali per la migrazione cellulare e il riconoscimento del substrato. Si può far risalire agli animali diploblastici (Cnidari e Ctenofori) il differenziamento cellulare, che porta alla formazione di tessuti definiti (fig. 5) secondo programmi alternativi e discontinui di espressione genica. Certamente nei primi metazoi triploblastici dovevano essere presenti come entità distinte gli epiteli, il tessuto muscolare, i condro citi e i neuroni. Anche il dimorfismo sessuale era presente, almeno a livello delle gonadi. Inoltre, la presenza di una informazione genetica in doppio (diploidia), i fenomeni di ricombinazione e riparazione del DNA e la conversione genica devono aver contribuito a determinare rapidi cambiamenti del genoma e a formare i diversi meccanismi morfogenetici. In conclusione, tutte le attività genetiche fondamentali erano all'opera nei metazoi cambriani, assicurando così l'organizzazione di territori multicellulari e determinando la formazione di una fantastica varietà di morfologie triploblastiche (v. figura 1). Nelle pagine che seguono analizzeremo in dettaglio questo argomento.
Diversi meccanismi del comportamento cellulare
La diversità morfologica dei metazoi cambriani suggerisce come i loro geni fossero in grado di svolgere un insieme complesso di operazioni correlate ai processi di sviluppo. Vediamo di considerare brevemente queste operazioni. Il processo di divisione delle cellule eucariotiche richiede l'intervento di una serie di cicline (fosfatasi e chinasi) che funzionano a cascata nelle diverse fasi del ciclo cellulare (Nurse, 1993). I geni di questo sintagma sono stati conservati nel corso dell'evoluzione, dal lievito fino agli insetti e all'uomo (Levine e Broach, 1995). In determinate condizioni, il ciclo cellulare viene sospeso e la cellula entra in uno stato di quiescenza dal quale viene richiamata in seguito a stimolazioni dall'esterno. Queste, per esempio, possono essere costituite da segnali di tipo nutritivo o di fusione (rappresentati dalla presenza di precisi ligandi) che attivano specifici recettori sulla membrana cellulare. Nei metazoi la proliferazione cellulare richiede un certo livello di coordinazione che conduce a sistemi multicellulari, di grandezza e forma specifica. Insetti e vertebrati hanno in comune gli stessi fattori di crescita, che agiscono da ligandi, come pure gli stessi recettori cellulari specifici richiesti per l'attivazione mitotica. Alcuni di questi fattori possono fungere da sostanze morfogenetiche che diffondono fuori dalla cellula, come la proteina codificata dal gene decapentaplegic (dpp in Drosophila, Bmp.4 nell'anfibio anuro Xenopus laevis), mentre altri, come le proteine codificate rispettivamente dai geni wingless (wg in Drosophila, Wnt-l nel topo) e hedgehog (hh in Drosophila, Shh nel topo), rappresentano fattori coinvolti nella trasmissione del segnale da una cellula all'altra (Hogan et al., 1994; Fietz et al., 1994).
La proliferazione cellulare associata alla morfogenesi può avvenire in due modi differenti. In un caso, questa può risultare dalla gemmazione di cellule all'altezza della zona marginale, o zona cambiale, di una struttura cellulare pluripotente, quale la più rudimentale forma di organo adulto (primordio); le cellule postmitotiche che derivano da questo tipo di divisione permangono allo stato indifferenziato nella struttura medesima dalla quale originano oppure si trasformano in cellule differenziate che migrano all'esterno della struttura. Questo tipo di divisione è definita asimmetrica, in quanto le due cellule figlie seguono regimi di proliferazione differenti (anamorfosi). Alternativamente la divisione cellulare può essere di tipo simmetrico, ovvero tutte le cellule della struttura primitiva si dividono rimanendo all'interno dei confini della struttura medesima, sicché le due cellule figlie saranno uguali tra loro e alla cellula progenitrice (diamorfosi). Entrambe queste modalità possono aver luogo durante lo sviluppo dello stesso individuo e caratterizzano tutti i metazoi. Le due modalità di proliferazione derivano da un meccanismo comune a piante e animali, la cui divergenza risale a 700 milioni di anni fa. In entrambi i casi, le cellule figlie registrano quantitativamente i segnali mito geni che inducono la divisione cellulare. Difetti di registrazione (come una mancanza circoscritta del fattore della crescita) possono portare alla morte programmata della cellula (apoptosi), i cui geni regolatori si sono conservati a partire dai pro genitori di insetti e vertebrati. Quando le cellule si differenziano cessano di dividersi; la proliferazione cellulare e il differenziamento cellulare sono di norma processi fra loro complementari, controllati dal livello di fosforilazione delle proteine codificate da geni come fos e jun, che si sono anch'essi conservati a partire dalle prime cellule eucariotiche.
L'orientamento del fuso nel corso dell'ultima fase della mitosi (citocinesi) comporta conseguenze per la morfologia della cellula. L'orientamento del fuso (formato da tubuline) dipende dalle anisometrie del cito scheletro (formato da actina e miosina) e queste, a loro volta, dipendono dalla ricezione localizzata dei segnali di comunicazione tra le cellule, come avviene durante la divisione cellulare del lievito. Nei metazoi, le cellule epidermiche mostrano differenze per almeno tre assi cellulari: uno apicale-basale (istologicamente visibile a partire dai Cnidari) e gli altri due, rispettivamente, antero-posteriore e medio-laterale, tutti deducibili da esperimenti di dissociazione e riaggregazione (negli insetti) nel quadro del riconoscimento cellulare (García-Bellido, 1966). Le due ultime specificazioni sono necessarie per le cellule perfino nei metazoi più primitivi, giacché è necessario, come vedremo tra breve, definire correttamente dimensioni e forma dei territori (organi). Per quanto riguarda le proprietà della superficie cellulare, le basi molecolari delle anisometrie assiali sono da ricercarsi, probabilmente, nelle molecole coinvolte nei processi di adesione fra le cellule oppure nei recettori che si trovano sulla membrana cellulare stessa, entrambi conservati a partire dai progenitori comuni dei protostomi e dei deuterostomi. Infatti le stesse molecole, o altre a esse correlate, possono essere già funzionanti durante processi quali la gastrulazione, caratterizzata da invaginazione e da formazione dei foglietti embrionali (delaminazione), nonché durante la successiva formazione del sistema nervoso centrale. Infatti sia le famiglie CAM (Cell Adhesion Molecules, molecole di adesione cellulare) sia le SAM (Substrate Adhesion Molecules, molecole di adesione al substrato), tra le molecole proteiche che promuovono l'adesività fra le cellule (come pure le proteine di membrana aventi le caratteristiche delle immunoglobuline), sono presenti in tutti i metazoi triploblastici (se non, addirittura, in alcuni diploblastici). Comportamenti cellulari più complessi, come la migrazione cellulare, l'inibizione laterale, l'induzione cellulare planare e verticale, tutti caratteristici dei metazoi triploblastici, si basano su processi di riconoscimento cellulare o di ricezione del segnale tra cellula e cellula; questi processi, utilizzando le funzioni di geni conservati, si basano sulle interazioni ligando/recettore.
Tutti gli animali triploblastici presentano una notevole diversificazione per quanto riguarda il differenziamento dei diversi tipi cellulari. l tessuti formati da cellule completamente differenziate possono essere istologicamente suddivisi in differenti classi (istotipi), tra cui, per esempio, la classe del tessuto epiteliale (inclusi dotti e ghiandole), del tessuto mesenchimale (muscoli e cartilagine) e del tessuto nervoso. Questi differenti istotipi si formano come derivati dei tre strati germinali e risultano, pertanto, scarsamente correlati a una precisa discendenza da cellule embrionali (eccetto per i tessuti che si formano dall'endoderma); il loro differenziamento costituisce pertanto il risultato di interazioni tra cellule a livello locale, in cui sono attivati gruppi particolari di geni caratteristici di ciascun istotipo. In cellule di animali diploblastici si può rivelare la presenza di caratteri appartenenti a cellule di istotipi differenti, come avviene per il mesoectoderma (dove le cellule presentano caratteri sia epiteliali sia muscolari) e per il neuroectoderma (dove le cellule presentano caratteri sia epiteliali sia nervosi). È solo negli animali triploblastici che le cellule perdono le proprietà caratteristiche di istotipi differenti per assumere quelle proprie di ciascun tessuto. Il fatto che i geni regolatori della trascrizione (selettori), che controllano gruppi di proteine specifiche per i diversi tipi di cellule, siano comuni a insetti e vertebrati, attesta quanto lontano nel tempo si possa collocare il processo di differenziamento istotipico. Così il gene snail (sna) di Drosophila, che reprime il percorso morfogenetico del neuroectoderma e promuove quello del mesoderma, è omologo al gene sna dei mammiferi (Nieto et al., 1992). I geni del complesso achaete-scute (AS-C) e il gene extramacrochaetae (emc) di Drosophila, correlati alla specificazione delle cellule proneurali a partire dal neuroectoderma, hanno i loro omologhi nei vertebrati (MASH e Id, HES), nei nematodi (Zhao e Emmons, 1995) e, perfino, nell'idra (Grens et al., 1995). È interessante notare come proteine diverse ma strutturalmente simili (cioè appartenenti tutte alla classe HLH, in quanto defrnibili da un motivo strutturale comune noto come Helix-Loop-Helix, elica-ansaelica) presentino sorprendenti similarità funzionali. Queste sono le proteine codificate dalla famiglia dei geni MyoD, che, nei mammiferi, sono coinvolte nel differenziamento delle cellule in direzione miogenica, e le proteine codificate dal complesso AS-C, coinvolte, a loro volta, nella neurogenesi in Drosophila (Skeath e Carrol, 1994). L'espressione dei geni in questione non è necessaria soltanto per il differenziamento istotipico, ma per la maggior parte delle attività comportamentali delle cellule da cui provengono e che devono svolgere funzioni associate a quella particolare fase dello sviluppo (come sna, che regola la delaminazione, la migrazione e il riconoscimento tra cellule durante la gastrulazione). Inoltre, queste omologie funzionali tra geni si estendono anche ai successivi processi di sviluppo del meso derma (Abmayr et al., 1995).
Esiste anche un altro meccanismo, conosciuto come inibizione laterale, che svolge un ruolo critico nel processo di selezione di singole cellule a partire da uno strato continuo di cellule precursori, come appunto si verifica nel corso della maturazione delle cellule neurali, che si selezionano da cellule precursori del neuroectoderma, e di quelle che si selezionano da cellule precursori del mesoderma. In Drosophila, questo meccanismo è sotto il controllo dei geni Notch (N) ed Epidermal Growth Factor (EGF), omologhi di geni presenti in organismi che vanno dai nematodi fino ai vertebrati (Maine et al., 1995; Jones et al., 1991). L' omologia di geni coinvolti nello stesso tipo di funzione cellulare, seppure in organismi di phyla diversi, si ritrova costantemente anche in altri geni connessi allo sviluppo. Pertanto appare chiaro che non sono soltanto i geni selettori a venire conservati, ma anche molti dei membri dei rispettivi sintagmi di appartenenza. Inoltre anche i processi coinvolti nella specificazione degli istotipi, che portano alla formazione di strutture topo graficamente delimitate quali sono gli organi, sono sottoposti al controllo di geni che si sono conservati nel corso della filo genesi (Manak e Scott, 1994). Così il cuore degli insetti e dei vertebrati viene specificato da geni omologhi al gene tinman di Drosophila e CSX del topo. Il differenziamento del primordio dell'occhio inizia con la sintesi del fotorecettore e la determinazione delle cellule del pigmento; in molti taxa animali (inclusi i nemertini primitivi e i nematodi) questo processo è sotto il controllo di geni omologhi a quelli eyeless di Drosophila e Pax6 del topo (Loosli et al., 1996), come illustrato in figura (fig. 6). Nel fegato dei mammiferi e nell'analogo organo delle mosche, chiamato corpo grasso, i geni del metabolismo sono regolati da fattori di trascrizione omologhi (Abel et al., 1992).
Tutti i dati sinora raccolti sulla generale complessità dell'organizzazione istologica, diretta dagli stessi geni di controllo in organismi appartenenti a phyla diversi, rivelano un livello molto alto di conservazione delle strutture gerarchiche dell'attività dei geni. Nelle strutture anatomiche dei fossili cambriani si possono facilmente riconoscere organi interni ed esterni che si sono formati presumibilmente dagli stessi tipi cellulari e sono stati specificati secondo le stesse attività genetiche che ancora operano nei loro discendenti attuali.
Iterazione modulare di territori cellulari e di tipi di cellule
Assi embrionali
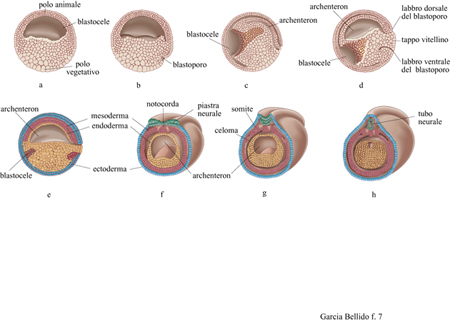
Di regola nel corso della segmentazione dello zigote si formano i blastomeri, in cui è già definita la futura topologia delle differenti parti del corpo e così pure gli assi corporei. La segmentazione può essere radiale o spirale (v. figura 2), ma entrambe le modalità non hanno conseguenze morfogenetiche rilevanti, poiché sia nel corso dell'una sia dell'altra si possono formare organi tanto simmetrici quanto asimmetrici. La determinazione dell'asse corporeo potrebbe derivare dalla distribuzione anisotropa dei prodotti dei geni di origine materna, oppure risultare dal rimescolamento dei componenti citoplasmatici, conseguente alla fertilizzazione o all'adesione dell'uovo a una superficie. Non si può dire con certezza quali siano stati i meccanismi per la determinazione assiale nei metazoi cambriani, proprio per il fatto che tali meccanismi sembrano cambiare facilmente perfrno nelle forme derivate. Generalmente le anisotropie dell 'uovo portano alla definizione di un asse cui segue immediatamente la definizione dell'altro, ortogonale al primo; in questo modo si defrniscono i piani di simmetria antero-posteriore (A-P) e dorso-ventrale (D-V) ed è indifferente quale dei due piani appaia per primo. Negli animali a simmetria bilaterale, l'intersezione degli assi A-P e D-V definisce il piano dorso-ventrale, e quindi la parte destra e quella sinistra dell'animale. In tutti gli organismi triploblastici a simmetria bilaterale, deuterostomi e protostomi, l'asse A-P è stabilito da un determinato gruppo di geni conservati che definiscono in sequenza specifica la regione cefalica, quella del tronco e quella della coda (v. oltre). Nel corso della gastrulazione (per invaginazione o delaminazione) i precursori del tubo digerente e degli organi di origine mesodermica si invaginano nella cavità del blastocele (fig. 7). Una seconda apertura di questo tubo digerente primitivo di origine endodermica dà luogo, rispettivamente, al futuro apparato boccale (stomodeo) nei deuterostomi e al futuro intestino retto (proctodeo) nei protostomi (v. figura 2). Oltre agli organi che derivano dal foglietto embrionale esterno (di origine ectodermica) e a quelli che derivano dal foglietto embrionale interno (di origine endodermica), si differenziano altri organi a partire dal foglietto di cellule compreso tra l'ectoderma e l'endoderma, il mesoderma, e che sono, appunto, organi di origine mesodermica.
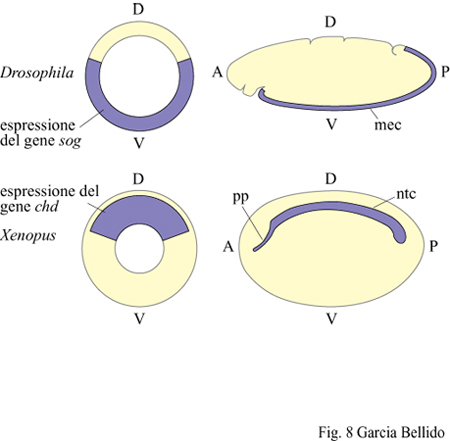
l tessuti neurali derivano generalmente da territori ectodermici e, nell' organismo adulto, rimarranno medio-dorsali (come nei cordati, tra i deuterostomi) oppure laterali e, tramite fusione ventrale successiva, anatomicamente medio-ventrali (come, tra i protostomi, negli anellidi e negli artropodi). L'origine dell'aorta è sempre mesodermica, ma questa è spostata in posizione medio-ventrale nei cordati e in posizione medio-dorsale negli anellidi. Considerando come riferimento l'asse D-V, le posizioni anatomiche del sistema nervoso, dell'aorta e del tubo digerente risultano pertanto invertite nei deuterostomi e protostomi a simmetria bilaterale (fig. 8). Tuttavia, nel corso della filogenesi si sono conservati a partire dai progenitori comuni anche i geni che specificano, attraverso antagonismo reciproco, il territorio dorsale e quello ventrale nel blastoderma (per il dorsale, dpp in Drosophila e chordin (chd) nello xenopo; per il ventrale, short gastrulation (sog) in Drosophila e Bmp.4 nello xenopo). Comunque le loro omologie molecolari sono in rapporto di reciprocità rispetto ai territori d'espressione: dpp (dorsale in Drosophila) presenta omologia di sequenza con Bmp.4 (ventrale nello xenopo), e lo stesso vale per sog e chd. Questo dato indica l'esistenza di un modello primitivo che potremmo chiamare Urbilateria, antecedente a una successiva inversione dorso-ventrale (De Robertis e Sasai, 1996).
La stessa inversione anatomica può aver separato deuterostorni e protostomi. Nei progenitori triploblastici, gli stessi processi di sviluppo, quali l'invaginazione e la delaminazione che hanno luogo nel corso della gastrulazione, devono aver portato alla formazione di un'apertura verso l'esterno con funzioni inverse nei deuterostomi rispetto ai protostomi e con conseguenti posizioni anatomiche diverse negli uni rispetto agli altri non solo per la bocca e l'ano, ma anche per il sistema nervoso centrale e l'aorta. Tali differenze sono state amplificate nel corso dell'evoluzione, tanto da poter definire i principali caratteri dei due gruppi. Pertanto la conoscenza di questi particolari rapporti anatomici e dei processi che portano al differenziamento delle cellule e dei tessuti, con la formazione dei diversi organi, consente di evidenziare omologie esistenti tra i vari phyla che all'osservazione topologica potrebbero sembrare semplici analogie.
La gastrulazione al tempo stesso è determinata e influisce sulle differenze presenti lungo gli assi corporei antero-posteriore e dorso-ventrale. Nei protostomi (così come nei cordati fra i deuterostomi), lungo l'asse A-P si specifica la reiterazione dei territori. Tale reiterazione si manifesta in una ripetizione dei segmenti (metameria) per tutti gli organi derivati dai foglietti embrionali (incluso, in parte, il tubo digerente). Nell'ambito dei protostomi, sia negli anellidi sia negli artropodi, gli istotipi e gli organi si susseguono lungo l'asse dorso-ventrale, seguendo un medesimo ordine anatomotopografico nella maggior parte dei metameri.
Le due aperture del tubo digerente, stomodeo e proctodeo, delimitano i segmenti anteriore, medio e posteriore. Solitamente, la segmentazione riguarda tutti gli organi di derivazione ectodermica e mesodermica ma non quelli di origine endodermica e, pertanto, interessa l'epidermide, il tessuto nervoso, i muscoli e il mesenchima. Né il mesoderma né l'ectoderma danno luogo a istotipi esclusivi; da ciascuno di questi foglietti germinali possono aversi tessuti con caratteristiche corrispondenti a quelle tipiche di cellule mesodermiche come pure ectodermiche e neurali. Pertanto ciascun istotipo non deriva esclusivamente da divisioni successive di cellule appartenenti a una sola discendenza cellulare. Gli orifizi di derivazione ectodermica relativi, rispettivamente, all'apparato urinario e a quello genitale possono comparire in segmenti corporei variabili, sia reiterati sia non reiterati. Appendici reiterate e branchie possono apparire come escrescenze dell' ectoderma. Scaglie, aculei e organi sensori rappresentano specializzazioni epidermiche che possono apparire reiterate in tutti i metameri, sebbene con differenti piani di sviluppo nei diversi segmenti.
Dalle comparazioni genetico-molecolari sta emergendo il fatto che differenze, sia a livello globale sia locale, sono controllate da geni conservati a partire dai pro genitori comuni ai protostomi e ai deuterostomi. I primitivi geni HOX (regolatori della trascrizione) appaiono, nella loro versione più arcaica, come tre membri di una medesima famiglia, espressi rispettivamente nella regione cefalica, mediana e terminale del corpo, in una medesima sequenza cefalo-caudale. È evidente come il loro allineamento sul genoma corrispondesse esattamente alla successione delle regioni corporee specificate da questi geni lungo l'asse A-P dell' embrione e anche al loro ordine di espressione antero-posteriore. Questo schema di espressione si presenta secondo questa successione anatomica anche in organismi non segmentati, quali i molluschi e gli echinodermi (Slack et al., 1993). La successiva evoluzione molecolare mediante duplicazione genica dei membri di questa famiglia ha generato fino a 10 complessi di geni, i cui membri relativi mantengono la stessa corrispondenza spaziale lungo l'asse A-P sia nei vertebrati sia negli insetti, suggerendo così un'origine comune e un medesimo ruolo nei processi di sviluppo dei diversi organismi (Akam, 1995; Ruddle et al., 1994; Duboule, 1995). I complessi di geni specificano l'eterogeneità tra gruppi di metameri o tra singoli metameri, perché sia in Drosophila sia nel topo le loro mutazioni causano sostituzioni omeotiche (mutazioni a seguito delle quali si ha la trasformazione di una parte del corpo in un'altra). Questo vale anche per tutti quegli organismi, sia insetti sia vertebrati, in cui l'espressione dei geni HOX coincide con le eterogeneità dorso-ventrali associate ai differenti istotipi in tutti i foglietti germinali di un determinato segmento. In Drosophila l'analisi dei mutanti a mosaico dei geni HOX ha evidenziato come, per i derivati epidermici, gli effetti morfogenetici di questi geni si manifestano come cellule autonome capaci di defmire il comportamento cellulare specifico di un determinato segmento (modalità di proliferazione e di differenziamento). Pertanto i geni HOX controllano, in qualità di geni selettori, l'espressione dei geni bersaglio (geni target, altrimenti detti geni rea lizza tori; alcuni di questi sono anche membri di sintagmi conservati) che definiscono il comportamento dei territori cellulari (García-Bellido, 1975) coordinando il legame di specifici fattori di crescita, indicati genericamente come ligandi, con i rispettivi recettori; questo vale, per esempio, per proteine quali hh, dpp, wg, N, ecc. (Capovilla et al., 1994; Pollock e Treisman, 1991).
Attualmente si conoscono molti geni selettori comuni a insetti e topi, che specificano territori cellulari e che sono conservati sin dai pro genitori comuni del Cambriano. Questi includono quei geni che codificano proteine con differenti motivi strutturali, e da ciò classificati come HOX, ZnF, P AX, LIM, POU e HLH, i quali controllano la trascrizione mediante il riconoscimento diretto delle sequenze promotrici del DNA. Alcuni di questi geni e i loro sintagmi possono funzionare contemporaneamente nella stessa cellula, generando mosaici di territori secondo le differenti combinazioni. Mentre i singoli processi genetici che essi controllano sono omologhi, cioè conservati, la loro combinazione differenziale nello spazio (e nel tempo dello sviluppo) dà luogo, nei differenti phyla, a strutture analoghe o completamente diverse.
Il fenomeno della metameria suscita diverse domande, tra cui come questa si sia potuta generare, in quale modo venga fissato il numero di metameri e come venga specificata la loro sequenza spaziale. Queste domande sono comprese in un'altra domanda di ordine più generale: come si generano gli insiemi sovracellulari e come riescono questi ad assumere una forma specifica? Come possono gli organismi animali e le differenti parti di cui sono costituiti raggiungere le dimensioni proprie a seconda della specie di appartenenza? Non si è ancora in grado di fornire una risposta in termini meccanicistici a questi classici quesiti, ma lo studio delle genealogie cellulari e dei dati provenienti dalla genetica molecolare suggerisce alcune possibili spiegazioni. Il meccanismo che determina metameria lungo l'asse A-P è strettamente collegato a quello che determina, a sua volta, differenze cellulari istotipiche lungo l'asse D-V, con susseguente formazione di territori bidimensionali di dimensioni specifiche della specie di appartenenza. Nei monomeri reiterati le differenze relative ai due assi comportano caratteristici piani progettuali di specificazione cellulare. Questi sono già osservabili negli anellidi e negli artropodi cambriani e sono simili a quelli individuabili in forme tuttora esistenti. Nel blastoderma embrionale degli insetti e del topo si formano, lungo l'asse D-V, istotipi discontinui che corrispondono ai foglietti germinali. All'interno di questi territori si evidenziano piani progettuali di differenziamento più fine. Così nel neuroectoderma, singole cellule si differenziano in neuroblasti con una netta diversificazione dagli epidermoblasti circostanti. Lo stesso avviene per le cellule epidermiche che si differenziano in scaglie o in aculei oppure in gruppi di mesodermoblasti. Ma come spiegare l'esistenza di tali piani progettuali? Cercheremo di individuare, attraverso una descrizione generale, il modo in cui si può essere prodotta la specificazione dei segmenti negli organismi metamerici.
L'iterazione metamerica può essere rappresentata visivamente da onde con valori massimi (ampiezza dell'onda) e valori intermedi a livello delle pendenze; possiamo così definire un parametro, il cui valore numerico è correlabile al numero delle cellule dell' embrione in quell' area, che potremmo chiamare lunghezza d'onda. L'analisi delle discendenze cellulari nei territori metamerici consente di evidenziare le due diverse modalità, dianzi enunciate, di proliferazione delle cellule. Negli anellidi (per esempio, la sanguisuga) i metameri mediani sono rappresentati da strutture periodiche generate per anamorfosi: cinque teloblasti (grosse cellule che si distinguono precocemente nell'uovo in segmentazione degli anellidi, così come nei molluschi e in alcuni artropodi), a simmetria bilaterale (designati MNOPQ, seguendo l'asse D-V), danno origine, mediante divisioni asimmetriche, a due bande. Le divisioni asimmetriche dei teloblasti avvengono secondo ritmi differenti, corrispondenti alle differenti lunghezze d'onda e caratteristici di ciascun teloblasto. I gruppi risultanti di cellule (5÷10), o blastocellule primitive, costituiscono il metamero primitivo. Le due bande sono suddivise, lungo l'asse D-V, in raggruppamenti di cellule precursori di istotipi diversi (ectoderma, neuroectoderma e mesoderma), specifici a seconda del teloblasto da cui discendono e organizzati secondo una determinata sequenza dorso-ventrale per ciascun metamero (lo stesso avviene negli insetti). La divisione cellulare per diamorfosi delle blastocellule originarie porta all'espansione dei metameri primitivi. Il differenziamento delle cellule muscolari e nefridiali, dei neuroni motori e sensoriali e degli epidermoblasti avviene in un tempo successivo, dando origine a modelli ad andamento periodico. Benché essi siano leggermente sfasati l'uno rispetto all'altro, il numero totale dei segmenti subesofagei è costante (32 nella sanguisuga), suggerendo così l'ipotesi che essi corrispondano a multipli di differenti 'lunghezze d'onda', come avviene nelle divisioni dei teloblasti. Mentre i segmenti sono molto simili l'uno all'altro (cioè omonimi), gli orifizi riproduttivi e le altre specializzazioni segmentali compaiono in segmenti riconducibili a un' identificazione numerica specifica (eteronomia).
Non è ancora chiaro come si realizzino tali periodicità nella sanguisuga. Tuttavia l'anamerismo (crescita per gemmazione iterativa) e la successiva espansione dei segmenti sono meccanismi operanti nel corso della segmentazione nella maggior parte degli artropodi (AverofeAkam,1995). ln Drosophila la periodicità dei segmenti dipende dal modo in cui le varie e diverse 'lunghezze d'onda' sono articolate tra loro. Le articolazioni lunghe sono quelle che coinvolgono quattro segmenti presuntivi e sono definite dall'espressione dei geni gap (geni zigotici espressi nel sincizio blastodermico, la cui trascrizione è controllata da proteine di origine materna e, a loro volta, coinvolti nella definizione sia dell'asse A-P sia della regione addominale). Le articolazioni di lunghezza media si realizzano lungo due segmenti presuntivi e sono defrnite dai geni chiamati pair-rule (geni anch'essi zigotici, la cui trascrizione è controllata da proteine di origine materna e da quelle codificate dai geni gap, che mediano la ulteriore definizione dell'organizzazione dell'embrione lungo l'asse AP). Infine le articolazioni corte sono definite da geni segment polarity (geni zigotici, espressi quando l'embrione è ormai totalmente formato da cellule, e che definiscono la polarità della distribuzione delle cellule entro un dato parasegmento). l confini entro i quali sono espressi i geni pair-rule e segment-polarity definiscono i campi d'espressione del complesso genico Antennapedia-Ultrabithorax (ANT -C e BX-C) e dei geni HOX che specificano l'identità dei segmenti e, quindi, le strutture delle varie parti del corpo (geni selettori). Negli artropodi i singoli segmenti sono suddivisi in due compartimenti, rispettivamente anteriore (A) e posteriore (P); quest'ultimo è specificato in tutti i segmenti dall'espressione del gene omeobox engrailed, il cui confine anteriore di espressione definisce iterativamente quello del segmento primigenio (parasegmento). Nella sanguisuga lo stesso gene (ht-EN) compare con periodicità segmentale ma soltanto nei derivati del teloblasto N, dando in questo modo origine ai neuroni. Così, per estrapolazione, l'ordine di comparsa dei segmenti negli anellidi potrebbe seguire un meccanismo analogo a quello di Drosophila e di altri artropodi, secondo il quale i geni, la cui diversa area d'espressione determina varie 'lunghezze d'onda', inducendo combinazioni diverse tra i prodotti quando le cellule si differenziano a partire dai teloblasti, generano segmenti di numero definito, con gli istotipi in registro. La particolare specificazione dei segmenti da parte dei geni HOX, chiamati LOX nella sanguisuga (per esempio, Ubx in Drosophila e Lox 2 nella sanguisuga), si realizza in modo autonomo relativamente alla singola progenie di derivazione teloblastica e non deriva dalle interazioni cellulari, cioè da informazioni relative alla posizione tra le blastocellule primitive (Nardelli-Haefliger et al., 1994; Wedeen e Weissblat, 1991). Da un punto di vista evolutivo, quest'ultimo processo è stato acquisito probabilmente in un tempo successivo. La precisione e la specificità del meccanismo di informazione sulla posizione delle cellule in relazione all'organizzazione corporea possono essersi evo Iute in organismi derivati.
Negli anellidi, negli insetti e nei cordati i confini territoriali dell'espressione differenziale dei geni HOX (e PAX) appaiono in successione, con limiti netti e discontinui nei segmenti cefalici e del tronco, ma si sovrappongono via via nei segmenti più caudali. Nel tronco di entrambi i phyla, l'ordine di comparsa dei segmenti è rostro-caudale. Questo comporta che, sia per gli artropodi sia per i cordati, i nuovi segmenti pregnatali sono comparsi secondo una sequenza caudo-rostrale (Averof e Akam, 1995; Finkelstein e Boncinelli, 1994). Questi nuovi segmenti possono essere omologhi a strutture cefaliche della sanguisuga che non derivano dai teloblasti del tronco. Si può affermare che i geni territoriali, mentre specificano l'identità di gruppi di cellule mediante le loro relazioni regolative, potrebbero avere la funzione di definire specifiche sequenze topo grafiche e, di conseguenza, il numero dei segmenti. Un numero costante di segmenti è caratteristico dei crostacei, dei chelicerati e degli onicofori cambriani (precursori degli insetti). Al contrario, i platelminti, i primi anellidi (Polychaeta) e i cordati possono avere un numero indefinito di segmenti.
Appendici e organi
Il fatto che i segmenti embrionali siano definiti dai geni HOX in bande della larghezza di poche cellule lungo l'asse A-P sembra costituire una regola. Queste bande si espandono in seguito in senso medio-laterale, seguendo una proliferazione cellulare di tipo simmetrico (diamorfosi), mentre possono comparire nuove periodicità di ampiezza non superiore ad alcune cellule. Il processo è reiterato, dando così origine a spazi morfologici con 'lunghezza d'onda' sempre più corta, proprio come si osserva nell'organizzazione finale.
È sempre il medesimo processo che funziona nella fase successiva dello sviluppo, durante l'organogenesi. In Drosophila, possiamo studiare dettagliatamente lo svolgimento di questo processo, durante la formazione delle appendici. Queste compaiono in campi embrionali secondari, nei quali vengono ricapitolate le diverse fasi di sviluppo già sperimentate nella formazione dei segmenti. Le appendici sono escrescenze reiterative che originano al confine A-P dei compartimenti all'interno di ciascun segmento embrionale, con primordi costituiti da poche cellule (meno di 30), di cui circa la metà si trova nel compartimento A e l'altra in quello P. I primordi si accrescono, generando per diamorfosi una struttura bidimensionale su entrambi i lati del confine (v. Cohen, 1993). In Drosophila, i raggruppamenti di cellule hanno un'origine policlonale, cioè derivano dall'interazione di cellule la cui genealogia non è direttamente correlata. L'attività dei geni selettori nelle cellule di ciascun compartimento fa sì che queste vengano contrassegnate da molecole di riconoscimento che impediscono alle cellule di un compartimento di mescolarsi con quelle del compartimento adiacente, attraverso un processo chiamato di restrizione clonale (García-Bellido et al., 1973). I confini, quindi, corrispondono alle discontinuità nell' espressione genica dei geni selettori.
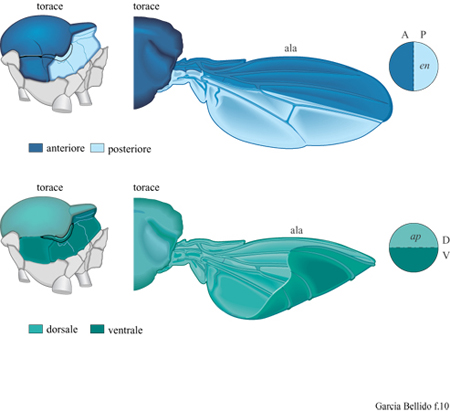
Nelle appendici, inoltre, i confini fungono da assi di simmetria e, lungo questi margini, le cellule si scambiano segnali, fattori di crescita e rispettivi ligandi (dei quali esistono versioni omologhe in Drosophila e nei vertebrati), usati sia per limitare l'espressione dei geni selettori sia per indurre la proliferazione cellulare (Williams e Carro l, 1993). In tal senso, i confini agiscono su ambedue i lati come 'organizzatori' per la proliferazione simmetrica e la polarità delle cellule. La suddivisione antero-posteriore del primordio embrionale, associata alla specificazione del gene en (engrailed), viene mantenuta durante la proliferazione successiva (fig. 10). In seguito a ulteriore crescita, compare un nuovo asse di simmetria che separa le cellule dorsali da quelle ventrali lungo un nuovo confine tra compartimenti che si escludono mutualmente; ciò è determinato dall'espressione di un nuovo gene selettore, apterous (ap) , che specifica le cellule dorsali in opposizione a quelle ventrali (v. figura 10). La sua funzione mobilita, ancora una volta, sia fattori di crescita sia recettori degli stessi, determinando una restrizione clonale lungo il nuovo margine, da una e dall'altra parte del quale si determina un incremento della proliferazione cellulare. Viene così a formarsi un nuovo compartimento che separa le regioni prossimali (noto) da quelle distali (ala vera e propria). Il primordio dell'ala è costituito a questo stadio da circa 200 cellule, cinquanta per compartimento. La proliferazione cellulare simmetrica all'interno dei quattro compartimenti dell'ala è ulteriormente stimolata da differenze nell' espressione di altri insiemi di geni regolatori in senso prossimo-distale, distalles (dll), nubbin (nub), aristaless (al), e dei loro ligandi (dpp, wgl); questi, agendo ai margini dei compartimenti, trasmettono messaggi di crescita (Williams e Carrol, 1993). La proliferazione cellulare continua in modo diamorfico per tutte le cellule del primordio. Con l'aumentare delle dimensioni in seguito alla ulteriore proliferazione, si verificano nuove restrizioni clonali che portano alla suddivisione di ciascun compartimento in tre bande, i cui margini corrispondono alle venature delle ali adulte (GonzaIez-Gaitan et al., 1994). Pertanto, il primordio dell'ala, così come quelli delle appendici ventrali (antenne, parti della bocca, arti e genitali esterni), viene a suddividersi durante la crescita in territori specificati da geni diversi, i cui margini agiscono da referenti per la proliferazione. Di nuovo, come nell'embrione, onde corte iniziali, comprese tra i confrni segnati dalla rispettiva espressione genica, si espandono in seguito alla proliferazione cellulare e nuove onde suddividono il territorio in crescita in frazioni bidimensionali di territori cellulari più piccole.
Questo tipo diamorfico simmetrico di crescita cellulare entro confini delimitati di volta in volta da una determinata espressione genica è, probabilmente, un processo attivo in tutti i metazoi. l meccanismi che sotto stanno a questo processo sono stati studiati in dettaglio per quanto riguarda la formazione dell'ala di Drosophila. La rigenerazione e il comportamento di alcuni tipi di cellule mutanti nei mosaici genetici rivelano eterogeneità spaziali che riflettono 'valori posizionali' differenziali. I valori sono massimi ai margini dell' area nella quale tale espressione è circoscritta, minimi nel punto centrale e intermedi nella zona compresa tra i due. In questo panorama di valori posizionali, le varie cellule mutanti per loei diversi possono crescere nella direzione delle creste o degli avvallamenti oppure, alternativamente, nella direzione opposta, a seconda del gene considerato e della sua condizione allelica (in omozigosi o eterozigosi). È stato costruito un modello (García-Bellido e De Celis, 1992), entelechia model (modello Entelechia) per il quale i valori posizionali sono rappresentati da differenze scalari nell'attività dei geni sui due assi ortogonali. Se questi valori sono espressi in quantità di ligandi mitogenetici e di recettori attivati che portano alla divisione cellulare, la proliferazione delle cellule con modalità simmetrica (intercalare) procederà dai margini esterni dell' area verso il centro, finché la differenza tra il valore massimo e quello minimo non raggiunga il punto massimo (ampiezza) e la spinta moltiplicativa a livello delle cellule adiacenti divenga minima (lunghezza d'onda), ottenendo così una mappa posizionale di dimensioni specifiche. Secondo questo assunto le dimensioni e le forme, che sono specie-specifiche, risulterebbero dalla soluzione di tutte le equazioni ipotizzate dal modello relative alle differenti lunghezze d'onda (segmenti), dalle più lunghe alle più corte presenti nella configurazione finale, secondo i due assi ortogonali del primordio. Dato che la spinta alla proliferazione cellulare dipende dalle ultime e più brevi lunghezze d'onda presenti nel primordio, al momento in cui quest'ultima equazione viene risolta, l'organo raggiunge la sua completezza, ovvero la perfezione (appunto la condizione aristotelica dell'entelechia). Non si sa ancora fino a che punto tale descrizione rappresenti un modello di crescita per le appendici di altri organismi. Tuttavia, giacché gli artropodi e gli anellidi cambriani possedevano appendici o escrescenze simili a quelle dei loro discendenti attuali, l'insieme dei processi genetici relativi allo sviluppo dell'organismo doveva essere in atto anche nei primi.
Il processo di differenziamento delle cellule secondo modelli prestabiliti si instaura parallelamente alla proliferazione delle stesse. Il differenziamento di cellule specifiche, per esempio di quelle sensoriali, delle scaglie e degli aculei, avviene in zone precise, in creste o in avvallamenti, secondo quei valori posizionali che sono in grado di attivare l'espressione dei geni preposti al differenziamento cellulare. È importante tenere presente che la specificazione territoriale per le diverse lunghezze d'onda e il differenziamento delle cellule secondo modelli prestabiliti (riguardanti territori, precise genealogie cellulari, gruppi di cellule, cellule singole) sono operazioni indipendenti, probabilmente già separate tra loro nei metazoi cambriani. Anche negli organismi attuali che da quelli derivano la prerogativa cellulare di conformarsi a uno schema prestabilito di sviluppo ha luogo nei territori di lunghezza d'onda lunga, come il neuroectoderma e l'epidermide degli embrioni primitivi oppure, ancora (utilizzando gli stessi sintagmi), nei territori o negli organi degli organismi adulti. L'analisi di questi schemi evidenzia, inoltre, come il destino delle cellule in proliferazione sia specificato da combinazioni di geni selettori, attivi durante tutto lo sviluppo. Pertanto la diversità morfologica che si evidenzia nel corso dello sviluppo non testimonia una 'cascata' di processi di ramificazione, bensì il risultato di combinazioni diverse di sintagmi in luoghi e tempi differenti nelle stesse cellule o negli stessi territori. È di notevole interesse il fatto che, durante lo sviluppo, gli stessi geni regolatori (quali HOX, PAX o LIM) vengano impiegati per specificare sia i territori sia la tipologia cellulare, utilizzando enhancers differenti (Castelli-Gair et al., 1992; Christen e Bienz, 1994). Diventa allora difficile appurare se la funzione originale di questi geni sia stata quella di specificare i territori o la tipologia cellulare. Per esempio, nella sanguisuga, i geni selettori HOX specificano la tipologia cellulare e non i segmenti, mentre in Drosophila gli stessi geni specificano sia l'una sia gli altri (come avviene anche nel caso del gene en).
Le specificazioni territoriali e il differenziamento delle cellule, secondo modelli precisi, possono limitarsi alla formazione di discendenze cellulari specifiche (monocloni) oppure rappresentare il risultato della coordinazione di cellule adiacenti mediante interazioni cellula-cellula (policloni). I confini possono essere manifesti prima che cessi la proliferazione (ed evidenziarsi così all'analisi della discendenza cellulare) oppure comparire soltanto alla fine di questa fase. La rigenerazione delle appendici degli insetti pare seguire le regole di un normale sviluppo, utilizzando i riferimenti dati dai margini, la sostituzione della lunghezza d'onda e la crescita per diamorfosi, in modo tale che le condizioni dell' entelechia possono essere raggiunte (come osservato in Drosophila). Se la rigenerazione avviene nello stesso modo in altri artropodi (e probabilmente anche nei cordati), allora i meccanismi di controllo della crescita che consentono di raggiungere dimensioni e forma specie-specifiche dovevano già essere attivi nei metazoi cambriani. Non sono solo le appendici e le branchie ad avere un'origine metamerica, ma anche i neuroni (motori e sensori), i condrociti precursori dei muscoli e delle ossa, nonché le strutture tubulari, come i nefridi, le vene e la trachea. Di conseguenza, sono tutti specificati primariamente dall'azione di meccanismi di regolazione di tipo combinatorio esercitata dai geni selettori con competenza territoriale. Anche questi organi si sviluppano a partire da un'invaginazione epiteliale oppure dalla delaminazione di un nuovo foglietto di cellule (consistente in una proliferazione ortogonale rispetto alla superficie d'origine) oppure, ancora, da un aggregato di cellule. I processi che sono alla base della formazione di tutti questi organi richiedono che si verifichi uno specifico riconoscimento cellulare e ciò si rivela con la presenza di particolari complessi di geni che si sono conservati durante l'evoluzione. Pertanto, negli insetti e nei topi, eventi quali la formazione di raggruppamenti di neuroni e di specifici territori cerebrali, nonché la sintesi di molecole per il controllo degli assoni, vedrebbero coinvolti geni omologhi (come le famiglie dei geni P AX ed EN).
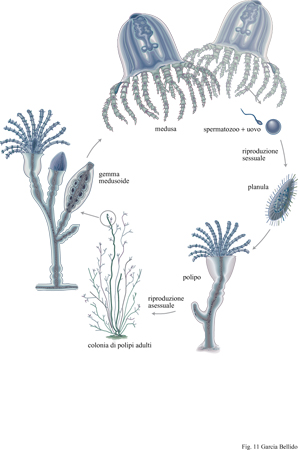
Gli eteromorfismi che si osservano negli animali odierni (fig. 11) dovevano essere presenti anche negli organismi cambriani. Probabilmente i polipi e le meduse degli cnidari erano già forme diverse del ciclo vitale di una stessa specie. Vi sono mute larvali nei trilobiti e in altri artropodi, sebbene queste corrispondano a forme caratterizzate da uno sviluppo piuttosto diretto (Walossek, 1995). Le forme sessili degli echinodermi sono derivate, probabilmente, da larve bentoniche e lo stesso si può dire per molluschi e anellidi. Nelle forme attuali i cambiamenti eteromorfici sono dovuti a ormoni che sono stati, probabilmente, conservati dai progenitori di artropodi e vertebrati. Nelle larve e nelle immagini di Drosophila sono attivi gli stessi geni e gli stessi sintagmi e lo stesso fenomeno si verifica senz'altro negli altri insetti. Così, la varietà di forme che caratterizzano le fasi vitali di un individuo eteromorfo nel corso dello sviluppo viene gestita dal medesimo genoma mediante una regolazione di tipo combinatorio, proprio come succede in territori diversi che si trovano al medesimo stadio di sviluppo (Raff, 1992; Davidson et al., 1995).
Basi genetiche della variazione evolutiva
Lo studio della conservazione dei geni e delle loro specifiche interazioni, mantenute dalle strutture del riconoscimento molecolare, ha aperto un'importante strada per il riconoscimento dei meccanismi evolutivi. La ricerca di una logica attraverso cui si realizza lo sviluppo degli organismi richiede studi comparativi tra specie esistenti. Per essere utile, la comparazione non deve essere posta nei termini di una dissertazione sulle diverse realtà anatomiche, bensì in un confronto tra i processi di natura genetica che determinano tali realtà, in una prospettiva complementare all'approccio anatomico. Per comprendere lo spettro di variazioni evolutivamente possibili in fenotipi adulti è necessario stimare i gradi di libertà concessi ai processi genetici cellulari per una regolazione di tipo combinatorio che sia in grado di descrivere lo sviluppo in termini genetico-molecolari, pur tenendo conto del ruolo dei determinanti esterni che introducono talune limitazioni alla morfogenesi (variazione adattativa). L'esplosione della diversificazione morfologica nella fauna cambriana, avvenuta, malgrado la conservazione dei geni, in un così breve periodo di tempo, suggerisce come essa si sia realizzata per eventi genetici di carattere combinatorio piuttosto che additivo. Inoltre, il fatto che la diversificazione morfologica si sia realizzata in specie animali che vivevano in condizioni biotiche ed ecologiche piuttosto omogenee, indica che i determinanti esterni hanno giocato un ruolo molto piccolo in questa storia.
Anche se la fauna cambriana fossile era distribuita in una situazione di continuità oceanica, era comunque iniziata la deriva dei continenti a partire da una massa continentale unica (Gondwana), sicché si venivano a creare condizioni ecologiche nuove e habitat divergenti. Questa è la ragione che spiega, probabilmente, le forme animali endemiche. Tale provincialismo tipologico è indicativo di un'ulteriore prolificazione incontrollata di morfologie in aree ristrette. A questo stadio dell'evoluzione morfologica, forze fisiche caratterizzate da una lunghezza d'onda lunga hanno cessato di funzionare come elemento primario per la morfogenesi e sono state sostituite da meccanismi più precisi di specificazione molecolare dei processi genetici. Le morfologie cambriane sembrano, inoltre, costituire il risultato diretto di espressioni genetiche poco ostacolate da strutture esterne: tali morfologie comprendevano specie facilmente riconosciute quali membri di phyla tuttora esistenti, come pure forme chimeriche di phyla estinti che successivamente sono state collocate in nuovi phyla. Infatti, la problematica fauna degli argilloscisti di Burgess Shale nella Columbia Britannica, Canada (v. figura 1), include specie fossili che, probabilmente, rappresentano transizioni tra i maggiori phyla attuali e che si sono suddivisi, con la comparsa dei protostomi, nelle ramificazioni costituite dai molluschi, dai brachiopodi e dai policheti (Conway Morris e Peel, 1995). In generale le specie cambriane vanno considerate come una rappresentazione molto fedele di archetipi o di forme ancestrali di periodi precedenti a cui sono seguiti successivi adattamenti e quindi non come forme iniziali, bensì come forme fmali, complete nei loro dettagli anatomici e funzionali.
Gli assunti appena formulati richiedono una spiegazione in merito alle capacità strutturali interne per una ulteriore diversificazione e evoluzione. La comparsa di sintagmi di sviluppo deriva da meccanismi di regolazione genica proprio come si verifica per gli operoni dei batteri. Gruppi di geni che si sono associati per assolvere processi genetici specifici sotto il controllo dei geni selettori possono essere stati selezionati indipendentemente dai loro effetti combinati. Pertanto i geni coinvolti nel ciclo cellulare, nella formazione del cito scheletro , nel controllo dell'attività dei ligandi e dei recettori durante le reazioni a cascata di trasduzione del segnale, come anche i geni selettori territoriali e istotipici, hanno svolto, nella loro forma primitiva, una funzione di domini proteici già nelle cellule procariotiche come in quelle eucariotiche, ancor prima di essere utilizzati per la morfogenesi multicellulare. Sarebbe insensato, data una conoscenza ancora scarsa della filo genesi dei gruppi cambriani, speculare su come i sintagmi si siano venuti a organizzare nelle cellule in modo da fissare il loro ruolo funzionale durante i processi di sviluppo oppure su come questi processi si siano integrati in morfologie attuali così discontinue. Probabilmente in parallelo si sono evoluti sistemi di controllo tempestivo delle nuove realtà che si venivano a formare, in modo da rendere ciascuna di esse fisicamente stabile (per esempio, sessile o mobile, a simmetria radiale o bilaterale), mentre varianti non funzionali venivano eliminate. L'unico elemento sul quale è possibile speculare riguarda il fatto che la comparsa dei predatori determina nelle loro prede la presenza stabile di uno scheletro e di altre strutture di difesa, fatto questo che ha innescato un processo dinamico, ancora in atto, per la realizzazione di forme morfogenetiche sempre più sofisticate. A fronte dell'inerzia evolutiva, che si basa sui limiti imposti dal riconoscimento molecolare e si contrappone al mutamento derivante dalle diverse interazioni genetiche, una complessità morfologica più alta può risultare soltanto dall'iterazione e dall' associazione combinatoria di funzioni preesistenti, come si può rilevare durante il tum aver del DNA e il rimescolamento concomitante delle sue sequenze. Le complesse regioni promotrici dei geni regolatori, così come di quelli strutturali, permettono variazioni combinatorie. A sua volta la duplicazione dei geni comporta variazioni modulatorie e la formazione di famiglie di geni. La regolazione combinatoria, d'altronde, ha permesso l'espressione del medesimo gene in sintagmi e discendenze cellulari differenti, consentendo così che si realizzassero tutti quei processi genetici che controllano lo sviluppo dell'organismo. Le classiche mutazioni, localizzate nelle regioni che codificano le proteine, devono aver avuto una scarsa rilevanza immediata per l'evoluzione morfologica, eccetto per il fatto di indurre una coevoluzione molecolare tra partner proteici interagenti che doveva assicurare la possibilità di legame tra molecole distinte e quindi la sopravvivenza. Tuttavia le nuove varianti genetiche risultanti dal rime scolamento degli enhancers, in seguito a uno dei meccanismi enunciati, sono state sottoposte a una selezione minima a causa della funzione primaria fondamentale assolta dai membri originari, la quale assicurava una morfogenesi inalterata. Presumibilmente queste costituiscono proprietà fondamentali con una certa elasticità di fronte alle variazioni mutazionali, cioè dotate di 'tolleranza evolutiva'. Di conseguenza l'evoluzione morfologica è dipesa principalmente da variazioni combinatorie di elementi regolativi in cis (si intendono con ciò sequenze di DNA che possono controllare un gene soltanto se localizzato sullo stesso cromosoma), piuttosto che da cambiamenti negli alleli, come affermato da Allan Wilson circa alla fine degli anni Settanta.
La tolleranza evolutiva, a sua volta, costituisce la base per la diversificazione morfologica. Dal punto di vista generativo, l'esplosione tipo logica cambriana rappresenta un'espansione sul piano della diversità piuttosto che un aumento di complessità degli organismi; la si può paragonare all'insieme delle variazioni determinate da un caleidoscopio in rotazione. Lo scarso numero di connessioni, altamente selettive a livello molecolare, tra i prodotti dei sintagmi ha fatto sì che questi possano essere stati utilizzati in discendenze cellulari differenti e in posizioni diverse lungo ciascuna ramificazione (eterotopismi) oppure in diversi momenti dello sviluppo (eterocronie), in virtù delle nuove interazioni cellulari che si vengono a determinare e, pertanto, di specifici geni selettori. Così si osservano membri delle famiglie dei geni HOX o PAX che specificano sia per territori sia per istotipi differenti (muscoli, nervi). Infatti i geni HOX, che probabilmente definivano territori anatomici rudimentali nei primi metazoi, solo in un secondo tempo devono aver partecipato alla specificazione dei segmenti negli animali metamerici. La duplicazione dei geni e lo splicing alternativo specifico associato a particolari enhancers sono stati impiegati solo in un momento successivo dell' evoluzione, per definire tessuti più specifici oppure elementi modulari od organi, all'interno di ciascun segmento. Pertanto alcuni membri della stessa famiglia genica hanno unitariamente cambiato la propria specificità territoriale per una specificità istotipica, come si può osservare nelle forme derivate (nematodi, moscerini e mammiferi). Queste nuove funzioni proprie dei geni selettori utilizzano probabilmente gli stessi geni target. In ogni caso, giacché il rimescolamento degli enhancers può includere nuovi geni target nello stesso sintagma o sottrarli al controllo di uno specifico gene selettore, cambiamenti nel tipo di cellule o di specificazione territoriale possono derivare da nuove combinazioni di membri dei sintagmi operanti nelle cellule. Questi cambiamenti combinatori possono verificarsi in qualsiasi stadio dello sviluppo e in qualsiasi discendenza cellulare. Presumibilmente questa costituisce la base che consente, dall' espressione di uno stesso genoma, la formazione di differenti segmenti (eteronomia) a partire da un contesto di omonomia, come anche lo sviluppo diretto o indiretto dell' organismo dalla fase embrionale a quella adulta attraverso uno o più stadi larvali, gli eteromorfismi di fase e di forma, il dimorfismo sessuale, nonché le forme parassitiche o neoteniche. Queste varianti costituiscono il mero risultato di pochi cambiamenti intervenuti nell'organizzazione genetica di un numero di sintagmi relativamente ristretto.
Possiamo estendere alle interazioni che si verificano a un livello più alto ciò che si è compreso per i meccanismi evolutivi che hanno determinato sostituzioni di amminoacidi negli enzimi, che possono cambiare la propria sequenza lineare per un amminoacido alla volta ma conservare la propria funzione in quanto questa dipende soltanto dalla struttura tridimensionale. Le forme coevolventi, come per esempio i cistroni dell'rDNA e le corrispondenti RNApolimerasi, cambiano a seconda della specie ma conservano la medesima interazione funzionale. Probabilmente le operazioni proprie del sintagma vengono mantenute nonostante i cambiamenti sostitutivi, che si verificano uno alla volta, dei suoi membri. Non sorprende il fatto che determinati processi vengano svolti da geni differenti in organismi correlati mentre i risultati rimangono gli stessi (come avviene nei due passaggi della determinazione e della differenziazione del sesso). Questo processo di 'metavariazione' può spiegare la permanenza di alcuni archetipi (come i tipi cellulari, i tessuti e gli organi, i segmenti, le appendici, gli elementi chiridiali e i diversi moduli) attraverso una lentissima sostituzione dei loro componenti sintagmatici che, comunque, conservano i loro compiti principali. Tuttavia a livelli così alti di organizzazione non è possibile affermare con certezza quali forme possano essersi conservate nel corso dell'evoluzione a seguito di un alto valore adattativo del prodotto finale e non per intrinseca inerzia generativa. Probabilmente le limitazioni alla generazione di nuove strutture sono un elemento di conservazione più efficiente di quanto non siano nuove eventuali morfologie risultanti dai processi selettivi.
Se comparate con eventi evolutivi più recenti, la rapidità e la versatilità dei cambiamenti verificatesi nel cambriano, in un intervallo di tempo così breve, risultano davvero sorprendenti. Comunque, anche nel corso di forti diversificazioni morfologiche successive, queste sono intervenute nel corso di pochi milioni di anni; valga come esempio il caso dei mammiferi in cui vi sono stati passaggi da forme terrestri a forme acquatiche (come per le balene e le foche), oppure da forme atte alla deambulazione a quelle in grado di volare (come i pipistrelli). Non vi è modo di confermare sperimentalmente alcuna ipotesi che possa dar conto di questi rapidi cambiamenti, ma è anche chiaro come le modalità di una selezione lenta differenziale, per cambiamenti fenotipici di piccola entità, non possono applicarsi alle esplosioni morfologiche di cui sopra. Dobbiamo considerare l'eventualità che la tolleranza a cambiamenti genetici compatibili per un buon adattamento sia più ampia di quanto si ritenesse in passato. Insomma, ancora una volta gli organismi sembrano dipendere maggiormente dai meccanismi generativi che dal grado di adattabilità delle loro forme finali.
Principi invarianti nella morfogenesi
Ci si chiede quanto sia possibile identificare, nelle descrizioni fenomenologiche precedenti, principi o processi che siano invarianti e che possano spiegare la comparsa di nuove forme e il loro modificarsi durante l'evoluzione. Quanto segue può servire da ricapitolazione. Analogamente all'associazione di gruppi di geni che interagiscono fra loro nei sintagmi, la multicellularità è associata a territori di espressione genica discontinui. Probabilmente, fin dai pro genitori dei metafiti e dei metazoi, gruppi territoriali di cellule hanno condiviso quei geni regolatori (selettori) che specificavano un gruppo come un'entità distinta dalle altre. Questi geni selettori sono dei coordinatori spaziali che operano tramite i sintagmi, definendo modelli di comportamento cellulare differenti. Nonostante la metavariazione dei loro componenti, essi sono stati trasmessi agli organismi attuali per definire territori, organi, tipi cellulari e anche il dimorfismo sessuale. Questi coordinatori spaziali specificano territori di lunghezza d'onda differente, come si osserva nelle forme terminali, sebbene all'inizio appaiano in piccoli gruppi di cellule che daranno poi origine alle discendenze cellulari (founder cells). Assieme alla proliferazione cellulare, durante lo sviluppo vi sono nuovi geni selettori che specificano territori di lunghezza d'onda più breve. Pertanto la forma adulta risulta costituita da un mosaico di territori di diverse lunghezze d'onda, specificate in modo combinatorio. Questo costituisce la base per l'iterazione nei segmenti embrionali e nelle appendici che dà origine a organismi più grandi e più complessi. Lungo gli assi corporei A-P e D-V, questi territori compaiono in sequenza; all'inizio dei processi evolutivi, essi determinano ripetizioni omonime e in seguito, con l'amplificazione di geni selettori all'interno delle famiglie, eteronomie. l territori vengono definiti da margini, cioè da discontinuità nell' espressione genica tra cellule adiacenti, e da restrizioni donali all'interno della loro progenie cellulare. Non sappiamo se intervengano prima le restrizioni donali, intese come limitazioni proliferative, oppure la specificazione degli istotipi a opera dei geni selettori. l margini territoriali dell'espressione dei selettori costituiscono un riferimento per l'ulteriore diversificazione, mediante meccanismi di inibizione/attivazione di nuovi geni selettori, e per la proliferazione intercalare, che termina con il raggiungimento di dimensioni e forme territoriali specie-specifiche.
In senso operativo, il progetto di formazione dei confini per restrizione donale è simile al progetto di definizione dei differenti tipi cellulari entro i territori. In tal modo, a partire da gruppi di cellule inizialmente omogenei, si arriva all'identificazione in posizioni invarianti, ciascuna corrispondente a una determinata quantità di espressione genica territoriale, dei neuroblasti o di aculei mediante inibizione laterale (rafforzamento/estinzione di geni). Assieme alla specificazione cellulare, compaiono nuove modalità comportamentali nelle cellule, quali la migrazione, la delaminazione, la condensazione, modificazioni delle modalità proliferative (che sono i comportamenti fondamentali necessari per la gastrulazione), oltre al controllo e al riconoscimento degli assoni, alla condensazione dei muscoli e delle ossa e alla crescita verso l'esterno delle appendici. Il riconoscimento cellula-cellula e la comunicazione fra cellule assicurano crescita e modalità di sviluppo coordinate, tramite stimolazioni tra cellule che si trovano sulla stessa superficie (induzione planare) o in territori aggiunti secondariamente (induzione verticale). In entrambi i casi, la comunicazione cellulare porta a un rafforzamento/estinzione dell' espressione genica e di qui a una attivazione/inibizione di nuovi geni selettori e a nuove vie di sviluppo. In tutti questi processi morfogenetici il controllo è locale, cioè tra cellule contigue, ed è diverso da un tipo di controllo a livello globale. Coordinatori temporali, come gli ormoni, devono essere anch'essi comparsi a uno stadio precoce dell' evoluzione, associati a una mutazione o al cambiamento delle condizioni esterne.
Abbiamo visto in precedenza che la sequenza degli eventi di sviluppo può variare, probabilmente per l'attivazione differenziale degli enhancers dei geni selettori, che può, a sua volta, condizionare la scelta dei loro geni target e la loro espressione in genealogie cellulari e sequenze temporali diverse. Pertanto le gerarchie genetiche sono essenzialmente delle sinarchie e la variazione morfologica altro non è se non una diversificazione combinatoria. L'evoluzione morfologica procede per lo più con modificazioni nella regolazione genica mediante un rimescolamento degli enhancers, mantenendo tuttavia la regione che codifica la proteina costante oppure variabile, ma comunque per un numero fmito di modificazioni che siano compatibili con il riconoscimento molecolare dei partners. D'altra parte, il riconoscimento molecolare per funzioni elementari consente all'inerzia evolutiva di modificarsi. Le sequenze causali di eventi regolatori rappresentano un'altra componente dell'inerzia evolutiva, basilare per la conservazione degli archetipi. Questa predisposizione organizzativa o di 'stampo' permette soltanto un'amplificazione della diversità oltre a un'amplificazione delle famiglie geniche. È solo la successiva diversificazione di linee filetiche che dà l'impressione dell'esistenza di adattamenti morfogenetici più adeguati. Se gli organismi cambriani avevano risolto i problemi morfogenetici con meccanismi simili a quelli delle forme recenti, quale è la ragione della loro evoluzione? Ovvero, perché si sono verificate l'esplosione cambriana e quelle successive? Se lo studio dell'evoluzione dello sviluppo consiste in quello delle modificazioni delle interazioni regolative dell'azione dei geni, diventa un problema di natura storica distinguere la contingenza dalla causalità, l'amplificazione dall'adattamento all'ambiente, la tendenza a esplorare con mezzi idonei dall'adattamento al mondo esterno.
Ringraziamenti
Desidero ringraziare il dr. S. Conway Morris, il dr. D. Duboule, il dr. A. Ghysen, il dr. G. Stent e i colleghi del laboratorio per i loro commenti oltremodo costruttivi a questo manoscritto. Il lavoro sperimentale è stato finanziato con un training grant (PB920036) della Direccion GeneraI de Investigacion Cientifica y Técnica (DGICYT) e da una borsa di studio istituzionale della Fundacion Ramon Areces al Centro de Biologia Molecular Severo Ochoa.
Bibliografia citata
ABEL, T., BHATT, R., MANIATIS, T. (1992) A Drosophila Creb/Atf transcriptional activator binds to both fat-body liver-specific regulatory elements. Genes Development, 6, 466-480.
ABMAYR, S.M., ERICKSON, M.S., BOUR, B.A. (1995) Embryonic development of the larval body wall musculature of Drosophila melanogaster. Trends Genet, Il, 153-159.
AKAM, M. (1989) Hox hom: homologous gene clusters in Insects and Vertebrates. CelI, 57, 347-349.
AKAM, M. (1995) Hox genes. The evolution of diverse body plans. Philos. Trans. R. Soc. Lond. B Biol. Sci., 349, 313-319.
AVEROF, M., AKAM, M. (1995) Insect-crustacean relationships: insights from comparative developmental molecular studies. Phil. Trans. R. Soc. Lond. (B), 347, 293-303.
CAPOVILLA, M., BRANDT, M., BOTAS, J. (1994) Direct regulation of decapentaplegic by ultrabithorax and its role in drosophila midgut morphogenesis. CelI, 76, 461-475.
CASTELLI-GAIR, J., MULLER, J., BIENZ, M. (1992) Function of an ultrabithorax minigene in imaginal cells. Development, 114, 877-886.
CHOTHIA, C. (1992) One thousand families for the molecular biologist. Nature, 357, 543-544.
CHRISTEN, B., BIENZ, M. (1994) Imaginal disc silencers from Ultrabithorax: evidence for Polycomb response elements. Mech. Dev., 48 (3), 255-266.
COHEN, S.M. (1993) Imaginal disc development of Drosophila. In The Development of Drosophila melanogaster, voI. 2, a c. di Martinez-Arias A., Bate M., Cold Spring Harbor, Cold Spring Harbor Laboratory Press, pp. 747-842.
CONWAY MORRIS, S. (1993) The fossil record and the early evolution of the Metazoa. Nature, 361, 219-225.
CONWAY MORRIS, S. (1994) Early Metazoan evolution: first steps to an integration of molecular and morphological data. In: Early life on Earth, Nobel Symposium No. 84, a c. di Bengtson S., New York, Columbia University Press.
CONWAY MORRIS S., PEEL, J. (1995) Articulated Halkieriids from the Lower Cambrian of North Greenland and their role in early protostome evolution Phil. Trans. R. Soc. Lond. (B), 347, 305-358.
DARNELL, J.E., DOOLITTLE, W.F. (1986) Speculation on the early course of evolution. Proc. Natl. Acad. Sci. Usa, 83,1271-1275.
DAVIDSON, E.H., KEVIN, J., PETERSON, R., CAMERON, A. (1995) Origin of bilaterian body plans: evolution of developmental regulatory mechanisms. Science, 270, 1319-1325.
DE ROBERTIS, E.M., SASAI, Y. (1996) A common pIan for dorsoventral patteming in bilateria. Nature, 380, 37-40.
DUBOULE, D. (1995) Vertebrate Hox genes proliferation: an alternative pathway to homeosis? Curr. Opin. in Genet. Dev., 5, 525-528.
ERWIN, D.H. (1991) Metazoan phylogeny and the Cambrian explosion. Trends Ecol. Evol., 6, 131-134.
ERWIN, D.H. (1993) The origin of Metazoan development: a palaeobiological perspective. Biological Journal of the Linnean Society, 50, 255-274.
FIETZ, M.J., CONCORDE T, J-P., BARBOSA, R., JOHNSON, R., KRAUSS, S., McMAHON, A.P., TABIN, C., INGHAM, P.W. (1994) The hedgehog gene family in Drosophila and vertebrate development. In Dev. Suppl., pp. 43-51.
FINKELSTEIN, R., BONCINELLI, E. (1994) From fty head to mammalian forebrain: the story of Otd and Otx. Trends Genet., 10, 310-315.
GARCÍA-BELLIDO, A. (1966) Pattem reconstruction by dissociated imaginal disk cell of Drosophila melanogaster. Dev. Biol., 14, 278-306.
GARCÍA-BELLIDO, A., RIPOLL, R., MORATA, G. (1973) Developmental compartmentalization of the wing disk of Drosophila. Nat. New Biol., 245, 251-253.
GARCÍA-BELLIDO, A. (1975) Genetic control of wing disc development in Drosophila. In Cell Patterning, Ciba Foundation Symposium 29, Amsterdam, Elsevier, pp. 161-182.
GARCÍA-BELLIDO, A. (1985) Celllineages and genes. Phil. Trans. R. Soc. Lond. (B), 312,101-128.
GARCÍA-BELLIDO, A., DE CELIS, J.F. (1992) Developmental genetics of the venation pattem of Drosophila. Annu. Rev. Genet., 26, 277-304.
GONZALEZ-GAITAN, M. CAPDEVILA, M.P., GARCÍA-BELLIDO, A. (1994) Cell proliferation pattems in the wing imaginal disc of Drosophila. Mech. dev., 40, 183-200.
GRENS, A, MASON, E., MARSH, J.L., BODE, H.R. (1995) Evolutionary conservation of a cell fate specification gene: the Hydra achaete-scute homolog has proneural activity in Drosophila. Development, 121, 4027-4035.
HOGAN, B.L.M., BLESSING, M., WINNIER, G.E., SUZUKI, N., JONES, C.M. (1994) Growth factors in development: the role of TGF-I3 related polypeptide signalling molecules in embryogenesis. In Dev. Suppl., pp. 53-60.
JONES, C.M., LYONS, K.M., HOGAN, B.L.M. (1991) Involvement of bone morphogenetic protein-4 (BMP-4) and Vgr-I in morphogenesis and neurogenesis in the mouse. Development, 111, 531-542.
KNOLL, AH. (1992) The early evolution of Eukaryotes: a geological perspective. Science, 256, 622-627.
LEVINE, A.J., BROACH, J.R. (1995) Oncogenes and cell proliferation. Curr. Opin. in Genet. Dev., 5, 1-4.
LOOSLI, F., KMITA-CUNISSE, M., GEHRING, W.J. (1996) Isolation of a Pax-6 homolog from the ribbonworm Lineus sanguineus. Proc. Natl. Acad. Sci. USA, 93, 2658-2663.
MAINE, E.M., LISSEMORE, J.L., STARMER, W.T. (1995) A phylogenetic analysis of vertebrate and invertebrate notch-related genes. Mol. Phylogenet. Evol., 4, 139-149.
MANAK, J.R., SCOTT, M.P. (1994) A class act: conservation of homeodomain protein functions. In Dev. Suppl., pp. 61-77.
MIKLOS, G.L.G., CAMPBELL, H.D. (1992) The evolution ofprotein domains and the organizational complexities of Metazoans. Curr. Opin. in Genet. Dev., 2, 902-906.
NARDELLI-HAEFLIGER, D., BRUCE, A.E.E., SHANKLAND, M. (1994) An axial domain of HOM-HOX gene expression is formed by morphogenetic aligmnent of independently specified celllineages in the leech Helobdella. Development, 120, 1839-1849.
NIETO, M.A., BENNET, M.F., SARGENT, M.G., WILKINSON, D.G. (1992) Cloning and developmental expression of Sna, a murine homologue of the Drosophila snail gene. Development, 116, 227-237.
NURSE, P. (1993) Cell cycle control. Phil. Trans. R. Soc. Lond. (B), 341, 449-454.
PATTERSON, C., WILLIAMS, D.M., HUMPHRIES, C.J. (1993) Congruence between molecular and morphological phylogenies. Annu. Rev. Ecol, Syst., 24, 153-188.
POLLOCK, R., TREISMAN, R. (1991) Human Srf-related proteins: DNA-binding properties and potential regulatory targets. Genes Dev., 5, 2327-2341.
RAFF, R.A (1992) Direct-developing sea urchins and the evolutionary reorganization of early development. Bioessays, 14, 211-218.
RUDDLE, F.H., BENTLEY, K.L., MURTHA, M.T., RISCH, N. (1994) Gene loss and gain in the evolution of the vertebrates. In Dev. Suppl., pp. 155-161.
SHENK, M.A, STEELE, R.E. (1993) A molecular snapshot of the Metazoan 'Eve'. Trends Biochem. Sci., 18, 459-463.
SKEATH, J.B., CARROLL, S.B. (1994) The achaete-scute complex: generation of cellular pattern and fate within the Drosophila nervous system. FASEB, 8, 714-720.
SLACK, J.M.W., HOLLAND, P.W.H., GRAHAM, C.F. (1993) The zootype and the phylotypic stage. Nature, 361, 490-492.
VALENTINE, J.W. (1994) Late Precambrian Bilaterians: grades and clades. Proc. Natl. Acad. Sci. USA, 91, 6751-6757.
WALOSSEK, D. (1995) The Upper Cambrian Rehbachiella, its larval development, morphology and significance for the phylogeny of Branchiopoda and Crustacea. Hydrobiologia, 298, 1-13.
WEDEEN, C.J., WEISSBLAT, D.A. (1991) Segmental expression of an engrailed-class gene during early development and neurogenesis in an annelid. Development, 113, 805-814.
WILLIAMS, J.A., CARROL, S.B. (1993) The origin, patteming and evolution of insect appendages. Bioessays, 15, 567-577.
ZHAO, C., EMMONS, S.W. (1995) A transcription factor controlling development of peripheral sense organs in C. elegans. Nature, 373, 74-78.