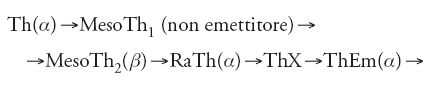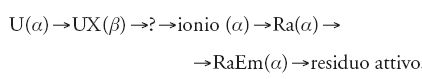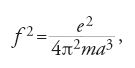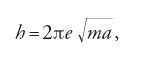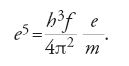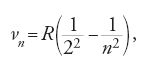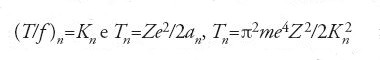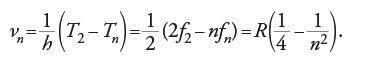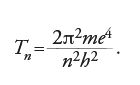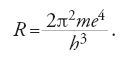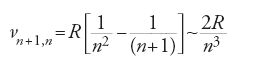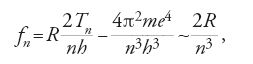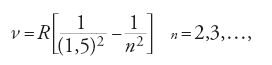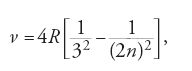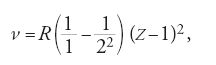La seconda rivoluzione scientifica: fisica e chimica. La struttura atomica
La seconda rivoluzione scientifica: fisica e chimica. La struttura atomica
La struttura atomica
La struttura degli atomi non era considerata un argomento di studio alla moda, né particolarmente produttivo, quando Joseph J. Thomson (1856-1940) nel 1897 ipotizzò che essi fossero costituiti interamente da corpuscoli, cioè da quelle particelle subatomiche negative appena identificate, da lui e da altri, come costituenti dei raggi catodici. Thomson dimostrò che la massa apparente di questi corpuscoli non era che un millesimo di quella dell'atomo d'idrogeno, mH. Usando questo valore, e basandosi sull'ipotesi fondamentale che tutta la massa atomica AmH (dove A è il peso atomico relativo all'idrogeno) fosse dovuta ai corpuscoli, determinò in 1000 A ca. il numero n di corpuscoli in un atomo. Le idee sviluppate da Thomson furono di guida per la costruzione dei modelli atomici fino alla quantizzazione dell'atomo a opera di Niels Bohr, tra il 1912 e il 1913.
Un argomento quasi nuovo
All'inizio degli anni Novanta del XIX sec., diverse linee di ricerca avevano ormai messo in luce la natura composita dell'atomo dal punto di vista chimico. Uno dei fattori considerati era il grande numero degli elementi chimici, che a molti appariva, in effetti, troppo elevato. I chimici accarezzavano ancora l'idea, formulata nel 1815 dal chimico inglese William Prout (1785-1850), secondo la quale tutti gli elementi si potevano ottenere come composti dell'idrogeno o di altro 'protilo'. Anche se, a mano a mano che i valori dei pesi atomici si facevano più precisi, l'ipotesi di Prout si rivelava non più in accordo con i risultati sperimentali, l'invenzione della tavola periodica degli elementi, avvenuta intorno al 1870, ridiede vita alla convinzione che gli elementi chimici dovessero avere qualcosa in comune tra di loro.
Un'altra linea d'indagine, che si muoveva a favore della concezione di un atomo complesso, traeva origine da un problema cruciale della fisica del XIX sec.: la relazione tra elettricità e materia. Secondo le teorie più sofisticate e ortodosse, come quella di Maxwell, l'elettricità si comportava come un fluido incomprimibile, e la carica elettrica indicava semplicemente i punti nei quali le linee di forza nel fluido si originavano o terminavano sui corpi materiali. D'altra parte, nelle teorie più ingenue e pratiche tra quelle in voga in Europa, la carica elettrica non era altro che una gocciolina di fluido elettrico, derivante dalla separazione di elettricità positive e negative. La questione giunse a una svolta nel decennio 1880-1890 a proposito dell'interpretazione degli esperimenti sull'elettrolisi. Come dichiarò Hermann von Helmholtz (1821-1894) nel 1881, in un discorso destinato a esercitare in seguito una notevole influenza, l'elettrolisi dimostrava che se la teoria atomica valeva per la materia doveva valere anche per l'elettricità, e viceversa.
Nella sua descrizione dell'elettrolisi, Michael Faraday (1791-1867) aveva introdotto i termini 'ione' ed 'elettrodo', a indicare che qualcosa si muoveva in un fluido elettrolitico, verso le piastre elettrificate immerse in esso e attraverso queste. I modelli elaborati per descrivere il fenomeno raffiguravano gli ioni come atomi o molecole carichi, strappati alle loro controparti neutre dall'azione degli elettrodi. Nel periodo compreso tra il 1880 e il 1890 Svante August Arrhenius (1859-1927), che sarebbe presto diventato il caposcuola della nuova scienza chimico-fisica, argomentò che alcune particelle del soluto esistevano nel fluido come ioni, anche in assenza di elettrodi o correnti. La dissociazione spiegava molti e diversi fenomeni, oltre alla conducibilità delle soluzioni, come per esempio il cambiamento del punto di congelamento con la concentrazione del soluto e la natura della pressione osmotica.
I fisici ripresero il concetto di ione (senza l'ipotesi della dissociazione) allo scopo di spiegare il fenomeno della scarica nei gas. Buona parte della ricerca svolta presso il Cavendish Laboratory diretto da Thomson, verso la fine del decennio 1880-1890 e all'inizio del successivo, riguardava lo studio degli ioni nei fluidi e nei gas. Thomson concepiva la relazione tra l'elettricità e la materia solitamente in termini maxwelliani, anche se in alcuni casi seguiva invece l'interpretazione prevalente nel resto d'Europa. Non esisteva un quadro generalmente accettato della relazione tra un atomo, o una molecola, e il suo ione; una molecola si poteva separare in una parte positiva e una negativa, ma come poteva farlo un atomo?
I pochi modelli rilevanti a questo riguardo, disponibili all'epoca, erano molto generici e ipotetici. Hendrik Antoon Lorentz (1853-1928) a Leida, e Joseph Larmor (1857-1942), collega di Thomson, a Cambridge, avevano escogitato atomi costituiti da ioni (Lorentz) e da elettroni positivi e negativi (Larmor). Entrambi gli schemi, che raggiunsero la forma definitiva nel 1895, permettevano di rappresentare lo ione nell'elettrolita o nel gas come un atomo o una molecola che avevano perso, o acquisito, un elettrone o uno ione; siccome però le particelle fondamentali in entrambi gli schemi avevano un rapporto tra carica e massa, e/m, circa uguale a quello dell'atomo di idrogeno elettrolitico, nessuno dei due fornì una rappresentazione utile della relazione tra un atomo e il suo ione prima che fosse avvenuta la scoperta dei corpuscoli.
Un terzo gruppo di ricerche, nelle quali si ipotizzava un qualche tipo di costituzione interna degli atomi, riguardava la radiazione e, in particolare, l'emissione di righe spettrali e la dispersione anomala della luce.
L'identificazione degli atomi come le sorgenti dei ricchi spettri a righe degli elementi diede avvio alla ricerca di un emettitore spettrale che fosse a essi associato. La teoria (sia quella elettromagnetica sia quella basata sul solido elastico) richiedeva che l'oggetto che irraggiava possedesse componenti capaci di oscillare in modi diversi; non necessariamente componenti identiche, come nell'ipotesi di Prout, o elementi dotati di esistenza indipendente, come nella teoria corpuscolare di Thomson, ma magari identiche o indipendenti a seconda delle circostanze.
Solamente in un caso, isolato ma di cruciale importanza, una teoria della struttura atomica forniva una spiegazione, e persino una previsione, dell'interazione tra luce, elettricità e materia. Si trattava della teoria di Lorentz: l'interazione, che provocava la separazione di righe spettrali in presenza di un campo magnetico, dimostrata dall'ex allievo di Lorentz Pieter Zeeman (1865-1943), forniva inaspettatamente un rapporto tra carica e massa per lo ione di Lorentz di circa 107, e oltre a ciò implicava che gli spettri fossero dovuti ai soli ioni negativi, mentre non appariva alcuna traccia della controparte positiva.
Un'altra difficoltà della teoria di Lorentz, e cioè la sua impossibilità di spiegare la separazione 'anomala' in più di tre componenti, fu accantonata con il consenso generale per la semplificazione e l'unificazione che il corpuscolo-elettrone aveva portato nella fisica. Questo infatti, nello stesso tempo, spiegava la relazione tra un atomo e il suo ione, rendeva disponibile sia un irraggiatore spettrale sia un agente della dispersione, confermava l'asimmetria della carica (i corpuscoli erano negativi indipendentemente dalla sorgente) e assumeva facilmente il ruolo centrale nell'ipotesi di Prout. Nel 1900 molti fisici erano ormai inclini ad accettare, o avevano già accettato, l'identificazione dei corpuscoli con le particelle dei raggi catodici e con gli ioni di Lorentz-Zeeman e, di conseguenza, le idee di Thomson sulla struttura atomica e sulle relazioni tra gli atomi e gli ioni.
Fare un passo ulteriore all'interno dell'atomo richiedeva una mente audace. Prima che fosse superata l'interpretazione di Lorentz, i fisici britannici affrontarono i due problemi principali. Nel suo acuto libro Aether and matter (1900), Larmor osservò che nulla, nelle caratteristiche del corpuscolo-elettrone, o nell'elettrodinamica, o nella meccanica, era in grado di fissare le dimensioni degli atomi. Come avrebbero potuto i teorici determinare quella particolare configurazione in grado di produrre lo spettro osservato, la cui nitidezza e coerenza dimostrava che le vibrazioni dalle quali traeva origine erano sottoposte a vincoli assolutamente rigidi? Inoltre, argomentava lord Rayleigh (John W. Strutt, 1842-1919) sempre nel 1900, anche in presenza di vincoli meccanici rigidi, atomi costruiti seguendo i principî della fisica dell'epoca avrebbero potuto non spiegare gli spettri osservati; le formule per le serie spettrali principali degli elementi non avevano la forma prevista per le frequenze di un sistema meccanico.
La domanda più immediata, tuttavia, riguardava la natura della carica positiva dell'atomo. Nel 1899 Thomson propose alla British Association for the Advancement of Science una soluzione oscura, ma ingegnosa: "quando [i corpuscoli] si uniscono a formare un atomo neutro, il loro effetto negativo è compensato da qualcosa per cui la sfera in cui i corpuscoli sono dispersi agisce come se possedesse una carica di elettricità positiva priva di massa, di misura uguale alla somma delle cariche negative sui corpuscoli". Thomson non attribuiva massa alla componente positiva e quindi, come Larmor, aveva bisogno di migliaia di elettroni per raggiungere il peso atomico.
Come osservò Larmor, tali grandi numeri avevano il merito di alleviare una grave difficoltà che si incontrava nell'attribuire le righe spettrali alle oscillazioni di particelle cariche: poiché nessun sistema di particelle cariche interagenti attraverso la legge di Coulomb può essere stabile se le particelle sono a riposo l'una rispetto all'altra, gli elettroni o corpuscoli atomici dovevano orbitare, dunque subire un'accelerazione e irraggiare; la conseguente perdita di energia li avrebbe alla fine costretti a cadere verso il centro della forza centripeta agente su di essi.
Larmor osservò che se la somma di tutte le accelerazioni degli elettroni fosse stata nulla e se i raggi delle loro orbite fossero stati piccoli rispetto alla lunghezza d'onda delle radiazioni da essi emesse, l'irraggiamento totale sarebbe stato di gran lunga minore di quello dovuto a un elettrone singolo sulla stessa orbita. Thomson dimostrò in seguito che se si fossero avuti molti corpuscoli in moto circolare, equispaziati su anelli concentrici, la perdita avrebbe potuto risultare trascurabile. Nel modello di Larmor, i moti responsabili delle righe spettrali erano le oscillazioni degli elettroni intorno alle loro orbite di equilibrio. Poiché ogni elettrone possiede tre gradi di libertà, n elettroni possono produrre 3n linee spettrali; questo costituiva un altro vantaggio del fatto di avere un atomo molto affollato, poiché le linee spettrali note degli elementi più pesanti erano migliaia.
Strutture ipotetiche
I fisici furono tanto ingegnosi e audaci da escogitare tre diverse rappresentazioni dell'interno degli atomi durante i primi anni del XX secolo. James Jeans (1877-1946), portando avanti la linea di Larmor, popolò l'atomo di cariche positive e negative in ugual numero, tra loro interagenti attraverso forze diverse da quella di Coulomb; Jean-Baptiste Perrin (1870-1942), traendo ispirazione dal Sistema solare, ipotizzò che gli elettroni fossero in moto lungo anelli intorno a un 'Sole' positivo centrale (o, per meglio dire, un 'Saturno' centrale); lord Kelvin (William Thomson, 1824-1907), materializzando l'idea di Joseph J. Thomson di uno spazio agente come elemento neutralizzante, collocò gli elettroni all'interno di una sfera diffusa di elettricità positiva.
Poiché non si manifestava alcuna prova dell'esistenza di un elettrone positivo, l'approccio di Larmor e Jeans non fu portato avanti, a differenza di quanto si verificò per l'atomo saturniano.
Nel 1904 Hantaro Nagaoka (1865-1950), professore di fisica presso l'Università di Tokio, pubblicò il calcolo delle frequenze di oscillazione degli elettroni negli anelli saturniani intorno alle loro orbite di equilibrio; ne concluse che quelle vibrazioni potevano dar luogo alle righe spettrali e avanzò l'ipotesi che la radioattività si manifestasse quando le oscillazioni diventavano tanto grandi da fare a pezzi l'atomo. G.A. Schott, un ex allievo di Thomson diventato professore presso l'Università del Galles, controbatté che tutti i modi di oscillazione nei piani del moto sarebbero stati instabili, a meno che la carica di 'Saturno' fosse stata di gran lunga maggiore della somma delle cariche degli elettroni negli anelli: conseguentemente, o il sistema andava in pezzi, o la materia risultava eccessivamente positiva. In entrambi i casi ne sarebbe risultato un modello di atomo molto insoddisfacente.
Il solo modello che subì un'evoluzione progressiva prima del 1910 fu quello di lord Kelvin, che Thomson adottò nel 1904. Analogamente, e contemporaneamente, a quanto fece Nagaoka, Thomson calcolò la frequenza delle oscillazioni perturbative degli elettroni in un atomo con un solo anello, in funzione del loro numero p. Egli sperava di ricavare informazioni sulla struttura atomica dal valore di p per cui si innescava l'instabilità meccanica; tale numero risultò essere sei.
Thomson scoprì che si potevano aggiungere più elettroni a un singolo anello se si collocavano uno o più elettroni al suo interno. Per il caso particolare p=20 si poteva assicurare la stabilità a patto che il numero di elettroni interni q fosse compreso tra 39 e 47. Queste nove configurazioni offrivano un'analogia con gli elementi del secondo e del terzo periodo della tavola di Mendeleev (che però erano solo otto). Per un valore di q vicino a 39 l'atomo poteva tendere a liberarsi di un elettrone esterno, e comportarsi così elettropositivamente; se invece q era vicino al massimo, l'atomo poteva tendere ad acquisire un elettrone, e a comportarsi elettronegativamente.
L'analogia di Thomson introdusse l'idea fondamentale secondo cui gli atomi di elementi successivi nella tavola periodica differivano l'uno dall'altro per l'aggiunta di un singolo elettrone. Tuttavia, nel modo in cui era presentata, tale idea non poteva apparire sensata agli occhi di un chimico. Come osservò Augusto Righi (1850-1920), essa implicava che gli elementi cambiassero specie senza un cambiamento di massa rilevabile, e non forniva alcun supporto alla distinzione qualitativa tra ionizzazione e trasmutazione, entrambe le quali possono derivare, nel modello, dall'acquisto o dalla perdita di un elettrone superficiale. L'analogia di Thomson, inoltre, funziona invertendo la moderna attribuzione di ruoli agli elettroni interni e di valenza: gli atomi di ciascun periodo hanno lo stesso numero di elettroni esterni, e differiscono soltanto per la popolazione degli anelli interni; le proprietà chimiche e ottiche, perciò, derivano principalmente dagli elettroni più interni. Analogamente, tutti gli elettroni in un atomo, e non soltanto i più interni, subiscono la lenta perdita per irraggiamento che, secondo il modello, conduce infine alla radioattività.
Ciononostante, il modello permise a Thomson di contare gli elettroni atomici calcolando il loro contributo alla diffusione di differenti tipi di radiazione. La sua ipotesi consisteva nel fatto che gli elettroni più esterni avrebbero diffuso la luce sulle frequenze ottiche; vecchie misure sulla dispersione nell'idrogeno fornivano, confrontate con le sue formule, la stima n∼A. I raggi X e β avrebbero messo in moto gli elettroni profondi; sulla base degli esperimenti che erano stati svolti dal suo ex allievo Charles G. Barkla (1877-1944) e da Ernest Rutherford (1871-1937), Thomson determinò il numero di centri di diffusione dei raggi X in circa 0,2A. Nel 1906 egli aveva ormai acquisito il risultato fondamentale per cui il numero di elettroni in un atomo è dello stesso ordine del suo peso atomico.
Nel 1907 Thomson fornì un compendio delle sue ricerche in un libro, The corpuscular theory of matter, che suscitò grande interesse anche nel resto dell'Europa. Ne fu pubblicata una versione in tedesco; Lorentz considerò positivamente il modello planetario; fu studiato nei seminari di fisica di Arnold Sommerfeld (1868-1951) a Monaco; Max Born (1882-1970) esaltò la spiegazione della tavola periodica nella sua conferenza di abilitazione a Gottinga, nel 1909. Il direttore del "Journal de chimie physique" richiese un'esposizione delle idee di Thomson sulle combinazioni chimiche, adattate alle competenze dei suoi lettori.
La diminuzione inaspettata di n confermò l'asimmetria tra l'elettricità positiva e negativa, e recuperò la carica positiva dalla sua condizione fantasmatica: essa doveva portare la maggior parte del peso atomico. Per capire di cosa si potesse trattare, Thomson intraprese lo studio dei raggi canale, i cui risultati sono esposti in un capitolo della sua opera, intitolato Ray physics. Per meglio comprendere la struttura atomica, escogitò una nuova teoria della diffusione dei raggi β, basata sull'ipotesi che la deviazione osservata per un fascio collimato derivasse dalla composizione di molte piccole deflessioni subite da singole particelle β. Gli esperimenti effettuati presso il Cavendish Laboratory erano in accordo con la teoria se si adottava un valore n∼3A.
Rutherford aveva motivi per dubitare sia degli esperimenti sia della teoria legati al valore n∼3A: né i vecchi esperimenti effettuati sui raggi β, né i dati ricavati nel 1910 sui raggi α, entrambi presso il suo istituto alla University of Manchester, erano compatibili con il modello o l'analisi di Thomson. L'elemento più sorprendente, che fu messo in luce da Hans Geiger (1882-1945) ed Ernest Marsden (1889-1970) nel 1909, consisteva nel fatto che una particella α ca. ogni 8000 lanciate contro una sottile lamina d'oro riappariva dallo stesso lato di incidenza.
Allo scopo di analizzare questo risultato alla maniera di Thomson, Rutherford dovette ipotizzare che una particella α, alla quale Thomson assegnava una decina di elettroni, si comportasse come una carica puntiforme. Tale circostanza equivaleva tuttavia a supporre che l'atomo di elio privato dei suoi due elettroni occupasse uno spazio molto più piccolo di quello occupato da un atomo. L'atomo dotato di un nucleo non fu tanto il risultato dell'analisi da parte di Rutherford della diffusione delle particelle alfa, quanto il suo principale ingrediente.
La teoria di Rutherford differiva da quella di Thomson non soltanto per l'introduzione del nucleo come principale centro di diffusione, ma anche per il fatto di attribuire la deflessione subita nell'attraversare una lamina metallica sottile a un solo incontro con un singolo nucleo: anche una particella, il cui percorso risulti deviato di un angolo notevole, quasi certamente subirà tutta la deflessione in un solo urto. Come Rutherford dimostrò mediante un'analisi probabilistica sul modello della più recente teoria della diffusione di Thomson, urti multipli contro sfere diffuse non avrebbero portato a deflessioni delle particelle alfa compatibili con i numeri osservati; né lo avrebbero potuto elettroni agenti individualmente, anche se vincolati in posizioni fisse all'interno delle sfere, a meno che un atomo d'oro ne possedesse 40.000. Si trattava naturalmente di una quantità di gran lunga troppo grande, visto il lavoro di Thomson del 1907. Rutherford dimostrò che si poteva ottenere un valore accettabile di nAu se la carica associata al centro di diffusione fosse stata ne, invece di e, nel caso in cui l'urto singolo fosse avvenuto con un nucleo, e non con un elettrone.
Rutherford raccolse i suoi argomenti a favore del modello nucleare, e la relazione A/2⟨n⟨A, in un brillante articolo pubblicato nel 1911 che, tuttavia, non sollevò grande interesse. Egli non si esprimeva su come il suo modello potesse evitare la fatale instabilità che portava alla distruzione quello di Nagaoka, né lo confrontò con ciò che preoccupava i 'costruttori di atomi': le proprietà periodiche degli elementi, le regolarità spettrali, la radioattività. Né d'altra parte, nel suo articolo del 1911, esplicitò chiaramente la conseguenza più ovvia e importante dei suoi risultati: poiché l'elio possiede due elettroni, e n⟨A, l'idrogeno ne ha soltanto uno e, in generale, la carica di un nucleo è uguale al numero d'ordine del corrispondente elemento nella tavola periodica.
La radioattività e gli elementi
Nel 1895, alla vigilia della scoperta della radioattività da parte di Henri Becquerel (1852-1908), i chimici erano a conoscenza di oltre sessanta elementi, a parte le terre rare, e di queste un numero tra sei e nove. Per collocare gli elementi nella tavola, ordinati per peso in orizzontale e secondo le proprietà chimiche in verticale, si lasciavano di solito posti vuoti tra il molibdeno e il rodio e tra il tungsteno e l'osmio, cinque spazi tra il torio e l'uranio, e un numero incerto tra le terre rare. Degli elementi di cui oggi conosciamo l'esistenza tra l'idrogeno e l'uranio, 67 erano riconosciuti da tutti, altri tre nelle terre rare da molti, e otto soltanto dagli specialisti della tavola periodica.
Tra il 1895 e il 1900 furono scoperte altre due specie di sostanze, le une che reclamavano alcuni degli spazi lasciati vuoti, mentre le altre ne creavano di nuovi. Queste ultime, i gas rari, fecero la loro prima comparsa nel 1894 con l'argo. William Ramsay (1852-1916) e lord Rayleigh determinarono la sua densità, che risultò venti volte quella dell'idrogeno gassoso; il suo peso atomico era di poco inferiore a 40. L'argo si posizionava quindi subito dopo il potassio (A=39,1), distruggendo la periodicità della tavola periodica.
Nel 1895 Ramsay scoprì elio di origine terrestre, mentre l'elemento era noto in precedenza solamente come sorgente delle righe nello spettro solare, e calcolò il suo peso, che risultò 4 ca., assicurandogli un posto tra l'idrogeno e il litio (A=7). Nel 1898, dopo essersi dotato dei mezzi per liquefare i gas atmosferici, scoprì il neon (A=20), e altri due membri più pesanti e più rari della famiglia, il cripto (84) e lo xeno (131). Tutti questi elementi, eccetto l'argo, si collocavano perfettamente tra gli alogenuri e i metalli alcalini.
Ben presto, altre discrepanze analoghe a quella calcio/argo, che coinvolgevano iodio/tellurio e cobalto/nichel, furono accettate come vere e proprie anomalie e non come errori di misura. Tali anomalie, con l'incertezza sul numero di posti vuoti, e le controversie sui principî fondamentali sottesi alla classificazione avevano, nel 1905, ormai quasi distrutto l'utilità della tavola periodica come elemento guida per le nuove scoperte.
L'altra specie di elementi nuovi era costituita da quelli radioattivi. Nel 1906 si conoscevano più di 20 prodotti di disintegrazione, nel 1910 più di 30, e oltre 40 nel 1914. Un esempio notevole di questa progressione è fornito dalla scoperta, tra il 1905 e il 1908 a opera di Otto Hahn (1879-1968), di tre prodotti radioattivi tra il torio e il torio X, sul presunto legame genetico diretto del quale Rutherford e Frederick Soddy (1877-1956) avevano basato il loro concetto rivoluzionario di disintegrazione. Hahn scoprì il primo di questi intrusi indesiderati, il radiotorio (RaTh), nel 1905, mentre lavorava nel laboratorio di Ramsey a Londra, e due 'mesotori', tra Th e RaThX mentre lavorava con Rutherford a Montreal. Il capostipite della serie del torio, identificato come tale nel 1908, rimaneva invariato nel 1911:
L'erronea classificazione del MesoTh1 come non emettitore (emette in realtà una debole radiazione β) offuscò le regolarità che si sarebbero presto espresse nella legge dello spostamento radioattivo.
Parallelamente all'arricchimento del torio procedette la scoperta del legame tra l'uranio e il radio. Il progenitore diretto del radio, obiettivo di numerose ricerche, fu individuato nel 1907, quando Bertram B. Boltwood (1870-1927), grande amico di Rutherford e professore di chimica alla Yale University, scoprì lo ionio, fino ad allora non trovato perché chimicamente molto simile al torio. Il capostipite della serie dell'uranio, stabilita come tale nel 1907, rimaneva invariato nel 1911:
Un indizio della massima importanza per la collocazione dei radioelementi nella tavola periodica fu la dimostrazione fornita da Rutherford che le particelle α trasportano due cariche (fatto che risultò per molti sorprendente) e che, ripristinati gli elettroni mancanti, formavano un atomo di elio (fatto che invece non stupì nessuno). Avendo fissato Aα a 4, i radiochimici potevano calcolare i pesi atomici dei prodotti di decadimento, a patto che, come dimostrato sempre più chiaramente dagli esperimenti, in ogni transizione radioattiva venisse emessa soltanto una particella β o una particella α. Per il calcolo erano anche necessari schemi affidabili di decadimento e la conoscenza dei pesi atomici di almeno alcuni degli elementi della serie. Tali informazioni nel 1911 erano disponibili soltanto per la serie dell'uranio: si conoscevano i pesi atomici di uranio e radio (di quest'ultimo Marie Curie aveva estratto quantità sufficienti a determinarne il valore 226 nel 1907). Non era possibile determinare i pesi atomici nella catena del torio; ciononostante, a prescindere da quante particelle alfa fossero coinvolte nel passaggio da Th a ThEm, le emissioni del torio e del radio non potevano avere lo stesso peso atomico. Per quanto riguarda la terza catena, quella che ha inizio con l'attinio, non era stato possibile isolarne alcun elemento in quantità anche lontanamente sufficiente a determinarne il peso atomico.
Per integrare ulteriormente i prodotti dei decadimenti radioattivi nella tavola periodica, i chimici determinarono il carattere dei loro radioelementi fantasma attraverso gli elementi chimici con cui si accompagnavano. Willy Marckwald, di Berlino, riuscì così a dimostrare che il polonio doveva collocarsi nel posto vuoto accanto al bismuto, e sopra il tellurio. Analogamente, i prodotti del radio dovevano posizionarsi al di sopra dello xeno.
I chimici si resero gradualmente conto che i radioelementi simili allo stesso reagente potevano essere chimicamente indistinguibili l'uno dall'altro. Nel 1907 Soddy elencò le coppie MesoTh/ThX, Th/RaTh e Th/ionio come chimicamente inseparabili con qualsiasi metodo noto. Bruno Keetman, di Vienna, tentò ripetutamente di separare la considerevole quantità di ionio che aveva preparato dalla notevole disponibilità di torio, ma inutilmente. Nel 1909, Theodor Svedberg e il suo collega Daniel Strömholm a Uppsala compilarono una tavola periodica in cui i prodotti del torio, del radio e dell'attinio occupavano la stessa posizione sopra lo xeno, mentre Ra/AcX/ThX si posizionavano insieme al di sopra del bario. Inoltre, gli eroici sforzi di diversi chimici per separare MesoTh1/Ra/ThX, e per separare dal piombo il radio D, un componente del residuo attivo del radio, dal piombo, fallirono. Nel 1911 Soddy riconobbe l'origine naturale del fallimento: gli elementi inseparabili erano chimicamente identici.
Soddy sottolineò che tra gli elementi inseparabili ve n'erano alcuni che differivano apprezzabilmente nei loro pesi atomici. Effettuando un calcolo a partire dai prodotti α conosciuti nelle catene di decadimento, scoprì una differenza di due unità tra i pesi atomici di membri successivi delle triadi ThX/Ra/Th e RaTh/ionio/Th. Nel 1911 affermò che l'emissione di una particella α spingeva l'emettitore di due posti a sinistra nella tavola, e dimostrò anche l'utilità di questa regola, reinterpretando la disintegrazione dell'uranio. Questo elemento sembrava infatti cedere due particelle alfa; Soddy osservò che la regola basata sull'emissione di una sola particella si poteva preservare, a patto che l''uranio' fosse composto da due componenti inseparabili, UI e UII, e che il decadimento avvenisse secondo lo schema
[3] UI(α)→UX(β)→UXII(α)→ionio (α)→radio (α)
portando così il capostipite della serie dell'uranio in pieno accordo con quello del torio.
Durante il 1913 i radiochimici chiarirono molti dettagli resi importanti dalla legge dello spostamento di Soddy, e trovarono l'analogo di questa per l'emissione β: l'emissione alfa determina lo spostamento di due posti a sinistra, mentre l'emissione β comporta lo spostamento di un posto a destra. In base a queste regole, e tenendo conto degli 'elementi chimicamente inseparabili' per i quali Soddy aveva coniato il termine 'isotopi', i quaranta radioelementi conosciuti nel 1913 occupavano dieci posti, dal tallio all'uranio inclusi. Per metà i posti erano occupati da elementi che erano già noti nel 1895: Tl, Pb, Bi, Th, U; l'altra metà, che corrispondeva a cinque dei sette posti tra Bi e U che venivano di solito lasciati vuoti nelle tavole compilate dopo il 1900, era riempita, anche troppo, da elementi identificati solamente sulla base della loro radioattività.
L'inserimento dei radioelementi nella tavola periodica a opera di Soddy fu il risultato della sintesi tra le sue teorie, gli esperimenti del suo assistente Alexander Fleck e diverse leggi degli spostamenti che erano state proposte nel 1912 e nel 1913 da ex collaboratori nel laboratorio di Rutherford a Manchester, in particolare George de Hevesy (1885-1966) e Kasimir Fajans (1887-1975). Il sistema di Fajans implicava l'esistenza di un secondo emettitore β (UX2) nell'uranio, come pure di un'emissione β da entrambi i mesotori. Fajans stesso scoprì l'UX2 a vita breve (brevio). Soddy osservò che il brevio aveva la particolare caratteristica di essere l'unico elemento identificato da un solo isotopo, e previde correttamente che gli si sarebbe presto unito il progenitore dell'attinio. Nel 1918 Hahn e Lise Meitner (1878-1968) annunciarono la separazione del protoattinio dalla pechblenda, rivelando così l'ultimo dei suoi elementi, e riempiendo il vuoto tra il torio e l'uranio.
I grandi progressi rappresentati dai concetti di disintegrazione atomica, spostamento radioattivo e isotopia furono ottenuti senza alcuna dipendenza da modelli atomici dettagliati. L'utilità del modello di Rutherford nel rappresentare contemporaneamente l'identità chimica e la diversità radioattiva rese l'isotopia e il modello nucleare inscindibili come il radio e il torio X.
La quantizzazione dell'atomo
La teoria quantistica divenne parte integrante dei modelli atomici intorno al 1910. Fino a quel momento la teoria era stata espressa, come del resto era stata creata, descrivendo la materia come un insieme di oscillatori armonici, analogamente alla teoria di Einstein dei calori specifici dei solidi (1907). L'impulso dato da questo lavoro agli esperimenti sui calori specifici a basse temperature condusse al celebre Congresso Solvay del 1911. Tra gli argomenti affrontati in quella sede figurava la relazione tra la teoria quantistica e la struttura atomica.
Il modello di Thomson sembrava fatto appositamente per questo tipo di sviluppi, poiché per il caso di un solo elettrone esso si comportava come un oscillatore armonico, con l'elettrone vibrante lungo un diametro invece che orbitante intorno al centro. Questa linea di pensiero era stata inaugurata prima del Congresso Solvay da Arthur Erich Haas (1884-1941), all'epoca studente presso l'Università di Vienna. I resoconti del Congresso spinsero John W. Nicholson (1881-1955), fisico-matematico formatosi a Cambridge, a inserire elementi quantistici in una versione di atomo nucleare che aveva formulato per spiegare alcuni spettri stellari. A loro volta, i risultati di Nicholson spinsero Bohr a riflettere sul modo in cui la sua versione quantizzata dell'atomo di Rutherford potesse irraggiare.
I primi atomi quantizzati
Nel 1910 Haas osservò che la frequenza di oscillazione f di un elettrone in una sfera di Thomson è indipendente dall'ampiezza:
in cui a è il raggio della sfera. Coerentemente con lo spirito della teoria quantistica egli pose f=W/h, dove W è un'energia, per la quale ipotizzò la relazione hf=e2/a. Ne risultava un'espressione elettromagnetica per h,
o, supponendo f nota ed eliminando a, una formula per e,
Costruendo il suo modello come un atomo di idrogeno, ottenne e=3,2×10−10 u.e.s., in accordo con il valore sbagliato per il quale si propendeva ancora al Cavendish. Al Congresso Solvay Lorentz difese il lavoro di Haas contro Max Planck (1858-1947), che non colse l'importanza dell'analogia con i suoi risonatori.
Neppure Nicholson la colse, ma egli comunque dai resoconti del Congresso Solvay trasse l'ispirazione per incorporare idee quantistiche nel modello saturniano ad anello singolo, di straordinario successo. Egli aveva assegnato un anello con tre elettroni all'idrogeno, e altri con due, quattro e cinque elettroni a 'protoelementi' responsabili di righe non classificate negli spettri del Sole e di alcune nebulose. Le frequenze di oscillazione degli elettroni perpendicolarmente ai piani dei rispettivi anelli risultavano stabili per quanto riguardava le popolazioni studiate da Nicholson. Nove tra le undici righe non classificate negli spettri delle nebulose si accordavano con le oscillazioni perpendicolari del 'nebulio' (n=4), e le righe coronali di maggiore intensità si accordavano con quelle del protofluoro (n=5). Diversi anni più tardi, gli astrofisici dimostrarono che tutte le righe di Nicholson appartenevano a molteplici forme ionizzate del ferro e di altri elementi terrestri comuni.
Oltre al numero di elettroni negli anelli, Nicholson aveva come parametro libero la frequenza della rotazione imperturbata nell'anello. Seguendo l'esempio di Haas, egli calcolò i valori del rapporto E/f, dove E è l'energia totale dell'atomo cambiata di segno, e quelli del momento angolare totale, che risultarono essere rispettivamente multipli interi di h e di h/2π. L'atomo quantizzato di Nicholson dava quindi luogo a diverse righe, secondo le quantità discrete di cui il suo momento angolare interno era diminuito rispetto a un valore di riferimento. Così come Nicholson comunicò alla British Association nel 1913, tale valore di riferimento, prescritto dalla teoria quantistica, avrebbe determinato la dimensione degli atomi.
L'atomo di Bohr
Bohr diede l'avvio al processo di quantizzazione dell'atomo nucleare nel giugno 1912. Nel 1911 egli si era recato in Inghilterra per lavorare con Thomson, senza però riuscire a instaurare con lui il rapporto stretto che aveva sperato, quindi si trasferì presso il laboratorio di Rutherford a Manchester, dove provò a perfezionare la teoria sul passaggio dei raggi α attraverso la materia.
Bohr scoprì presto autonomamente che le oscillazioni degli elettroni saturniani nel piano del moto non sono stabili; come si sarebbe dunque potuta calcolare la risposta di un atomo all'attraversamento da parte di una particella alfa? La soluzione da lui proposta consisteva nell'assegnare uno status speciale a particolari orbite, secondo ciò che egli riteneva fosse lo spirito della teoria quantistica. Gli elettroni in rotazione su un'orbita con energia cinetica T e frequenza f non avrebbero irraggiato, né avrebbero reagito a piccole perturbazioni, purché T/f=K, con K costante. Il fatto che apparisse T invece dell'energia totale W(=−T) permetteva di evitare che comparissero numeri negativi, mentre d'altra parte la costante K compariva al posto della costante di Planck h per tener conto del fatto che l'atomo nucleare non è semplicemente un oscillatore armonico.
Il principale argomento di ricerca di Bohr, dal giugno 1912 al febbraio 1913, fu l'applicazione di questa condizione di stabilità alla soluzione dei problemi emersi nella teoria di Thomson sulla struttura atomica. Anche se non riuscì a trovare una spiegazione della periodicità, mise a buon frutto un risultato errato dei suoi calcoli, e cioè il fatto che un elettrone aggiunto a un atomo con uno o più anelli saturati si posizionasse al di fuori, e non all'interno, della struttura esistente. Sulla base di questa affermazione, e usando l'approssimazione di Rutherford, n∼A/2, Bohr poté spingersi molto oltre Thomson, ed enunciare in modo preciso il numero di elettroni in tutti gli atomi normali. Poiché il modello nucleare richiede nHe=2, ne risulta che nH=1, nLi=3 e così via, in modo tale che ogni atomo, neutro, contenga un numero di elettroni orbitanti pari al numero Z dell'elemento corrispondente nella tavola periodica, partendo dall'idrogeno al quale si associa Z=1.
Verso la fine del 1912 Bohr era già venuto a conoscenza del modello di Nicholson che, come il suo, era quantizzato e nucleare. L'atomo di Nicholson però irraggiava, al contrario di quello di Bohr, mentre il nebulio e il protofluoro avevano le stesse popolazioni elettroniche previste dalla teoria dei numeri atomici per il berillio e il boro. Fu probabilmente nel cercare di capire la relazione tra il suo modello e quello di Nicholson che Bohr introdusse l'idea che gli stati eccitati soddisfacessero la relazione (T/ν)n=Kn, in cui l'indice n indica lo stato; questo lo avrebbe messo in condizione di rispondere al suo collega danese Hans Marius Hansen (1886-1956), esperto di spettroscopia, che lo aveva sfidato a dare una spiegazione della formula di Balmer
dove ν è la frequenza delle righe spettrali, R la costante di Rydberg e n un numero intero. In questa formula la frequenza appare come una differenza, che può essere legata a una differenza di energia moltiplicata per h. L'espressione Rh/n2 avrebbe dunque rappresentato un'energia, forse l'energia di uno degli stati irraggianti di Nicholson. Bohr aveva già trovato che se
Uguagliando Tn a Rh/n2 per l'idrogeno (Z=1), e scrivendo K=αn per eliminare le n (con α costante da determinare), Bohr avrebbe trovato (T/f)n=nh/2, da cui avrebbe potuto calcolare Tn, invertire il ragionamento e ottenere R come prodotto di costanti atomiche. Nel suo famoso articolo in tre parti sulla struttura atomica, On the constitution of atoms and molecules, pubblicato nel 1913, egli fornì due giustificazioni per la strana equazione (T/f)n=nh/2.
La prima giustificazione, in analogia con la procedura seguita da Planck, si basava sulla assunzione Tn=nhνn, in cui il significato fisico di νn non è ovvio. Bohr voleva identificare νn con fn/2, e argomentò che si trattava della frequenza media della luce emessa da un elettrone esterno catturato a partire da uno stato di riposo (f=0) nell'orbita n-esima, con frequenza meccanica fn.
Tale dimostrazione ad hoc sottolineava la difficoltà di trasferire la formula di Planck per il semplice oscillatore armonico, per il quale la frequenza irraggiata e quella meccanica coincidono, all'atomo nucleare, in cui ciò non è vero. Da questo risultarono sia la grande invenzione ‒ o scoperta ‒ che le frequenze irraggiate sono in relazione solamente formale con quelle meccaniche, sia l'imposizione della condizione quantica sulla radiazione che si pensava venisse prodotta durante la cattura di un elettrone, piuttosto che sulle quantità meccaniche che definivano l'orbita.
La seconda formulazione di Bohr, che è quella oggi generalmente ricordata, parte dal punto di vista per cui le equazioni Tn=hνn e νn=fn/2 vanno lette come Tn=nhfn/2, cioè come una condizione imposta sulle quantità che definiscono le orbite degli elettroni nei particolari stati 'stazionari' n. Poiché T/f non è altro che πp, dove p è il momento angolare, si può dare una diversa espressione, pn=nh/2π, in cui si è persa ogni traccia della formulazione di Planck, e quindi del percorso seguito da Bohr. Dunque per l'usuale atomo di idrogeno di Bohr, in cui si ha radiazione quando l'elettrone si sposta da uno stato stazionario all'altro, non è necessario alcun processo di ionizzazione; quando si ha una transizione tra lo stato n e lo stato 2, è prodotta una riga di Balmer,
Il valore di Tn in termini delle costanti fondamentali si può ottenere da Tn=e2/2an, dall'equilibrio delle forze e2/a2n=4π2f2nan, e da pn=2πfna2n=nh/2π:
Identificando Rh/n2 con Tn, risulta
Alla fine del 1913, in una lezione tenuta alla Società danese di fisica, Bohr presentò una terza dimostrazione, che utilizzava in senso positivo l'assenza di una relazione tra ν e f. Nella transizione tra lo stato (n+1)-esimo e lo stato n-esimo, un elettrone dovrebbe emettere una riga di frequenza
quando n≫1, e cioè quando l'elettrone atomico è così debolmente legato da potersi descrivere come un elettrone ordinario. Bohr formulò quindi il 'principio di corrispondenza', secondo il quale in questo limite la frequenza ν, calcolata a partire dai salti quantici tra orbite contigue, dovrebbe essere numericamente uguale alla frequenza meccanica f di ciascuna orbita. Siccome
ne risulta come prima la [10].
Gli spettroscopisti recepirono le argomentazioni di Bohr come una sfida, e al tempo stesso videro in esse una verifica sperimentale cruciale per le sue teorie. Essi avevano attribuito all'idrogeno diverse righe spettrali che rientravano nello schema della formula
del tipo di quella di Balmer. Nello schema di Bohr non c'era posto per orbite semintere. Egli riscrisse audacemente la formula come
attribuendo la riga all'elio ionizzato: se il nucleo possiede una carica Ze, il termine e4 nella formula per R si deve sostituire con Z2e4. Alfred Fowler, uno spettroscopista inglese ingaggiato da Rutherford, confermò che la riga problematica appariva in tubi contenenti elio e privi di idrogeno, e osservò anche che l'accordo tra la formula della serie spettroscopica e le righe che Bohr attribuiva all'elio non era mai confrontabile con quello tra la formula di Balmer e le righe dell'idrogeno.
Bohr rispose nell'ottobre del 1913 con un colpo da maestro che gli guadagnò grande considerazione tra i teorici. Sostenne che, nello stimare l'energia dell'elettrone nello stato stazionario, aveva trascurato il contributo secondario del moto del nucleo pesante. Correggendo questa omissione come si fa in meccanica elementare, e cioè sostituendo m con m′=m/(1+m/mZ), dove mZ è la massa del nucleo, Bohr ricavò la vera costante dell'idrogeno, RH=(m′H/m)R. La teoria prevedeva RHe+/RH=4,00163; Fowler fece la misurazione, ottenendo RHe+/RH=4.0016. L'impressione che tale straordinaria conferma suscitò si può apprezzare dalla descrizione fatta da Hevesy della reazione di Einstein alla notizia: "Quando la sentì ne fu estremamente stupito e mi disse: 'la frequenza della luce non dipende affatto dalla frequenza dell'elettrone [...] E questo è un risultato eccezionale. La teoria di Bohr deve essere giusta'".
Nel secondo e nel terzo articolo sulla struttura atomica, Bohr utilizzò i modi stabili perpendicolari per determinare le popolazioni degli anelli degli atomi pesanti, in base all'ipotesi che tutti gli elettroni, nel loro stato fondamentale, possedessero un quanto di momento angolare. Nell'assegnare le configurazioni a ogni elemento, però, si lasciò guidare dall'intuizione piuttosto che dal calcolo, e la sua deduzione va considerata più come un argomento di plausibilità nello stile di Thomson, che come una vera e propria dimostrazione.
Conferme
Per quanto problematiche fossero le popolazioni sugli anelli, la struttura saturniana dotava l'atomo di componenti ben identificate, in grado di fornire una convincente geometria dei fenomeni atomici. La struttura elettronica esterna determinava la chimica e la radiazione visibile, il nucleo custodiva la radioattività, mentre nel mezzo, nella struttura elettronica interna, trovavano la loro collocazione i raggi X.
Mentre Bohr lavorava al suo capolavoro, lo studente prediletto di Rutherford, Henry G.J. Moseley (1887-1915) si affrettava a ricavare le frequenze delle righe K e L utilizzando la nuova tecnica dell'interferenza dei raggi X. Nel novembre 1913 fu in grado di affermare che la riga K più intensa, la Kα, in undici metalli, dal calcio allo zinco, verificava la relazione νKα=(3/4)(Z-1)2R. Questi undici elementi includevano la coppia Co/Ni, le cui righe andavano secondo Z, e non A. Nei processi atomici profondi, da cui nascevano i raggi K, non vi era traccia delle proprietà chimiche o periodiche degli elementi. Moseley assunse come dimostrata la teoria dei numeri atomici; capovolse il suo approccio e usò la sua formula così sorprendentemente efficace, insieme a quella simile per Lα, νLa=(5/36)(Z-7,4)2R, per cercare gli elementi mancanti. La sua ricerca confermò la correttezza degli spazi solitamente vuoti per gli omologhi del manganese (Z=43, 75) e rimise in ordine le terre rare.
Moseley congetturò che la sua formula per Kα, che si poteva scrivere, alla Balmer,
confermasse la condizione di Bohr sul momento angolare nello stato fondamentale. Né lui né lo stesso Bohr, però, riuscirono a derivarla dai principî che Bohr aveva enunciato. Nell'ottobre 1914 Walther Kossel (1888-1956) esaminò le formule di Moseley da un punto di vista naturale per un fisico che si trovava nell'ambiente di Monaco, ricco di studi sui raggi X. Kossel ipotizzò che la riga Kα derivasse dalla transizione di un elettrone dal secondo anello al primo. Nel suo modello, la conservazione dell'energia imponeva che νK=νKα+νL in cui νK e νL rappresentano le massime frequenze, al limite delle serie K e L; la formula risultò essere in accordo con i risultati sperimentali.
Dopo la Prima guerra mondiale, quando può considerarsi chiuso il periodo della fisica classica, gli spettri caratteristici dei raggi X erano ormai considerati una conferma importante delle idee di Bohr, anche se nessuno riuscì mai a trovare una dimostrazione di come le formule derivassero dai principî teorici. Si presentò però a questo punto una seria difficoltà. Il potenziale di eccitazione minimo (EP) misurato dallo spettro dell'elio nel laboratorio di Wien a Würzburg si collocava 4 eV al di sopra del potenziale di ionizzazione dell'elio (IP) determinato da James Franck (1882-1964) e Gustav Hertz (1887-1975) a Berlino.
Secondo Bohr, l'irraggiamento doveva determinarsi quando un elettrone di valenza reagiva a uno stato legato eccitato, per cui EPmin⟨IP. Bohr riuscì a volgere a proprio vantaggio la minaccia proveniente dall'esperimento di Franck-Hertz con la stessa abilità con cui aveva gestito il caso della disputa con gli spettroscopisti sullo spettro dell'elio. Egli ipotizzò che la corrente attribuita da Franck e Hertz alla ionizzazione derivasse dall'effetto fotoelettrico: la luce emessa nelle transizioni dagli atomi eccitati estraeva elettroni dal rivelatore negativo, simulando così un flusso entrante di ioni positivi. I fisici americani confermarono questa ipotesi negli anni della guerra.
Un ultimo e inatteso elemento di supporto alla teoria di Bohr venne, suo malgrado, da Johannes Stark (1874-1957). Seguendo, come era sua abitudine, idee completamente autonome, questi aveva sottoposto un fascio di ioni idrogeno all'azione di un forte campo elettrico tra un catodo perforato e un elettrodo più negativo collocato immediatamente dietro. Nessuno credeva che ne potesse risultare alcunché di interessante; studi precedenti, infatti, avevano dimostrato che le vibrazioni degli atomi non sarebbero state influenzate in modo apprezzabile da campi elettrici con le intensità allora ottenibili. Nel novembre del 1913, invece, Stark annunciò che la seconda e la terza delle righe di Balmer risultavano separarsi ognuna in cinque componenti.
Poiché la fisica classica non prevedeva l'effetto osservato da Stark, diversi studiosi si affrettarono a studiarlo con i metodi della teoria atomica quantistica. Tra questi vi fu Antonio Garbasso (1871-1933), professore di fisica presso l'Università di Firenze; il suo interesse era stato suscitato dalla disavventura occorsa al suo assistente, Antonio Lo Surdo, che aveva notato un allargamento delle righe spettrali dei raggi canale idrogeno prima che Stark riferisse dello stesso fenomeno, ma aveva omesso di pubblicare le proprie osservazioni. Garbasso, prima, e successivamente Bohr elaborarono diversi modi per spiegare l'effetto Stark sulla base dei nuovi principî di Bohr, ed entrambi giunsero a riprodurre le misure di Stark entro un fattore due.
Molti fisici si preoccupavano del sacrificium intellectus richiesto da Bohr nel sostituire con h una "conoscenza della struttura dell'atomo", come disse Thomson. Lorentz voleva una spiegazione meccanica del modello di Bohr. Wien era convinto che una buona fisica dovesse attenersi alla "validità generale delle leggi della fisica teorica, anche per gli atomi", e condannava la teoria di Bohr per il fatto di "non dire assolutamente nulla sulla meccanica della radiazione". Rutherford identificava l'unica vera debolezza della teoria nella mancanza di una descrizione spaziotemporale della radiazione, e a questo proposito scrisse a Bohr: "Mi sembra che vi sia una seria difficoltà nelle vostre ipotesi, della quale non dubito siate pienamente consapevole, e cioè, come fa un elettrone a decidere a quale frequenza vibrerà nel passaggio da uno stato stazionario a un altro? Mi pare che voi dovreste ipotizzare che l'elettrone sappia in anticipo dove andrà a finire". Stark scelse di esprimere la stessa obiezione in una pubblicazione. Si trattava però essenzialmente di critiche alle quali non si associavano proposte di soluzione.
Forse l'interesse, e le perplessità, degli osservatori competenti furono espresse nel modo migliore da Exum P. Lewis (1863-1926), professore di fisica presso la University of California. In una conferenza tenuta come vicepresidente della American Association for the Advancement of Science, Lewis si espresse così sul lavoro di Bohr e sulle sue prospettive future: "Per quanto possiamo esitare nell'accettare in ogni dettaglio questa teoria, che ci chiede di abbandonare le leggi nelle quali abbiamo finora riposto la nostra fiducia, questa teoria, come pure la teoria quantistica, potrebbe rappresentare il lampo di genio che rivela in modo incompleto i contorni della verità per raggiungere la quale lottiamo, lungo un cammino illuminato di luce fioca".
Bohr è il Tolomeo di questo strano, nuovo mondo: "Un giorno o l'altro potrebbero manifestarsi il Keplero o il Newton dell'atomo".