La grande scienza. Dinamica molecolare
La grande scienza. Dinamica molecolare
Dinamica molecolare
La ricerca sperimentale e teorica nel campo della dinamica molecolare ha per obiettivo la caratterizzazione di processi microscopici, corrispondenti alle proprietà macroscopicamente osservabili che riguardano le trasformazioni delle sostanze; ovvero di chiarire in che modo tali proprietà dipendano dalla distribuzione, nei reagenti e nei prodotti delle reazioni relative, di alcune grandezze fisiche come la velocità, il momento della quantità di moto e l'energia associata ai gradi di libertà interni (rotazionali, vibrazionali, elettronici). Per quanto concerne la reattività, le grandezze osservabili, quali le costanti di velocità e le sezioni d'urto, possono essere misurate con un grado di accuratezza che dipende dal sistema in esame e dall'avanzamento delle tecniche sperimentali. Negli ultimi decenni, il progresso in questo campo ha consentito di elaborare teorie e tecniche computazionali che permettono di correlare i fenomeni osservabili con le forze d'interazione intermolecolari (superfici di energia potenziale), verificando ed estendendo i semplici modelli della cinetica chimica (Aquilanti e Mele 1992). Per illustrare alcuni aspetti dell'ampia fenomenologia accumulatasi, considereremo esempi sui processi elementari in fase gassosa, sufficientemente rappresentativi sia delle tecniche sperimentali e interpretative in uso, sia delle prospettive e dei problemi nella modellizzazione di processi macroscopici a partire dalla dinamica dei processi elementari.
Lo studio della velocità delle reazioni chimiche e della dinamica molecolare risulta di primaria importanza non solo dal punto di vista della ricerca fondamentale - per approfondire la conoscenza della struttura della materia e delle leggi che la governano - ma anche da quello applicativo; in questo secondo caso, esso apre prospettive importanti per la preparazione di nuovi composti e per la comprensione dell'evoluzione di sistemi complessi (processi di combustione, chimica e fisica delle atmosfere planetarie e dei plasmi, comportamento della materia in condizioni estreme di pressione e di temperatura).
Cenni storici
La cinetica delle reazioni diventa un capitolo importante della chimica a partire dalla metà dell'Ottocento. All'inizio l'attenzione è rivolta alla determinazione delle leggi che governano le velocità delle reazioni e la loro dipendenza da grandezze quali le concentrazioni delle specie reagenti e la temperatura del sistema. Un successivo stadio di queste ricerche riguarda la determinazione del meccanismo delle reazioni chimiche, vale a dire la caratterizzazione di reazioni complesse come combinazione di processi elementari. Lo stadio più avanzato consiste nell'interpretazione del processo macroscopico secondo un modello dettagliato di processi microscopici.
Fin dalla metà dell'Ottocento, parallelamente alla nascita della teoria cinetica dei gas, è risultato evidente il ruolo delle collisioni tra molecole reagenti nelle reazioni bimolecolari; di contro si è dovuto attendere il primo quarto del XX sec. per interpretare le reazioni monomolecolari in termini di trasferimento intermolecolare e di ridistribuzione dell'energia nei moti intramolecolari. La legge generale che descrive la dipendenza dalla temperatura termodinamica della costante di velocità (dovuta allo svedese Svante Arrhenius, 1859-1927) prevede una dipendenza esponenziale da un parametro empirico, l'energia di attivazione, interpretata come la quantità minima di energia di collisione che le molecole devono possedere per poter reagire (Aquilanti e Volpi 1998). La formulazione di Arrhenius (1884) può quindi essere considerata l'atto di nascita della dinamica delle reazioni chimiche intesa come studio del moto degli atomi e delle molecole nel singolo evento reattivo.
L'analogia con i semplici modelli microscopici a fondamento della teoria cinetica dei gas, modelli che consentono la descrizione soddisfacente della fenomenologia macroscopica, ha fornito un'utile guida per gli sviluppi successivi, anche se la grande varietà di comportamento riscontrata nella fenomenologia delle reazioni chimiche ha richiesto l'introduzione di una maggiore complessità delle interazioni in gioco e ha comportato quindi la necessità di adottare modelli e teorie adeguate. Si è dovuta attendere la fine degli anni Venti e l'inizio degli anni Trenta del XX sec. perché la dinamica delle reazioni chimiche potesse avere solide basi teoriche, a seguito dell'introduzione dei principî della meccanica quantistica, mentre soltanto a partire dagli anni Sessanta si sono rese disponibili le tecniche sperimentali che permettono lo studio dettagliato delle reazioni a livello microscopico. Da allora la dinamica delle reazioni chimiche è diventata uno dei settori di punta della ricerca chimica. Il suo studio ha impegnato un numero sempre maggiore di ricercatori e ha visto riconosciuta la sua importanza con l'assegnazione del premio Nobel per la chimica nel 1986 a Dudley R. Herschbach, Yuan T. Lee e John C. Polanyi e nel 1999 ad Ahmed H. Zewail. La quantità di lavori pubblicati sulle riviste scientifiche specializzate è andata sempre più aumentando nel tempo. In questo ambito ci si limiterà alla presentazione dell'argomento nelle sue linee più generali e ad alcuni esempi più significativi relativi a reazioni chimiche semplici in fase gassosa (Levine e Bernstein 1987; Aquilanti e Volpi 1998).
Aspetti sperimentali
Le tecniche sperimentali utilizzate per lo studio della dinamica delle reazioni chimiche possono essere classificate in due grandi categorie: le tecniche collisionali e quelle spettroscopiche. Le tecniche collisionali (Tav. I) consentono di ottenere valori sperimentali delle sezioni d'urto integrali o differenziali, che forniscono una misura delle probabilità che una collisione tra particelle si risolva in un evento reattivo. Uno degli aspetti più interessanti di tali esperimenti sta nel fatto che permettono di verificare, mediante un confronto più o meno diretto con il dato sperimentale, l'accuratezza dei modelli teorici e dei metodi computazionali. Una caratteristica importante delle tecniche collisionali è, in particolare, quella di permettere la misura della distribuzione angolare dei prodotti di reazione.
L'apparecchiatura per misure differenziali mostrata nella Tav. I (in basso) consente anche lo studio di reazioni per le quali si possono ottenere informazioni sulla ripartizione dell'energia tra moto traslazionale e moti interni attraverso la determinazione della velocità dei prodotti con una tecnica a tempo di volo (TOF, time of flight). Questa tecnica venne usata per la prima volta con successo nello studio di una reazione chimica da Ellison H. Taylor e Sheldon Datz nel 1955 negli Stati Uniti, ed è stata sviluppata e utilizzata per lo studio di una notevole varietà di reazioni dal gruppo di ricerca di Herschbach negli anni Sessanta e Settanta (Herschbach 1993) e da quello di Lee negli anni Settanta e seguenti (Lee 1993). Le tecniche di produzione dei fasci variano a seconda della natura delle specie in gioco. In genere uno dei reagenti è una specie chimica stabile, così che il fascio molecolare può essere prodotto per semplice espansione del gas attraverso un foro oppure una fenditura in una camera da vuoto, con successiva collimazione per mezzo di altre fenditure; si ottiene in tal modo un fascio di particelle che procedono in una determinata direzione senza subire collisioni con il gas residuo.
In un esperimento di dinamica di una reazione è praticamente impossibile controllare contemporaneamente i numerosi parametri importanti, quali velocità, stati interni e orientazione di reagenti e prodotti, e quindi sono necessari processi di media, ciascuno dei quali toglie parte delle informazioni contenute, per esempio, nelle sezioni d'urto differenziali tra specifici stati rotazionali, vibrazionali ed elettronici di reagenti e prodotti. Si ottengono in questo modo sezioni d'urto differenziali o integrali per insiemi di particelle, per i quali alcuni dei gradi di libertà possono non essere univocamente definiti. Sebbene ciò complichi l'interpretazione degli esperimenti, è innegabile che le misure di sezioni d'urto contengono sempre qualche informazione in più rispetto alle misure delle costanti di velocità delle reazioni, che sono gli ingredienti tradizionali della cinetica chimica. Queste ultime implicano la possibilità di definire la temperatura e quindi l'equilibrio termico di tutti i gradi di libertà traslazionali e interni di reagenti e prodotti. Pertanto, le costanti di velocità sono sempre ottenibili, almeno in via di principio, mediando le sezioni d'urto secondo distribuzioni di Boltzmann su quei gradi di libertà che non si è riusciti a controllare, mentre il processo inverso (e cioè una deconvoluzione da costanti di velocità a sezioni d'urto) non è praticabile. È anzi necessario introdurre esplicitamente le sezioni d'urto per interpretare le velocità dei processi reattivi o di trasporto nei casi in cui l'ipotesi dell'equilibrio termico non è verificata, vale a dire nelle condizioni in cui la temperatura non è un parametro significativo.
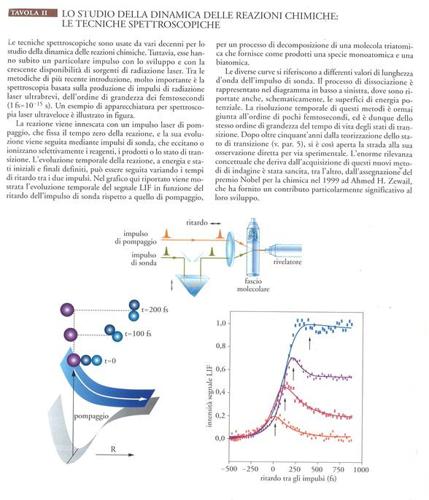
L'altra grande famiglia di metodiche sperimentali per lo studio della dinamica delle reazioni chimiche è rappresentata dalle tecniche spettroscopiche, che forniscono la possibilità di seguire nel tempo l'evoluzione dei reagenti nei prodotti e di determinare lo stato energetico interno delle specie coinvolte. Un esempio tipico è rappresentato dalla misurazione della chemiluminescenza nell'infrarosso dei prodotti 'nascenti', cioè di prodotti che si trovano a pressioni tanto basse e che vengono rivelati a tempi così brevi dalla loro produzione da non poter subire collisioni prima di emettere la radiazione caratteristica dei loro stati interni. Mediante questa tecnica, applicata fin dal 1958 da Michael Polanyi, è possibile ricavare la popolazione degli stati eccitati vibrorotazionali risultanti da particolari processi reattivi. Più generale è l'utilizzo della fluorescenza indotta da laser (LIF, laser induced fluorescence), che richiede stati eccitati con vita media molto breve. Altre tecniche basate sull'estensione dei metodi spettroscopici sono state sviluppate di recente (Tav. II).
Tra queste tipologie limite di tecniche spettroscopiche c'è tutta una serie di tecniche sperimentali intermedie che spesso possono essere utilizzate per lo studio di reazioni con particolari caratteristiche. Per esempio, con le tecniche di spettroscopia veloce, impiegando impulsi di pompaggio e di sonda linearmente polarizzati, si possono ottenere informazioni sulla direzione del moto dei prodotti dall'analisi dello spostamento Doppler della fluorescenza indotta dal laser della pompa. Le reazioni nelle quali sono coinvolte specie cariche hanno caratteristiche particolari. Gli ioni reagenti o prodotti possono essere selezionati - più facilmente che non le specie neutre - mediante spettrometria di massa, e l'energia di collisione può essere variata in intervalli piuttosto ampi, soprattutto per energie superiori all'energia termica. Infine, l'impiego di laser polarizzati negli impulsi di pompaggio e di sonda apre notevoli prospettive per lo studio della stereospecificità delle reazioni in funzione dell'orientamento dei reagenti o per l'analisi dell'orientamento dei prodotti.
Aspetti teorici
Le proprietà di trasporto della materia (quali la conducibilità e la viscosità) e le reazioni chimiche sono manifestazioni macroscopiche di collisioni che avvengono a livello atomico e molecolare e sono descritte, in ultima analisi, dalle leggi generali che regolano le collisioni.
Tali leggi sono quelle della meccanica quantistica e, per lunghezze d'onda molto piccole, della meccanica classica. L'applicazione di queste leggi è tuttavia ostacolata da enormi difficoltà di calcolo, data la complessità dei sistemi di interesse pratico. Questa è dovuta principalmente al fatto che le equazioni del moto dipendono da un numero elevatissimo di coordinate (tre per ogni elettrone e per ogni nucleo).
D'altra parte, fino alla metà del XX sec., le informazioni sperimentali disponibili erano fornite da esperimenti su proprietà macroscopiche, e quindi costituite da quantità, come i coefficienti di trasporto e le costanti di velocità, mediate su un numero enorme di collisioni le cui proprietà medie possono, in casi favorevoli, corrispondere a situazioni di equilibrio caratterizzate da una temperatura ben definita. Pertanto, le approssimazioni dei modelli usati in quegli anni potevano già considerarsi soddisfacenti e non si avvertiva la necessità di affrontare direttamente il problema dinamico delle singole collisioni.
Gli importanti progressi realizzati negli ultimi decenni, legati in gran parte all'avvento di nuove tecniche sperimentali (raggi molecolari, spettroscopie risolte in tempi molto brevi; Tavv. I e II) hanno reso possibile lo studio della dinamica delle singole collisioni. In casi favorevoli, questi dati permettono di ottenere a ritroso informazioni sulle forze d'interazione, fornendo così un ponte tra eventi osservati e leggi dinamiche fondamentali. Il programma attuale della cinetica chimica sperimentale consiste dunque nel fornire dati sempre più accurati sulla dinamica dei processi elementari, mentre dalla teoria ci si devono attendere modelli interpretativi e metodi di approssimazione sempre più raffinati.
Occorre sottolineare che la teoria delle collisioni costituisce un campo estremamente vasto della fisica teorica: le tecniche collisionali, mentre rappresentano uno strumento d'indagine di recente sviluppo in cinetica chimica, costituiscono invece il metodo d'elezione in fisica nucleare e delle particelle. In definitiva, ogni nostra informazione sulla struttura della materia e sulle sue trasformazioni è il risultato di collisioni tra particelle elementari. Anche se la descrizione dei processi molecolari è riconducibile alla meccanica quantistica, per molti problemi d'interesse può essere sufficiente muoversi nell'ambito del limite classico. Una metodologia spesso interessante per la dinamica chimica consiste quindi nell'impostare classicamente un determinato problema e nell'introdurre successivamente un formalismo quantomeccanico. Si sono così sviluppate teorie semiclassiche delle collisioni in cui le particelle seguono traiettorie classiche e manifestano proprietà ondulatorie soltanto in certe regioni critiche del loro cammino. È possibile in questo ambito descrivere fenomeni molecolari con formalismo analogo a quello dell'ottica ondulatoria: tale analogia si riflette anche nel linguaggio, per cui, per esempio, effetti d'interferenza quantomeccanica prendono il nome di 'aureola' o 'arcobaleno'.
Dinamica delle reazioni
Il problema fondamentale della dinamica chimica consiste nella ricerca di relazioni tra le forze che si esercitano a livello molecolare e le grandezze osservabili (per es., le sezioni d'urto). Questo procedimento tipicamente riduzionistico è in molti casi a senso unico. Infatti, il cosiddetto 'problema dell'inversione' consistente nel risalire dalle sezioni d'urto alle forze di interazione è risolubile soltanto in situazioni particolarmente semplici. Più spesso è necessario costruire un modello per le interazioni che sia, da un lato, sufficientemente realistico e, dall'altro, abbastanza trattabile, e quindi impostare il problema dinamico relativo, confrontando infine i risultati con quelli degli esperimenti.
L'interazione tra le particelle dipende da tanti termini quante sono le interazioni tra ognuno degli elettroni e dei nuclei che le compongono con tutti gli altri elettroni e nuclei. Le superfici di energia potenziale avranno una dimensionalità pari a tre volte il numero totale di particelle (tre coordinate per ogni nucleo e per ogni elettrone), e per tale ragione possono essere descritte da funzioni assai complicate; è quindi importante averne, con riferimento a un processo specifico, una visualizzazione appropriata e una rappresentazione matematica sufficientemente trattabile in termini delle sole coordinate che sono effettivamente cruciali per la descrizione della dinamica delle reazioni. Comunemente si adotta la separazione di Born-Oppenheimer che sfrutta l'enorme differenza tra le masse dei nuclei e quelle degli elettroni, per cui si può descrivere il moto (lento) dei nuclei nel campo medio prodotto dal moto veloce degli elettroni. Si ottengono così le superfici di energia potenziale in funzione delle sole coordinate nucleari. In generale, è ben caratterizzabile la forma delle superfici di energia potenziale per le configurazioni corrispondenti ai reagenti e ai prodotti, corrispondenti cioè alle situazioni di 'partenza' e di 'arrivo' delle reazioni. Infatti, reagenti e prodotti sono in genere sostanze sufficientemente stabili da poter essere studiate con le tecniche convenzionali dell'analisi chimica e della spettroscopia atomica e molecolare. Assai meno note sono le configurazioni corrispondenti agli stadi intermedi delle reazioni (complessi intermedi o stati di transizione; Rolla 1948).
Per quanto riguarda gli stadi intermedi e la caratterizzazione dei 'cammini di reazione' tramite i quali i reagenti danno origine ai prodotti, è fondamentale il contributo della chimica teorica moderna, in buona parte incentrata sulla trattazione quantistica della struttura elettronica delle molecole, che consente di individuare accuratamente le modificazioni geometriche intervenute a livello molecolare nel corso delle reazioni chimiche e di classificare le simmetrie dominanti. Tuttavia, dato che le previsioni della chimica teorica non hanno ancora raggiunto una sufficiente accuratezza per quanto riguarda le caratteristiche energetiche fondamentali della dinamica delle reazioni (esotermicità o endotermicità, energia di attivazione), per queste grandezze si fa ricorso anche a modelli totalmente o parzialmente empirici.
A partire dagli anni Sessanta, grandi passi avanti sono stati compiuti in questa direzione. La possibilità di trattare accuratamente il dettaglio della dinamica di una reazione chimica elementare come problema quantomeccanico dell'interazione fra tre corpi è emersa invece negli anni Settanta, grazie all'avvento di strumenti di calcolo sempre più potenti. Ove sono stati possibili confronti, si è concluso che le tecniche basate esclusivamente sulla meccanica classica, che trascurano quindi tipici effetti quantomeccanici quali l'interferenza, l'effetto tunnel e le risonanze, forniscono in generale una stima accettabile per le costanti di velocità, almeno per reazioni non coinvolgenti atomi di idrogeno, mentre è necessario un approccio esplicitamente quantomeccanico per la previsione accurata di sezioni d'urto. In base a queste considerazioni, sono stati sviluppati procedimenti intermedi, generalmente designati come 'semiclassici', in cui l'evoluzione dinamica sulle superfici di energia potenziale è descritta quale moto essenzialmente classico dei nuclei, ma gli effetti quantistici sono introdotti tenendo conto esplicitamente del comportamento ondulatorio nel regime di lunghezze d'onda piccole rispetto alle dimensioni molecolari. Per quanto riguarda la trattazione di problemi più complicati di quelli delle reazioni a tre centri fin qui considerati, l'uso di tecniche classiche, semiclassiche o statistiche si rende necessario, a causa della difficoltà di affrontare direttamente la soluzione delle equazioni della meccanica quantistica.
Lo stato di transizione
È opportuno approfondire la teoria dello stato di transizione, che ha lo scopo di formulare in termini quantistici il procedere di una reazione attraverso uno o più stati intermedi.
La teoria è anche nota come 'teoria del complesso attivato', o anche 'teoria delle velocità assolute di reazione' (Levine e Bernstein 1987), e il fatto stesso che le si attribuiscano molti nomi e che abbia avuto varie formulazioni alternative testimonia come lo stato di transizione sia difficile non solo da caratterizzare sperimentalmente, ma anche da mettere a fuoco dal punto di vista teorico. Henry Eyring, uno dei fondatori della teoria (1934), ne propose una versione termodinamica, che è tuttora utilizzata in pratica. Allo stato di transizione sono attribuiti valori delle funzioni termodinamiche (entalpia ed entropia, e quindi energia libera), alla stregua di un ben definito stato di equilibrio termodinamico. Poiché le tecniche di calcolo quantomeccanico dell'epoca non erano sufficientemente precise da consentire un'accurata caratterizzazione dello stato di transizione, si ipotizzava che a tale stato corrispondesse un minimo energetico nella superficie di energia potenziale, il 'lago di Eyring'. Incidentalmente, è interessante far notare che la dinamica di una reazione chimica è spesso descritta con un linguaggio pittoresco; per esempio, nel rappresentare l'evoluzione del sistema reattivo sulle superfici di energia potenziale, introdotte all'inizio degli anni Trenta da Eugene Wigner e Michael Polanyi, si parla di 'valle' dei reagenti e dei prodotti e si dice che la reazione avviene per superamento di una 'sella' o di un 'crinale'.
Le ricerche teoriche successive al lavoro di Eyring indicarono come erronea l'indicazione dell'esistenza di un 'lago', vale a dire di una buca di potenziale sulla sella, dove è localizzato lo stato di transizione (o 'complesso intermedio'). Le ricerche recenti sulla caratterizzazione, anche sperimentale, dello stato di transizione sono state inquadrate in una prospettiva storica da Zewail nel libro The chemical bond: structure and dynamics (1992). Negli ultimi anni, grazie soprattutto ai lavori di Zewail, si è aperta la strada per rendere possibile l'osservabilità dello stato di transizione (Tav. II). Come già detto in precedenza, questa prospettiva si è concretizzata come conseguenza dello sviluppo delle tecniche basate sulla spettroscopia laser ultraveloce e sui fasci molecolari, che hanno consentito di ottenere informazioni sperimentali su scale di tempi di interazione brevissimi (dell'ordine dei femtosecondi), offrendo la possibilità di seguire eventi singoli, ancorché in condizioni tali che il principio di indeterminazione può limitare la precisa definizione in energia degli stati.
Viste le difficoltà inerenti alla caratterizzazione sperimentale dello stato di transizione, un ruolo decisivo gioca qui la chimica teorica, che si è chiaramente posta il problema del calcolo delle sue proprietà sin dagli anni Trenta, anche se con risultati spesso contraddittori. Possibili equivoci e ingiustificati ottimismi sono stati successivamente ridimensionati dall'affinamento delle tecniche computazionali e dal potenziamento degli strumenti di calcolo. I notevoli ostacoli incontrati dagli approcci della chimica quantistica, spesso indicati genericamente come ab initio, sono fortemente dipendenti dalle capacità di memoria e di tempi di calcolo dei computer, oltre che ovviamente dall'adeguatezza del modello e dalle tecniche di programmazione. Oggi il chimico ha a disposizione strumenti di calcolo molto elaborati. Nel 1998 il premio Nobel per la chimica è stato assegnato a John A. Pople proprio per il suo contributo in questa direzione. Il riconoscimento è stato condiviso con Walter Kohn, premiato per aver contribuito alla ricerca di vie di calcolo alternative a quelle tradizionali della chimica quantistica (in particolare, con il metodo del funzionale della densità). Non è sorprendente che, accanto alle metodologie ab initio, continuino a essere proposte e sviluppate altre tecniche, anche di natura semiempirica.
La descrizione di aspetti complessi della chimica - come, per esempio, la relazione tra struttura e reattività, oppure il comportamento in condizioni estreme di pressione e di temperatura, e così via - fa tuttora ampio ricorso a correlazioni empiriche che, da un lato, tentano di compattare un insieme molto ampio di eventi sperimentali entro schemi semplici e con una drastica riduzione del numero di variabili, dall'altro lato si propongono come agile strumento di previsione di fenomeni non ancora osservati e quale stimolo per ulteriori misurazioni sperimentali.
Dinamica molecolare dei sistemi complessi
Nel corso degli ultimi decenni si è realizzato uno sviluppo molto significativo nello studio della dinamica molecolare dei sistemi che coinvolgono fasi condensate, utilizzando tecniche sperimentali e teorico-interpretative basate su principî simili a quelli sin qui esposti con riferimento alla sola fase gassosa. Le tecniche dei fasci molecolari e della spettroscopia ultraveloce sono risultate particolarmente utili per la caratterizzazione della dinamica dei processi reattivi che avvengono alle interfasi, così come per la caratterizzazione dei processi che coinvolgono aggregati molecolari (cluster) di dimensioni sempre crescenti. La reattività in sistemi coinvolgenti superfici e aggregati è oggetto di intensi studi teorici; nelle tecniche utilizzate, un ruolo fondamentale è svolto dalle simulazioni che fanno esplicito riferimento alla meccanica classica come approssimazione al comportamento quantistico, che è in generale più difficile da descrivere. Si prevede che nei prossimi anni queste simulazioni potranno affinarsi utilizzando sia descrizioni più accurate delle interazioni intermolecolari (per es., ottenute da esperimenti come quelli illustrati nella Tav. I), sia trattazioni in cui meccanica classica e quantistica siano opportunamente combinate (per es., il modello Car-Parrinello, oggetto di recente attenzione). Ulteriori sviluppi, che possono qui essere soltanto menzionati, riguardano i settori fondamentali della chimica delle reazioni nello stato di soluzione, soprattutto acquosa, e della reattività di sistemi intrappolati in matrici solide.
La modellizzazione di sistemi macroscopici come insiemi di processi microscopici è uno dei principali campi di attività della ricerca chimica moderna ed è importante che si faccia almeno un accenno al nuovo tipo di problemi che si aprono per quanto riguarda gli aspetti metodologici. Un punto fondamentale riguarda la non linearità delle equazioni fenomenologiche che descrivono le variazioni nel tempo delle concentrazioni delle specie coinvolte in un processo (diminuzione dei reagenti, crescita dei prodotti). Tale non linearità viene discussa nell'ambito delle problematiche associate al cosiddetto 'caos chimico' che emerge nella modellistica dei sistemi complessi. Ulteriori aspetti di particolare interesse riguardano il ruolo delle 'tecniche semiclassiche' (o 'teorie asintotiche') nella descrizione quantistica di sistemi che classicamente si presentano caotici, laddove la trattazione esatta, basata sulla meccanica quantistica (che è essenzialmente una teoria lineare), non prevede l'emergenza di tale fenomeno.
Il tema del rapporto tra mondo microscopico e mondo macroscopico, strettamente legato a quello tra meccanica classica e meccanica quantistica (e anche della linearità e della non linearità, del determinismo e dell'indeterminazione, della complessità e del caos) assume notevole importanza e trova ulteriore sviluppo nelle ricerche di meccanica statistica che hanno lo scopo di costituire la base microscopica della termodinamica chimica. Mentre la teoria della velocità delle reazioni come sviluppata da Arrhenius, nella sua interpretazione in termini dei modelli collisionali della teoria cinetica dei gas, ha sempre fatto ricorso alla realtà microscopica nell'interpretazione dell'energia di attivazione e del fattore preesponenziale (Aquilanti e Mele 1992), l'approccio termodinamico di Eyring è il più importante esempio del tentativo di mantenere la descrizione della realtà chimica entro uno schema di linguaggio - quello della termodinamica - specifico della realtà macroscopica. Questo è anche l'ambito entro cui si sviluppano le ricerche di Ilya Prigogine premio Nobel per la chimica nel 1977. Si tratta di un'alternativa, diremmo fenomenologica, rispetto al progetto riduzionistico della meccanica statistica mirante a interpretare come opportune medie su comportamenti microscopici le quantità che compaiono nelle formulazioni termodinamiche. La dinamica molecolare contribuisce a tale progetto mediante una modellistica che fa amplissimo uso di simulazioni computazionali. Lo scenario della ricerca in questo campo si è andato talmente modificando da trasformare profondamente il ruolo e gli strumenti d'indagine del chimico moderno rispetto alle problematiche della scienza dei materiali, offrendo una serie di spunti per ulteriori indagini, che potranno condurre ad acquisizioni di rilevante interesse non soltanto per la ricerca chimico-fisica più avanzata, ma anche più in generale, dal punto di vista delle prospettive di progresso delle scienze della Natura.
Bibliografia
Aquilanti, Mele 1992: Aquilanti, Vincenzo - Mele, Antonio, Cinetica chimica, in: Enciclopedia delle scienze fisiche, Roma, Istituto della Enciclopedia Italiana, I, 1992, pp. 603-608.
Aquilanti, Volpi 1998: Aquilanti, Vincenzo - Volpi, Gian Gualberto, Dinamica delle reazioni chimiche, in: Enciclopedia del Novecento, Roma, Istituto della Enciclopedia Italiana, XI, suppl. II, 1998, pp. 573-582.
Bonino 1931: Bonino, Giovanni Battista, Cinetica chimica, in: Enciclopedia Italiana di Scienze, Lettere ed Arti, Roma, Istituto della Enciclopedia Italiana, X, 1931, pp. 358-367.
Herschbach 1993: Herschbach, Dudley R., Molecular dynamics of elementary chemical reactions, in: Nobel lectures in chemistry: 1981-1990, edited by Bo G. Malmstrom, Singapore, World Scientific Publishing, 1993, pp. 265-314.
Lee 1993: Lee, Yuan T., Molecular beam studies of elementary chemical processes, in: Nobel lectures in chemistry: 1981-1990, edited by Bo G. Malmstrom, Singapore, World Scientific Publishing, 1993, pp. 320-354.
Levi 1993: Levi, Andrea Claudio, Fasci molecolari, in: Enciclopedia delle scienze fisiche, Roma, Istituto della Enciclopedia Italiana, II, 1993, pp. 522-525.
Levine, Bernstein 1987: Levine, Raphael D. - Bernstein, Richard B., Molecular reaction dynamics and chemical reactivity, New York-Oxford, Oxford University Press, 1987.
Polanyi 1993: Polanyi, John C., Some concepts in reaction dynamics, in: Nobel lectures in chemistry: 1981-1990, edited by Bo G. Malmstrom, Singapore, World Scientific Publishing, 1993, pp. 359-407.
Rolla 1948: Rolla, Mario, Cinetica chimica, in: Enciclopedia Italiana di Scienze, Lettere ed Arti, Roma, Istituto della Enciclopedia Italiana, Appendice II, 1948, pp. 614-617.
Zewail 1992: Zewail, Ahmed H., The chemical bond: structure and dynamics, San Diego, Academic Press, 1992.
Zewail 2000: Zewail, Ahmed H., Femtochemistry: atomic-scale dynamics of the chemical bond, "Journal of physical chemistry A", 104, 2000, pp. 5660-5694.