iperconiugazione
iperconiugazione
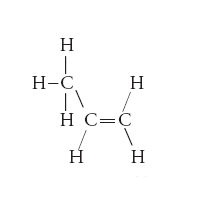
In chimica organica, tipo di interazione stabilizzante tra un legame saturo di tipo σ e un orbitale di tipo π. Nella sua forma più comune, l’iperconiugazione coinvolge la donazione di una parte della coppia di elettroni che costituisce un legame saturo σ C−H a un orbitale vuoto di tipo π. Per es., ha luogo tra i legami C−H del gruppo metile −CH3 e il doppio legame carbonio-carbonio nel propene:
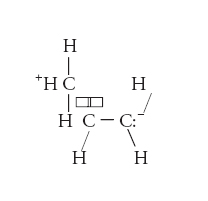
In termini di teoria del legame di valenza, l’iperconiugazione viene trattata prendendo in considerazione una forma di risonanza aggiuntiva che, per il caso del propene, può essere così scritta:
In questa struttura, formalmente un atomo di idrogeno non è legato al carbonio metilico, e i due elettroni del legame C−H vengono usati per stabilire un doppio legame tra questo e l’atomo di carbonio centrale, mentre l’atomo di carbonio insaturo terminale acquisisce una carica negativa. In termini di teoria degli orbitali molecolari, l’iperconiugazione viene interpretata come un’interazione di tipo legante tra un orbitale π legante del gruppo −CH3 contenente due elettroni e un orbitale π* antilegante vuoto del legame insaturo. In entrambe le interpretazioni, il risultato è un rilascio di elettroni dal legame C−H alla porzione insatura della molecola, con conseguente rafforzamento del legame C−C saturo e indebolimento di quello insaturo. In altri casi, la donazione può riguardare coppie elettroniche di non legame (per es., nelle ammine). Il fenomeno dell’iperconiugazione viene invocato per spiegare varie osservazioni sperimentali relative alla struttura e alla reattività di molecole organiche: per es., l’arricchimento in elettroni degli atomi insaturi di alcheni e alchini in presenza di gruppi radicalici adiacenti ai legami insaturi rispetto alle analoghe specie prive di sostituenti (con importanti effetti sulla reattività) e la preferenza per determinate conformazioni (per es., la conformazione eclissata nel propano).
→ Aromaticità e composti aromatici