Immunoterapia
Immunoterapia
Il termine ha avuto nel corso del tempo varie interpretazioni e il suo significato, se non ben definito, può indurre una falsa lettura dei suoi reali contenuti. Esso descrive quel complesso di interventi (farmacologici, vaccinali, sierologici, di manipolazione cellulare) in grado di agire sul sistema immunitario per modulare le sue funzioni. Il problema dell'i. è naturalmente legato alle conoscenze sulle diverse caratteristiche dei meccanismi cellulari e umorali che regolano la fisiologica risposta all'antigene. Una comprensione del sistema immunitario quale struttura integrata dell'organismo si è venuta delineando nel corso degli anni Novanta e pertanto un razionale approccio all'i. ha basi relativamente recenti. Si possono distinguere, nell'ambito dell'i., l'immunopotenziamento e la immunosoppressione. Un capitolo in parte autonomo riguarda l'i. dei tumori.
Immunopotenziamento
L'immunopotenziamento è un processo che, con vari meccanismi, amplifica o modifica uno o più componenti che formano il network della risposta immunitaria. Le condizioni biologiche nelle quali è possibile un immunopotenziamento sono varie: rinforzo della risposta verso agenti infettanti, controllo di sottopopolazioni cellulari che possono ridurre l'aggressione di reazioni autoimmunitarie, stimolo in grado di ripristinare stati di immunodeficienza. Per descrivere con miglior cognizione di causa le procedure di immunopotenziamento si distinguono quelle proprie dei meccanismi specifici (verso antigeni noti) e quelle di tipo non specifico.
Nel gruppo dei meccanismi specifici si distinguono: vaccinazioni (v. vaccino, App. V e in questa Appendice); impiego di anticorpi (terapia xenogenica e uso di sieri iperimmuni); immunopotenziamento adottivo. L'insieme dei meccanismi aspecifici include: sistemi di immunostimolazione attiva con impiego di sostanze di varia origine biologica o molecole di sintesi; uso di immunoglobuline; cellule attivate con citochine.
Alcuni aspetti tra quelli sopraelencati hanno avuto il pregio di chiarire i meccanismi di controllo della risposta immunitaria, ma non sempre hanno avuto un pratico successo nel trattamento delle varie forme patologiche nelle quali sono stati proposti.
Il prototipo della stimolazione attiva è quello ottenuto impiegando vaccini. Come è noto, l'obiettivo della vaccinazione consiste nel potenziare le difese dell'ospite consentendo la produzione di anticorpi e generando cloni di cellule sensibilizzate in grado di agire su un substrato antigenico nel modo più efficiente ed efficace possibile.
I caratteri di produzione di un vaccino debbono rispondere a criteri rigidi di qualità che comprendono la stabilità del prodotto, la ridotta comparsa di effetti collaterali e la buona durata nel tempo. Un elemento non trascurabile nell'impiego dei vaccini è la via di somministrazione: tenendo conto delle vaccinazioni da impiegare su vaste popolazioni, non secondaria è infatti la scelta di una via di somministrazione facilmente praticabile.
Gli studi sulle biotecnologie hanno cercato di produrre vaccini sempre più efficaci, impiegando come immunogeni molecole isolate ricavate da batteri o virus, evitando di somministrare il patogeno intero (sia ucciso sia inattivato). Un buon progresso in questo senso si è avuto nella preparazione di vaccini sintetici costituiti da catene aminoacidiche ottenute per via chimica. Un altro sistema di preparazione consiste nella tecnica dei vettori eterologhi attenuati. Con questo approccio alcuni virus vengono attenuati (privati cioè del loro potenziale patogeno) e diventano vettori di molecole immunogene verso le quali si vuole ottenere la risposta immunitaria.
La tecnica del DNA ricombinante ha rappresentato un altro sensibile progresso. Essa si fonda sulla possibilità che un gene isolato, codificante per le molecole immunogene, possa essere inserito in un sistema di replicazione naturale: utilizzando cellule batteriche, lieviti o cellule di mammiferi si può provvedere alla sintesi e alla purificazione di prodotti utilizzabili per le vaccinazioni.
Aspetti ancora più interessanti si sono affacciati nel corso delle ricerche sull'AIDS utilizzando le stesse modalità naturali della risposta immunitaria. Infatti, è noto dalla teoria del network idiotipico che un anticorpo prodotto nei confronti del proprio antigene specifico è in grado di stimolare la produzione di un altro anticorpo rivolto verso il proprio idiotipo (anticorpo anti-idiotipo). Ne deriva che in termini sterici la conformazione dell'anticorpo anti-idiotipo somiglia o coincide con la struttura dell'antigene che ha indotto la sintesi del primo anticorpo. Se utilizziamo il secondo anticorpo come antigene inoculandolo in un animale, otterremo una risposta verso l'anticorpo anti-idiotipo generato nel primo sistema e pertanto questa molecola funziona come un vaccino naturale in quanto, stimolando una risposta anti-idiotipo del tutto simile a quella generata dall'antigene originalmente utilizzato per l'immunizzazione, consente di evitare l'uso di prodotti potenzialmente rischiosi, ottenendo lo stesso risultato.
Oltre che in ambito strettamente profilattico (immunità antivirale e antitossica) le vaccinazioni sono state impiegate per trattare alcune malattie infettive ad andamento cronico nelle quali la chemioterapia risulta insufficiente. Un esempio di questa forma di vaccinazione è stato proposto per la cura della leishmaniosi cutanea, associando promastigoti uccisi di Leishmania a BCG (Bacillo di Calmette Guérin) quale adiuvante. Più recentemente, in altro contesto, sono stati impiegati componenti proteici del virus HIV-1 (gp 120) in soggetti sieropositivi, con lo scopo di stimolare la risposta al virus e ritardare l'evoluzione verso l'AIDS dei soggetti infettati.
Gli aspetti di un immunopotenziamento adottivo hanno riguardato in modo particolare la terapia antitumorale (v. oltre: Immunoterapia dei tumori).
L'uso di immunostimolanti aspecifici rappresenta ancora un capitolo in evoluzione e le varie sostanze impiegate in terapia o in protocolli sperimentali hanno avuto una storia piuttosto articolata, generandosi talora confusione per dati contraddittori e non comparabili.
Un modo semplice di classificare gli immunostimolanti si può basare sull'origine e le modalità di preparazione dei vari prodotti. Possono pertanto essere distinti prodotti di origine fisiologica (ormoni timici, interferoni, citochine), molecole sintetiche (levamisolo, metisoprinolo, componenti lipopeptidici, induttori della sintesi di interferoni) o di origine biologica e batterica (BCG, Corynebacterium parvum, estratti batterici variamente selezionati, endotossine).
L'interferenza dei prodotti immunostimolanti aspecifici sulle cellule della risposta immunitaria rappresenta uno dei problemi più complessi; infatti, se è possibile in prima approssimazione distinguere i vari agenti in rapporto alla preferenziale cellula bersaglio, non si deve dimenticare la forte interazione che si verifica nei vari momenti della risposta immunitaria stessa e pertanto gli aspetti funzionali e 'numerici' conseguenti a una stimolazione primaria vanno accuratamente valutati ai fini di una corretta interpretazione del risultato finale. Stimolare i linfociti T, per esempio, può significare uno stimolo indiretto anche per altre popolazioni linfocitarie (B e T), macrofagi e cellule NK (Natural Killer).
D'altro canto stimolatori macrofagici (i macrofagi sono cellule che svolgono un ruolo cruciale quali APC, Antigen Presenting Cells) possono indurre un meccanismo a cascata coinvolgente i linfociti T, B e cellule NK. Gli stessi prodotti di sintesi (immunofarmaci) impiegati come modulatori della risposta immunitaria non seguono regole standard nell'ambito del rapporto dose-risposta. Infatti, al crescere della dose somministrata può non corrispondere un'azione farmacologicamente attiva e addirittura possono derivarne effetti soppressivi (per es. dovuti a stimolazione selettiva di cellule T suppressor).
Alcune molecole sono state studiate nell'ambito delle ricerche sulle funzioni timiche e su fattori similormonali. Il gruppo dei derivati timici è piuttosto numeroso e include la timosina (frazione polipeptidica 5-30), la timopoietina i e ii, il fattore timico umorale, il fattore timico sierico, la timopentina (prodotto sintetico pentapeptidico costituito dai residui aminoacidici 32-36 della timopoietina ii). L'impiego dei derivati timici ha indicazione precipua nel trattamento di deficit immunologici con ipoplasia timica e in alcune malattie congenite con alterazioni gravi della risposta cellulo-mediata (malattia di Di George, sindrome di Wiskott-Aldrich, candidiasi cronica mucocutanea). L'uso in altre patologie come le malattie autoimmuni o alcune forme tumorali, ancora proposto negli anni Ottanta, non ha avuto valide e stabili conseguenze terapeutiche.
Un'evoluzione di notevole interesse ha rappresentato l'applicazione di biotecnologie (per es. DNA ricombinante) nel rendere disponibili molecole in grado di agire nel corso di varie patologie coinvolgenti in forma diretta o indiretta il sistema immunitario (ruolo dei cosiddetti Biological Response Modifiers).
Nell'ambito dell'immunopotenziamento con molecole naturali ha assunto un significato importante l'uso delle immunoglobuline per via endovenosa (terapia sostitutiva e immunomodulante). Il progresso in questo settore ha avuto inizio a partire dalla seconda metà degli anni Settanta, ma l'applicazione su vasta scala si è avuta nel decennio successivo. I progressi dell'industria farmaceutica hanno consentito la preparazione di immunoglobuline IgG in grado di essere somministrate per via endovenosa grazie al loro trattamento mediante vari approcci (enzimatici, fisico-chimici, impiego di stabilizzanti molecolari). Conservando il valore biologico dell'anticorpo nativo, è stato possibile l'uso delle IgG per via endovenosa dapprima nei deficit congeniti della risposta umorale (ipo-agammaglobulinemie originate da varie cause) e quindi, grazie a osservazioni sperimentali e cliniche, nel trattamento di alcune malattie autoimmuni o disregolative. Tra queste alcune sindromi neurologiche, piastrinopervie, e la malaria di Kawasaki.
Immunosoppressione
Gli sviluppi sull'impiego di farmaci ad azione immunosoppressiva hanno avuto, rispetto all'immunostimolazione, un'evoluzione mirata al trattamento delle malattie autoimmuni e al controllo del rigetto dei trapianti d'organo. La ricerca in questo settore è andata evolvendo in rapporto alle conoscenze immunopatologiche e, in particolare, in relazione alle conoscenze sul controllo della risposta immunitaria. Sono noti vari preparati farmaceutici (cortisonici, prodotti alchilanti, antimitotici, antimetaboliti, inibitori della sintesi purinica ecc.), mezzi ad azione fisica (radioterapia), alcuni preparati biologici adatti allo scopo. I farmaci immunosoppressivi sono il cardine per il trattamento delle malattie autoimmuni del connettivo e svolgono la loro azione deprimendo la risposta del sistema immunitario sia per quanto riguarda le reazioni mediate da anticorpi sia per quanto concerne la fase più strettamente cellulo-mediata. In tal modo si osserva, in base a protocolli terapeutici via via aggiornati e sperimentati, una sostanziale riduzione dei processi infiammatori che rappresentano il substrato anatomopatologico delle lesioni proprie delle malattie del connettivo.
La storia di impiego dei farmaci immunosoppressori ha avuto un'importante evoluzione nel corso degli anni Novanta grazie ai progressi dell'immunologia. Infatti, sebbene si sia ancora lontani dal disporre di molecole completamente selettive nel controllo di una risposta immunitaria, sono tuttavia state identificate alcune popolazioni cellulari sulle quali è ragionevole prevedere il verificarsi di un certo tipo di risposta farmacologicamente attesa. D'altro canto, l'importanza di una conoscenza critica, concettualmente necessaria per razionalizzare ogni terapia immunosoppressiva, consiste nell'identificare i punti di attacco significativi di ogni farmaco per ottenere un determinato risultato, superando quel certo empirismo clinico che ha guidato in passato la gestione di numerose malattie a patogenesi autoimmune. I farmaci dei quali disponiamo sono numerosi; ne verranno presi in considerazione alcuni sia per l'evoluzione storica che hanno rappresentato sia per l'importanza pratica che hanno assunto.
I corticosteroidi esercitano un'azione antinfiammatoria e immunosoppressiva. In generale l'effetto immunosoppressivo è legato all'impiego di dosi molto elevate o all'assunzione, da parte del paziente, di un dosaggio medio-alto per un lungo periodo di tempo. Essi esercitano la loro azione riducendo il numero dei linfociti T circolanti nel sangue con funzione helper, deprimendo la capacità della risposta agli antigeni T-dipendenti, inibendo la produzione di alcuni mediatori chimici (citochine) in grado di attivare momenti funzionalmente critici della risposta immunitaria. In particolare è stato dimostrato che i corticosteroidi agiscono anche sulla produzione di immunoglobuline, riducendo la sintesi di IgG, IgA e IgE (con incremento del loro catabolismo) e che possono ridurre l'attività sia delle cellule NK sia del sistema monocitario, abbassando in queste cellule la loro capacità di liberare l'interleuchina 1 (IL-1) e deprimendo l'espressione delle molecole di classe ii dell'MHC (Major Histocompatibility Complex) sulla loro membrana (con conseguente alterazione nella presentazione dell'antigene).
Un altro gruppo di farmaci di vasto impiego nell'immunosoppressione è rappresentato dai citostatici: essi agiscono in varie fasi della sintesi degli acidi nucleici inducendo il processo finale della lisi su bersagli cellulari che si trovano in forte attività di proliferazione. Possono essere raggruppati in base al meccanismo d'azione e pertanto divisi in alchilanti (ciclofosfamide, clorambucil), analoghi delle purine (6-mercaptopurina, azatioprina), antagonisti dell'acido folico (metotrexate).
La ciclofosfamide ha un'azione sulla fase premitotica della proliferazione cellulare e ha come bersaglio monociti, cellule precursori dei macrofagi, il gruppo delle NK e i linfociti B. Diversificata è l'azione sulle sottopopolazioni linfocitarie di tipo adiuvante e soppressivo.
L'azatioprina esercita il suo ruolo farmacologico interferendo sulla sintesi di DNA in fase S del ciclo cellulare e svolgendo un ruolo precipuo su cellule che hanno una funzione citotossica (linfociti T citotossici, cellule NK, azione citotossica mediata da anticorpi). Meno evidente è il ruolo dell'azatioprina sulle popolazioni linfocitarie B e sui linfociti T helper. Il farmaco, molto usato nelle malattie autoimmuni, è spesso impiegato in associazione ai corticosteroidi e consente una modulazione del loro dosaggio anche in rapporto alla necessità di prevenire o ridurre nel tempo, quanto più sia possibile, gli effetti collaterali emergenti dalla somministrazione steroidea.
Il farmaco che agisce inibendo sia la formazione di RNA sia quella di DNA è il metotrexate: esso ha un'azione prevalente sulla sintesi degli anticorpi.
Una molecola chiave nella storia recente dell'i. è la ciclosporina. Essa, ricavata originariamente da un particolare fungo, e oggi sintetizzabile in laboratorio, è un polipeptide ciclico costituito da 11 aminoacidi. Impiegata all'inizio delle sue applicazioni quale potente immunosoppressore per prevenire il rigetto dei trapianti, ha avuto una rapida estensione di uso nelle malattie a patogenesi autoimmune. Il livello di azione riguarda sia la risposta anticorpale sia l'azione linfocitaria T cellulo-mediata. Sono anche coinvolte le risposte legate alle NK. È possibile un'azione sui linfociti suppressor (stimolo). La ciclosporina blocca la cellula linfocitaria quiescente in fase G₀ o nei primi momenti della fase G₁ del ciclo cellulare. Viene inibita la sintesi dell'IL-2 che rappresenta il principale fattore necessario alla crescita e all'attivazione dei linfociti T helper e citotossici. Dotata, quindi, sia di effetto anti-infiammatorio che immunosoppressivo, la ciclosporina è un prodotto di grande efficacia terapeutica, può essere associata ai corticosteroidi (che pertanto vengono somministrati a dosi minori), e svolge la sua funzione se è costantemente presente nell'organismo.
I farmaci impiegati per l'immunosoppressione sono sperimentati soprattutto per ridurre gli effetti collaterali, spesso gravi se il paziente non è adeguatamente controllato nel corso della terapia, e per raggiungere una valida selettività di bersaglio. Da ricordare un farmaco ricavato dallo Streptomyces tsukubaensis (FK-506) che presenta un'attività soppressiva sul sistema immunitario confrontabile con quanto noto per la ciclosporina (inibizione di varie citochine, tra le quali l'IL-2).
Di particolare rilievo sono le ricerche su anticorpi monoclonali in grado di identificare, nel contesto delle cellule attivate responsabili della patologia autoimmune, il proprio bersaglio, così da ridurre al minimo gli effetti collaterali non desiderati. Sono note ricerche sull'impiego di anticorpi monoclonali contro linfociti T o sottopopolazioni linfocitarie.
Immunoterapia dei tumori
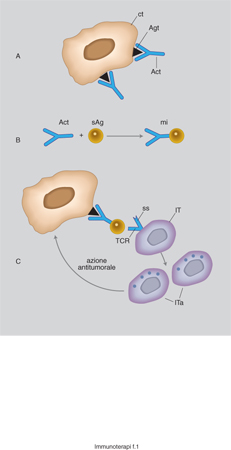
Gli studi sulla risposta immunitaria alla crescita neoplastica si basano sui principi della teoria della sorveglianza immunologica dei tumori proposta da sir F.M. Burnet all'inizio degli anni Settanta. Le linee guida che sono alla base dell'i. trovano pertanto razionale applicazione nella possibilità che il sistema immunitario sia in grado, almeno in alcune condizioni biologiche, di controllare e/o abolire la crescita di cellule cancerose. Perché sia possibile attuare questa funzione le cellule linfocitarie e le altre componenti del sistema immunitario (umorali o cellulari), debbono essere in grado di discriminare tra degenerazione della cellula cancerosa e cellule sane (fig. 1). Il meccanismo operativo consiste nel riconoscimento di un antigene tumorale specifico che sia espresso su cellule tumorali o nell'identificare antigeni associati alla crescita neoplastica. La complessità del problema, per il quale si sono accumulati dati sperimentali e clinici non di rado contraddittori, è generata dai diversi fattori che possono indurre in vivo la crescita tumorale, dalle caratteristiche metabolico-morfologiche acquisite dalla cellula degenerata e dal sistema di interazioni tra cellula neoplastica e il complesso dei meccanismi costitutivamente deputati alla sorveglianza immunitaria dell'espansione neoplastica stessa. La possibilità che il sistema immunitario agisca o venga stimolato ad agire terapeuticamente verso i tumori si fonda su osservazioni sperimentali (sia in vitro sia in vivo) e su rilievi clinico-epidemiologici (per es. l'associazione tra difetti congeniti del sistema immunitario e rischio di crescita neoplastica) che comunque evidenziano la presenza di correlazioni significative tra l'insorgenza di alcune neoplasie e la capacità, per queste ultime, di adottare sistemi di escape (evasione) nei confronti della sorveglianza immunitaria. L'acquisizione di nuove conoscenze sulle cellule dell'immunità nell'uomo e negli animali da esperimento e gli sviluppi delle biotecnologie hanno consentito di elaborare nuovi modelli sull'i. dei tumori, e ne sono derivate applicazioni cliniche di notevole interesse.
In generale risulta critica la possibilità di stimolare una risposta nei confronti della cellula neoplastica in tempi rapidi, in modo che il bersaglio tumorale venga colpito precocemente, prima di assumere dimensioni fisiche tali da rendere non realistica la sua eliminazione per via naturale. D'altro canto esistono studi su animali che dimostrano come la riduzione chirurgica della massa neoplastica consenta, entro certi limiti, di stimolare una risposta secondaria efficace verso definiti antigeni tumorali. Il tentativo di risolvere il problema dell'i. dei tumori segue alcune linee di approccio che tengono conto sia dell'etiopatogenesi di alcuni tumori (virus, oncogèni, cofattori) sia della fase nella quale il tumore può essere aggredito. Per es., il razionale di un vaccino antitumorale in corso di neoplasie già clinicamente diagnosticabili nasce dal fatto che alcune mutazioni geniche possono indurre trasformazioni molecolari associate al tumore. Poiché gli oncogèni o molecole regolatrici degli oncogèni sono coinvolti nelle fasi di proliferazione cellulare, è possibile che si abbiano mutazioni in grado di esprimere proteine o peptidi capaci di stimolare la risposta cellulo-mediata dei linfociti T.
Poiché i tentativi di immunizzazione con cellule tumorali o con antigeni purificati del tumore non hanno fornito dati incoraggianti, sono stati compiuti numerosi sforzi per amplificare la capacità di risposta immunitaria verso i tumori o per stimolare l'immunogenicità stessa delle cellule cancerose. Per es., un modello riguarda la possibilità di associare a cellule neoplastiche molecole dell'MHC in modo tale che l'espressione di MHC alloantigenico possa favorire una reazione verso gli antigeni tumorali. Altre linee di ricerca hanno ipotizzato l'elaborazione di molecole ibride, ottenute combinando varie caratteristiche di componenti diverse. Tra queste merita interesse l'associazione tra un anticorpo antitumorale e un superantigene (per superantigene si intende una particolare molecola, spesso di origine batterica, in grado di attivare linfociti T a prescindere dalla specificità del riconoscimento antigenico). Poiché la risposta cellulo-mediata sembra svolgere un ruolo critico nel controllo della crescita tumorale, il modello elaborato prevede che l'anticorpo riconosca l'antigene tumorale e che il superantigene a esso aggregato sia in grado di attivare il linfocita T, il quale attacca il superantigene come falso bersaglio e distrugge di conseguenza la cellula tumorale.
Sebbene la ricerca di un approccio vaccinale al trattamento dei tumori rappresenti una linea stimolante e ricca di potenziali sviluppi, altri progressi sono stati ottenuti ricorrendo all'impiego di molecole regolatrici della risposta immunitaria (citochine) che in vario modo interagiscono sulle cellule deputate al controllo della crescita neoplastica. Alcune di queste molecole hanno già avuto applicazione in clinica e rappresentano in ogni caso un modello applicativo in notevole espansione. Si tratta in particolare degli interferoni e delle linfochine.
Gli interferoni (IFN) furono scoperti da A. Isaacs e I. Lindemann nel 1957 e inquadrati nell'ambito delle sostanze antivirali. Nel corso delle ricerche su queste componenti della risposta ai virus sono stati identificati tre classi principali di IFN (α, β, γ). Gli IFNα e β reagiscono con un proprio recettore specifico, mentre l'IFNγ ha un altro tipo di recettore. Oltre all'attività antivirale sono conosciute per gli IFN un'attività antiproliferativa, una capacità immunomodulante ed effetti di inibizione su espressione di oncogèni cellulari. Il complesso delle interazioni tra IFN e sistema immunitario riguarda diverse sottopopolazioni linfocitarie e si esplica in rapporto alla dose, manifestandosi in forma positiva o negativa. In particolare si ricorda come funzioni citotossiche, attività macrofagica o correlata a cellule NK, e produzione di anticorpi possano dipendere dalla quantità di IFN somministrato e anche dalle modalità (timing) con le quali vengono attuati i protocolli di applicazione.
Un aspetto interessante riguardo all'uso degli IFN concerne anche la loro capacità di interferire sulla differenziazione cellulare. È probabile che la serie di effetti registrati nell'uso degli IFN nella terapia antitumorale dipenda dall'integrazione delle loro azioni di natura antiproliferativa e differenziativa esercitata sulle cellule tumorali. L'uso di IFNα-ricombinante è stato di particolare interesse in determinate forme di neoplasia: leucemia mieloide cronica (risposta obiettivamente documentabile in circa quattro quinti dei casi trattati, con migliori risultati nei soggetti non sottoposti a chemioterapia preventiva), micosi fungoide-sindrome di Sézary (forme proliferative di linfociti T a carattere neoplastico nel fenotipo T helper), Hairy Cell Leukemia (leucemia a 'cellule capellute' o tricoleucemia; in questa forma di leucemia a carico dei linfociti B sono stati ottenuti forse i migliori risultati terapeutici, dovuti probabilmente a una correzione indotta delle fasi di differenziazione cellulare piuttosto che ad altri effetti di natura soppressiva del fenomeno proliferativo), mieloma multiplo (con buon decremento del rischio di recidive), sarcoma di Kaposi (soprattutto in corso di AIDS, il sarcoma di Kaposi viene ben controllato grazie a un'azione antiproliferativa dell'IFN). Gli studi sul melanoma in stadio avanzato sono risultati più discutibili, sebbene siano segnalati alcuni successi. In alcune neoplasie particolarmente aggressive e comunque molto resistenti alla terapia antitumorale il progetto per l'uso di IFNα si è rivelato promettente, come nel caso del carcinoma renale metastatico. Aperto è il problema dell'uso dei vari IFN in associazione con altri farmaci immunomodulanti o antiblastici.
Nel corso degli anni Novanta un impiego sempre più interessante in campo oncologico è stato proposto per le linfochine. Tra queste un rilievo notevole ha assunto l'interleuchina 2 (IL-2, fattore di crescita e differenziazione dei linfociti T). Le conoscenze sul recettore per IL-2 (IL-2R) hanno consentito di capire meglio il meccanismo di azione di questa molecola. Sono note tre catene dell'IL-2R: α, β e γ. Il legame con la frazione γ dà il via alla partenza per il segnale che dalla membrana si dirige all'interno della cellula. Ne deriva la fosforilazione della tirosinfosfochinasi p56lck e della serina/tirosina-chinasi (p72-74). Varie cellule possiedono il recettore per IL-2 e pertanto il ruolo polivalente di questa interleuchina si esercita sulle capacità proliferative, regolative e differenziative di linfociti T, cellule NK, linfociti B. L'integrarsi dei segnali mediati da IL-2 e da altre linfochine porta ai risultati funzionalmente specifici per le cellule coinvolte nei meccanismi di risposta.
L'interesse dell'IL-2 si è generato dall'osservazione che in coltura i linfociti prelevati dal sangue periferico possono essere attivati e già dopo 2-3 giorni esercitano funzioni antitumorali. Le cellule linfocitarie attivate da IL-2 sono state definite LAK (Lymphokine-Activated Killer cells). Queste cellule hanno un fenotipo caratteristico in quanto risultano CD3- (non linfociti T), CD16+ (cellule NK). Somministrando assieme LAK e IL-2 si sono osservati buoni risultati in animali da esperimento e altre osservazioni consentono di ottenere buoni risultati con dosi adeguate di IL-2, senza necessariamente aggiungere LAK al sistema terapeutico. L'IL-2 è commercializzata per il trattamento del carcinoma renale con metastasi. Poiché anche una parte di linfociti T può essere stimolata da IL-2, l'attenzione si è rivolta a questo tipo di cellule potenzialmente dotate di TCR (T Cell Receptor) specifico adeguato al riconoscimento dell'antigene tumorale. Di particolare interesse sono stati gli studi che hanno utilizzato cellule linfocitarie T infiltranti i tumori e pretrattate con IL-2 per amplificare la loro efficacia antitumorale. Si parla in questo caso di una popolazione TIL (Tumor Infiltrating Lymphocytes). Gli schemi operativi di questo sistema terapeutico risultano di non estensiva applicazione, ma hanno permesso di riproporre sotto altra luce l'adozione di una forma alternativa di vaccinazione antitumorale, ricorrendo a sistemi di identificazione dell'espressione genica dell'antigene tumorale sul quale l'efficacia della risposta T può essere dimostrata (infatti sarebbe del tutto inutile ricorrere a vaccinazioni con cellule che non esprimono in modo adeguato l'antigene tumorale riconoscibile dal sistema immunitario).
Sebbene la risposta anticorpale non sembri in generale efficace nel controllo della crescita neoplastica, un ulteriore campo di prospettive per l'i. dei tumori consiste nell'applicazione delle biotecnologie che consentono di produrre anticorpi monoclonali antitumorali. Il problema si è andato chiarendo con l'evidenza che l'azione degli anticorpi può risultare efficace non tanto per mezzo di sistemi di citotossicità correlata al complemento, quanto nell'ambito delle reazioni ADCC (Antibody Dependent Cell-mediated Cytotoxicity).
La sostanza dell'approccio è semplice: produrre anticorpi monoclonali verso bersagli predefiniti (antigeni tumorali specifici o associati alla crescita neoplastica) può facilitare l'uso di un sistema nel quale l'anticorpo diventa il vettore di una molecola citotossica che raggiunge il bersaglio, evitando di colpire o coinvolgere in modo significativo le cellule sane. Sono stati proposti vari coniugati (uso di farmaci citotossici, tossine, radioisotopi), tuttavia non sempre l'efficacia in vitro si mantiene in vivo, dove peraltro alcuni vantaggi 'topografici' non sempre sono esenti da effetti collaterali indesiderabili.
Tuttavia, malgrado le difficoltà di questa linea di studi, sembra ragionevole ipotizzare che una migliore conoscenza di antigeni tumorali critici possa costituire la base per una futura ed efficace applicazione dell'i. antitumorale mediata da anticorpi monoclonali.
bibliografia
C. De Simone, E. Jirillo, Immunomodulazione e immunomodulatori, in Enciclopedia Medica Italiana, Agg. ii, Firenze 1991, ad vocem;
C. De Simone, E. Jirillo, Immunoterapia delle neoplasie, in Enciclopedia Medica Italiana, Agg. ii, Firenze 1991, ad vocem;
R.T. Dorr, Interferon-α in malignant and viral disease, in Drugs, 1993, 45, pp. 177-211;
R.M. Blaese, K.W. Culver, A.D. Miller et al., T lymphocyte-directed gene therapy for ADA-SCID: initial trial results after 4 years, in Science, 1995, 270, pp. 475-80;
P.S. Mattila, The actions of cyclosporin A and FK-506 on T-lymphocyte activation, in Biochemical society transaction, 1996, pp. 45-49;
M. Ballow, R. Nelson, Immunopharmacology: immunomodulation and immunotherapy, in The journal of the American medical association, 1997, 278, pp. 2008-17;
H.A. Bruining, F.H. de Jong, Drug therapy: corticosteroid therapy in severe illness, in New England journal of medicine, 1997, 337, pp. 1285-93;
C. Law, M. Marcaccio, P. Tam et al., High-dose intravenous immune globulin and the response to splenectomy in patients with idiopathic thrombocytopenic purpura, in New England journal of medicine, 1997, 336, pp. 1494-99; W.M. McDonnell, F.K. Askari, Immunization, in The journal of the American medical association, 1997, 278, pp. 2000-07;
S. Shu, G.E. Plautz, J.C. Krauss et al., Tumor immunology, in The journal of the American medical association, 1997, 278, pp. 1972-81.