Immunologia
Immunologia
L' i. è la disciplina che studia la risposta immunitaria, cioè il complesso fenomeno biologico attraverso il quale un organismo risponde a un segnale di pericolo, attaccando e distruggendo strutture riconosciute come pericolose, siano esse patogeni che provengono dall'esterno, o cellule tumorali generate nell'organismo stesso. Per i precedenti si rinvia a immunità nel XVIII vol. dell'Enciclopedia Italiana e nelle App. II -V.
Al di là delle sue formidabili applicazioni in terapia e prevenzione, l'i. ha svolto costantemente un ruolo pilota nella ricerca biologica, ruolo che ha mantenuto anche negli ultimi decenni del 20° secolo. All'inizio degli anni Ottanta, G. Edelman - vincitore del premio Nobel nel 1972 per le sue ricerche sulla struttura degli anticorpi - tenne una conferenza dal titolo Bees in the bonnet (traducibile forse come "Un alveare in testa"), basata sulle analogie che esistono tra sistema immunitario, sistema nervoso e uno sciame di api. Ai tre sistemi sono richieste prestazioni straordinarie, quali la capacità di riconoscere e discriminare, rispondere prontamente, ricordare l'evento. Per far fronte a queste esigenze, si sono evolute precise suddivisioni funzionali tra i componenti di ciascun sistema: come in ogni società organizzata, i singoli, pur altamente specializzati, devono però rimanere in costante dialogo con gli altri, e obbedire a strette gerarchie.
Il ruolo pilota dell'i. nella ricerca è dovuto a due fondamentali fattori: l'intrinseco interesse del sistema, e la sua accessibilità a manipolazioni in vitro. Da molti decenni è possibile coltivare le cellule del sistema immunitario, creando situazioni sperimentali che ne mimano con buona approssimazione il comportamento. Ciò ha condotto alla rottura dell'approccio fenomenologico, permettendo agli scienziati di comprendere alcuni dei meccanismi fini che sottendono al funzionamento del sistema immunitario. Inoltre, l'approccio meccanicistico che ha caratterizzato gli anni Ottanta e Novanta trae ragione dalle collisioni che l'i. ha avuto con altre discipline in rapida espansione: la biologia molecolare, la biologia cellulare, la strutturistica e l'embriologia.
L'incontro tra immunologia e biologia molecolare e la soluzione del problema GOD (Generation Of Diversity)
Forse il caso più eclatante di collisioni sinergiche si è avuto intorno a uno dei problemi centrali dell'i., la generazione della diversità. Come è possibile generare un repertorio di anticorpi praticamente infinito (siamo in grado di produrre anticorpi contro sostanze che non esistono in natura) quando il numero dei nostri geni è limitato? L'acronimo anglosassone di questo problema, GOD, ci fa subito capire come la sua comprensione abbia rappresentato una delle sfide più importanti della scienza di questo secolo. La sua soluzione è venuta dall'incontro tra i. e biologia molecolare, verificatosi a metà degli anni Settanta, quando S. Tonegawa, un giovane virologo con una notevole conoscenza della biologia molecolare allora in fase esplosiva, venne invitato da N. Jerne a Basilea, nel tempio dell'i. tradizionale europea. Fu Tonegawa a comprendere che i geni delle cellule che producono anticorpi sono diversi da quelli trasmessi per via germinale. E fu osservato, per la prima volta, che il genoma ereditato da ciascun individuo non è immutabile nell'arco della sua esistenza, ma, almeno per ciò che riguarda i linfociti, va incontro a un rimaneggiamento.
Dopo Tonegawa, la presenza di biologi molecolari negli istituti di i. divenne sempre più frequente: furono clonati i geni per molte molecole chiave del sistema immune, i recettori per l'antigene dei linfociti T e delle cellule NK (Natural Killer), i costituenti del complesso maggiore di istocompatibilità (MHC, Major Histocompatibility Complex), le citochine, molti marcatori delle sottopopolazioni linfocitarie ecc. L'identificazione dei geni ha permesso di spiegare molte patologie, e in particolare alcune immunodeficienze ereditarie, (v. immunopatologia, App. V e in questa Appendice) tra cui la deficienza di adenosina deaminasi (ADA), una malattia rara ma fatale, che costringe i bambini a vivere in una 'bolla di vetro', e che è stata oggetto dei primi tentativi di terapia genica (v. terapia genica, App. V), coronati da un parziale successo.
Biologia cellulare e strutturale nel campo dell'immunologia
Dopo la biologia molecolare, fu la biologia cellulare a fare il suo ingresso innovatore nell'immunologia. Verso la metà degli anni Ottanta, lo sviluppo delle tecniche di microscopia confocale e videoimaging, insieme alla possibilità di isolare, modificare e reintrodurre i geni in cellule in coltura, diede grande impeto alla comprensione di domande fondamentali quali, per es., quelle relative a come le cellule disegnino e mantengano la loro architettura, o come esse indirizzino proteine e altre molecole ai vari distretti che le compongono. Il sistema immunitario fornì ai biologi cellulari sistemi sperimentali formidabili. La comprensione di come le molecole del sistema maggiore di istocompatibilità vengono ripartite nella cellula, e delle basi molecolari della presentazione dell'antigene hanno rappresentato tappe fondamentali per tutta la biologia, costituendo uno dei principali argomenti della letteratura scientifica.
Alla fine degli anni Ottanta fu la biologia strutturale a fare ingresso nell'i. cellulare. Può sorprendere che si sia dovuto attendere tanto, visto che quasi trent'anni prima M.F. Perutz, sir J.C. Kendrew, J.D. Watson, F.H. Crick e M.H.F. Wilkins avevano ricevuto il premio Nobel per aver identificato la struttura dell'emoglobina e del DNA. Inoltre, la struttura tridimensionale degli anticorpi, liberi o legati ai rispettivi antigeni, fu identificata con relativa facilità, grazie alla disponibilità di proteine monoclonali ottenibili in grande quantità dal siero di pazienti affetti da mieloma e poi, grazie al lavoro di G.J.F. Kohler, C. Milstein e N.K. Jerne, dal sopranatante degli ibridomi (v. ibrido cellulare e monoclonali, anticorpi, App. V). Molecole come il recettore per l'antigene dei linfociti T e le molecole del complesso maggiore di istocompatibilità sono però proteine integrali di membrana, dotate di una regione idrofobica che ne permette l'ancoraggio nel doppio strato lipidico che separa le cellule dal mondo esterno. Queste zone idrofobiche resero a lungo problematico l'ottenimento di cristalli e la successiva analisi strutturale. Lo sviluppo delle tecniche di cristallizzazione permise finalmente nel 1987 a P.J. Bjorkman, J.L. Strominger e D.C. Wiley di chiarire la struttura delle molecole di Classe I del sistema maggiore di istocompatibilità. Il sistema MHC nel topo è contenuto nel cromosoma 17, mentre l'analogo sistema HLA (Human Leukocyte Antigen) è contenuto nel braccio corto del cromosoma 6. Apparve subito chiaro che nella zona di contatto tra catena pesante e β₂ microglobulina, si veniva a formare una tasca. Questa non era vuota, bensì occupata da materiale proteico eterogeneo: i frammenti di antigene presentati. Come si vedrà meglio più avanti, erano state finalmente comprese le basi molecolari della presentazione dell'antigene, un fenomeno che, dai pionieristici lavori di R. Zinkernagel e P. Doherty nel 1976, aveva catalizzato l'attenzione di molti ricercatori.
Risposta immunitaria
Tutto ciò che attrae l'attenzione del sistema immunitario, scatenando una risposta, viene definito antigene. Emerge subito il punto chiave del sistema immunitario: la necessità di distinguere tra i normali componenti dell'organismo (self) e le molecole estranee (non-self). L'importanza di questa discriminazione è testimoniata dalle malattie autoimmuni, dove componenti del self diventano antigeni e bersaglio di aggressione. Esistono due tipi di risposte immunitarie, naturale (o innata) e adattativa: pur essendo espletate da cellule che originano dal midollo osseo, esse presentano fondamentali differenze tra loro.
Immunità naturale. - È la più ancestrale, essendo presente già negli invertebrati, ed è composta da cellule (granulociti, monociti-macrofagi) e da proteine solubili (complemento, difensine), che hanno la caratteristica di essere sempre predisposte all'attacco dei patogeni. Granulociti polimorfonucleati e monociti-macrofagi, infatti, circolano nel sangue come cellule mature, e sono in grado di migrare in un tessuto infettato, richiamati dal processo infiammatorio locale, dove attaccano i patogeni in maniera relativamente aspecifica. Naturalmente, le cellule che sostengono la risposta innata devono essere in grado di discriminare in qualche modo tra self e non-self. Per farlo esse utilizzano sistemi di riconoscimento poco sofisticati, basati per es. sulla diversa composizione glicolipidica della membrana dei patogeni. La scarsa specificità è dovuta alla mancanza sulla loro membrana di recettori specifici per gli antigeni, quali quelli sviluppati dalle cellule che sostengono l'immunità adattativa. Granulociti e macrofagi svolgono la loro funzione inglobando indistintamente, mediante fagocitosi, tutti gli antigeni particolati, che vengono distrutti al loro interno.
Un caso particolare nella risposta immunitaria naturale è dato dalle cellule NK, la cui funzione principale è quella di uccidere cellule infettate da virus o cancerose. Le cellule NK, pur riconoscendo bersagli cellulari ad ampio spettro, non sono capaci di fagocitosi. È importante notare che alcune delle molecole riconosciute dai recettori NK sono molecole del self, per es. componenti del complesso maggiore di istocompatibilità. Le cellule NK sembrano riconoscere quindi alterazioni nella cellula bersaglio non necessariamente causate da patogeni, e giocano quindi un ruolo chiave nella sorveglianza immunologica contro i tumori. Esse esprimono sulla loro superficie due tipi fondamentali di recettori in grado di discriminare tra cellule sane o patologiche: recettori che inibiscono l'attività citotossica delle cellule NK (o KIR, Killer Inhibitory Receptors), e recettori che, al contrario, attivano l'attività citotossica (o KAR, Killer Activatory Receptors). Lo stato funzionale della cellula NK dipende quindi dall'equilibrio tra segnali positivi e negativi. La comprensione dettagliata della risposta NK è una delle frontiere dell'i., anche in vista di possibili manipolazioni a scopo terapeutico in oncologia e nelle infezioni virali.
L'immunità naturale è anche composta da molecole solubili, rappresentate principalmente dal complemento e dalle difensine, che costituiscono forse il sistema più antico di difesa contro le intrusioni. Il complemento è formato da diverse proteine che circolano nel sangue e che, in certe condizioni, si attivano a cascata, fino a depositarsi in forma attiva sulla superficie delle cellule o dei microrganismi bersaglio, che vengono uccisi per lisi. Oltre all'effetto litico, la deposizione di complemento facilita la cattura dei microrganismi da parte di granulociti e macrofagi, mediante un meccanismo di fagocitosi chiamato opsonizzazione. Le difensine, presenti già negli insetti, sono costituite da diverse famiglie di proteine che esercitano un'azione litica diretta sui batteri. Dunque, entrambi i bracci (cellulare e umorale) che compongono l'immunità naturale cooperano, per migliorare l'efficacia della risposta. In animali privi di meccanismi immunologici adattativi, l'immunità naturale è in grado di contenere inizialmente le infezioni batteriche. Successivamente però, in assenza della subentrante immunità adattativa, i patogeni sfuggono al controllo, e si diffondono nell'organismo. Una caratteristica saliente delle cellule immunitarie naturali è che queste hanno una vita breve, e muoiono dopo aver eliminato l'antigene. Il braccio naturale dell'immunità non conserva quindi memoria dell'antigene, ma interviene ogni volta ex novo, utilizzando cellule neoformate.
Immunità adattativa. - È quella sostenuta dai linfociti. Anch'essi si originano dal midollo osseo, ma vanno incontro a un elaborato processo di differenziamento, attraverso il quale arrivano a esprimere sulla loro superficie recettori altamente specializzati e dotati di finissima specificità per gli antigeni. I linfociti sono divisi in due classi: i linfociti T maturano nel timo (da cui il nome di Timo-derivati), mentre i linfociti B maturano nel midollo osseo (negli uccelli maturano in una particolare appendice dell'intestino, la borsa di Fabricius, da cui il nome di Borsa-derivati). Un uomo adulto possiede circa 10¹² tipi (cloni) di linfociti diversi, ciascuno dei quali esprime un particolare recettore per l'antigene. A differenza delle cellule dell'immunità naturale, i linfociti T e B non sono sempre pronti a riconoscere l'antigene, ma devono andare incontro a un processo di attivazione e differenziamento (adattamento), che avviene negli organi linfatici secondari (milza e linfonodi). Durante questo processo, vengono selezionati quei linfociti che esprimono i recettori in grado di riconoscere l'antigene. I linfociti così selezionati si attivano e si dividono. Ciascuno di essi dà luogo a un 'clone' di cellule che esprimono tutte lo stesso recettore.
La specificità antigenica dei singoli cloni è alla base della teoria della selezione clonale, uno dei cardini dell'i. moderna, formulata sul finire degli anni Cinquanta da sir F.M. Burnet, premiato con il Nobel nel 1960. I linfociti B, selezionati dall'antigene, si differenziano in plasmacellule, che lasciano gli organi linfatici e ritornano nel midollo osseo. Le plasmacellule sono vere e proprie fabbriche di anticorpi: ciascuna di esse è in grado di rilasciarne migliaia ogni secondo. Gli anticorpi circolano liberamente nell'organismo, riuscendo a neutralizzare a distanza gli antigeni. La breve vita delle plasmacellule spiega come la risposta anticorpale sia limitata nel tempo. Alcuni linfociti selezionati dall'antigene si differenziano però in cellule a lunga vita, le cellule della memoria immunitaria. Grazie a queste cellule l'immunità contro una certa malattia dura per tutta la vita.
I linfociti T, espansi clonalmente dall'antigene, lasciano gli organi linfatici secondari, e migrano negli organi sede d'infezione, richiamati dal processo infiammatorio. A questo livello, essi svolgono la loro funzione effettrice attraverso il recettore specifico per l'antigene (o TCR, T Cell Receptor). A differenza degli anticorpi, che possono essere prodotti in una forma solubile capace di agire a distanza, il recettore dei linfociti T è una proteina integrale di membrana. Pertanto, le risposte T linfocitarie richiedono la presenza in loco della cellula effettrice. Una quota consistente di linfociti T, selezionati e attivati da un antigene, muore a seguito di questo incontro. Tuttavia, una parte di queste cellule sopravvive e persiste nell'organismo per lungo tempo, conservando memoria per l'antigene.
L'immunità adattativa si articola quindi in cicli di espansione e contrazione di cloni di linfociti, in risposta a un riconoscimento antigenico specifico, ed è caratterizzata dalla generazione di linfociti capaci di conservare memoria della battaglia contro un certo antigene, proteggendo a lungo dal patogeno.
Riconoscimento antigenico
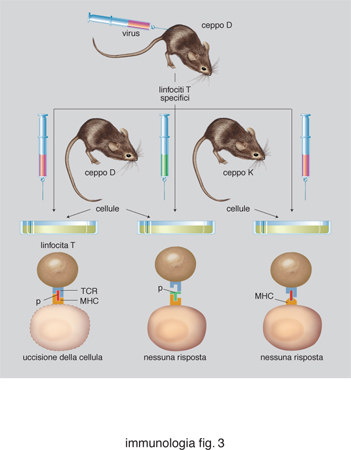
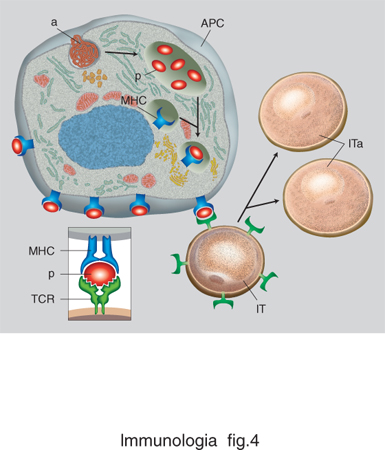
Esiste una fondamentale differenza tra il riconoscimento antigenico da parte dei linfociti B e T. I primi riconoscono antigeni solubili, principalmente nella loro forma nativa (non denaturata). Gli anticorpi possono riconoscere antigeni di varia composizione biochimica: proteine, carboidrati, ormoni steroidei, lipidi ecc. Il TCR, al contrario, riconosce antigeni proteici denaturati e degradati (o processati) in sequenze lineari brevissime, chiamate peptidi, solo quando questi sono associati a (o presentati da) molecole del MHC. Questa interazione molecolare è alla base del fenomeno della restrizione della risposta cellulare. Nel 1976, P. Doherty e R. Zinkernagel notarono che i linfociti T di un certo ceppo di topolini, immunizzati contro un determinato virus, sono in grado di riconoscere quel virus solo quando questo ha infettato cellule provenienti da topolini geneticamente identici. Il fenomeno della restrizione, una scoperta premiata con il Nobel nel 1996, rappresenta il fulcro di tutta la risposta immunitaria. La restrizione del riconoscimento T è basata su una interazione fra tre molecole: il TCR, espresso da un singolo clone di linfociti T, la molecola MHC, espressa da una cellula che contiene l'antigene, e il peptide antigenico, che si associa saldamente alla molecola MHC (fig. 3). Il TCR riconosce quindi un complesso bimolecolare, composto da MHC e peptide (fig. 4). Gli antigeni di natura proteica vengono ridotti a frammenti peptidici di lunghezza variabile dagli 8 ai 20 aminoacidi, a seguito di un processo di degradazione intracellulare chiamato processamento dell'antigene. Le molecole MHC sono quindi dei recettori per peptidi, e hanno il compito di presentare continuamente al sistema immunitario un campionario delle proteine sintetizzate all'interno della cellula. A seguito di un'infezione virale nuove proteine vengono sintetizzate, e nuovi peptidi presentati dalle molecole MHC esposte alla superficie della cellula. I linfociti T sono tolleranti ai peptidi del self, ma non ai nuovi peptidi che compaiono nelle cellule infettate da virus o da patogeni intracellulari. Alcuni di essi noteranno questa differenza, e si daranno da fare per eliminare le cellule che esprimono un campionario di peptidi diversi. In questo modo eventuali anomalie patologiche possono venire segnalate in tutti i tessuti dell'organismo. Non a caso, le molecole MHC vengono espresse su tutte le cellule dell'organismo, con l'eccezione di oociti e spermatozoi. In queste cellule il processo di ricombinazione del patrimonio genetico genera fisiologicamente nuovi peptidi, non necessariamente patologici.
Non sorprende che le molecole MHC presentino un notevole grado di polimorfismo (cioè eterogeneità) a livello di popolazione. Maggiore è il polimorfismo, maggiori sono le possibilità che vi siano individui in grado di 'presentare' un certo peptide e pertanto di rispondere a un'infezione. Nel corso dei secoli, la pressione selettiva esercitata dai vari agenti patogeni ha selezionato in popolazioni diverse l'espressione di tipi diversi di molecole MHC (dette alleli): per es., le tribù indie amazzoniche esprimono alleli MHC diversi dai caucasici dell'Europa occidentale e dell'America Settentrionale, poiché evidentemente sono state esposte alla pressione selettiva di agenti patogeni diversi. A differenza del TCR e delle immunoglobuline (Ig), la cui enorme variabilità è dovuta a un processo molecolare che avviene a livello somatico, diverso da individuo a individuo, la variabilità delle molecole MHC è determinata a livello genetico, e viene quindi trasmessa dai genitori ai figli, che ne ereditano le caratteristiche.
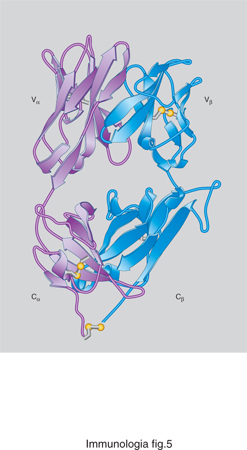
Come è stato anticipato, il fenomeno della restrizione per MHC del riconoscimento T è posto al centro della risposta immunitaria. La soluzione molecolare del problema della restrizione è stata ottenuta grazie all'apporto della cristallografia. Con l'utilizzazione di tecniche di ingegneria genetica, sono state prodotte molecole MHC e TCR solubili, cioè svincolate dalla membrana cellulare, che sono state co-cristallizzate in presenza del peptide specifico. L'analisi della struttura dei cristalli dei complessi trimolecolari ha rivelato che le molecole MHC formano sulla superficie di contatto con il TCR una piattaforma allungata, delimitata sui due lati lunghi da due catene di aminoacidi a forma elicoidale. Viene generata così una specie di nicchia o tasca (in ingl. groove), all'interno della quale si lega il peptide. La struttura ricorda in un certo senso un hot-dog: le due fette di pane sono le eliche della molecola MHC, mentre il salsicciotto centrale è costituito dal peptide. La superficie esposta, composta dalle due eliche aminoacidiche e dal peptide compreso tra queste due, interagisce con le due regioni variabili del TCR. Il TCR è costituito da due catene, chiamate α e β (fig. 5), oppure γ e δ in un tipo di recettore meno rappresentato, ciascuna delle quali è suddivisibile in una porzione variabile (detta regione Vα, Vβ, Vγ ecc.), e una porzione costante (Cα, Cβ ecc.). La regione variabile è incaricata di legare il complesso MHC-peptide mentre la regione costante, saldamente inserita nella membrana plasmatica, trasduce all'interno del linfocita l'informazione dell'avvenuto incontro con l'antigene. La superficie generata dall'appaiamento di due regioni Vα e Vβ si adatta all'area formata da una certa coppia MHC-peptide.
Non sorprendentemente, il TCR ha una struttura globale simile a quella delle Ig, seppur con importanti differenze, dettate in primo luogo dalla necessità d'interagire con una molecola di restrizione MHC e non con un antigene solubile. Le Ig sono costituite da quattro catene: due catene pesanti (dette H, dall'ingl. heavy) e due leggere (dette L dall'ingl. light). Anche le catene H o L sono composte da una parte variabile, diversa da clone a clone, e da una regione costante, che si suddividono i compiti, rispettivamente riconoscimento dell'antigene (specifico per ciascun clone linfocitario) e funzione effettrice (comune a tutti i cloni). A differenza di quella del TCR, la porzione costante delle Ig viene sostituita nel corso della vita di una cellula B. Durante la maturazione della risposta anticorpale, grazie a un processo di ricombinazione genetica altamente regolato, diverse regioni costanti vengono montate sulla stessa regione variabile. La ricombinazione switch spiega come diversi isotipi Ig (IgM, IgD, IgG, IgA, IgE) vengano prodotti nel corso di successive esposizioni all'antigene. Ogni isotipo è dotato di particolari funzioni effettrici: per es., le IgM o IgG fissano il complemento, scatenandone l'attivazione, mentre le IgE si legano ai granulociti, scatenandone la degranulazione che causa la reazione allergica. I meccanismi molecolari del cambiamento isotipico delle Ig sono innescati da segnali extracellulari, parzialmente noti, rispondenti a precise esigenze del sistema immunitario, che adatta la scelta di un certo isotipo a un certo patogeno. Un'altra importante differenza tra TCR e Ig sta nel duplice ruolo delle Ig, prima come recettore per l'antigene sui linfociti e poi come molecola solubile effettrice rilasciata in circolo dalle plasmacellule. La produzione di due forme di anticorpo topologicamete distinte sfrutta un sofisticato meccanismo di rimaneggiamento degli RNA messaggeri.
Il processamento dell'antigene
È un complesso fenomeno biochimico, attraverso il quale un antigene proteico viene degradato a peptidi, che vengono quindi presentati nel contesto di molecole MHC per l'ispezione da parte di linfociti T. In questo modo, la cellula segnala al mondo esterno il suo stato antigenico, sia esso fisiologico o patologico. Una cellula infettata da un virus o da un batterio intracellulare esibirà così peptidi derivati da proteine dell'agente patogeno, dando modo ai linfociti T specifici di eliminare la cellula infettata e, di conseguenza, di eradicare l'infezione. Il processamento dell'antigene è quindi un evento fondamentale per la risposta immunitaria: non a caso, parecchi patogeni virali o batterici hanno elaborato strategie per interferire con l'apparato molecolare coinvolto nel processamento, cercando così di eludere la risposta immunitaria.
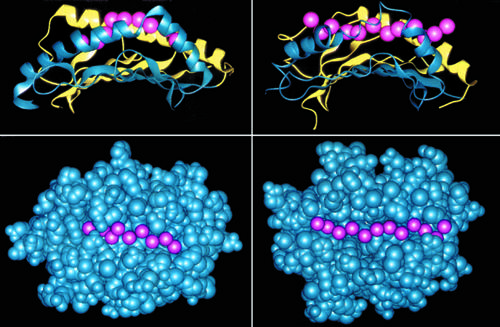
Possiamo dividere i complessi eventi biochimici che danno vita al processamento dell'antigene in due categorie principali, in relazione al tipo di molecole MHC che legano e presentano i peptidi. Esistono infatti due classi principali di molecole MHC: classe I e classe II, entrambe estremamente polimorfiche (fig. 6). La distinzione funzionale principale tra le molecole MHC di classe I e II risiede nella capacità delle prime di legare peptidi che originano da proteine intracellulari (peptidi endogeni), mentre le seconde si trovano associate a peptidi che provengono da proteine extracellulari (peptidi esogeni). I due meccanismi sfruttano sistemi degradativi diversi, funzionali al tipo di molecola MHC coinvolta. Gli antigeni endogeni vengono degradati nel citoplasma, grazie a strutture altamente specializzate, i proteasomi. I peptidi prodotti vengono veicolati dal citoplasma al reticolo endoplasmatico da specializzati trasportatori chiamati TAP (trasportatori associati alla presentazione). Curiosamente, i geni TAP sono localizzati nel cromosoma 6, molto vicini ai geni per le molecole MHC di classe i. Nel reticolo endoplasmico, i peptidi si associano alle molecole MHC di classe I nascenti, e il complesso così formato viene trasportato alla superficie cellulare. Gli antigeni esogeni vengono invece catturati dalle cellule, attraverso la formazione di strutture delimitate dall'invaginazione della membrana cellulare, dette endosomi. Gli endosomi si staccano dalla membrana cellulare, e si spostano all'interno della cellula per fondersi con altri organelli intracellulari ricchi di enzimi specializzati nella degradazione delle macromolecole, i lisosomi. Qui gli antigeni vengono frammentati in peptidi, che vengono legati dalle molecole MHC di classe ii, veicolate nello stesso compartimento da un sofisticato sistema di smistamento. La sfida per il futuro è capire i dettagli biochimici più fini del processamento, per poter interferire in senso positivo o negativo su di esso, in modo da condizionare l'esito della risposta immunitaria.
Ontogenesi dei linfociti
La generazione (ontogenesi) dei linfociti T e B maturi è un complesso processo di selezione, che avviene rispettivamente nel timo o nel midollo osseo. Questo processo selettivo svolge una duplice funzione: a) la 'educazione' dei linfociti a riconoscere antigeni estranei (o non-self) attraverso il loro recettore; b) l'eliminazione dei linfociti autoreattivi, cioè in grado di riconoscere e aggredire cellule dello stesso organismo. Le conoscenze sulle fasi precoci del differenziamento dei linfociti T e B e sulla natura del precursore midollare comune alle due popolazioni sono ancora piuttosto vaghe, mentre meglio noti sono i processi di maturazione dei linfociti già chiaramente riconoscibili come T o B. Si tratta di un settore di studi che ha avuto un enorme impulso negli anni Novanta, grazie all'intersezione tra i. ed embriologia sperimentale. In particolare, lo sviluppo di topi transgenici, il cui genoma è manipolato in modo da eliminare un certo gene o, al contrario, in modo da sovraesprimerlo selettivamente in certi tessuti, ha permesso di analizzare fenomeni biologici altrimenti troppo piccoli per essere misurati. In questi modelli sono state ricostruite le tappe salienti del processo 'educativo' dei linfociti. I linfociti T immaturi che migrano nel timo (detti timociti) non esprimono ancora un recettore per l'antigene. Nel microambiente timico, la compresenza di particolari fattori di crescita e contatti intercellulari inducono il riarrangiamento ordinato dei geni che codificano per il TCR. I meccanismi molecolari che sottendono al riarrangiamento dei recettori T e delle Ig sono molto simili, a parte alcuni dettagli nelle sequenze coinvolte nella escissione o nella giunzione. Alcune proteine coinvolte sono espresse in maniera specifica dai linfociti, altre si trovano espresse anche da altri tessuti, e fanno parte di un più generale sistema di controllo dell'integrità del DNA cellulare. Il riarrangiamento dei geni del TCR e delle Ig sembra rappresentare una versione specializzata del meccanismo attraverso il quale i pezzi danneggiati del DNA di una cellula possono essere escissi, per ripristinare la sequenza originale. Sia nelle cellule B sia nelle cellule T, la costruzione di un recettore per l'antigene implica la fusione di tre frammenti - V, D e J - originariamente distanti fra loro. Esistono un centinaio di frammenti V, alcune dozzine di geni D, e 5 o 6 geni J. Dalla ricombinazione casuale si può generare un vasto assortimento di segmenti VDJ. Nel processo di fusione, vengono inserite alcune sequenze casuali, non codificate nel genoma (le sequenze N), che amplificano sensibilmente il repertorio di regioni variabili. Inoltre, un lungo tratto del genoma viene rimosso per avvicinare il nuovo gene VDJ al gene codificante per la porzione costante (C). In questo modo, un processo stocastico permette a ogni linfocita di riarrangiare un recettore per l'antigene (TCR o Ig) diverso. Dapprima saggi genetici, e più recentemente saggi biochimici, hanno permesso di definire con precisione sia l'ordine delle fasi di escissione e di giunzione dei filamenti di DNA, sia l'anatomia delle sequenze del DNA coinvolte nella rottura o nella giunzione. È chiaro che questo sofisticatissimo sistema evolutosi per generare variabilità è intrinsecamente soggetto a creare geni 'difettosi'. Si sono pertanto coevoluti meccanismi che consentono alla cellula di verificare rapidamente se il prodotto della ricombinazione soddisfa o meno le esigenze del sistema. Solo se la risposta è affermativa la cellula si impegna nella ricombinazione successiva; per es., i linfociti B iniziano il loro processo differenziativo riarrangiando i geni delle catene pesanti. Solo se il riarrangiamento ha avuto successo, si procede in modo analogo per i geni delle catene leggere. Per prevenire la generazione di linfociti privi di un recettore funzionale, sicuramente inutili e potenzialmente dannosi, l'inizio dei processi di ricombinazione genica si accompagna all'accensione di un programma di morte cellulare. Solo le cellule che ricevono un segnale positivo, generato dalla sintesi del componente in corso di riarrangiamento, sfuggono alla morte programmata (apoptosi): v. cellula in questa Appendice.
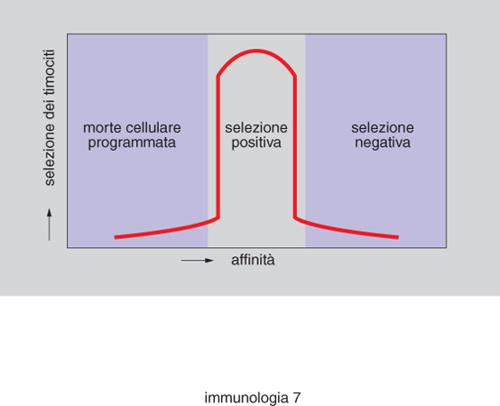
A seguito del riarrangiamento dei geni che codificano per il TCR, il timocita esprime sulla sua membrana un recettore per l'antigene. Anche in questo caso, la sopravvivenza dei linfociti T immaturi è funzione dell'affinità del legame tra il TCR e i complessi MHC-peptide (self) presenti sulla superficie di cellule non linfoidi che si trovano nel timo. Se il TCR espresso da un timocita ha un'affinità troppo bassa per uno qualsiasi dei complessi MHC-peptide presenti sulle cellule timiche, il timocita non riceverà lo stimolo necessario alla sua sopravvivenza. Se l'affinità è invece intermedia, l'interazione tra TCR e complessi MHC-peptide genera un segnale di sopravvivenza (selezione positiva). Durante il processo di selezione positiva, i linfociti imparano a riconoscere le molecole MHC presenti nell'organismo, dando inizio alla restrizione del riconoscimento T. Nel processo di selezione positiva potrebbero generarsi cloni linfocitari autoreattivi, capaci di aggredire componenti del self che presentino quella combinazione di peptide e MHC. È necessaria quindi anche una selezione negativa. Quei linfociti il cui TCR ha affinità troppo alta per i complessi MHC-peptide del self riceverà un segnale che ne causa la morte (fig. 7). I linfociti T potenzialmente autoimmuni vengono in questo modo eliminati durante la loro maturazione, e non possono raggiungere gli organi linfatici periferici. Globalmente, quindi, il timo dà vita al processo detto di tolleranza centrale, vale a dire quel meccanismo per cui la popolazione di linfociti T che lascia il timo viene resa tollerante verso i tessuti che troverà nella periferia, a seguito dell'eliminazione fisica dei linfociti autoimmuni.
Anche i linfociti B vanno incontro a un processo di 'educazione', che avviene nel midollo ed è per ora meno conosciuto di quello T. Nel caso dei linfociti B, le immunoglobuline non sono soggette alla restrizione MHC, per cui nella selezione positiva dei linfociti B non si può invocare un ruolo per l'affinità delle Ig per molecole MHC. Esistono probabilmente altri ligandi per le Ig espresse dai linfociti B immaturi, di natura ancora sconosciuta, che permettono ai linfociti B di sopravvivere (selezione positiva), o di essere eliminati se potenzialmente autoimmuni (selezione negativa). Modelli animali transgenici hanno permesso di dimostrare che, in una situazione sperimentale creata artificialmente, anche la selezione positiva e quella negativa dei linfociti B sono basate rispettivamente su una bassa e un'alta affinità d'interazione tra le Ig e il proprio ligando.
Tolleranza periferica
Un problema fondamentale della risposta immunitaria adattativa è l'induzione della tolleranza periferica, vale a dire del meccanismo per cui i linfociti T e B neoformati, che migrano dal timo o dal midollo negli organi linfatici secondari periferici, non attaccano i tessuti del proprio organismo (il cosiddetto self; v. anche immunità, App. V). La tolleranza centrale (timica), pur essendo efficace, non è perfetta, e permette quindi ad alcuni linfociti T, potenzialmente autoimmuni, di migrare in periferia. La comprensione dei meccanismi che conducono alla tolleranza periferica è di straordinaria importanza per il futuro della medicina, se si pensa ai tre aspetti della patologia a essa collegati: le malattie autoimmuni, il rigetto dei trapianti e l'eliminazione dei tumori. Ciascuna delle tre patologie è legata alla rottura della tolleranza (malattie autoimmuni e rigetto dei trapianti), o alla sua mancata rottura (eliminazione dei tumori). Modelli animali transgenici hanno permesso di identificare due meccanismi principali di induzione di tolleranza periferica. Il primo è chiamato di tollerizzazione attiva: i linfociti T sfuggiti alla selezione negativa nel timo, ma il cui TCR è dotato di un'affinità ancora alta per il self, vengono 'disattivati' a seguito di un riconoscimento sub-ottimale dei complessi MHC-peptide self, tale da impedirne l'espansione clonale. Il secondo meccanismo di tolleranza periferica è dovuto a 'ignoranza' dei linfociti per il self: i linfociti T autoimmuni vergini, quelli cioè che non hanno ancora mai incontrato l'antigene, non incontrano l'antigene, poiché questo è espresso in un tessuto nel quale i linfociti vergini non possono migrare, a causa del loro peculiare modo di ricircolazione tra linfatici e sangue.
Nelle malattie autoimmuni (v. immunopatologia, App. V e in questa Appendice), la tolleranza viene rotta e cloni autoreattivi prendono il sopravvento. Non è chiaro come ciò accada all'insorgere della malattia. Alcuni TCR potrebbero riconoscere molecole MHC complessate a peptidi esogeni (per es. di origine virale o batterica) che per caso siano simili a peptidi derivati da proteine endogene, non presenti nel timo, e quindi non tollerogeniche. In questo modo l'antigene esogeno potrebbe innescare una risposta T primaria, sostenuta in seguito dall'autoantigene contro il quale esiste reazione crociata.
Nel caso dei trapianti d'organo, si cerca di trapiantare organi tra soggetti che abbiano tutte le molecole MHC identiche tra loro. Purtroppo, esistono molto spesso altre differenze genetiche tra organo trapiantato e ricevente, che sono sufficienti a scatenare il rigetto del trapianto. Nei trapianti d'organi, quindi, bisogna cercare di indurre tolleranza periferica tra i linfociti del ricevente e l'organo trapiantato.
Nei tumori, infine, il sistema immunitario sembra ignorare la presenza di cellule neoplastiche in cui, a causa della trasformazione maligna, sono verosimilmente presenti proteine mutate, e quindi peptidi diversi dal self. Anche nel caso in cui il sistema riconosca per un certo tempo le cellule tumorali, queste riescono prima o poi a sfuggire all'attacco, per rendersi nuovamente invisibili alla risposta immune specifica. L'obiettivo dell'i. dei tumori è quindi quello di rompere lo stato di tolleranza verso gli antigeni tumorali.
A differenza dei linfociti T, per i quali esiste una stringentissima e duratura tolleranza periferica, per i linfociti B è più facile rompere la tolleranza, e produrre anticorpi autoimmuni. Probabilmente, questo è dovuto al peculiare meccanismo d'attivazione dei linfociti B. Un linfocita B può infatti andare incontro ad attivazione quando il suo recettore leghi con sufficiente affinità un antigene self, e contemporaneamente riceva un aiuto da parte di un linfocita TH (helper, v. oltre). Può accadere che un linfocita TH non specifico per antigeni del self, e quindi non intrinsecamente pericoloso, lo diventi fornendo aiuto a un linfocita B autoimmune con il quale è venuto a stretto contatto. Conoscere e manipolare i meccanismi della tolleranza periferica, in termini sia d'induzione sia di rottura, rappresenta uno dei traguardi più importanti che l'i. si è posta per il futuro.
La dinamica della risposta immunitaria
Una volta 'educati', i linfociti T e B lasciano il timo e il midollo osseo, e migrano nella periferia, circolando tra il sangue e gli organi linfatici secondari (milza, linfonodi, tonsille). I linfociti vergini possono persistere per molti anni nell'organismo, senza incontrare l'antigene e in assenza di divisioni cellulari. Quando i linfociti vergini incontrano l'antigene per la prima volta, essi danno inizio a una risposta primaria. L'inizio di una risposta immunitaria si avvale della stretta interconnessione esistente tra le cellule dell'immunità naturale e di quella adattativa. Infatti, i linfociti vergini non sono in grado di migrare negli organi periferici, specie nella cute o nelle mucose dell'albero respiratorio e intestinali, che sono le principali porte d'entrata dei patogeni. L'antigene deve quindi venir trasportato dai tessuti agli organi linfatici secondari. Incaricate di questo compito sono le cellule dell'immunità naturale, derivate dai monociti-macrofagi, specializzate nel catturare gli antigeni negli organi periferici per 'mostrarli' ai linfociti. Queste cellule vengono chiamate APC (Antigen Presenting Cells, cellule che presentano l'antigene) di tipo professionale, e sono quelle che in ultima analisi danno inizio a una risposta immunitaria primaria. In generale, la risposta immunitaria è preceduta da un processo infiammatorio, che si scatena nel sito di entrata dell'antigene. L'infiammazione è causata dal rilascio di mediatori solubili, le citochine primarie, da parte delle cellule del tessuto infettato o dei leucociti che si trovano nei tessuti. Le citochine primarie, a loro volta, inducono il rilascio di citochine secondarie, che hanno lo scopo di attirare nell'organo infiammato i leucociti che compongono la risposta immunitaria naturale, tra cui le APC. Una famiglia molto complessa di citochine, dette chemochine, sembra svolgere un ruolo primario nell'infiammazione, essendo responsabile del reclutamento di granulociti, macrofagi o linfociti. Il ruolo svolto da citochine e chemochine, nell'ambito dei processi infiammatori, rappresenta un importante argomento di ricerca per il futuro, a medio e a lungo termine, sia per la comprensione dei rapporti tra l'immunità naturale e quella adattativa, sia per ipotizzare strategie terapeutiche nelle malattie infiammatorie croniche o autoimmuni (v. immunità, App. V).
Durante le fasi acute del processo infiammatorio, i componenti cellulari e i mediatori solubili dell'immunità naturale limitano la diffusione dell'antigene, e ne facilitano contemporaneamente il riconoscimento da parte del braccio adattativo. Grazie all'azione delle citochine primarie e secondarie, rilasciate durante il processo infiammatorio, le APC si attivano e vanno incontro a un processo differenziativo che le rende competenti a catturare, processare e presentare gli antigeni e a migrare rapidamente negli organi linfatici secondari regionali.
Una volta arrivate nel linfonodo più vicino, le APC presentano i peptidi antigenici ai linfociti T, scatenando l'attivazione e l'espansione di quei cloni che esprimono i recettori specifici per quegli antigeni. Contemporaneamente, antigeni non denaturati, talvolta anche microrganismi interi, raggiungono il linfonodo e vengono riconosciuti dai recettori presenti sulla membrana dei linfociti B. In generale, lo scatenarsi di una risposta immune primaria B (o umorale) richiede per i linfociti B l'aiuto di un particolare gruppo di linfociti T, i linfociti TH (helper), anch'essi specifici per l'antigene e attivati in precedenza. L'espansione clonale T e B termina quando l'antigene è stato eliminato del tutto dall'organismo: è stato calcolato che un clone linfocitario vergine si espande di circa 100 volte durante una risposta primaria, per poi contrarsi di circa 10 volte al termine della risposta primaria. La quota di linfociti che persiste dopo la risposta primaria dà quindi vita alla memoria immunitaria.
La memoria immunitaria (detta anche risposta secondaria o protettiva) costituisce la base dell'immunità, cioè dello stato fisiologico per cui, per es., dopo una prima infezione con un virus o un batterio non ci si ammala una seconda volta, o non ci si ammala dopo la vaccinazione. La memoria immunitaria rappresenta forse lo stato fisiologico principale per la sopravvivenza della specie umana. La risposta secondaria è molto più veloce ed efficace di quella primaria. Innanzitutto, i linfociti memoria sono più numerosi, in quanto sono già andati incontro a un ciclo di espansione antigene-specifica. Inoltre, esistono anche differenze qualitative: nel caso dei linfociti B, la risposta secondaria si accompagna a un progressivo aumento dell'affinità degli anticorpi. I meccanismi che sottendono alla ipermutazione somatica dei geni delle Ig - oggetto di intensi studi - rappresentano una sorta di lotta contro il tempo in cui si impegna il sistema immune. Così come il patogeno muta per sottrarsi alle difese immunitarie, queste ultime mutano a loro volta, non solo per rispondere meglio, ma anche per prevenire le mosse del nemico. Come tutte le strategie difensive, anche questa non è scevra da pericoli. È possibile infatti che la mutazione generi un anticorpo capace di reagire con una proteina del self, dando luogo a una malattia autoimmune.
Nel caso dei linfociti T, le basi molecolari della maturazione della risposta sono meno chiare. Per es., è possibile che i linfociti della memoria esprimano delle molecole nuove rispetto a quelli vergini, che ne facilitano l'interazione con l'antigene, aumentando in tal modo l'efficienza della risposta.
Due scuole di pensiero si contrappongono nel tentativo di spiegare come viene mantenuta la memoria immunologica. La prima afferma che la memoria immunitaria è dovuta alla persistenza di piccoli depositi di antigene negli organi linfatici secondari, sufficienti a causare la continua stimolazione dei linfociti T e B specifici. La seconda invoca la persistenza dei linfociti, in assenza fisica dell'antigene. Sicuramente, i linfociti della memoria persistono in uno stato di apparente quiescenza, cioè in assenza di divisione cellulare. Come questo avvenga non è chiaro: probabilmente, lo stato di quiescenza dipende da un fenomeno attivo, con segnali che i linfociti ricevono continuamente attraverso recettori e ligandi non noti.
bibliografia
Fundamental immunology, ed. W.E. Paul, New York 1984, 1993³.
La nuova immunologia. L'io guarda sé stesso per conoscere il mondo esterno, a cura di F. Celada, Milano 1992. Ch.A. Janeway, P. Travers, Immunobiology. The immune system in health and disease, London-San Francisco-New York 1994, 1997³.