Immunologia e immunopatologia
Immunologia e immunopatologia
di Giorgio Cavallo, Antonio Ascenzi e Cesare Bosman, Jan G. Waldenström
IMMUNOLOGIA E IMMUNOPATOLOGIA
Immunologia generale
di Giorgio Cavallo
sommario: 1. L'immunità: a) significato e origine dell'immunità; b) la risposta immunitaria; c) gli antigeni; d) la formazione degli anticorpi: teorie istruttive e selettive. 2. Le immunoglobuline: a) struttura della molecola immunoglobulinica; b) eterogeneità delle immunoglobuline. 3. Dall'antigene all'anticorpo: a) destino dell'antigene e origine delle cellule linfatiche; b) i tre compartimenti del sistema linfatico; c) caratteristiche delle cellule linfatiche; d) cellule fagocitarie; e) i sistemi immunitari. 4. Tolleranza e immunogenicità: a) la tolleranza; b) la paralisi immunitaria. 5. Il complemento: a) evoluzione delle conoscenze; b) costituzione del complemento; sua attivazione; c) modalità d'azione del complemento; d) lisozima e batteriocidine. 6. Fagocitosi: a) cellule fagocitanti; b) malattia cronica granulomatosa dell'infanzia. 7. Ipersensibilità immunitaria: a) definizione e tipi dell'ipersensibilità; b) ipersensibilità immediata: anafilassi e allergia; c) ipersensibilità citotossica; d) ipersensibilità mediata da complessi immuni; e) ipersensibilità di tipo ritardato; f) immunologia dei trapianti: il rigetto e le terapie immunosoppressive. 8. Immunopatologia: a) immunodeficienze: agammaglobulinemia tipo Bruton, immunodeficienza atasso-teleangectasica, sindrome di Di George, agammaglobulinemia linfopenica del tipo svizzero; b) difetti della tolleranza: le malattie autoimmuni. □ Bibliografia.
1. L'immunità
a) Signjficato e origine dell'immunità
Nata nella seconda metà del XIX secolo come studio dei fattori di resistenza contro le infezioni, l'immunologia ha subito nel corso dell'ultimo trentennio un enorme sviluppo, sia per la profondità delle acquisizioni ottenute, che la pongono all'avanguardia della biologia molecolare, sia per l'espansione dei suoi interessi, che oggi coprono un campo larghissimo di discipline: dalla genetica alla zoologia, dalla patologia alla biochimica, alla terapia medica. In special modo per questi ultimi aspetti i risultati più recenti lasciano prevedere uno sviluppo ulteriore verso mete che fino a qualche anno fa sarebbero state inimmaginabili.
I fenomeni immunitari non si identificano con la sola resistenza alle infezioni, ma coinvolgono problemi biologici molto più vasti. Quando si consideri il pur limitato aspetto antinfettivo dell'immunità, appare chiaro che la resistenza si basa su proprietà complesse e molto articolate, che investono fattori individuali, di razza e di specie. Fra queste proprietà la più importante, quella che d'altra parte colpì anche l'attenzione dei primi osservatori, è costituita dalla natura specifica dell'immunità, come nel caso dell'immunità acquisita dagli individui che superano una malattia infettiva; verso questa e non verso altre malattie, anche se simili, si attua un processo di difesa che risulta in diversi casi altamente efficiente e che può, molto spesso, protrarsi per tutto il corso della vita. L'elemento fondamentale dei fenomeni immunitari è precisamente questa specificità che non coinvolge i soli agenti infettanti. Gli sviluppi ulteriori degli studi hanno modificato il primitivo concetto e oggi individuiamo nell'immunità in senso antinfettivo soltanto uno dei molteplici aspetti di un vasto complesso di fenomeni che si svolgono nei Vertebrati. Gli stessi processi che vengono messi in atto contro virus, batteri, miceti, protozoi costituiscono la reazione dell'organismo verso molecole diverse dalle proprie; essi quindi debbono considerarsi fra i mezzi più importanti che l'organismo possiede per preservare la propria specificità biochimica, e cioè per bloccare e quindi eliminare tutti gli elementi che non si identificano con i costituenti dei propri protoplasmi.
Le macromolecole, di cui i vari organismi sono costituiti, hanno struttura e configurazione proprie della specie biologica cui appartengono. Le differenze fra specie e specie dipendono, oltre che dalla composizione delle molecole elementari (per es., la sequenza degli amminoacidi in una proteina), anche dalla forma che in una determinata specie la macromolecola assume e dalla posizione che in essa occupano i vari gruppi chimici che la costituiscono, in special modo quelli situati alla superficie della molecola. Se una di queste molecole viene a trovarsi nell'interno di un organismo estraneo, quest'ultimo non la riconosce come propria e tende a eliminarla attraverso l'intervento di una serie di fattori e lo svolgimento di alcune reazioni che nel loro insieme costituiscono i meccanismi immunitari.
L'immunità pertanto dovrebbe essere considerata come un fenomeno protettivo e come tale venne inizialmente giudicata; l'effetto benefico che ne deriva fu attribuito alla comparsa, negli organismi che erano venuti a contatto con un agente di infezione, di un quid capace di neutralizzare la sostanza estranea. Questa ipotesi fu confermata nel 1890, quando E. A. Behring e S. Kitasato dimostrarono che l'immunità verso il tetano era dovuta alla comparsa, nel sangue degli animali vaccinati, di un fattore che neutralizzava la tossina elaborata dal Clostridium tetani; da quel momento gli studi immunologici si identificarono per lunghi anni con le ricerche su questa particolare sostanza elaborata durante il processo immunitario, che fu detta anticorpo.
Ma il concetto di immunità ha subito evoluzioni notevoli in quanto, a parte l'acquisizione della validità della risposta contro tutte le macromolecole eterogenee, ci si avvide ben presto che lo stesso concetto di protezione e di difesa aveva limitata validità, dato che i meccanismi che ne sono alla base possono arrecare danno agli organismi che li pongono in atto.
La formazione degli anticorpi, infatti, può anche dar luogo a esiti dannosi, così come nelle manifestazioni di ipersensibilità, il cui studio tende negli ultimi anni a confluire nella immunopatologia; questa comprende anche lo studio degli stati morbosi dipendenti dalla diminuita o aumentata proliferazione e dalla diminuita o aumentata attività delle cellule appartenenti al sistema immunocompetente, a quel sistema cellulare, cioè, cui si deve la produzione degli anticorpi.
Un'ulteriore espansione delle ricerche immunologiche è stata favorita dall'interesse di ricercatori di estrazioni le più diverse, fisici, chimici, genetisti, patologi, embriologi attratti da ragioni molteplici. La produzione di anticorpi, e più precisamente lo studio delle cellule che sono responsabili del fenomeno, costituisce un elegante modello per le ricerche sulla moltiplicazione cellulare; nei fenomeni immunitari le cellule immunocompetenti intervengono non soltanto producendo gli anticorpi, ma anche direttamente, sia su microbi sia su sostanze e cellule eterogenee di per sé non tossiche, e ciò ha avuto particolare rilievo relativamente al problema dei trapianti. Lo stesso attecchimento e l'evoluzione dei tumori maligni sono legati alla reazione immune. Gli embriologi e i biologi generali, inoltre, sono impegnati nello studio dei rapporti tra la risposta specifica e l'evoluzione.
Fra questi ultimi problemi uno dei più affascinanti è quello che riguarda l'origine dell'immunità nei Vertebrati. Al momento se ne discute in termini di ipotesi e le principali teorie al riguardo sono le seguenti.
1. L'immunità avrebbe avuto inizio con l'apparizione dei primi organismi viventi sul nostro pianeta, o meglio allorquando dal primo protista ancestrale è cominciata la differenziazione in microrganismi differenti tra loro, i quali mutando hanno dato luogo a molteplici popolazioni, che verosimilmente dovevano o meglio potevano convivere nella niedesima nicchia ecologica. Di qui si originò il processo di evoluzione e contemporaneamente ebbe inizio la convivenza fra i microrganismi primordiali, che probabilmente differivano tra loro per la morfologia ed erano certo provvisti di sistemi enzimatici operanti la sintesi di costituenti diversi. Questi primitivi esseri viventi dovevano utilizzare substrati in parte identici e in parte differenti; su questa base si sarebbero creati i presupposti per uno stato di competizione fra le specie che si è andato accentuando con la comparsa dei primi esseri pluricellulari.
Ciascuna specie apparsa nel corso dell'evoluzione ha dovuto, pertanto, formare armi di difesa e armi di offesa e in conseguenza di ciò alcuni organismi si sono accresciuti e moltiplicati uccidendone altri e utilizzandone i protoplasmi per le proprie sintesi. A poco a poco ciascuna specie ha subito processi di adattamento; alcune sono riuscite a vivere e a moltiplicarsi a spese di altre senza provocarne necessariamente la morte, limitandosi a utilizzarne alcuni componenti o, a volte, i prodotti del metabolismo, e ciò ha dato luogo alla comparsa del parassitismo; d'altro canto le specie parassitate si sono abituate ai parassiti approntando mezzi idonei ad annullarne o almeno a limitarne la nocività e questi processi hanno costituito l'inizio dei fenomeni immunitari in senso lato, i quali, quindi, potrebbero essere considerati quale espressione di un accentuato sviluppo dei mezzi di difesa (v. Boyd, 1966).
2. I fenomeni immunitari riguardano tutte le sostanze eterogenee che, oltrepassata la barriera della cute o delle mucose di un vertebrato, penetrano nei tessuti. Essi, pertanto, non vanno considerati come conseguenti all'adattamento alle infezioni, bensì quali mezzi per il mantenimento della specificità biochimica delle singole specie.
Gli Invertebrati mettono in opera meccanismi molteplici per preservare la propria specificità e fra questi predominano quelli fagocitari; a mano a mano che l'evoluzione ha proceduto verso i Vertebrati si è assistito al perfezionamento di questi meccanismi, tra i quali, a un certo punto, è prevalso il sistema immunitario, dotato di altissima specificità oltre che articolato in funzioni diverse benché armonicamente correlate tra loro (v. Califano, 1966).
3. R. A. Good, che è il maggiore conoscitore di fenomeni dello sviluppo dei sistemi linfatici, dai quali dipende in effetti la risposta immunitaria, pensa che questa sia sorta nel corso dell'evoluzione in dipendenza dalla necessità di controllare la proliferazione di tessuti sempre più complessi, che si sono andati differenziando; ciò sarebbe avvenuto in concomitanza con l'apparizione dei primi Vertebrati. In questi, difatti, alcuni tipi cellulari, come le cellule dei tessuti emopoietici, quelle della mucosa intestinale ecc., posseggono capacità moltiplicativa elevatissima e pertanto possono subire variazioni somatiche a ritmo accelerato (v. Good e Fisher, 1971).
Tale situazione ben si adatta all'ipotesi di una sempre maggiore possibilità, lungo il corso dell'evoluzione, di formazione di strutture differenti da quelle originariamente presenti in un organismo di una determinata specie. La comparsa del sistema linfatico avrebbe, perciò, dato la possibilità a ciascun vertebrato di liberarsi di tali nuovi costituenti e delle stesse cellule mutate, che verosimilmente possono essere prodotte nel corso della vita.
Good acutamente osserva che la comparsa di variazioni somatiche mal si adatta al concetto di stabilità e fissità di una specie. Perché ciascun individuo sia di generazione in generazione sempre lo stesso e di conseguenza perché ciascuna specie rimanga sempre identica, e quindi costituita dalle medesime molecole, bisogna che sussista un meccanismo capace di eliminare le sostanze estranee. Tale meccanismo deve avere la capacità di distinguere i normali costituenti dai nuovi e di distruggere questi ultimi.
Il sistema linfatico sarebbe apparso in dipendenza di una necessità di tal genere e la sua insorgenza, quindi, dovrebbe mettersi in relazione, più che col bisogno di difendersi da antigeni provenienti dall'esterno, con l'opportunità di eliminare antigeni prodotti dall'organismo stesso; in altre parole la genesi dell'immunità specifica sarebbe stata provocata da sostanze eterogenee e quindi antigeniche, ma non di provenienza esterna, bensì sintetizzate dallo stesso organismo.
Tutto ciò avrebbe reso possibile la continuità e la fissità delle specie, determinando un'attiva e perfetta difesa della specificità biochimica di ciascun vertebrato.
b) La risposta immunitaria
Le ricerche sulla risposta immunitaria si sono sviluppate nel corso di questo secolo secondo due direttrici; la prima, che ha seguito i successivi stadi dei fenomeni immunologici dall'introduzione dell'antigene alla produzione degli anticorpi, ha reso possibile l'acquisizione di dati numerosi, ma, in verità, non sembra aver raggiunto la meta prefissa e cioè il chiarimento di tutte le tappe della risposta; la seconda, la quale si potrebbe definire strutturale in contrapposizione con la qualificazione di funzionale che può essere assegnata alla precedente, in un solo decennio ha portato alla conoscenza precisa e della struttura degli anticorpi e dell'attività dei singoli frammenti di queste molecole, e ha così raggiunto gli obiettivi che si prefiggeva, ma non ha molto chiarito il problema principale che riguarda l'intimo meccanismo del processo immunitario.
La direttrice funzionale, pertanto, non ha concluso il suo tragitto, ma al tempo stesso mantiene in fieri tutta la sua validità, anche perché, se gli studiosi porteranno una maggiore attenzione ai problemi e alle tecniche di ricerca attinenti le cellule coinvolte nel processo specifico, come effettivamente sembra che si stia verificando in questi ultimi anni, i risultati che si potranno ottenere saranno determinanti.
La risposta immunitaria può essere divisa in tre fasi. Della prima, o fase afferente, è protagonista l'antigene, la sostanza estranea che introdotta in un vertebrato riesce a fargli produrre anticorpi specifici. La seconda fase, o fase centrale, si collega invece con la funzione delle cellule linfatiche e più particolarmente con la questione più importante e più intricata dell'immunologia, e cioè con la base genetica dell'informazione necessaria alla sintesi degli anticorpi. La terza fase, o fase efferente, comprende gli eventi cellulari che seguono l'interessamento primitivo del unfocita reattivo verso l'antigene e si articola nella moltiplicazione di queste cellule, nel loro differenziamento e nella produzione degli anticorpi.
c) Gli antigeni
Perché una molecola possa essere considerata un antigene deve avere le seguenti proprietà: a) eterogeneità rispetto alla specie nella quale viene introdotta; b) lenta eliminazione attraverso gli emuntori dell'organismo; c) grandezza notevole della molecola; d) rigidità dei gruppi attivi superficiali.
M. Sela (v., 1966) ha suggerito una classificazione degli antigeni in tre categorie: 1) sintetici, consistenti in prodotti che possono essere ottenuti in laboratorio; 2) artificiali, nei quali gruppi chimici di grandezza differente sono accoppiati a un vettore, che può essere costituito da una proteina naturale; 3) naturali, che sono costituiti da cellule, ivi comprese quelle dei microrganismi, o da frammenti o da singoli componenti di esse.
L'eterogeneità, come si è detto, è condizione essenziale per l'antigenicità e pertanto ciascun organismo non forma anticorpi verso i propri costituenti. Esistono però anticorpi che reagiscono con sostanze presenti in individui della stessa specie, ma non nell'organismo in cui si formano: a questi si dà il nome rispettivamente di isoanticorpi e isoantigeni.
I più importanti fra gli isoantigeni sono le sostanze presenti negli eritrociti, le quali, ad esempio, permettono di distinguere gli individui della specie umana a seconda dei gruppi sanguigni; differenze dello stesso tipo si hanno per le altre popolazioni cellulari degli organismi superiori, come per i leucociti e in modo particolare per i linfociti.
Vere e proprie eccezioni fanno poi gli autoanticorpi, che reagiscono con costituenti dello stesso organismo. Quello degli autoanticorpi rappresenta uno dei problemi più interessanti attualmente allo studio, potendosi attraverso la loro azione spiegare anche la patogenesi di numerose affezioni note appunto come malattie da autoimmunizzazione (v. immunologia e immunopatologia: Malattie autoimmuni).
Circa la costituzione chimica degli antigeni si può dire che proteine e carboidrati, e in grado minore lipidi e acidi nucleici, posseggono attività antigenica; varia invece l'immunogenicità, nel senso che, mentre le proteine e alcuni carboidrati sono dei veri e propri antigeni, i lipidi e gli acidi nucleici hanno funzione di aptene, nome con cui si definiscono in immunologia tutte quelle sostanze che di per sé non sono in grado di indurre la formazione di anticorpi, ma che con questi hanno la capacità di reagire. Particolarmente importante negli anni sessanta è stata la scoperta di O. J. Plescia, che ha fornito la dimostrazione dell'attività immunologica degli acidi nucleici uniti con albumina metilata: ne è derivato un nuovo indirizzo di ricerche volto a definire l'aspetto immunologico di questi essenziali costituenti della materia vivente e al tempo stesso a tentare di neutralizzarne alcune attività biologiche (v. Plescia e altri, 1964 e 1965).
Importante per l'attività dell'antigene è la superficie della sua molecola, dalla quale protrudono numerosi determinanti antigenici, cioè sequenze di almeno sette amminoacidi nel caso delle proteine o di 4-6 unità glucidiche per i polisaccaridi: questi pertanto possono combinarsi con un'apposita nicchia specularmente identica al determinante situata sulla molecola di anticorpo, che viene chiamata sito combinatorio. Al determinante antigenico si dà anche il nome di epitope, al sito combinatorio quello di paratope.
Ma non tutti i determinanti che si trovano sulla superficie degli antigeni hanno importanza per la specificità e si è infatti dimostrato che in una molecola di antigene è possibile distinguere: a) una porzione dalla quale dipende la specificità e che è la sola a prender parte alle reazioni antigene-anticorpo, identificabile con gli epitopi; b) una parte vettrice, detta pezzo di trasporto o carrier dagli anglosassoni, la cui funzione è quella di conferire alla molecola la grandezza necessaria nonché la capacità di combinarsi, mediante altri gruppi chimici presenti sulla superficie (i cosiddetti determinanti del carrier), con particolari cellule linfatiche che a loro volta intervengono nei primissimi stadi della risposta immunitaria, unitamente con le cellule che in un secondo tempo sintetizzeranno gli anticorpi.
d) La formazione degli anticorpi: teorie istruttive e selettive
Il problema della sintesi degli anticorpi a livello molecolare ha da sempre affascinato gli studiosi e rimane ancor oggi oggetto di ricerche e di ipotesi. Per la verità le speculazioni teoriche hanno prevalso per quasi un secolo sulle acquisizioni sperimentali e solo da qualche anno si assiste all'inversione di questa illogica tendenza.
Le teorie sulla formazione degli anticorpi possono essere distinte in istruttive e selettive. Le prime, che ascrivono il ruolo principale all'antigene sotto la cui azione diretta e preponderante avrebbe luogo la sintesi delle molecole anticorpali, furono formulate nel 1930, quando risultò in modo chiaro la possibilità di ottenere una risposta immunitaria specifica verso un numero praticamente infinito di antigeni, ivi comprese le nuove sostanze che l'industria chimica già a quel tempo produceva a ritmo elevato. Tale dato di fatto rendeva plausibile l'ipotesi di un ruolo primario da attribuire all'intervento diretto dell'antigene nell'interno delle cellule produttrici. Questi presupposti furono alla base della prima teoria istruttiva, quella dello stampo, formulata da F. Breinl e F. Haurowitz, secondo la quale le cellule produttrici conterrebbero un modello di globulina sul quale se ne formerebbero altre; l'antigene potrebbe a questo livello interferire sullo stampo provocando la sintesi di molecole modificate in particolari configurazioni specularmente identiche agli epitopi e, quindi, perfettamente adattabili a questi. Si spiegherebbe, così, l'alta specificità delle reazioni fra antigeni e anticorpi corrispondenti.
Secondo le teorie selettive, invece, l'informazione necessaria alla sintesi dei diversi anticorpi non è provocata dall'antigene ma è preesistente nell'organismo interessato. La prima di tale teorie è quella delle catene laterali, che venne formulata da P. Ehrlich all'inizio del Novecento e che dominò incontrastata per un trentennio. Essa fu abbandonata a favore della teoria dello stampo, ma nel 1955 N. K. Jerne avanzò una nuova ipotesi che, fondamentalmente, è dello stesso tipo di quella di Ehrlich. Con la messa a punto di tecniche molto sensibili fu possibile agli inizi degli anni cinquanta dimostrare che nel sangue di molti vertebrati sono spesso presenti in tracce, e sporadicamente anche in quantità ragguardevoli, anticorpi capaci di reagire con diversi antigeni. Jerne fu colpito dal fatto che animali normali fossero provvisti di anticorpi contro un batteriofago col quale non potevano essere stati preventivamente a contatto. Tale osservazione gli servì per la formulazione di una nuova ipotesi selettiva, la quale presuppone la preesistenza dei più svariati anticorpi: un antigene penetrato nell'organismo si legherebbe alle poche molecole di anticorpo specifico preesistente; il complesso immune così formato verrebbe inglobato da una cellula a capacità anticorpopoietica e la ecciterebbe a produrre nuove molecole della globulina presente nel complesso.
È questa la teoria della selezione naturale, dalla quale partì qualche anno più tardi M. Burnet per formulare una propria ipotesi, nota come ipotesi della ‛selezione clonale', che ha avuto un'enorme importanza per lo sviluppo delle ricerche negli ultimi anni.
Egli immaginò l'esistenza nei Vertebrati di molteplici doni di cellule mesenchimali provviste in superficie di configurazioni immunologicamente reattive e diverse nei vari doni, ognuno dei quali quindi potrebbe venire a contatto con un singolo antigene; l'avvenuto attracco della sostanza eterogenea alla superficie cellulare comporterebbe la rapida proliferazione del clone interessato e, conseguenzialmente, la produzione di anticorpi specifici per quella sostanza.
Le acquisizioni più recenti hanno portato all'accettazione delle idee di Burnet per almeno quattro punti fondamentali: a) la diversità delle immunoglobuline ha base genetica e trova riscontro anche a livello cellulare; b) è stata comprovata l'esistenza di recettori superficiali; c) una singola cellula immunitaria porta recettori di una sola specificità; d) l'antigene seleziona le cellule e ne condiziona la proliferazione.
La teoria della selezione clonale, inoltre, è stata di fondamentale importanza per la scoperta del fenomeno della tolleranza (v. sotto, cap. 4) oltre che per spiegare la capacità dei Vertebrati di distinguere i propri costituenti dalle sostanze eterogenee. Per altri versi essa non appare completamente soddisfacente; l'attività degli antigeni probabilmente non si limita all'incontro casuale con le cellule linfatiche corrispondenti, data anche l'importanza del metabolismo antigenico nell'induzione della risposta specifica e la dimostrazione dell'esistenza di complessi formati da piccoli frammenti dell'antigene stesso con ribonucleopepti di, complessi provvisti di alta attività immunogena (D. H. Campbell); l'ipotesi di Burnet, tuttavia, non è sufficiente a spiegare tutte le fasi del processo, le quali, d'altra parte, non sono ancora completamente chiarite.
Una delle difficoltà di accettare la teoria della selezione clonale di Burnet consiste nel fatto che è difficile immaginare l'esistenza di tanti recettori diversi per quanti sono gli antigeni, anche se numerose osservazioni hanno consentito di restringere di molto il numero dei recettori. È stato recentemente dimostrato che le immunoglobuline di topi mielomatosi, così come le immunoglobuline di mielomi umani, possono copularsi con apteni svariati: una loro aliquota, ad esempio, reagisce con il dinitrofenolo (DNP). È nota inoltre la non rara reattività crociata fra antigeni di diversa natura: parentele immunologiche, che si estrinsecano in reattività crociate, sono state dimostrate fra gli isoantigeni dei globuli rossi e alcuni costituenti delle cellule batteriche, fra i batteri e i virus, e, come recentemente si è osservato, fra gli antigeni di istocompatibilità e gli antigeni batterici e fra il DNP e le nucleoproteine.
I recettori dei linfociti normali, pertanto, potrebbero copularsi con antigeni che provengono dall'esterno e, in dipendenza dalle reattività crociate che esistono in natura, uno stesso linfocito può impegnare due o più antigeni apparentemente molto diversi tra loro, quali costituenti di batteri e antigeni dell'istocompatibilità.
Poiché il problema delle parentele immunologiche non è stato ancora indagato a fondo, si può presumere che le reattività crociate siano molto più frequenti di quanto oggi non appaia; ciò ridurrebbe in modo considerevole il numero dei doni che finora sono stati postulati.
2. Le immunoglobuline
Le ricerche immunologiche a livello molecolare hanno avuto inizio alla fine degli anni cinquanta e, come si è detto, sono giunte in poco tempo a chiarire la struttura dell'anticorpo. Era questo lo scopo che l'immunologia si prefiggeva, ed essa, mercé l'opera sagace di diversi immunochimici, fra i quali R. R. Porter, G. M. Edelman, A. Nisonoff, ecc., ha raggiunto questo ambito traguardo portando ad acquisizioni di grande rilievo: è stato possibile delineare una vera e propria mappa dell'anticorpo, il quale più propriamente viene oggi chiamato immunoglobulina (Ig), e inoltre indagare le funzioni di queste molecole. I risultati ottenuti, quindi, non solo costituiscono una tappa essenziale per l'immunologia generale, ma portano anche nuova luce nel campo della biochimica, della fisiologia, della patologia e della genetica.
a) Struttura della molecola immunoglobulinica
La struttura di base di una molecola anticorpale è costituita da un'unità di quattro catene polipeptidiche, e cioè da due catene pesanti (H) e da due catene leggere (L). Sulla base della struttura e del luogo di formazione fra le Ig sono comprese, oltre agli anticorpi, anche le proteine mielomatose, benché sprovviste in generale di un'attività specifica; di esse, infatti, soltanto una certa percentuale si lega ad alcuni apteni.
Sono state descritte cinque classi di immunoglobuline, l'identificazione di ciascuna delle quali si fa risalire, più che al ritrovamento di un anticorpo con una determinata struttura, all'esistenza in immunopatologia di una proteina mielomatosa di quel tipo.
Le cinque classi si diversificano fra loro perché dotate di differenti caratteristiche fisico-chimiche, antigeniche e biologiche; particolarmente importante è da questo punto di vista l'esistenza di antigeni propri di ciascuna classe, antigeni che si trovano sulle catene H; le catene H, cioè, non sono sempre identiche ma variano da classe a classe e in qualche caso anche nella stessa classe, perché in una determinata regione del frammento Fc posseggono determinanti con attività antigenica particolare: in altre parole, la diversità delle Ig dipende essenzialmente dalle differenze antigeniche delle relative catene H sulla base di determinanti che sono indicati con le sigle γ, μ, α, δ, ε. A questi determinanti corrispondono le cinque classi di Ig, che vengono chiamate pertanto IgG, IgM, IgA, IgD e IgE, rispettivamente.
Anche le catene L sono distinguibili per struttura e per differenze antigeniche in due tipi, le κ e le λ. Questi due tipi si ritrovano in tutte le classi di Ig, che pertanto si diversificano tra loro essenzialmente per le catene pesanti. In una data immunoglobulina, le due catene leggere e rispettivamente le due catene pesanti sono sempre eguali tra loro; ogni immunoglobulina, perciò, è costituita da catene leggere di tipo λ o κ e da catene pesanti del tipo specifico di quella classe di Ig. Ne consegue che, ad es., la formula di una immunoglobulina della classe IgG può risultare κ2 γ2 oppure λ2 γ2, quella di una IgA κ2 α2 ovvero λ2 α2, e così via per le altre classi.
Sono stati descritti, finora, dieci tipi di catene pesanti e tre tipi di catene leggere, in quanto fra le IgG sono state riconosciute quattro sottoclassi di catene pesanti, che differiscono tra loro per alcuni determinanti; fra le IgA sono state identificate due sole sottoclassi. Per le catene leggere inoltre il tipo κ è unico, ma recentemente sono stati individuati due sottotipi distinti del tipo λ.
Per la struttura la classe più studiata è quella delle IgG, che costituiscono la frazione più abbondante fra le immunoglobuline presenti nei sieri. Esse hanno una costante di sedimentazione di 7 S e un peso molecolare di 160.000. La loro concentrazione nel sangue dell'uomo è di circa 12 mg/ml. Le IgG sono dotate di alcune particolari qualità, quali la possibilità di attraversare la placenta e la capacità di sensibilizzare la cavia nel fenomeno dell'anafilassi cutanea passiva; alcune di esse, inoltre, fissano il complemento.
Le quattro catene polipeptidiche sono unite tra loro mediante tre ponti disolfuro. La frammentazione della molecola di IgG, ottenuta con processi di riduzione, con la digestione a mezzo di papaina e di pepsina, ecc., ha portato a distinguere in essa un frammento Fab e uno Fc; sul primo sono collocati i due paratopi, e cioè i siti reattivi per i determinanti antigenici, mentre il secondo possiede diverse proprietà tra le quali quella di fissare il complemento.
Le IgM, a coefficiente di sedimentazione 19 S e con peso molecolare di 900.000, così come le precedenti, e a differenza di tutte le altre Ig, hanno la capacità di fissare il complemento. Esse si formano vistosamente durante il primo periodo dell'immunizzazione artificiale indotta in alcune specie animali e anche nell'uomo, e costituiscono l'unica risposta umorale inducibile nei vertebrati primitivi, dal che si è dedotto che le IgM sono stati i primi anticorpi apparsi nel corso dell'evoluzione. Ciascuna molecola di IgM è formata da cinque subunità, uguali fra loro ed aventi una elevata mobilità elettroforetica; ciascuna di esse è costituita da quattro catene polipeptidiche: si tratta, quindi, di un polimero che comprende venti catene polipeptidiche. La loro normale concentrazione nel siero è di circa 1 mg/ml. A mezzo di mercaptoetanolo vengono scisse nelle cinque unità di base, ciascuna delle quali ha peso molecolare di 180.000.
Le IgA, che hanno peso molecolare di 170.000, sono presenti nel siero nella concentrazione di 1,8 mg/ml. Per ogni molecola di IgA presente nel siero ne esistono, quindi, cinque o sei di IgG; ma tale rapporto si inverte a livello delle secrezioni esterne e, ad esempio, nella saliva esso è di venti a uno in favore delle IgA. Oltre che nella saliva, le IgA si riscontrano nel secreto nasale, in quello intestinale, nel colostro e nelle lacrime.
La produzione di IgA è particolarmente abbondante nella mucosa intestinale, la quale è molto ricca di linfociti e di plasmacellule; è verosimile che ciò dipenda dalla continua esposizione di tale mucosa a materiale eterogeneo e quindi antigenico proveniente dall'alimentazione e ancor più dalla flora microbica presente in questo distretto dell'organismo.
Nelle secrezioni le IgA si trovano per lo più sotto forma di dimeri, le cosiddette IgA secretorie di peso molecolare 390.000 e coefficiente di sedimentazione 11 S.
La IgA secretoria è composta da due molecole di IgA tenute insieme da un pezzo aggiuntivo, il cosiddetto pezzo secretorio, dal peso molecolare di circa 60.000 e privo di struttura immunoglobulinica, che viene prodotto nelle cellule epiteliali delle mucose anziché nelle plasma- cellule. Il pezzo secretorio è una proteina molto ricca in carboidrati e con un'alta percentuale di acido sialico che rende la IgA molto resistente, tanto che questa risulta poco o nulla sensibile agli enzimi proteolitici quali tripsina, chimotripsina, pepsina ecc.; esso è anche chiamato pezzo di trasporto, perché pare, benché i risultati ottenuti in questo senso non siano ancora definitivi, che renda possibile il passaggio dell'intero complesso attraverso le mucose.
Le IgA secretorie costituiscono la prima linea di difesa verso gli agenti microbici che popolano l'intestino e anche verso quelli che continuamente penetrano nelle vie respiratorie e nei dotti delle ghiandole a secrezione esterna. Recenti ricerche condotte negli Stati Uniti su volontari hanno infatti dimostrato che la guarigione dalle infezioni virali delle prime vie respiratorie è correlata con lo sviluppo di questi anticorpi nelle secrezioni nasofaringee. Lo stesso si può dire per quanto riguarda l'attività di alcuni vaccini, come quello antipoliomielitico approntato dal Sabin, costituito come è noto da virus vivi che si moltiplicano a livello della mucosa intestinale: il numero di IgA che si producono per azione di questi vaccini è in stretta relazione con la potenza del vaccino e con il conseguente grado di resistenza dell'individuo vaccinato.
Le IgD sono gammaglobuline a peso molecolare 150.000 e con costante di sedimentazione 7 S, isolabili dal siero in concentrazioni molto basse (circa 0,03 mg/ml): evidenziate nel 1965 in un caso di mieloma la cui globulina aveva caratteristiche antigeniche differenti da quelle delle tre classi già note a quel tempo, si trovano sulla membrana di un'alta percentuale di linfociti B, sui quali svolgono funzione di recettori.
Le IgE, con costante di sedimentazione 7,9 S e peso molecolare di 196.000, sono presenti nel sangue delle persone normali in quantità ancora più esigue che le IgD, ma raggiungono livelli considerevoli nel siero di individui sensibili ai pollini di graminacee e ad altri allergeni, fra i quali alcuni di natura penicillinica. Esse si identificherebbero quindi con le reagine, che sono gli anticorpi responsabili delle malattie allergiche o atopiche (v. sotto, cap. 7).
Le IgE contengono una quantità relativamente grande di carboidrati, pari all'11% del peso molecolare totale; inoltre la metionina, un amminoacido raramente presente nelle altre immunoglobuline, è molto frequente nelle sequenze amminoacidiche delle catene H di tipo ε. Le IgE sono le responsabili dell'allergia e quindi della reazione di Prausnitz-Küstner e anche dell'anafilassi cutanea passiva nella scimmia, ma non nella cavia, grazie alla loro capacità di combinarsi coi tessuti a mezzo del frammento Fc.
b) Eterogeneità delle immunoglobuline
La caratteristica più impressionante delle immunoglobuline è senza dubbio la loro eterogeneità: oltre a quelle basate sull'antigenicità delle catene pesanti e su quella delle catene leggere, altre differenziazioni consentono di suddividere in allotipi le sottoclassi nelle quali sono distinte le classi principali. Per allotipi si intendono caratteristiche antigeniche delle immunoglobuline che si riscontrano soltanto in individui della stessa specie; in altre parole nell'uomo, così come negli altri Mammiferi (coniglio, topo, cavia), è possibile una suddivisione in gruppi dipendenti da differenze antigeniche delle Ig, in modo analogo a quanto avviene per la dassificazione dei gruppi sanguigni.
Sono stati così dimostrati nel coniglio 8 allotipi diversi e nell'uomo circa 30, dei quali i più noti sono i gruppi Gm e InV che costituiscono due sistemi di fattori geneticamente indipendenti, in quanto prodotti da geni separati.
Oltre alla differenziazione in allotipi esiste poi una variabilità idiotipica legata a specificità individuali dipendenti strettamente dalla costituzione del sito combinatorio, e cioè dalla sequenza di amminoacidi che costituisce la zona della Ig destinata a combinarsi specificamente coi determinanti antigenici. Tale importante porzione della molecola coinvolge non più di 12-14 amminoacidi, i quali, variando nella natura o nella sequenza o nella disposizione spaziale, possono specificamente adattarsi ai differenti e innumerevoli antigeni.
L'inomogeneità delle Ig trova riscontro nelle differenze fra i tipi molecolari di anticorpo che costituiscono il prodotto delle risposte immunitarie ai diversi antigeni, i quali inducono spesso la sintesi di un tipo di Ig piuttosto che di un altro: così, ad es., alcuni batteri gramnegativi e gli isoantigeni dei gruppi sanguigni danno luogo prevalentemente, se non esclusivamente, alla formazione di anticorpi della classe IgM, mentre, nella maggioranza dei casi, alla precoce comparsa di IgM segue la massiva e costante produzione di IgG. Molto cammino resta ancora da percorrere per chiarire il perché di questi differenti comportamenti, e occorrono sicure dimostrazioni per poter sostenere la validità delle varie ipotesi avanzate; gli studi intrapresi negli ultimi anni hanno comunque consentito di acquisire dati di notevole interesse sia in campo generale sia in campo applicativo, quale ad esempio l'osservazione che alcuni mosaici antigenici possono indurre la sintesi contemporanea di anticorpi appartenenti a classi diverse di Ig. Si è infatti constatato che verso alcuni batteri gramnegativi appartenenti ai generi Escherichia e Brucella, così come verso i globuli rossi provvisti di antigene Rh, si possono formare non solo IgG, ma, come accade in diversi casi, anche IgA.
Quest'ultimo dato è molto importante, perché può contribuire a spiegare i motivi per cui non sempre si giunge alla eritroblastosi del neonato anche quando sussiste uno stato di incompatibilità fra madre e feto: lo stato di malattia, infatti, si verificherebbe solo quando la risposta anticorpale è del tipo IgG, in quanto le risposte del tipo IgA non riescono a danneggiare il feto, dato che queste immunoglobuline non passano attraverso la placenta.
3. Dall'antigene all'anticorpo
a) Destino dell'antigene e origine delle cellule linfatiche
Le numerose acquisizioni, vecchie e nuove, sul destino dell'antigene hanno consentito di stabilire che in massima parte le proteine e i polipeptidi sintetici vengono disseminati più o meno ubiquitariamente nel corpo del vertebrato nel quale sono stati inoculati, e che la loro scissione è rapida così come l'escrezione dei prodotti di degradazione. Si può affermare che dopo 48 ore nei tessuti linfatici rimane circa l'1% delle sostanze iniettate, e che questo esiguo quantitativo si addensa essenzialmente intorno ai fagociti situati a stretto contatto con i linfociti, i quali costituiscono l'elemento cellulare più importante fra quelli coinvolti nella risposta immunitaria.
Si è visto di recente che negli organi linfatici le popolazioni cellulari in via di moltiplicazione derivano essenzialmente da cellule provenienti dal sangue e che queste cellule a loro volta sono di origine midollare. Agli inizi degli anni sessanta sembrava evidente che quasi tutti i linfociti derivassero da cellule epiteliali di origine timica, ma gli esperimenti di M. A. S. Moore, pur confermando che nell'embrione il primo organo a popolarsi di linfociti è il timo, hanno dimostrato chiaramente che, all'inizio della vita embrionale, il timo è completamente epiteliale e solo in un secondo tempo viene colonizzato da larghe cellule di tipo emocitoblastico.
Molti dati stanno a dimostrare che sono appunto queste cellule, e non quelle epiteliali, i veri progenitori dei linfociti timici, progenitori che possono anche ritrovarsi nella borsa di Fabrizio degli Uccelli e nel fegato e nella milza fetali dei Mammiferi.
È oggi anche universalmente ammesso che queste cellule staminali sono multipotenti, cioè possono differenziarsi lungo diverse vie e dar luogo a eritrociti, mielociti, linfociti.
b) I tre compartimenti del sistema linfatico
Nell'animale adulto e probabilmente anche nell'uomo la maggior parte delle cellule progenitrici si trova nel midollo osseo, ma alcune di esse si possono anche trovare nella milza. Il midollo osseo, pertanto, può essere anche considerato il primo compartimento del sistema linfatico; da esso derivano continuamente cellule che raggiungono gli organi linfatici e vi si moltiplicano, rendendo possibile la continuaziòne della linfopoiesi.
Le cellule staminali non sono immunocompetenti, cioè non reagiscono con l'antigene né possono fissarsi ad esso; esse acquisiscono tali caratteri soltanto dopo la differenziazione e dopo che abbiano subito, per l'influenza del timo, un processo di induzione e di maturazione.
Il secondo compartimento del sistema linfatico è costituito dagli organi linfatici primari, che negli Uccelli si identificano con il timo e con la borsa di Fabrizio. Gli organi linfatici primari hanno la caratteristica di contenere una notevole quantità di cellule epiteliali e di non formare anticorpi, e sono inoltre capaci di un'attivissima linfopoiesi.
L'importanza del timo in immunologia è stata chiaramente dimostrata dalle ricerche di Miller (v., 1965) sugli effetti della timectomia neonatale nel topo. L'animale timectomizzato alla nascita, infatti, si impoverisce di linfociti a livello sia del sangue circolante sia degli organi linfatici periferici o secondari (milza, linfonodi, placche del Peyer, ecc.) e al tempo stesso non rigetta i trapianti cutanei provenienti da altri ceppi di topo, anzi è finanche possibile fare attecchire in esso trapianti eterologhi, come quelli di ratto. Tutte queste conseguenze sono abolite da trapianti di timo proveniente da topo neonato e impiantato nella prima settimana di vita: in tal modo si riesce a ripristinare la normale attività immunitaria.
Il timo, infatti, fin dai primi giorni dopo la nascita, popola con i propri linfociti i tessuti linfatici periferici e può al tempo stesso ricevere dal midollo osseo elementi emocitoblastici, che subiscono in esso la trasformazione linfocitaria e passano quindi negli organi secondari. Il timo, però, come si è detto, non è l'unico organo primario dell'immunopoiesi; ciò è ben evidente negli Uccelli, nei quali, mentre il timo regola lo sviluppo delle cellule responsabili della immunità mediata da cellule, la borsa di Fabrizio, che è un piccolo organo linfatico situato in prossimità della cloaca, presiede alla genesi degli anticorpi umorali.
La situazione non è altrettanto chiara nei Mammiferi, nei quali si è visto che la timectomia inibisce la reazione ai trapianti, ma non inibisce la produzione di tutti gli anticorpi umorali: evidentemente in questi Vertebrati esiste un organo equivalente alla borsa di Fabrizio, che tuttavia ancora non è stato identificato con certezza. Alcune ricerche sembrano indicare che la rimozione contemporanea dell'appendice e delle placche del Peyer nel coniglio determina effetti simili a quelli provocati dalla borsectomia nel pollo: esse tuttavia non hanno trovato conferma in diversi esperimenti di controllo.
Alcuni dati inducono a pensare che per l'uomo l'equivalente della borsa di Fabrizio possa essere la tonsilla palatina oppure tutto l'apparato linfatico orofaringeo. Ciò si deduce dal fatto che nella sindrome agammaglobulinemica senza linfopenia si osserva un quadro molto simile a quello riscontrabile nei polli nei quali sia stata effettuata l'ablazione della borsa di Fabrizio: all'atrofia congenita e totale del tessuto linfatico orofaringeo fa riscontro l'incapacità di formare immunoglobuline, mentre persistono sia i fenomeni immunitari di tipo ritardato sia i linfociti circolanti. E, comunque, opinione largamente accettata che la funzione della borsa, nei Mammiferi, sia generalizzata e diffusa in molti organi e organuli linfatici.
Il terzo compartimento del sistema linfatico, come si è accennato, comprende gli organi linfatici periferici: unfonodi, milza, placche di Peyer, tonsille faringee e palatine, appendice cecale e macchie lattee dell'omento. Una caratteristica comune a tutti questi organi è quella di essere poco sviluppati o di non esserlo affatto negli animali mantenuti fin dalla nascita in ambiente privo di microrganismi (germfree animals), ma di apparire abbastanza trofici e di divenire ipertrofici nel corso di infezioni negli animali che vivono nel loro ambiente naturale e che sono quindi a continuo contatto col mondo microbico. Questi organi costituiscono un complesso molto vasto e dinamico di cellule che hanno grandi capacità di movimento da un organo linfatico all'altro.
c) Caratteristiche delle cellule linfatiche
Gli esami istologici dei linfonodi durante la risposta ad antigeni di tipo diverso hanno messo in luce l'esistenza di due tipi di linfociti: il primo è sotto la direzione del timo e viene indicato come cellula T, l'altro è indipendente dal timo e prende il nome di cellula B (borsadipendente o bone marrow-dipendente).
Le cellule T si trovano per lo più nel tessuto linfatico diffuso, nei linfonodi e nella milza rispettivamente a livello della corticale e della polpa bianca; le cellule B costituiscono invece i centri germinali degli organi linfatici e si riscontrano per lo più lungo i cordoni midollari del linfonodo e nella polpa rossa della milza. È stato anche accertato che i linfociti T hanno rapporto con l'immunità mediata da cellule (v. sotto, cap. 7, È e), mentre da quelli B dipende la formazione degli anticorpi circolanti.
Oltre a differenziarsi per la loro origine e per la loro capacità di migrazione, i linfociti possono anche essere distinti, a seconda delle loro funzioni, in CFA (cellule formanti anticorpi) e in CRA (cellule reattive all'antigene). Alle prime appartengono le plasmacellule, dalla caratteristica morfologia e con reticolo endoplasmatico molto sviluppato, derivanti da linfociti B, che si trasformano prima in immunoblasti e poi in plasmablasti; la plasmacellula, elemento terminale della trasformazione, è l'unico tipo cellulare di questa serie che non soltanto produce Ig, ma riesce anche a secernerle (anticorpi solubili o umorali, presenti nel siero).
Altre cellule formanti anticorpi, e quindi sempre appartenenti alle CFA, sono alcuni linfociti con citoplasma molto più abbondante di quello del linfocita usuale (v. figg. 8 e 9). In tali cellule si riscontrano poliribosomi e molte di esse contengono sia polisomi con 5-7 ribosomi sia polisomi con 15-18 ribosomi: di questi i primi sintetizzerebbero le catene leggere dell'anticorpo, mentre i secondi sarebbero preposti alla sintesi delle catene pesanti.
La seconda categoria funzionale di linfociti, le cosiddette CRA, non sintetizzano anticorpi in quantità stimabili, ma ne hanno la potenzialità. Queste cellule possono a loro volta essere distinte in due classi: le cellule vergini, che non sono mai state a contatto con un antigene, e le cellule della memoria, presenti negli animali che sono stati preimmunizzati e che attraverso tali elementi risentono del contatto avvenuto con la sostanza estranea.
Per merito di H. N. Claman e quindi di J. F. A. P. Miller e dei suoi collaboratori si è scoperto che le CFA si possono identificare con le cellule che derivano dai linfociti B, mentre le CRA provengono da quelli T.
Secondo diversi autori (v. Mitchison, 1964; v. Plescia, 1969; v. Rajewski e altri, 1969) le cellule T, sebbene non secernano anticorpi, possiedono sulla loro superficie dei recettori di natura non ancora chiarita, per mezzo dei quali si fissano ai determinanti del carrier e portano l'antigene in posizione ottimale a contatto delle cellule B; per questa ragione le cellule T sono anche chiamate cellule helpers. Dell'esistenza di una reale collaborazione fra le cellule T e le cellule B nell'indurre la risposta immunitaria esistono oggi molteplici prove; tuttavia, che i linfociti di origine ti- mica dovessero collaborare all'induzione della risposta immunitaria si desumeva anche da precedenti ricerche di J. L. Gowans, il quale scoprì che un animale sottoposto a drenaggio di tutte le cellule linfocitarie a mezzo di una fistola del dotto toracico perde la capacità di rispondere alla prima iniezione di alcuni antigeni, come tossine batteriche ed eritrociti.
Tuttavia, l'attività di queste cellule non è responsabile della risposta secondaria, nel senso che anche animali privati dei linfociti circolanti risentono del primitivo contatto avuto con l'antigene e rispondono alla seconda introduzione con una forte produzione di anticorpi specifici (‛effetto booster' degli anglosassoni): tale constatazione è valsa a suffragare l'ipotesi secondo la quale per la risposta primitiva è necessario anche l'intervento dei linfociti circolanti (le cellule T), mentre per la risposta secondaria è sufficiente la presenza dei linfociti B che sono stabili nei tessuti linfatici e che, pertanto, non possono essere agevolmente rimossi dall'animale mediante il drenaggio del dotto toracico.
Recentemente è stata individuata un'altra classe di lin- fociti, che presenta caratteristiche diverse sia dalla B sia dalla T; tali cellule linfocitarie intervengono nei fenomeni di ipersensibilità ritardata, nei quali le cellule estranee diventano bersaglio oltre che dei linfociti T anche di questi linfociti di recente individuazione che vengono chiamati null.
d) Cellule fagocitarie
Particolare interesse rivestono i rapporti fra antigeni e cellule fagocitarie. I microfagi (leucociti polimorfonucleati) sono certamente in grado di catturare gli antigeni sotto forma sia di molecole uniche sia di complessi antigeneanticorpo, ma la loro attività si limiterebbe alla partecipazione ai fenomeni non specifici che normalmente si attuano a carico dei corpi estranei che pervengono all'interno degli organismi superiori. Sembra, al momento, che questa partecipazione non interessi la risposta immunitaria specifica.
I macrofagi, in modo particolare quelli peritoneali e le cellule dendritiche degli organi linfatici, sono stati oggetto di numerosi studi. Ancora non sono chiariti perfettamente i rapporti fra antigene e macrofagi, ma si pensa che questi elementi o direttamente o indirettamente debbano intervenire nel processo immunitario, come dimostra il costante reperto di antigeni in associazione con cellule macrofagiche.
Il legame tra la molecola estranea e la cellula fagocitaria è costituito, secondo Nossal e Ada (v., 1971), da immunoglobuline che prendono contatto con la membrana cellulare tramite il frammento Fc. Si tratta di Ig, dette citofile, la cui esistenza era ipotizzata da tempo ma che è stata chiaramente dimostrata solo di recente. Identificate come anticorpi della classe IgG, le immunoglobuline citofile possono essere preesistenti nell'organismo oppure si formano in animali all'uopo sensibilizzati.
Essendo la molecola di immunoglobulina legata alla cellula per mezzo del frammento Fc, restano esposti in superficie i siti reattivi che possono copularsi con molecole di antigene. Buona parte di questo, comunque, viene inglobata dal macrofago secondo un processo che è stato dettagliatamente analizzato. La maggior parte dell'antigene viene digerito completamente dal macrofago, ma una piccola frazione, che è stata identificata con quella più vicina alla membrana citoplasmatica, viene degradata solo parzialmente - alcuni autori parlano icasticamente di ‛processo' - e si dimostra provvista di un elevato potere immunogeno.
Fino al 1960 non si poteva escludere che i macrofagi producessero anticorpi; eliminata tale possibilità sulla base di precise prove sperimentali, si è indagato sulle eventuali collaborazioni tra queste cellule e i linfociti.
Che i macrofagi potessero prender parte ai primi stadi della risposta immunitaria era già dimostrato dalle ricerche pionieristiche di N. Fishman, B. A. Askonas e altri. Uno degli esperimenti più convincenti al riguardo è, comunque, quello di Ford e collaboratori, i quali, facendo reagire macrofagi di ratto con globuli rossi di pecora lisati e mettendoli quindi a contatto con linfociti drenati dal dotto toracico, inducevano in questi ultimi la sintesi di anticorpi verso i globuli rossi; i linfociti, infatti, allontanati dai macrofagi e quindi inoculati in animali privati delle popolazioni immunocompetenti a mezzo di irradiazione, vi permettevano una rapida e abbondante produzione di Ig specifiche.
Dati recentissimi confermano queste acquisizioni ed è stata dimostrata la necessità della presenza dei fagociti per ottenere produzione di anticorpi in vivo e in vitro. Le ricerche attualmente in corso con l'ausilio del siero antimacrofagi, ottenuto in condizioni ottimali solo da poco tempo, potrebbero d'altra parte risolvere il dubbio avanzato da alcuni autori circa un possibile intervento indiretto dei macrofagi.
e) I sistemi immunitari
L'antigene, o come tale o dopo essere stato ‛processato' dal macrofago, deve ovviamente raggiungere le cellule linfatiche e con queste prendere contatto: ciò avverrebbe, secondo quanto oggi generalmente si pensa, tramite particolari recettori presenti sulla superficie del linfocita, che sarebbero costituiti da vere e proprie immunoglobuline o da catene peptidiche di tale tipo.
Nossal e Ada (v., 1971), dopo aver esaminato il problema, sono arrivati a queste conclusioni: a) per la maggior parte i linfociti contengono dei recettori superficiali di natura immunoglobulinica; b) vi è un'eterogeneità fra le cellule linfatiche, dipendente dalla specificità di questi recettori; c) la specificità del recettore riflette probabilmente la capacità della cellula di reagire con l'antigene dal quale è stimolata; d) nei primi stadi del processo immunitario notevoli quantità di antigene sono presenti sul linfocita, ma non si conosce quale attività esso vi esplichi; e) durante gli stadi ulteriori del processo immunitario, gli antigeni non sono più contenuti nella cellula o vi sono contenuti in piccolissime quantità (non più di quattro molecole di antigene per ogni cellula).
Che recettori immunoglobulinici siano presenti su linfociti di animali già sensibilizzati verso un dato antigene è abbastanza chiaramente dimostrato, anche se per lo più in via indiretta; più controverso sembra il fatto che tale tipo di recettore sia sempre presente nei linfociti, e cioè anche in quelli di animali non immunizzati.
Esistono, comunque, anche a questo riguardo numerosi studi, il più interessante dei quali è forse ancora oggi quello eseguito da R. Van Furt e altri (v., 1966), i quali, mediante tecniche di immunofluorescenza specifiche per le principali classi di immunoglobuline, riuscirono a individuare su larga parte degli elementi delle popolazioni linfocitarie dell'uomo recettori a Ig. È stato dimostrato, successivamente, che i linfociti B hanno recettori immunoglobulinici (IgD e IgM) e quelli T recettori particolari che non sono al momento identificabili con veri e propri anticorpi.
Riguardo alle prime tappe del processo immunitario, pertanto, noi sappiamo oggi che l'antigene, una volta penetrato in un vertebrato, si imbatte in una serie di meccanismi, molto differenziati e al tempo stesso articolati tra loro, che ne rendono possibile l'entrata, la diffusione e la distribuzione, ne permettono la conservazione per qualche giorno e operano su di esso alcune modificazioni. Infine, in conseguenza di tali modificazioni, l'antigene risulta in grado di influire attivamente sul sistema immunopoietico fino a renderlo capace di produrre anticorpi specifici.
Il sistema linfatico, che come si è detto è proprio dei Vertebrati, mostra una chiara tendenza a un maggior grado di perfezione e di complessità proporzionale al livello della scala zoologica, ma non costituisce l'unico baluardo difensivo per questi esseri viventi, nei quali infatti si accompagna ad altri sistemi di difesa tra cui la fagocitosi e il complesso dei fattori aspecifici.
Queste due attività non sono di tipo specifico, cioè non si attuano attraverso l'intervento di anticorpi: pertanto non si esplicano su una sola specie batterica o su un singolo microrganismo o un singolo virus, ma più generalmente su tutti i microrganismi o su larghi raggruppamenti di essi. Va aggiunto, però, che da un lato l'attività dei sistemi aspecifici, pur potendo svolgersi indipendentemente dalle immunoglobuline, è da queste incrementata, dall'altro il complemento, che è il principale fattore umorale aspecifico, costituisce al tempo stesso l'elemento determinante della stessa reazione sostenuta dagli anticorpi.
L'agente infettivo che penetra in un organismo, pertanto, trova fattori molteplici molto dissimili tra loro, che però armonicamente cooperano al fine di distruggerlo o almeno di neutralizzarne l'azione; i rapporti tra i differenti sistemi sono molto stretti e spesso le loro attività si sovrappongono e si completano a vicenda.
Le immunoglobuline umorali non costituiscono l'unica espressione dell'immunità specifica, perché negli animali superiori, come nell'uomo, una parte di tale immunità è esplicata da linfociti T dotati di recettori specifici sulle membrane cellulari (immunità mediata da cellule).
Da un punto di vista filogenetico le immunoglobuline del siero rappresentano la parte più evoluta nella catena di difese che si è andata sviluppando con l'evoluzione stessa. Negli animali inferiori infatti sono molto sviluppati i fenomeni di fagocitosi, che probabilmente rappresentano i primi fattori difensivi apparsi negli organismi, ai quali si sono poi aggiunti i fattori umorali aspecifici: il complemento, ad esempio, è contenuto in molti invertrebati i quali, come è noto, non possono formare immunoglobuline. La stessa immunità mediata da cellule è primitiva rispetto all'immunità umorale, che è stata l'ultima, quindi, in ordine di tempo e di specializzazione, a formarsi e a maturare.
Negli animali superiori e nell'uomo noi troviamo tutti e quattro questi sistemi, la cui coesistenza comporta risultati di alta efficacia, ma al tempo stesso un'estrema delicatezza di funzionamento. Il complesso dei sistemi immunitari, infatti, deve provvedere sia alla formazione di anticorpi o di cellule specificamente attive, capaci di eliminare le sostanze e le cellule estranee, sia alla distruzione - mediante un identico meccanismo - di tutti i componenti abnormi che possono venir prodotti nell'organismo; ma al tempo stesso non deve intervenire contro i normali costituenti, i quali ultimi, spesso, contengono porzioni identiche alle sostanze che giungono dall'esterno. Deve, inoltre, fornire la memoria immunitaria, la quale consente di riconoscere gli antigeni anche a distanza di anni, e deve, infine, come caratteristica essenziale per il normale equilibrio di tutto il sistema, provvedere a regolare la risposta immunitaria, il cui eccesso potrebbe determinare un danno per l'organismo.
4. Tolleranza e immunogenicità
Come si è già accennato, si può verificare che sostanze eterogenee introdotte in un vertebrato non vi determinino la risposta immune: è quanto accade nel caso della tolleranza e della paralisi immunitaria.
a) La tolleranza
La scoperta del fenomeno della tolleranza ha segnato una delle tappe più importanti nello sviluppo dell'immunologia. Di estremo interesse fu un'osservazione di Owen, nel 1945: in gemelli bovini, non identici geneticamente ma con circolazione placentare comune, persistono per tutto il corso della vita emazie dei due genotipi, vale a dire nel circolo del bovino A si riscontrano globuli rossi propri del bovino B, laddove, essendo eterogenei, tali eritrociti dovrebbero essere eliminati nelle prime settimane di vita. Sulla base di questa acquisizione Burnet ipotizzò che tutte le sostanze che possono prendere contatto con le cellule linfatiche di un vertebrato durante la vita fetale, sopprimono specificamente ogni risposta futura. Ciò fu invero dimostrato sperimentalmente subito dopo, nel 1958, da P. B. Medawar e dai suoi collaboratori, che designarono appunto il fenomeno con il nome di ‛tolleranza immunitaria'.
Tale tolleranza può essere indotta in varie guise, che Mitchison ha così schematizzato: a) contatto della sostanza coi tessuti linfatici del vertebrato, oltre che durante la vita fetale, anche nel periodo perinatale; b) trattamento prolungato con antigeni molto deboli; c) iniezione di macromolecole eterogenee in stato monomerico, e cioè di molecole singole e non aggregate tra loro; d) inoculazione dell'antigene per una via diversa da quella usuale (alcune sostanze, che provocano la risposta quando sono introdotte per via percutanea, inducono tolleranza se iniettate per via endovenosa); e) preventivo trattamento dell'animale da esperimento con raggi X o con sostanze radiomimetiche.
La scoperta della tolleranza ha modificato alcuni presupposti dell'immunologia generale e ha reso necessario, tra l'altro, introdurre il concetto di tollerogeno e quello di immunogeno.
Per tollerogeno si intende un antigene che, inoculato in un organismo in particolari condizioni, vi determina un processo attraverso il quale si stabilisce l'incapacità di risposta immunitaria verso l'antigene stesso anche quando questo venga successivamente adoperato secondo le normali modalità. Parlando nello stesso senso, si designa in- vece come immunogeno un antigene che stimola il meccanismo immunitario, comportando in tal modo la formazione di anticorpi umorali o di linfociti specificamente attivi.
L'antigene, per poter esplicare la potenzialità immunogena, deve trovare un recettore costituito da un anticorpo specifico situato su un linfocito o, comunque, da una struttura superficiale che si adatti specificamente ai suoi determinanti. A questo punto, possono determinarsi a livello del linfocito tre effetti diversi: a) mancanza di risposta; b) risposta immunitaria, che comporta poi l'attivazione del processo di moltiplicazione del clone cellulare cui il linfocito appartiene, e non di altri; c) instaurazione di una tolleranza, cioè distruzione del clone interessato, che in dipendenza dal numero esiguo di cellule che compongono ciascuno di detti doni comporta l'incapacità di dar luogo a una risposta immunitaria anche dopo successive introduzioni di antigene.
Ma come può l'antigene, o meglio come possono i determinanti dell'antigene indirizzare il linfocito verso la prima, la seconda, la terza via?
Per quanto riguarda la mancanza di risposta, questa può dipendere dal caso; può cioè accadere che la sostanza estranea non trovi nell'organismo alcun recettore di quel tipo, sia perché l'organismo non ha in quel momento linfociti adatti, sia perché il contatto è difficile o inammissibile, come nel caso di una rapida eliminazione attraverso gli emuntori.
Per quanto riguarda le altre due eventualità, un'ipotesi è stata avanzata da P. A. Bretscher e M. Cohn (v., 1968): secondo tali autori, perché un antigene riesca a indurre la risposta immunitaria, deve potersi copulare con almeno due recettori linfocitari molto vicini tra loro, in quanto se il recettore è unico o risulta distante dall'altro si instaurerebbe la tolleranza. Tale teoria, però, non trova conferma in esperimenti condotti con apteni macromolecolari, dato che in questo caso la tolleranza non sempre si manifesta.
G. E. Roelants e J. W. Goodman nel 1970, muovendo dall'acquisizione della cooperazione tra cellule T e cellule B, hanno ipotizzato che, per potere indurre la risposta, la molecola di antigene debba possedere ambedue i tipi di determinanti, cioè i determinanti del carrier e i determinanti specifici (o epitopi), i quali debbono legarsi nello stesso momento rispettivamente ai linfociti T e a quelli B. La tolleranza verrebbe ottenuta quando per ragioni diverse i determinanti del carrier non risultano operanti e l'antigene blocca invece con gli epitopi tutte le cellule competenti di tipo B.
La terza ipotesi poggia su prove fornite da Mitchison sui rapporti fra la dose dell'antigene e la capacità di indurre tolleranza. Già nel 1964 Mitchison (v., 1964) aveva osservato che, inoculando in un animale quantità diverse di antigene, si possono individuare due zone in grado di provocare tolleranza: la zona alta, comprendente le dosi più elevate, e la zona bassa, che comprende le dosi più piccole. La zona intermedia viene detta zona immunogena, perché corrisponde a dosi con le quali si ottiene nel modo migliore la risposta. La zona alta di solito è più efficace di quella bassa nell'indurre lo stato di tolleranza.
Sulla base di questi dati la terza ipotesi postula che la cellula linfocitaria può reagire in modo diverso a seconda del numero dei recettori che sono stati impegnati dai determinanti antigenici: nella zona alta, infatti, tutti i recettori vengono impegnati e la cellula non reagisce, mentre con piccole dosi l'esiguo numero di recettori impegnati comporterà o una induzione parziale o una completa assenza della risposta.
In relazione al contatto tra antigene e macrofago, sembra chiaro che su questo elemento cellulare non esistano recettori al di fuori ovviamente degli anticorpi citofili, che però non sono prodotti dai macrofagi ma, come si è detto, vi si adsorbono.
Di un certo interesse appare l'acquisizione che il macrofago risulta maggiormente attivo nei confronti di antigeni localizzati su cellule (batteri, eritrociti, ecc.), su strutture, cioè, che costituiscono veri e propri mosaici antigenici: in tutti questi casi il macrofago spezzetta le cellule e può staccarne frammenti antigenici. Molti immunologi sono del parere che l'attività dei macrofagi consista solo in questa frammentazione, ma tale interpretazione sembra troppo limitativa e non pone in sufficiente rilievo un dato regolarmente osservato, e cioè l'accumulo della maggior parte degli antigeni, anche di quelli monomolecolari, nei follicoli della milza e dei linfonodi, dove si depositano sulla membrana della cellula dendritica. Non è ancora stato stabilito con sicurezza quale sia l'importanza precisa di questa cellula in tutto il processo, ma che essa non sia del tutto marginale sembra emergere, oltre che dalla suddetta dimostrazione, dalla constatazione che le cellule dendritiche sono sempre situate in una zona in cui passano numerosi linfociti e che tale passaggio avviene di continuo. Una delle ipotesi più probabili è che il macrofago possa presentare l'antigene in una situazione ottimale ai linfociti che attraversano il follicolo.
Una quarta ipotesi, che prende in considerazione anche la presenza delle cellule fagocitarie, è stata avanzata recentemente da W. O. Weigle, secondo il quale perché un antigene risulti immunogeno debbono realizzarsi tre condizioni.
La prima di queste condizioni consiste nella possibilità che l'antigene venga fissato da un macrofago: le forme monomeriche di antigene sarebbero tollerogene in quanto tale processo di fissazione sarebbe per esse impossibile ovvero altamente improbabile. La seconda condizione è rappresentata dall'avvicinamento al macrofago che abbia già fissato l'antigene di cellule linfatiche dei due tipi fondamentali, e cioè cellule T e cellule B. Ambedue i tipi cellulari si fissano alla stessa molecola di antigene, sebbene a livello diverso, cioè copulandosi con determinanti differenti; è stato già detto, infatti, che le cellule T si fissano ai determinanti del carrier mentre quelle B prendono intimo contatto con i determinanti specifici.
Una volta verificatasi questa situazione si può attuare l'interazione fra le due cellule linfatiche, che logicamente sono molto ravvicinate tra loro; secondo Weigle sarebbe possibile in tal modo lo scambio di un'informazione fra la cellula T e quella B.
Solo in questo caso nella cellula B si verificherebbero contemporaneamente due ordini di fenomeni: manifestazione di mutamenti delle configurazioni superficiali della membrana e scatenamento dei meccanismi che permettono la sintesi delle immunoglobuline e di quelli che, svolgendosi parallelamente, portano alla differenziazione della stessa cellula B in plasmablasto e poi in plasmacellula.
Perché tutto ciò avvenga bisogna perciò che il macrofago fissi l'antigene, che su questo antigene si portino ambedue i tipi cellulari devoluti alla risposta immunitaria e che ambedue queste cellule siano specificamente adatte all'antigene stesso; la tolleranza si realizza quando una di queste evenienze non si verifica e, nella maggioranza dei casi, quando ambedue le cellule o soltanto quelle di un tipo non sono capaci di reagire con l'antigene.
La mancata risposta ai propri costituenti da parte di un organismo è stata teoricamente spiegata appunto con l'incapacità immunologica specifica di ambedue i tipi di cellule linfatiche; essa tuttavia, secondo Weigle, potrebbe spesso dipendere dall'incapacità o delle sole cellule T o delle sole B.
L'azione del macrofago è certamente aspecifica, ma al tempo stesso risulta essenziale in questi fenomeni; in altre parole la presenza e l'attività del macrofago sono necessarie per rendere immunogeni alcuni antigeni e al tempo stesso anche per la trasformazione degli antigeni in tollerogeni, sebbene in quest'ultimo caso l'intervento del macrofago sia di tipo indiretto.
Ben spiegato è il ruolo del macrofago nell'induzione della tolleranza a seguito dell'inoculazione di antigeni disaggregati o monomerici. In questo caso, come si è notato, le molecole di antigene non riescono ad attaccarsi alla membrana del macrofago e non viene a crearsi quella situazione locale capace di fare interferire i due tipi cellulari T e B in vicinanza dell'antigene, e quindi del macrofago stesso. Da ciò consegue che gli antigeni rimangono liberi nel sangue o nei tessuti e possono evidentemente venire a contatto e quindi fissarsi sia con i recettori delle cellule T sia con quelli delle cellule B, ma, appunto perché il macrofago in questo caso è inerte, l'avvenuta copulazione dei determinanti dell'antigene con i due tipi cellulari non comporta quella situazione di vicinanza, che è essenziale per lo svolgimento della cooperazione fra i due tipi cellulari.
Tuttavia le cellule T e le cellule B competenti per l'antigene in questione sono state impegnate dagli antigeni monomerici, per cui, se a questo punto un antigene a capacità immunogena viene inoculato nello stesso organismo, trova impegnate tutte le cellule B e T interessate alla copulazione: ne risulta allora una tolleranza specifica.
Da quanto detto si può concludere che gli antigeni, i quali possono muoversi liberamente nella circolazione e passare negli spazi intracellulari con maggiore facilità, non si trovano nelle condizioni migliori per poter essere immuno- geni; essi hanno sempre bisogno del macro lago come punto di contatto perché si provochi l'innesco delle reazioni immunitarie. Gli antigeni cellulari, come globuli rossi, batteri e in grado minore gli stessi virioni, al contrario e almeno in via ipotetica, possono giungere al contatto contemporaneo con una cellula T e una B più facilmente che non gli antigeni solubili. Così verrebbe spiegato perché gli antigeni solubili divengono tollerogeni molto più facilmente che non gli antigeni cellulari.
Nel caso di un antigene solubile, come, ad esempio, una albumina, è necessario anzitutto che la sua concentrazione sia abbastanza elevata perché si possa attuare l'interazione macrofago - cellula B - cellula T, e inoltre che questa si prolunghi per un certo periodo di tempo in modo da permettere alla cellula B di ricevere il segnale necessario alla propria trasformazione in cellula produttrice di anticorpi. Se il tempo del contatto è scarso o la quantità di antigene è insufficiente si può verificare un altro fenomeno: alcune cellule non riescono a trasformarsi in plasmablasti e in plasmacellule, ma l'avvenuto contatto è sufficiente a indurvi uno stato di risentimento. Esse allora divengono cellule della memoria per quell'antigene da cui sono state coinvolte e, a una sua successiva introduzione, si trovano già preadattate alla risposta verso l'immunogeno in questione.
Con questa teoria, postulata da Weigle, si spiega sia la risposta immunitaria di tipo umorale, sia quella di tipo mediato da cellule.
È noto che un antigene ha sulla propria superficie determinanti diversi tra loro, e così su un'albumina vi possono essere almeno 30 tipi di determinanti. Alcuni soltanto possono essere identificati con quelli specifici, mentre i rimanenti sono considerati propri del carrier. Esistono alcuni antigeni che danno solo risposta di tipo umorale e altri antigeni che danno solo risposta cellulare, e inoltre complessi antigenici che possono eccitare sia un tipo di risposta sia l'altro.
È molto verosimile che, quando la risposta anticorpale di tipo umorale è eccitata, essa dipenda dalla reazione ai determinanti antigenici specifici, quelli cioè che hanno preso contatto con la cellula B; e che quando, invece, si attua una risposta di tipo cellulare questa possa essere conseguente al contatto coi determinanti che entrano in connessione con i recettori delle cellule T; nell'uno e nell'altro caso, comunque, è necessario il contatto contemporaneo con ambedue i tipi cellulari. In altre parole, qualunque sia il tipo di risposta, vi è sempre bisogno della cooperazione fra le due cellule e dell'aggregazione dell'antigene, la quale può avvenire di per sé oppure può essere mediata dal macrofago.
b) La paralisi immunitaria
Il fenomeno della paralisi immunitaria, osservato da M. W. Chase, consiste nella mancata produzione di immunoglobuline specifiche dopo inoculazione di alte quantità di antigene, ed è correlato, secondo Weigle, con la concentrazione dell'antigene in vicinanza delle cellule immunocompetenti. Quando tale concentrazione è abbastanza elevata la cellula è attivata completamente e forma anticorpi, mentre con minori quantità di antigene essa può solo trasformarsi in cellula della memoria; se si inocula un antigene in grandissima quantità, tutte le cellule precommesse per quel determinato antigene saranno stimolate a formare anticorpi e non ne rimarrà più alcuna trasformabile in cellula della memoria, cosicché un'iniezione di richiamo non può dar luogo a ulteriore produzione di anticorpo specifico.
5. Il complemento
Si designa come complemento un gruppo di undici proteine del siero costituenti un sistema biologico unitario, la cui attività comporta effetti molteplici, dei quali il principale è rappresentato dal danneggiamento delle membrane cellulari. Sulla base di questo meccanismo il complemento esplica una notevole attività antibatterica e probabilmente condiziona il saprofitismo dei germi gramnegativi, molti dei quali, in effetti, sono risultati estremamente sensibili ai fattori complementari in collaborazione tra loro.
a) Evoluzione delle conoscenze
L'esistenza del complemento apparve evidente tra il 1880 e il 1890, dopo che numerose prove avevano concordemente dimostrato che l'azione battericida del siero fresco veniva notevolmente ridotta dal riscaldamento a 56 °C. Il fenomeno fu messo in relazione con l'inattivazione di una sostanza, cui furono dati in un primo tempo i nomi di alessina e di addimento e successivamente, da Ehrlich, quello di complemento. Qualche anno dopo si scoprì che le emolisine, cioè gli anticorpi specificamente attivi sui globuli rossi, possono operare la lisi di tali cellule soltanto in presenza di siero fresco, e fu individuato nel complemento il fattore responsabile del processo emolitico; si dimostrò, quindi, che il complemento è in grado di agire non soltanto sui batteri, ma anche su cellule appartenenti a organismi superiori.
Le ricerche sul complemento hanno subito nel corso degli ultimi settant'anni almeno tre decisive svolte. La prima si può far risalire al 1905, quando l'italiano A. Ferrata riuscì a dimostrare che il complemento non è costituito da un'unica sostanza, bensì consta di almeno due componenti diverse, ciascuna delle quali suscettibile di essere specificamente inibita con un appropriato trattamento. Egli riuscì anche a ricostruire il complesso attivo, combinando tra loro i due pezzi già distinti.
Intorno al 1940 M. Heidelberger introdusse metodi chimici precisi per la titolazione del complemento e rese così possibili gli studi quantitativi su ben quattro costituenti diversi, che vennero designati convenzionalemente con le sigle C′l, C′2, C′3, C′4, indicandosi con la sigla C′ il complemento in toto.
Verso il 1958 fu dimostrato che l'attività del C′3 risulta dall'intervento concomitante di più sostanze; contemporaneamente, l'applicazione dei più moderni mezzi di studio della immunochimica e della chimica organica ai componenti complementari portò alla conoscenza approfondita di tutto il sistema, per cui oggi si può asserire che lo studio della natura chimica del complemento è quasi del tutto concluso.
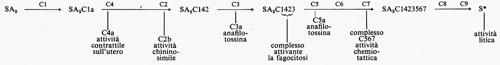
Tuttavia, la complessità stessa del sistema complementare e il gran numero dei ricercatori che hanno contribuito a questo genere di indagini hanno determinato una certa confusione nella nomenclatura e nella differenziazione del sistema. A ciò è stato posto rimedio nel 1970, quando una commissione internazionale unificò opportunamente la terminologia specifica: il complemento viene oggi indicato più semplicemente con C, e i 9 componenti principali rispettivamente con C1, C2, C3, C4, C5, C6, C7, C8 e C9.
b) Costituzione del complemento; sua attivazione
Accanto alla funzione citolitica del sistema complementare, alla cui preponderante importanza già si è fatto cenno, se ne annoverano altre, delle quali alcune ancora non ben conosciute; e d'altro canto l'ipotesi di un'unica funzione male si accorderebbe con l'accertata esistenza di numerosi componenti e col fatto che per molti di questi si sono individuati, nel sangue dei Vertebrati, fattori anticomplementari, evidentemente deputati a regolare la funzione e la produzione di ogni singolo componente del sistema.
Le proteine complementari (v. tab. I) sono molto dissimili fra loro per quanto riguarda le proprietà delle singole molecole; il loro peso varia da 79.000 a 400.000 e la mobilità elettroforetica ci induce a identificarle per lo più con betaglobuline, con una sola eccezione per C1q che migra con la frazione più lenta delle gammaglobuline.
La concentrazione delle proteine complementari nel siero dell'uomo è abbastanza elevata, pari a 2,3 mg per ml di siero. Se si confronta questo dato con la quantità di IgG (12 mg per ml) si può facilmente constatare che le proteine complementari rappresentano circa un quinto delle proteine degli anticorpi classici; tuttavia, il catabolismo delle proteine complementari è molto più rapido di quello delle IgG, tanto che è stato calcolato che l'uomo produce giornalmente quantità di complemento doppie rispetto a quelle di IgG.
Immunochimicamente le proteine del sistema complementare sono molto ben distinte fra loro e non si osserva a loro carico l'esistenza di reazioni crociate.
Tutti i componenti complementari contengono una frazione (2-4%) di glicidi rappresentati da esosi, esosammina e acido neuramminico; una delle subunità del C1, il C1q, contiene, però, il 10% di carboidrati, che in questo caso si identificano quasi esclusivamente con molecole di glucosio e di galattosio; tale composizione chimica è molto vicina a quella delle glicoproteine del tessuto connettivo, e ciò ha fatto pensare che il C1q si sintetizzi appunto in questo tessuto.
Il primo componente del complemento, il C1, è stato oggetto di particolare studio: si tratta di un'esterasi che si trova nei sieri normali sotto forma di precursore o proesterasi, e che viene anche indicata con la sigla C1p. Per azione della plasmina presente nel sangue, la proesterasi si trasforma in esterasi attiva (indicata con la sigla C1a) quando reagisce con complessi immuni, cioè con il prodotto della copulazione di molecole anticorpali e dei rispettivi antigeni. È stato ipotizzato che ogni molecola di C1p coinvolga due molecole di anticorpi fissati a due determinanti antigenici, situati in posizioni molto ravvicinate fra loro, ma non esiste ancora una dimostrazione sicura di detta ipotesi. È accertato che il C1a è in grado, oltre che di scatenare una serie di reazioni che conducono al fenomeno dell'emolisi immunitaria, anche di scindere substrati sintetici quali alcuni composti esterificati di amminoacidi. È stato chiarito inoltre che il C1 è un complesso macromolecolare, con costante di sedimentazione uguale a 19 S, che rimane compatto in presenza di Ca2+; se però si fa agire su di esso un chelante, come il Versene, si assiste alla sua dissociazione in tre subunità a costante di sedimentazione differente fra loro, e cioè il C1q il C1r e il C1s.
Il C1q, come si è già detto l'unico componente identificato con una gammaglobulina, è il responsabile della fissazione del C1 al complesso immune per la capacità che possiede di combinarsi con il frammento Fc delle IgG e delle IgM; non pare tuttavia che esso sia in grado di esplicare la stessa attività sulle IgA, le IgD e le IgE. C1r è dotato a sua volta di attività enzimatica e costituisce l'unità più termolabile del complesso, mentre C1s si deve identificare con il sito catalitico della esterasi.
Eccezion fatta per il C1, che come si è detto può essere attivato per azione di un complesso plasmatico e per la presenza di immunoglobuline, tutti gli altri componenti, di per sé inattivi, vengono resi funzionanti per azione di altri componenti complementari. Ciascuna molecola è attivata dal componente precedente e si trasferisce quindi dal luogo di attivazione a quello dove si trova il rispettivo substrato, il quale può essere, a seconda dei casi, o il recettore della membrana cellulare sulla quale si svolge l'azione, oppure un'altra proteina complementare, cioè un altro dei componenti. La dinamica del processo è complicata: si attua anzitutto attraverso la scissione di ciascun componente complementare, che è il requisito essenziale per l'attivazione del singolo componente interessato e dà luogo alla formazione di subunità del componente stesso. Alcune di queste subunità, che solitamente si identificano con i frammenti maggiori, agiscono sulla catena di reazioni cui è devoluto l'effetto lesivo, mentre gli altri prodotti della scissione hanno differenti funzioni biologiche e intervengono in attività collaterali.
Il C4, invece, viene scisso dal C1 in un frammento più piccolo C4a e in un frammento più grande C4b, che contiene la parte attiva del processo complementare.
Intervenendo subito dopo nella reazione, il C2 viene scisso in due frammenti: il C2a e il C2b, dei quali solo il primo è in questo caso attivo nella sequenza dell'attività complementare.
Il C3, a sua volta, viene scisso da un enzima che è costituito dal prodotto di fusione del C2 e del C4 e che è indicato come C3-convertasi, e il prodotto di tale scissione comporta la formazione anche in questo caso di due frammenti: il C3a, a minor peso molecolare, e un frammento maggiore, il C3b, che possiede capacità combinatoria con i successivi elementi della catena complementare.
Il C5 viene scisso in C5a e in C5b da un enzima che è composto da un complesso dei frammenti C4b, C2a, C3b.
Dei frammenti secondari dei diversi componenti, quello più piccolo del C2 possiede un'attività chininosimile, mentre il C3a e il C5a sono stati identificati con due distinte anafilotossine di importanza essenziale per la produzione dei fenomeni di ipersensibilità immediata e dotate inoltre di attività chemiotattica. Il C4a si è dimostrato in grado di determinare la contrazione dell'utero di diverse specie animali. La formazione dei frammenti si può così schematizzare:
Il C3b, d'altro canto, oltre a condizionare la successiva evoluzione della reazione principale, può trasferirsi su altre cellule (macrofagi, globuli rossi, piastrine) determinando il fenomeno della immunoaderenza, che si risolve in un vistoso incremento dei processi di fagocitosi. Inoltre, il C3 presente in questi complessi può reagire con un fattore presente nel sangue, il cosiddetto KAF (Konglutinogen Activating Factor), provocando la formazione di una nuova Ig specifica; il C3, infatti, assume in tali condizioni una configurazione spaziale diversa da quella normale e determina la formazione di un autoanticorpo, cui si dà il nome di immunocongiutinina, che è impiegato in alcune reazioni diagnostiche.
Quando il primo componente è attivato da un complesso immune acquisisce la capacità di attivare in un secondo tempo molte molecole del successivo componente complementare: questo a sua volta diventa capace di agire sul successivo componente, e così via.
Una volta fissato e reso attivo il C3, vengono attivati quasi contemporaneamente tre componenti, C5, C6 e C7, che danno luogo a un complesso particolarmente efficace: questo può essere trasferito su cellule normali, le quali, cioè, non sono state poste a contatto dell'anticorpo né sottoposte all'azione dei primi componenti complementari e che, nondimeno, subiscono l'effetto litico (lisi reattiva).
Il C8 e il C9, che intervengono a questo punto della sequenza delle reazioni complementari, possono fissarsi al complesso C5 C6 C7 sia sulle cellule legate agli anticorpi, sia su quelle che non hanno reagito con gli anticorpi. Tale acquisizione è di notevole interesse, perché dimostra tra l'altro che le immunoglobuline costituiscono un elemento importantissimo ma non essenziale nel provocare gli effetti della risposta immunitaria. L'elemento essenziale del processo deve quindi essere identificato nel complemento.
Il vero effettore della lesione cellulare è il C8, mentre il C9 si limita ad accelerare la velocità di reazione del fattore precedente.
Quello che si è descritto, però, è soltanto uno dei modi secondo i quali è resa possibile l'attivazione del complemento; esso è anche noto come ‛via classica' della reazione complementare. Come sarà detto a (v. sotto, § c), gli stessi risultati possono essere ottenuti attraverso uno schema differente (‛via alternativa').
Quanto abbiamo riferito emerge da ricerche eseguite sui globuli rossi, cioè dallo studio dei fenomeni della emolisi immunitaria (v. tab. II), ma, come si è detto, anche in altre cellule animali e nelle stesse cellule batteriche possono osservarsi gli stessi fenomeni. Le manifestazioni citotossiche che si manifestano nel corso del normale processo immunitario sono imputabili essenzialmente all'azione del complemento, mentre l'anticorpo effettua il riconoscimento della cellula che deve essere distrutta e costituisce il punto di innesco della prima delle reazioni complementari.
c) Modalità d'azione del complemento
Già nel 1960 B. Goldberg e H. Green avevano ipotizzato che le reazioni complementari dovessero comportare la formazione di minutissimi fori sulle membrane cellulari, e questa ipotesi venne poi confermata dalle osservazioni di T. Borsos e collaboratori nel 1964. Al microscopio elettronico, infatti, la superficie degli eritrociti che hanno subito l'azione dell'anticorpo e dei componenti del complemento appare cosparsa di minutissime soluzioni di continuo, di forma circolare, scure al centro e circondate da un alone molto chiaro. W. F. Rosse e altri (v., 1966) hanno approfondito lo studio delle alterazioni della membrana nei globuli rossi umani, dimostrando che la grandezza e il numero delle lesioni dipendono dalla natura del complemento e sono invece completamente indipendenti dal tipo dell'anticorpo usato; ciò significa che, se la reazione antigene-anticorpo è sostenuta da anticorpi formati in animali di specie diversa, sulle membrane cellulari si producono alterazioni di uguali dimensioni solo quando nel sistema viene impiegato il medesimo complemento, mentre qualora si operi con anticorpo della stessa origine, ma con complemento di specie diverse, si osservano notevoli variazioni dei suddetti caratteri. Così, ad esempio, il complemento umano determina lesioni che sono sempre del diametro di 103 Å, mentre col complemento di cavia si ottengono in ogni caso alterazioni circolari il cui diametro è di 88 Å; anche per questa via, quindi, si torna a sottolineare l'importanza del complemento e a identificare in esso il vero effettore della lisi.
L'azione litica del complemento è stata anche studiata su membrane sintetiche, quali quelle recentemente preparate da Kinsky (v. Kinsky e altri, 1966), usate dapprima per sperimentare l'azione degli antibiotici polienici. Queste membrane, note anche col nome di liposomi, sono costituite da strati concentrici formati da lipidi e contenenti all'interno una certa quantità di glucosio, destinata a svelare l'avvenuta rottura degli strati lipidici, in quanto è resa libera non appena il lipide viene disciolto. Con membrane di questo tipo è stato osservato, tra l'altro, che la liberazione del glucosio avviene soltanto per azione del C8 e che il C9, come già si è detto, si limita ad accelerare tale azione. Va ricordato che l'alterazione non interessa tutto lo spessore delle membrane e che quindi non si tratta di veri e propri fori, ma di erosioni parziali le quali, comunque, condizionano la fragilità osmotica della cellula lesa.
Lesioni simili a quelle osservate sui globuli rossi e sui liposomi si formano anche sulla parete cellulare dei batteri gramnegativi; in questi schizomiceti, infatti, il complemento trova sulla superficie il suo substrato specifico, rappresentato dai lipopolisaccaridi del cell wall, o parete cellulare; una volta scisso il lipopolisaccaride, il complemento permette al lisozima di raggiungere e di depolimerizzare lo strato più interno della parete cellulare, che è costituito da mucopeptide, e in tal modo si determina la rottura completa della cellula batterica.
In effetti, nella difesa contro le infezioni da schizomiceti, il complemento ha una duplice importanza, in quanto, oltre a intervenire nei processi immunitari specifici, costituisce di per sé uno dei fattori dell'immunità aspecifica, poiché può attaccare gli schizomiceti gramnegativi anche in assenza di anticorpi.
Nell'attività antibatterica non specifica esso interviene in concomitanza con un'altra proteina del siero, la cosiddetta properdina, scoperta nel 1954 da L. Pillemer (v. Pillemer e altri, 1954). In tale condizione il complemento, insieme con altri tre fattori e in presenza di ioni Mg2+, distrugge diversi batteri, usa alcuni protozoi e neutralizza virus animali e batterici. La primitiva idea di Pillemer, secondo la quale questa proteina è un enzima, è stata criticata da Nelson, che attribuisce l'attività del sistema complemento-properdina all'intervento di un anticorpo di tipo particolare che sarebbe specifico per un antigene contenuto nella parete cellulare di diversi batteri gramnegativi; ma tale asserzione è stata smentita da successive osservazioni che ridanno grande importanza alla properdina.
È stato anzitutto confermato che la properdina può essere attivata a mezzo di diverse sostanze, fra le quali i lipopolisaccaridi batterici, che non hanno certamente né struttura né funzione immunoglobulinica; tale attivazione comporta, attraverso l'intervento di tre fattori proteici presenti nel siero dei Mammiferi, e che sono conosciuti con le sigle A, B e D, la scissione del C3.
Più precisamente, è possibile affermare che la properdina, indipendentemente dagli anticorpi e dai primi componenti del sistema complementare (C1, C4, C2) può provocare, analogamente a quanto accade nello schema classico e così come è già stato precedentemente descritto, l'identica attività della C3-convertasi.
Esistono quindi in natura due differenti vie attraverso le quali è possibile attivare i componenti complementari e cioè, o attraverso lo schema classico, che coinvolge tutti i componenti, o secondo quello alternativo che coinvolge la properdina (e perciò viene denominato anche schema properdinico) che interessa soltanto C3, C5, C6, C7, C8, C9.
Di notevole interesse è il fatto che la properdina viene attivata sia aspecificamente, come da parte dei lipopolisaccaridi batterici, sia anche a mezzo di alcune classi di immunoglobuline e cioè le IgG, le IgA e le IgE.
La scoperta della via alternativa, quindi, non soltanto ha convalidato l'importanza della properdina quale fattore aspecifico di resistenza antibatterica, ma ha anche dimostrato che il complemento risulta il mediatore di un gran numero di reazioni immunitarie, in quanto può essere attivato, oltre che da complessi immuni contenenti IgG e IgM, anche da quelli con IgA e IgE.
Anche nell'infiammazione il complemento interviene in maniera notevole (v. infiammazione). Tale attività si svolge in almeno due fasi: in primo luogo i componenti complementari, dotati di proprietà chemiotattiche, attraggono i polimorfonucleati nel luogo in cui il complemento è stato attivato, e in secondo luogo la formazione di anafilotossina, attraverso la successiva liberazione di istamina e di sostanze istaminosimili, aumenta la permeabilità vascolare, incrementando in tal modo la concentrazione di anticorpo specifico nell'area infetta.
Sul significato del ruolo del complemento nella resistenza contro le infezioni esistono anche dati indiretti. Alper e collaboratori hanno descritto recentemente un caso di deficienza in C3 nell'uomo: si trattava di un paziente che presentava un'elevata suscettibilità alle infezioni, in cui la deficienza in C3 si accompagnava anche a diminuita produzione di anticorpi umorali e di linfociti attivi nella immunità legata a cellule.
Sono stati descritti anche casi di pazienti mancanti di C5 e che presentano un abbassamento dell'attività fagocitaria. Effetti simili sono stati riscontrati anche in alcuni ceppi di topi.
Il complemento interviene, inoltre, anche nella distruzione di cellule normali e di cellule neoplastiche, e sporadicamente partecipa a qualche forma di ipersensibilità ritardata; H. Gewurtz ha infatti dimostrato che esso può anche mediare il rigetto di tipo rapido. Se si effettua un trapianto di rene da pecora o da coniglio, o anche da maiale, in un cane, il flusso sanguigno nel rene trapiantato si biocca dopo appena 12 minuti e al microscopio si osservano nel rene trapiantato lesioni tipiche, che risultano dalla deposizione di polimorfonucleati e di piastrine privi di granulazioni in quasi tutti i vasi renali. Il danno sembra associato alla presenza di fattori complementari, in quanto contemporaneamente al prodursi di queste lesioni si assiste alla scomparsa di quasi tutti i componenti complementari presenti nel siero dell'animale.
Tali osservazioni vengono avvalorate dai risultati di altri esperimenti effettuati dallo stesso Gewurtz: l'inoculazione nel cane che riceve il trapianto di veleno di cobra, che è un inibitore del C3, determina una sopravvivenza molto più lunga del rene trapiantato e la durata del flusso del sangue oltre i 150 minuti. V'è da aggiungere che anche nei trapianti effettuati sull'uomo si assiste spesso, in concomitanza con le crisi di rigetto, a un abbassamento dei titoli di complemento.
d) Lisozima e batteriocidine
Oltre ai fattori complementari, esistono altre sostanze che contribuiscono aspecificamente alle difese contro le infezioni. Fra queste una posizione importante occupa il usozima, un enzima scoperto da A. Fleming, presente in numerosi liquidi e tessuti degli organismi sia superiori sia inferiori.
Il lisozima depolimerizza un mucoide (mureina o mucopeptide o glicopeptide) composto da acido muramico, da acetilgiucosammina e da alcuni amminoacidi, che costituisce la quasi totalità della parete cellulare dei germi grampositivi e la porzione più interna di quelli gramnegativi, e in tal modo risulta attivo sui batteri grampositivi, in particolare usa quasi tutti i germi conosciuti come saprofiti. L. Califano, a tale proposito, ha osservato che nell'uomo la differenza fra batteri grampositivi saprofiti e grampositivi patogeni poggia appunto sulla sensibilità dei primi al lisozima e sulla insensibilità dei secondi: questi infatti non sono sensibili all'enzima di Fleming perché la mureina del cell wall è ricoperta da materiale capsulare o da ricettori di altra natura, come per es. le proteine che costituiscono l'antigene M degli streptococchi.
L'ultimo gruppo dei fattori aspecifici dell'immunità è quello delle batteriocidine. Sotto questo nome Q. N. Myrvik ha compreso tutte le sostanze contenute nel siero dei Mammiferi, la cui attività non dipende né dal complemento né dal lisozima. Fra le batte riocidine, che generalmente agiscono sui batteri grampositivi, sono comprese le leuchine, prodotte dai leucociti, e le plachine, elaborate dai trombociti.
6. Fagocitosi
Più volte si è fatto cenno agli intricati rapporti fra fattori specifici e fattori aspecifici dell'immunità e anche a quelli molto intimi tra cellule e anticorpi, cioè fra i due tipi di resistenza, cellulare e umorale, nei quali fino a pochi anni fa si usava rigidamente dividere i fenomeni di resistenza.
a) Cellule fagocitanti
Oltre che nei diversi stadi della risposta, alcune delle cellule coinvolte nella produzione degli anticorpi intervengono direttamente e autonomamente quale baluardo difensivo nei riguardi delle infezioni, essendo in grado di svolgere attività fagocitaria che consiste nella capacità di inglobare materiale corpuscolato e quindi anche i microrganismi.
I fagociti, che si distinguono in microfagi (i polinucleati del sangue) e in macrofagi (cellule reticolari, cellule di Kupffer, istiociti, ecc.), assumono corpuscoli e cellule mediante l'emissione di piccole porzioni di citoplasma, gli pseudopodi, con i quali avvolgono il materiale corpuscolato e lo trasportano nel citoplasma, dove lo scindono e lo degradano.
La fagocitosi esercita una funzione essenziale contro l'attecchimento delle malattie infettive, e di ciò si hanno molte prove sia dirette sia indirette.
b) Malattia cronica granulomatosa dell'infanzia
L'importanza dell'attività delle cellule fagocitanti, in modo particolare dei polinucleati neutrofili, è confermata dallo studio di alcune sindromi, che sono state poste nella giusta luce solo di recente, e specialmente di quella che R. A. Good chiama ‛malattia cronica granulomatosa dell'infanzia'. La malattia dipende da un deficit enzimatico leucocitario, trasmissibile come un carattere legato al cromosoma X, e consiste in linfoadeniti granulomatose e suppurative ed epatosplenomegalia. Il quadro può essere complicato da setticemie acute e da osteomieliti, così come da ascessi epatici e da pericarditi.
Si tratta di una malattia molto rara contrassegnata da letalità totale, dato che in media i bambini che ne sono colpiti non raggiungono i 7 anni di vita. Solo di recente ne è stata dimostrata la eziologia infettiva sostenuta da microrganismi a bassissima virulenza, i quali tuttavia riescono a indurre un grave stato patologico in quei soggetti che, a causa della anomalia leucocitaria, reagiscono ai microrganismi in guisa insolitamente difforme dal normale. Questi individui competono abbastanza bene con lo streptococco, col meningococco, con lo pneumococco ecc., ma soccombono a schizomiceti quali Escherichia coli e Aerobacter, provvisti di scarsa virulenza, e finanche a Serratia marcescens, che è considerato un vero e proprio saprofita. In questi soggetti, inoltre, microrganismi come le Candide, gli Aspergilli e le Nocardie, che di solito determinano malattie non gravi, possono produrre affezioni a esito mortale.
Il quadro istopatologico somiglia molto a quello dell'infezione da Mycobacterium tuberculosis, caratterizzato essenzialmente dalla formazione di granulomi; parallelamente, i microrganismi infettanti permangono a lungo nei leucociti, così come accade appunto nel caso del bacillo tubercolare, il quale è fagocitato ma non viene digerito dagli enzimi leucocitari.
Di recente è stato chiarito che la malattia dipende da un difetto delle normali funzioni dei polinucleati, i quali ingeriscono i batteri ma non li distruggono. I leucociti normali provocano la lisi degli schizomiceti inglobati attraverso un complicato processo che comporta tra l'altro un accentuato consumo di O2 e lo shunt dell'esosomonofosfato; in queste condizioni la cellula fagocitaria produce perossido di idrogeno in quantità da due a quattro volte maggiori rispetto alla norma.
La distruzione dei microrganismi avviene quando i vacuoli che li contengono vengono a contatto con i lisosomi, le cui idrolasi acide scindono i costituenti batterici; tuttavia ciò ha luogo solo quando lo schizomicete è già stato ucciso per azione del perossido di idrogeno. Tale meccanismo si esplica nei confronti di tutti i batteri ingenti, tanto di quelli che non producono catalasi quanto di quelli catalasi positivi, i quali ultimi in effetti elaborano quantità di enzima insufficienti a scindere l'enorme quantità di perossido che col tempo si accumula nel vacuolo. Solo quando il batterio è stato ucciso può esplicarsi l'attività dei lisosomi, che determina le lesioni dei tegumenti batterici e quindi la batteriolisi.
I leucociti degli individui affetti da malattia cronica granulomatosa non producono perossidi o ne producono in quantità minima, e in ciò consiste il deficit essenziale dal quale dipende l'insorgenza della malattia. L'effetto che ne deriva è diverso a seconda che il batterio fagocitato sia catalasi positivo o catalasi negativo.
I batteri catalasi negativi sono anch'essi produttori di sia pur modeste quantità di perossidi, che accumulandosi nell'interno della cellula - la quale per la sua anomalia non ne sintetizza altri - bastano tuttavia a uccidere il batterio ingerito: si assiste così a quello che Good icasticamente definisce il suicidio metabolico del microrganismo, ed è questo il caso ad esempio dei lactobacilli. I germi produttori di catalasi, come Serratia marcescens, essendo invece in grado di distruggere con i propri enzimi i perossidi che essi stessi producono, e dato che manca naturalmente l'accumulo di perossidi di origine leucocitaria, riescono a rimanere in vita. Questo meccanismo patogenetico è responsabile dell'evoluzione dell'infezione granulomatosa, che ovviamente può essere provocata solo da microrganismi a scarsa patogenicità, i quali normalmente vengono eliminati per mezzo della fagocitosi; i germi maggiormente patogeni, invece, o non vengono fagocitati, perché con i loro prodotti paralizzano i leucociti, oppure una volta fagocitati distruggono i leucociti.
7. Ipersensibilità immunitaria
a) Definizione e tipi dell'ipersensibilità
I fenomeni di ipersensibilità riguardano in generale le reazioni fra antigeni e anticorpi che si attuino in vivo e che si risolvano in un danno per l'organismo nel quale si svolgono. Di norma, tali reazioni si scatenano soltanto in seguito alla reintroduzione di un immunogeno al quale l'individuo sia stato preventivamente sensibilizzato da un contatto e determinano danni a livello dei tessuti o delle singole cellule.
Tuttavia, in alcuni casi, meccanismi di base dell'ipersensibilità possono contribuire alla difesa dei Vertebrati.
I. Roitt (v., 1971) ha recentemente schematizzato l'ipersensibilità in cinque tipi diversi: a) ipersensibilità di tipo anafilattico, che forse è meglio definita come ipersensibilità immediata; b) ipersensibilità citotossica, che è basata sulla reazione che si determina quando gli anticorpi si uniscono agli antigeni posti sulla superficie cellulare, e in seguito alla quale si può giungere alla morte della cellula e talvolta, per il successivo intervento del sistema complementare, anche alla sua distruzione; c) ipersensibilità da complessi immuni, la cui formazione comporta sempre la fissazione del complemento circolante, e che è in grado, quando è di entità rilevante, di scatenare reazioni che sfociano in manifestazioni patologiche; d) ipersensibilità di tipo ritardato, dipendente dalla produzione di linfociti specificamente attivi, i linfociti T, che portano sulla superficie molecole di Ig: il contatto di queste cellule con l'antigene corrispondente dà luogo alla formazione di alcune sostanze a effetto lesivo, chiamate linfochine; e) ipersensibilità stimolatoria, dovuta al fatto che anticorpi possono, a volte, stimolare le cellule su cui sono posti gli antigeni specifici, anziché distruggerle.
b) Ipersensibilità immediata: anafilassi e allergia
Al primo tipo di ipersensibilità appartengono l'anafilassi e l'allergia, che si era creduto in passato avessero in comune soltanto la rapidità dell'attuazione; le recenti ricerche, invece, consentono di considerare queste due forme molto più vicine fra loro, sulla base dei meccanismi che determinano in ambedue i casi il danno patologico.
L'anafilassi si svolge in tre fasi: a) fissazione dell'anticorpo all'antigene; b) liberazione di sostanze farmacologicamente attive; c) effetto determinato da tali sostanze sui muscoli lisci (contrazione) e sui capillari (dilatazione con conseguente aumento della permeabilità, caduta della pressione, stato di shock).
Gli anticorpi dai quali dipende l'anafilassi sono alcune IgG e le IgE; nell'uomo le ultime acquisizioni hanno consentito di individuare le maggiori responsabili del fenomeno nelle IgE, cioè in quella classe di immunoglobuline da cui dipendono le manifestazioni dell'allergia.
Le Ig che intervengono nella ipersensibilità immediata sono anche dette omocitotropiche, perché sono dotate della particolare capacità di localizzarsi sui basofili circolanti e sulle mastcellule dei tessuti a mezzo del frammento Fc; l'avvenuta fissazione provoca un mutamento della configurazione superficiale delle cellule interessate solo in presenza dell'antigene specifico, e soltanto se questo può contemporaneamente legarsi a più molecole di Ig omocitotropiche. In queste condizioni il frammento Fc determina la continuazione del processo, il cui svolgimento nella fase successiva dipende dal livello cellulare dell'adenosinmonofosfato ciclico (AMP ciclico) al quale è dovuta la stabilità delle mastcellule. Il segnale che parte dal frammento Fc degli anticorpi omocitotropici viene raccolto dall'adenilciclasi delle membrane cellulari e probabilmente comporta l'inibizione di tale attività enzimatica, dalla quale dipende la formazione dell'AMP ciclico.
Tutte le sostanze che stimolano il sistema betaadrenergico e che attivano l'adenilciclasi, infatti, inibiscono la formazione dei mediatori dell'ipersensibilità immediata, la quale, al contrario, viene incrementata dalla stimolazione alfaadrenergica che al tempo stesso comporta una diminuzione dell'AMP ciclico.
Le sostanze liberate durante il processo sono almeno quattro: l'istamina, la serotonina (5-idrossitriptammina), la bradichinina e la SRS-A (Slow Reacting Substance). L'istamina proviene dalle granulazioni delle mastcellule presenti nel connettivo perivascolare, ove si trova legata elettrostaticamente a complessi eparina + proteina; dagli stessi elementi proviene anche la serotonina; la bradichinina è un peptide costituito da 9 amminoacidi che si forma per azione della callicreina su un'alfaglobulina del plasma; la SRS-A, lipide a carattere acido la cui struttura non è ancora completamente nota, origina sia dalle mastcellule sia dai polimorfonucleati e risulta per l'uomo il mediatore più attivo.
Studiando l'attività biologica dei mediatori della ipersensibilità immediata, sono stati individuati diversi composti chimici capaci di inibirli, che possono essere usati con qualche successo in pazienti affetti da malattie di questo tipo: tra tali sostanze antiallergiche possono essere ricordate la dietilcarbamazina, che inibisce la formazione di SRS-A, e il cromoglicato bisodico, di recente introduzione, che blocca sia la produzione di istamina sia quella della SRS-A. Un effetto analogo provocano tutte quelle sostanze che fanno aumentare il livello intracellulare dell'AMP ciclico; così l'isoproterenolo, che attiva l'adenilciclasi e impedisce la liberazione di istamina e di SRS-A; così pure la metilxantina, e derivati dello stesso tipo (teofillina, ecc.) che producono identico effetto. Gli stessi derivati alchilici dell'AMP ciclico esplicano un'azione similare. Solo alcune di queste sostanze, come la dietilcarbamazina e il cromoglicato, sono entrate da poco tempo nella pratica medica, ma i sistemi sperimentali messi a punto negli ultimi tempi consentono di prevedere la prossima risoluzione di un problema pratico la cui notevole importanza risulta evidente da semplici considerazioni: i fenomeni anafilattici non sono rari nell'uomo e possono manifestarsi, oltre che nel corso di trattamenti con sieri specifici, usati a scopo profilattico o terapeutico, in casi di punture di insetti e di rotture di cisti di echinococco e anche in seguito a contatto con sostanze naturali o prodotti sintetici (le iniezioni di penicillina, ad esempio, sono in qualche caso responsabili di shock anafilattici).
Va aggiunto inoltre che il secondo gruppo delle reazioni immediate, il gruppo delle malattie allergiche, interessa, sebbene con sintomi di gravità differente, circa il 10% dell'umanità. Gli individui affetti da tali malattie diventano facilmente e spontaneamente ipersensibili a un gran numero di sostanze dette allergeni o atopeni, quali polveri, pollini, ecc.: tali sostanze, generalmente prive di caratteristiche antigeniche complete, anche perché di peso molecolare molto basso, non provocano alcuna risposta quando vengono inoculate in individui normali, mentre risultano immunogene negli allergici o atopici.
Fra le malattie allergiche, che oltre tutto riconoscono una forte predisposizione familiare, alcune sono da lungo tempo ben note, come la febbre da fieno, l'asma bronchiale, ecc. In tutte queste condizioni patologiche è possibile dimostrare nel paziente la presenza delle IgE specifiche, note anche con il vecchio termine di reagine, usando vari metodi: o mediante i test cutanei, consistenti nell'inoculazione intradermica dell'allergene corrispondente che determina la formazione di un pomfo eritematoso; o mediante la determinazione dei livelli ematici di IgE; o, infine, per mezzo della prova di Prausnitz-Küstner, consistente nell'inoculazione intradermica, in un soggetto sano, di una piccola quantità di siero di individuo atopico, seguita a distanza di 24 ore dall'iniezione nella stessa zona dell'allergene sospettato che, se vi è corrispondenza tra allergene stesso e reagina presente nel siero in esame, provoca la formazione di un pomfo, dovuta alla sensibilizzazione delle cellule del soggetto sano da parte delle IgE inoculate.
Recentemente è stato dimostrato che la reazione di Prausnitz-Küstner può essere bloccata dalla preventiva iniezione di IgE prelevate da individui affetti da mieloma. Si è ipotizzato che tale inibizione sia la conseguenza della completa saturazione, da parte dei frammenti Fc delle IgE mielomatose, di tutti i recettori delle mastcellule presenti nella zona inoculata, i quali pertanto non risultano più liberi quando le IgE specifiche giungono al luogo di inoculazione, così che la fissazione dell'aptene e la conseguente reazione cutanea non possono aver luogo.
È stata sottolineata di recente l'importanza del fatto, rilevato sporadicamente già da alcuni anni, che gli individui allergici risultano nei confronti dei normali meno predisposti all'insorgenza dei tumori. Questo dato, a prima vista paradossale, sembra trovare una spiegazione logica in alcune delle nuove acquisizioni sull'immunologia di base. Nei portatori di tumori risulta molto attenuata e forse perduta la capacità di riconoscere come estranei gli antigeni delle cellule tumorali: è probabile che gli individui allergici, che hanno una maggiore capacità di formare anticorpi verso antigeni molto deboli (e quelli tumorali debbono essere considerati di questo tipo), riescano a eliminare con maggiore facilità le sostanze atipiche che si formano nel proprio organismo e quindi a bloccare i tumori al momento della loro insorgenza.
c) Ipersensibilità citotossica
Il secondo tipo di ipersensibilità comprende i fenomeni citotossici. Numerose sono le modalità secondo le quali la risposta immunitaria può comportare la distruzione di una cellula. Anzitutto, dopo fissazione degli anticorpi sugli antigeni superficiali, si può avere un intervento dei macrofagi: la reazione antigene-anticorpo, che si svolge sulla superficie cellulare, provoca fenomeni di immunoaderenza, responsabili, tramite la fissazione al complesso immune del C3, di una maggiore attivazione dei fenomeni fagocitari e, conseguentemente, della distruzione della cellula bersaglio. In altri casi la citolisi dipende essenzialmente dall'azione del complemento. È probabile che un terzo tipo di citotossicità da reazione immune si manifesti in vivo in modo analogo a quello osservato in vitro da P. Perman: il fenomeno descritto da questo autore consiste nell'evidente azione citotossica esercitata da cellule linfatiche normali, per solito prive di attività fagocitaria, quando vengono a contatto con cellule sulle quali si sia formato un complesso immune.
A questo secondo tipo di ipersensibilità possono essere ascritte molte reazioni patologiche che si riscontrano nell'uomo: anzitutto le reazioni trasfusionali da incompatibilità fra gruppi sanguigni e quelle legate alla presenza di antigeni Rh; inoltre alcuni fenomeni delle reazioni ai trapianti, che sono essenzialmente connessi con l'immunità legata a cellule. In tali casi, tuttavia, intervengono a volte manifestazioni citotossiche da anticorpi umorali, gli stessi che partecipano anche alle reazioni patologiche verso i farmaci, sempre in via subordinata all'attività di linfociti specificamente attivi.
d) Ipersensibilità mediata da complessi immuni
Ogniqualvolta anticorpi solubili si legano in vivo ai relativi antigeni ha luogo la formazione di complessi immuni, che possono rimanere in circolo almeno per qualche tempo oppure localizzarsi in diversi distretti dell'organismo; in ogni caso su di essi vengono a fissarsi i componenti del complemento, dalla scissione di alcuni dei quali, come si è detto, originano frammenti (C3a e C5a) in grado di formare anafilotossina e, attraverso questa, di provocare la liberazione di istamina.
I danni che ne conseguono, quindi, sono simili a quelli riscontrabili nel primo tipo di ipersensibilità; ad essi si aggiungono anche quelli provocati da fattori chemiotattici che si liberano in alcune fasi del processo di fissazione dei componenti complementari e che fanno affluire i polinucleati nel luogo in cui è avvenuto il contatto fra complemento e complesso immune. Un terzo tipo di danneggia- mento può essere indotto dalla formazione del fattore di Hageman, che scatena la formazione delle chinine.
I recenti progressi delle conoscenze sulla patologia da complessi immuni hanno fra l'altro consentito di rilevare l'importanza del rapporto tra la quantità di antigene e quella di anticorpo, rispettivamente presenti nei complessi stessi, al quale è strettamente correlato il fenomeno patologico. Si è, infatti, accertata l'esistenza di una patologia da eccesso di anticorpo e di una da eccesso di antigene: quando prevale l'anticorpo i complessi vengono precipitati e si localizzano nel punto dove si trova l'antigene; nel caso di eccesso di antigene i complessi sono per lo più solubili e in grado, pertanto, di provocare reazioni generali e sistemiche, in quanto vengono distribuiti dal circolo sanguigno in tutto l'organismo, pur mostrando un certo tropismo per particolari distretti come reni, cute e articolazioni.
Esempio classico della patologia da complessi nella zona di eccesso dell'anticorpo è il fenomeno di Arthus, consistente in una grave risposta infiammatoria alla formazione di precipitati specifici in tessuti vascolarizzati ove è presente l'anticorpo in grande quantità e nei quali sia stato introdotto l'antigene. Nell'esperimento descritto dal ricercatore francese, la ripetuta inoculazione di siero di cavallo in un coniglio ne determina l'iperimmunizzazione nei confronti delle proteine contenute nel siero stesso; a questo punto l'introduzione in quel coniglio per via sotto- cutanea o intradermica di una piccola quantità di antigene determina una rapida reazione infiammatoria che raggiunge il suo massimo in 3-8 ore.
Fatti patologici che poggiano sulla stessa base patogenetica si osservano anche nell'uomo: per esempio nella sindrome di Farmer, consistente in gravi difficoltà respiratorie che insorgono dopo 6-8 ore dalla esposizione a polvere di fieno, contenente actinomiceti termofili, di individui precedentemente sensibilizzati a tali microrganismi.
Con ogni probabilità alcune delle reazioni designate come allergiche e ascritte solitamente al primo tipo di reazione di ipersensibilità sono invece provocate da complessi.
Condizioni opposte, e cioè formazione di complessi nella zona di eccesso di antigene, occorrono nella ben nota malattia da siero, che si osserva in individui trattati per la prima volta con siero immune, e consiste nell'insorgenza di una orticaria febbrile con albuminuria e interessamento dei linfonodi e delle articolazioni. I primi segni compaiono dopo 6-10 giorni dall'inoculazione e dipendono dalla produzione di anticorpi contro il siero immune, quando aliquote di questo sono ancora presenti nell'individuo, con conseguente formazione di complessi immuni. Con lo stesso meccanismo insorgono ed evolvono alcune glomerulonefriti: ad es. negli ammalati di lupus eritematoso sono presenti nel glomerulo complessi formati da DNA-siero antiDNA-complemento, e quadri simili si possono osservare anche in altre malattie dell'uomo. (Per quanto riguarda tutti gli altri aspetti della patologia da complessi in generale, v. immunologia e immunopatologia: Malattie autoimmuni).
e) Ipersensibilità di tipo ritardato
Questo tipo di ipersensibilità, mediato direttamente dalle cellule linfatiche, si svolge nel corso di diverse infezioni da batteri, protozoi, virus e funghi, ed è inoltre alla base delle dermatiti da contatto e del cosiddetto rigetto dei tessuti trapiantati. Esso è quasi posto in antitesi con il primo, cioè con quello immediato; le differenze fra i due tipi non riguardano soltanto la velocità di evoluzione, ma anche la loro patogenesi, il cui studio è reso possibile dalle caratteristiche istologiche dei tessuti colpiti.
Nel tipo immediato la reazione locale è costituita da edema contenente poche cellule, mentre nel tipo ritardato si osserva un'abbondante reazione cellulare con formazione di notevole addensamento di macrofagi e di cellule mononucleate, fra le quali prevalgono i linfociti, nelle zone di connettivo poste immediatamente intorno ai vasi. L'ipersensibilità ritardata, inoltre, non è sostenuta da anticorpi umorali e non può essere trasferita da un individuo all'altro mediante trasfusione di siero. Essa è legata agli anticorpi sessili, che vengono prodotti dai linfociti e rimangono attaccati alla loro superficie in modo da renderli specificamente attivi verso gli antigeni che ne hanno determinato la produzione. Il trasferimento di questo tipo di immunità dall'individuo sensibilizzato al normale può essere attuato per mezzo di linfociti o anche mediante l'iniezione di una sostanza a basso peso molecolare estratta da tali cellule: è questo il cosiddetto fattore di trasferimento di Lawrence, la cui struttura non è ancora completamente conosciuta, di peso molecolare inferiore a 10.000 e probabilmente costituito da un polipeptide.
Per quanto riguarda l'ipersensibilità ritardata che evolve nel corso delle infezioni, è stato chiarito che non tutti gli schizomiceti possono determinare questo tipo di risposta immunitaria; il suo significato patogenetico, al contrario, è particolarmente importante solo nei confronti di alcuni microrganismi, fra i quali i micobatteri, le brucelle, le listerie, le bedsonie (psittacosi e linfogranuloma venereo) ecc. L'intervento dei fenomeni di ipersensibilità ritardata è stato anche dimostrato in alcune infezioni sostenute da miceti, come l'istoplasmosi, le dermatomicosi, la coccidiomicosi, e da protozoi, come le leishmaniosi; e inoltre nelle parassitosi da elminti, in modo particolarmente evidente in alcune, come nella idatidosi. Fra le malattie virali, fenomeni di ipersensibilità ritardata sono ben dimostrabili nella parotite, ma probabilmente intervengono nei confronti di quasi tutti i virus, contro i quali i Mammiferi reagiscono più con linfociti attivati specificamente che non attraverso l'azione degli anticorpi umorali; in questo senso parlano le numerose vecchie e nuove acquisizioni sul comportamento degli agammaglobulinemici nel corso delle virosi, che, salvo rare eccezioni, non si discosta da quello degli individui con corredo normale di anticorpi umorali.
A tale riguardo è significativo il fatto che negli agammaglobulinemici rimangono intatti i sistemi di difesa dipendenti dalle cellule T, dalle quali è condizionata la produzione di linfociti specificamente attivi.
Le ricerche sull'ipersensibilità ritardata di tipo infettivo hanno avuto molta importanza non soltanto per lo studio della patogenesi delle diverse infezioni, ma anche perché su questa risposta immunitaria sono basate alcune reazioni diagnostiche, quali quelle alla tubercolina, alla lepromina, alla istoplasmina ecc.
Negli ultimi anni un discreto sviluppo hanno avuto gli studi sull'ipersensibilità infettiva da Mycobacterium tuberculosis, da Pasteurella tularensis e da Listeria monocytogenes. Nelle infezioni sostenute da questi batteri la difesa dell'organismo viene esplicata sia da linfociti sia da macrofagi attivati specificamente, che inglobano e distruggono i batteri. La difficoltà maggiore delle ricerche svolte sull'argomento è consistita nello spiegare in quale modo i macrofagi acquisissero l'attività specifica. I risultati di numerose osservazioni hanno consentito di stabilire che queste cellule, durante le infezioni sperimentali da bacillo di Koch, subiscono importanti modificazioni morfologiche e funzionali: appaiono ripiene di mitocondri, dimostrano una maggiore attività metabolica e una capacità di movimento superiore a quella dei macrofagi normali, presentano un incremento della velocità di ingestione dei microrganismi.
Nell'infezione sperimentale da Listeria monocytogenes tutte le cellule del sistema reticoloendoteliale entrano in mitosi; inoltre, i macrofagi presentano un'aumentata pinocitosi e sono dotati di lisosomi con maggiore contenuto in idrolasi acide. A questo punto, l'ulteriore inoculazione di listerie è prontamente seguita dalla loro inattivazione; inoltre i macrofagi prelevati dagli animali infettati in questa fase della sperimentazione e coltivati in vitro mostrano chiaramente di aver acquisito una netta capacità di inglobare le listerie. Tuttavia, poiché l'azione dei macrofagi risulta quasi nulla quando dalle loro sospensioni si allontanino completamente i linfociti, è ragionevole pensare che tali ultime cellule siano coinvolte in questo tipo di difesa. Che l'attività dei macrofagi sia di tipo immunitario è dimostrato dalla specificità della protezione: è infatti possibile trasferire la sensibilità alla tubercolina usando i linfociti di un animale trattato con bacillo tubercolare, ma non quelli di un animale trattato con listerie, che pure possiede macrofagi attivati e linfociti evidentemente adattati a questo tipo di difesa.
Secondo G. B. Makaness l'immunità mediata da cellule è realizzata attraverso la collaborazione fra linfociti a corta vita, che vengono prodotti nei primi giorni dopo l'infezione sperimentale, e cellule fagocitarie. L'influenza dei linfociti sui macrofagi potrebbe essere esplicata in varie guise: ad esempio mediante l'elaborazione di anticorpi dotati di capacità citofila e in grado quindi, anche se in piccolissime quantità, di legarsi ai macrofagi e di provocare una reazione antigene-anticorpo sulla superficie della membrana di queste cellule, incrementandone l'attività.
Appare più verosimile, però, che l'attività dei macrofagi sia resa specifica in via indiretta: sotto l'azione di un antigene specifico, il linfocita elabora i fattori dell'ipersensibilità ritardata, dei quali si dirà più diffusamente in seguito, e uno di questi fattori immobilizza i macrofagi nel luogo dove i linfociti specifici hanno reagito con il batterio. In altre parole la specificità della reazione sarebbe condizionata dai linfociti e non dai macrofagi, i quali agirebbero in modo aspecifico solo a contatto del microrganismo cui si è legata la cellula linfocitaria.
Lo studio sistematico dei fenomeni di ipersensibilità ritardata di tipo infettivo, che pure è la prima osservata tra le manifestazioni immunitarie cellulari, ha registrato un rapido sviluppo solo negli ultimi anni, dopo la dimostrazione che lo stesso meccanismo determina il rigetto dei trapianti. La comprensione delle modalità di svolgimento ditale dannoso e indesiderabile fenomeno è così valsa a far luce sulla patogenesi delle malattie infettive e su quel complesso di reazioni che consentono all'organismo di guarirne.
Di tipo ritardato è anche l'ipersensibilità da contatto, che è responsabile di un grande numero di dermatiti allergiche conseguenti al contatto della cute o delle mucose con sostanze chimiche dotate di attività farmacologica o con estratti vegetali. In seguito a una successiva esposizione all'azione della medesima sostanza, in media dopo un giorno, si osserva la comparsa di una zona di infiammazione cutanea con formazione di papule, destinate a trasformarsi poi in vescicole con conseguente ulcerazione e produzione di croste. Questo capitolo dell'immunologia, fino a pochi anni or sono il meno prolifico di risultati, rappresenta oggi uno dei campi più fervidi di ricerca, anche perché i numerosi argomenti studiati sono di notevole interesse in patologia umana: basti pensare, infatti, che oltre al problema dei trapianti esso riguarda anche quello della resistenza ai tumori.
f) Immunologia dei trapianti: il rigetto e le terapie immunosoppressive
Gli studi immunologici sui tumori hanno ricevuto un notevole impulso quando l'interesse dei ricercatori si è rivolto dallo studio degli anticorpi umorali a quello delle reazioni di ipersensibilità ritardata e, in pari tempo, si sono utilizzati, nella sperimentazione, ceppi di animali geneticamente identici (v. neoplasie: Oncologia sperimentale).
Le recenti dimostrazioni che la resistenza ai tumori si svolge in modo simile, se non identico, a quella ai trapianti, hanno segnato l'inizio di un nuovo settore di studi immunologici relativo ai fenomeni dell'istocompatibilità. Il suo sviluppo si deve soprattutto ai genetisti, in particolare a quelli che si occupano dei problemi di immunologia.
È ormai stabilito che i trapianti sono possibili solo quando donatore e ricevente hanno lo stesso patrimonio genetico, sono cioè composti da sostanze uguali: tale condizione è definita come autotrapianto. Nel caso degli omotrapianti, cioè di trapianti effettuati tra individui della stessa specie ma con patrimonio genetico non identico, e nel caso degli eterotrapianti, cioè di quelli effettuati fra individui di specie diverse, si instaura il processo immune, in quanto non esiste istocompatibilità fra donatore e ricevente. È ovvio che proprio in quest'ultima condizione le differenze antigeniche sono enormi; tuttavia, anche per quanto riguarda gli omotrapianti è difficile trovare due individui della stessa specie che abbiano identica costituzione antigenica, cosicché risulta indispensabile far precedere tali interventi dal confronto tra gli antigeni del donatore e quelli del ricevente.
Un notevole progresso nella chirurgia dei trapianti è stato realizzato in seguito allo studio dei costituenti dei leucociti. Già nel 1946 Medawar aveva osservato nei leucociti del topo la presenza di importanti antigeni; questi dati furono poi confermati nell'uomo, tanto che attualmente, grazie ad autori quali R. Ceppellini, J. J. Van Rood, J. R. Paine, J. Dausset e molti altri, le popolazioni umane possono essere suddivise in base all'appartenenza a determinati gruppi leucocitari, la cui importanza per i trapianti è identica a quella che i gruppi sanguigni hanno per la pratica delle trasfusioni.
La specificità degli antigeni dei gruppi linfocitari, che sono coinvolti nel rigetto dei trapianti, è sotto controllo genetico: ne consegue che soltanto in individui genetica- mente identici, cioè in animali di ceppo puro oppure in gemelli monocoriali, è possibile attuare con assoluta sicurezza i trapianti di organi o di tessuti.
Lo studio della segregazione dei geni che controllano questi antigeni, condotto mediante esperimenti di ibridizzazione, è stato particolarmente approfondito nel topo, in cui si è riusciti a individuare almeno 15 loci che controllano gli antigeni dei trapianti; fra questi il locus H2 è predominante, in quanto controlla quegli antigeni di trapianto definiti ‛forti', responsabili di una intensa reazione di rigetto difficilmente controllabile anche dalle corrette terapie immunosoppressive.
Gli antigeni dipendenti dal locus H2 sono glicoproteine che si ritrovano adese alla superficie cellulare; i linfociti ne sono molto ricchi, il fegato, i reni, il polmone ne posseggono proporzioni discrete, i muscoli e il cervello quantità molto esigue.
Nell'uomo, mediante studi ben più complessi condotti da numerosi ricercatori, è stato individuato un altro gruppo di antigeni forti, il cosiddetto sistema HL-A, che rappresenta l'equivalente di quello H2 del topo e risulta dipendente da due sottoloci: uno comprendente gli antigeni 1, 2, 3, 9, 10, 11, e l'altro quelli 5, 7, 8, 12, 13.
Per i soli antigeni del sistema HL-A sono possibili almeno 4.000 differenti combinazioni antigeniche, onde si comprende agevolmente la grande difficoltà di reperire nella popolazione umana individui tra loro istocompatibili.
Il trapianto può essere eseguito quando almeno gli antigeni forti sono identici nel donatore e nel ricevente, anche se non coesiste una esatta corrispondenza fra altri antigeni denominati ‛deboli': anche questi ultimi sono in grado di determinare la reazione di rigetto, la quale però in questo caso risulta controllabile per mezzo delle radiazioni, oppure di sostanze che con modalità differenti deprimono le attività immunitarie. A tale scopo possono essere utilizzati numerosi farmaci, dagli ormoni steroidei alle sostanze alchilanti, ad alcuni antibiotici, fra i quali l'actinomicina D, agli antimetaboliti analoghi dell'acido folico e delle basi puriniche.
Ricorderemo appena fra gli ormoni steroidei il prednisone, particolarmente utile per combattere gli attacchi acuti di rigetto, e fra gli antimetaboliti l'azatioprina, che insieme con la ciclofosfammide trova un largo impiego in clinica per la modesta tossicità.
Dei mezzi di immunosoppressione è entrato a far parte da qualche anno il siero antilinfocitario, già noto dal 1961 (B. Waksman) quale efficace inibitore dei fenomeni dell'ipersensibilità ritardata, la cui azione, consistente nel provocare una linfopenia generalizzata, è temporanea e va mantenuta a mezzo di ripetute inoculazioni. Risultati migliori, con questo mezzo terapeutico che già costituisce la migliore arma contro il rigetto, saranno certamente ottenuti allorquando sarà possibile produrre un siero dotato di un più elevato grado di specificità, sia limitando il bersaglio ai soli linfociti T, sia focalizzandone l'attività sulle sostanze elaborate da tali cellule.
Va sottolineato, comunque, che già il siero antilinfocitario normale risulta maggiormente attivo sulle cellule linfocitarie responsabili del rigetto che non su quelle B: è infatti noto che gli individui sottoposti a terapia con questo siero sono in grado di formare anticorpi circolanti e quindi di produrne anche contro i costituenti dello stesso siero iniettato. Ed è proprio in considerazione di questa possibilità che, per prevenire i gravi fenomeni dello shock anafilattico, si usa inoculare il siero dopo averlo centrifugato in modo da eliminare gli aggregati proteici, inducendo in tal modo uno stato di tolleranza. È stato inoltre accertato che la maggior parte degli agenti chimici inibisce la formazione di IgG ma non quella di IgM e che è possibile indurre una tolleranza specifica a un determinato antigene in vari modi: ad esempio, come è stato recentemente dimostrato, iniettando quasi contemporaneamente ciclofosfammide e un antigene cellulare, nei cui confronti conseguentemente manca la risposta e si instaura una tolleranza abbastanza duratura. Lo stato attuale delle ricerche su questi intricati problemi, i risultati incoraggianti finora conseguiti, pur se apparentemente modesti e non risolutivi, inducono a ritenere possibile in un futuro non lontano la realizzazione di una immunosoppressione specifica, cioè la distruzione selettiva delle sole cellule immunopotenti che intervengono nei singoli casi.
Il valore pratico, oltre che concettuale, della questione è enorme, in quanto le terapie immunosoppressive non solo ledono, come è logico, i sistemi impegnati nelle reazioni di ipersensibilità ritardata che intervengono anche nelle infezioni, ma possono agire ancora sugli altri tipi di risposta immunitaria a loro volta preposti a costituire validi baluardi contro l'attività dei microrganismi: conseguentemente tali terapie possono determinare l'annullamento o l'abbassamento delle difese generali e quindi, come complicanze più frequenti, la comparsa di infezioni concomitanti, solitamente sostenute da germi a potere patogeno scarso o nullo.
Anche la possibilità dell'induzione di tolleranza specifica a mezzo di antigeni iniettati in quantità minime è oggetto di intensi studi, ma fino a questo momento i risultati ottenuti sono modesti.
In realtà, il problema della prevenzione del rigetto potrà essere risolto solo quando le nostre conoscenze sulla induzione dell'ipersensibilità ritardata saranno più profonde. Numerose ricerche hanno chiaramente dimostrato che l'antigene capace di evocare questo tipo di immunità deve avere un costituente proteico, il quale può essere rappresentato anche da una proteina a basso peso molecolare o da un semplice polipeptide.
È significativo a questo riguardo lo studio condotto sulle infezioni da Tricophyton: è stato infatti possibile dimostrare che in tali condizioni l'antigene completo comprende una frazione polisaccaridica e una proteica, e che la sua attività può essere completamente inibita rimuovendo o provocando la scissione della sola frazione proteica. D'altra parte, è ormai accertato che nelle allergie da contatto l'antigenicità dipende non dal farmaco in sé, ma dal complesso derivante dall'unione di questo con le proteine del derma.
L'aspetto che più interessa gli immunologi nel momento attuale e che, effettivamente, costituisce il nucleo centrale di tutto il problema dell'ipersensibilità ritardata anche nei riguardi della sua immediata importanza pratica, è quello della fase finale di questo tipo di risposta immunitaria, identificabile nel momento in cui si attua il danno.
I due elementi cellulari che partecipano a questa fase sono il linfocita sensibilizzato, quindi provvisto in superficie di strutture capaci di reagire specificamente con l'antigene, e il monocita. Quest'ultimo giunge per via ematica nella zona interessata, e istologicamente può apparire in stadi differenti di evoluzione: come istiocita, o come macrofago ripieno di materiale fagocitario, o - nelle lesioni di tipo granulomatoso - come cellula epitelioide, o come cellula gigante: tutti stadi però riconducibili sempre allo stesso tipo cellulare.
Per quanto concerne l'attività dei linfociti, J. L. Turk e D. A. Willoughby hanno dimostrato di recente che le reazioni di ipersensibilità ritardata evolvono in tre tempi, che hanno paragonato ai tre stadi dell'arco riflesso, secondo una nomenclatura in parte già introdotta da R. E. Billingham: lo stadio afferente del processo si identifica col riconoscimento dell'antigene, che potrebbe avvenire o per penetrazione diretta dell'antigene nei linfociti ovvero per informazione antigenica mediata da cellule linfatiche che attraversano la zona dove risiede la sostanza eterologa e pervengono al ganglio linfatico drenante; qui si svolgerebbe il secondo stadio del processo, quello della proliferazione cellulare; nel terzo stadio, corrispondente alla parte efferente dell'arco riflesso, ha luogo la migrazione verso l'antigene di queste cellule immunologicamente attive.
I monociti interessati alla reazione, invece, non sono dotati di specificità: essi derivano dal midollo osseo e, senza subire alcuna differenziazione immunologica da parte del timo o di altri organi equivalenti, entrano nel sangue direttamente dal loro punto di origine in una forma già adatta a incontrare l'antigene.
Tra le numerose acquisizioni attualmente in nostro possesso circa la collaborazione dei due tipi cellulari, dalla quale dipendono in definitiva gli effetti della reazione immunitaria, particolarmente importante appare la dimostrazione fornita da K. R. David (v., 1971) che linfociti sensibilizzati messi a contatto con l'antigene specifico elaborano un fattore proteico capace di inibire la migrazione dei macrofagi, denominato MIF. È ragionevole ammettere che tale fenomeno, osservato in vitro, avvenga anche in vivo: i macrofagi, accorsi nel punto di incontro fra antigene e linfocita specifico, sarebbero quindi bloccati in questa zona e non potrebbero migrare altrove, pur conservando la capacità di esercitare l'attività fagocitaria, che anzi risulta incrementata dallo stesso MIF o da altra sostanza elaborata dal linfocita. E stato calcolato a tale proposito che un solo linfocita sensibilizzato può, una volta venuto a contatto con l'antigene, produrre tanto MIF da inibire la migrazione di 99 macrofagi.
Il MIF è inoltre risultato capace di uccidere in vitro fibroblasti e altri tipi cellulari, probabilmente provocando un considerevole aumento della loro attività lisosomiale.
Per quanto riguarda i tempi dell'attività dei due tipi cellulari, si è accertato che l'inibizione della migrazione avverrebbe nelle prime 24 ore, mentre occorre qualche giorno per giungere alla distruzione delle cellule bersaglio.
Si possono perciò distinguere tre fasi nel processo: la prima, che dura pochi minuti, è quella della reazione fra l'antigene e l'anticorpo specifico legato alla cellula; la seconda, che si svolge in 16-24 ore, culmina nella produzione del MIF; la terza, nella quale si svolgono gli effetti sulle cellule bersaglio, interessa un arco di tempo più lungo.
Il MIF è solo uno dei fattori elaborati dai linfotici specifici. Il linfocita può infatti esplicare almeno dodici attività che tuttavia non si sa ancora se siano dipendenti dall'esistenza di dodici fattori diversi oppure di un numero più limitato di sostanze, ciascuna delle quali dotata di più capacità.
A tutti questi fattori si dà il nome di mediatori linfocitari o anche, secondo un suggerimento di D. C. Dumonde (v. Dumonde e altri, 1969), quello di linfochine. Alle linfochine appartengono, oltre il MIF, l'attivatore dei macrofagi, cui si è già fatto cenno, e un fattore che induce l'aggregazione di queste cellule; un fattore chemiotattico per i macrofagi e uno distinto per i polinucleati; un fattore di estrema importanza, la linfotossina, capace di distruggere le cellule coltivate in vitro. Alcuni mediatori anziché uccidere le cellule bersaglio ne inibiscono la crescita: di questo piccolo gruppo fanno parte il fattore di Lebowitz e Lawrence, quello di Green e quello di Adler e Smith, il quale ultimo esplica attività inibente sulla sintesi del DNA nelle cellule coltivate in vitro. B. R. Bloom e B. Bennet hanno identificato una linfochina capace di provocare reazioni cutanee, alla quale probabilmente sono imputabili gli eritemi cutanei che si manifestano nel corso delle reazioni di ipersensibilità ritardata eseguite a scopo diagnostico. Inoltre, fra i prodotti del linfocita sensibilizzato, si annoverano gli stessi anticorpi specifici, una certa quantità di interferon e infine il transfer factor di Lawrence, con il quale è possibile trasferire lo stato di ipersensibilità in individui normali.
Tutti questi fattori probabilmente agiscono in stretta collaborazione fra loro; tale concomitanza d'azione, d'altronde, è già stata dimostrata per il MIF, per il fattore chemiotattico dei macrofagi e per quello dei microfagi. I fattori chemiotattici, prodotti insieme con il MIF nel punto in cui l'antigene ha preso contatto con i linfociti, richiamano quivi i macrofagi che sono poi trattenuti e attivati dal MIF; in tal modo, nel luogo di incontro si determina un rilevante accumulo di macrofagi, che possono giungere a costituire il 90% di tutti gli elementi cellulari presenti. Il MIF, come si è detto, oltre a trattenere i macrofagi nel distretto colpito, quasi certamente è in grado di attivarli; dei fattori chemiotattici, quello per i macrofagi ha all'incirca lo stesso peso molecolare del MIF (si distingue però da questo per la differente migrazione elettroforetica su gel di acrilamide), quello per i neutrofili ha un peso molecolare inferiore.
Fra i fattori linfotossici il più importante sembra essere la già ricordata linfotossina, una proteina di peso molecolare compreso tra 80.000 e 90.000, la cui scoperta ha segnato una tappa importante, e probabilmente decisiva, nello studio della fase conclusiva delle reazioni di ipersensibilità ritardata, in particolare in quella che è alla base del fenomeno del rigetto, identificabile nella distruzione finale delle cellule bersaglio. In un primo momento (v. Möller, 1965) sembrava chiaro che l'effetto citotossico fosse indotto esclusivamente dall'intimo contatto tra il linfocita aggressore e la membrana della cellula bersaglio. Attualmente, pur ammettendo senza alcuna riserva la specificità del fenomeno - condizione che rappresenta la premessa indispensabile all'ulteriore evoluzione delle altre fasi del processo distruttivo -, si pensa che la distruzione finale della cellula bersaglio avvenga a opera di una sostanza aspecifica, cioè non di un anticorpo, e che questa sostanza debba essere identificata col fattore LT o linfotossina.
Numerosi rilievi, forniti in special modo da G. A. Granger e dal suo gruppo, autorizzano a identificare nella linfotossina il fattore decisivo del processo o almeno il mediatore finale della reazione di ipersensibilità ritardata.
8. Immunopatologia
I processi immunitari non determinano in ogni caso manifestazioni favorevoli negli organismi in cui si svolgono: infatti, come si è visto a proposito dei fenomeni di ipersensibilità, l'introduzione di cellule o sostanze estranee in un vertebrato può indurre risposte immunitarie che si risolvono in effetti dannosi. Le manifestazioni patologiche dell'immunità sono anzi molteplici, tanto che il loro studio ha dato vita a una branca della patologia generale attualmente in via di sviluppo, la immunopatologia, cui compete lo studio sia di questi fenomeni dannosi, sia degli stati morbosi dipendenti dalla diminuita o aumentata attività delle cellule immunocompetenti deputate alla produzione delle immunoglobuline.
Nell'immunopatologia si possono schematicamente comprendere: a) gli stati di deficienza immunitaria; b) le malattie immunoproliferative (v. immunologia e immunopatologia: Malattie immunoproliferative); c) i fenomeni di ipersensibilità (di cui già si è discusso nel precedente capitolo) dato che i meccanismi che ne sono alla base interessano in parte anche le manifestazioni normali dell'immunità; d) i difetti della tolleranza immunitaria, che comprendono le cosiddette malattie autoimmuni (v. immunologia e immunopatologia: Malattie autoimmuni).
a) Immunodeficienze: agammaglobulinemia tipo Bruton, immunodeficienza atasso-teleangectasica, sindrome di Di George, agammaglobulinemia linfopenica del tipo svizzero
Le conoscenze sugli stati di immunodeficienza si sono recentemente ampliate per l'individuazione di nuove sindromi di tal tipo e per l'accurato studio dei rapporti fra le singole carenze e la resistenza alle infezioni. Il merito di questi progressi spetta principalmente a Good e alla sua scuola che, oltre a recare contributi notevoli alla sistematica, hanno acutamente analizzato i rapporti tra le differenti entità nosologiche e le attività immunitarie coinvolte nelle specifiche carenze, contribuendo in tal modo a più profonde acquisizioni anche nel campo dell'immunologia di base.
Attualmente lo sviluppo di queste ricerche è comunque in una fase che può a ragione essere considerata appena iniziale, così che la sistematizzazione delle carenze immunitarie risulta ancora incerta. Molto schematicamente si possono distinguere: a) ipogammaglobulinemie dell'infanzia associate con anomalie dello sviluppo degli organi linfatici e delle cellule immunocompetenti (del tipo T o del tipo B); b) ipogammaglobulinemie acquisite, che si manifestano nell'adolescenza o in un'età più avanzata; c) difetti secondari a leucemie, mielomi e malattie neoplastiche del sistema reticolo-endoteliale.
Grazie alle ricerche condotte in tutto il mondo, si può dire che continuamente si individuano nuove sindromi immunocarenziali. È accertato che esistono affezioni che interessano soltanto la produzione di alcune immunoglobuline e a volte solo di varianti o sottoclassi di immunoglobuline, e altre caratterizzate da deficienze limitate a un solo tipo di risposta immunitaria e finanche a uno specifico antigene. È stata riscontrata, per esempio, una deficienza selettiva riguardante le IgA, un'immunodeficienza generalizzata con corrispettiva elevazione delle IgM, un'immunodeficienza che però si accompagna a una normale quantità di IgG, oppure a un'ipergammaglobulinemia, ecc.
Fra le sindromi più interessanti e più note, il cui studio ha recentemente consentito di chiarire importanti aspetti dei meccanismi della resistenza immunitaria, sono: l'agammaglobulinemia tipo Bruton, l'immunodeficienza con atassia e teleangectasia, la sindrome di Di George, l'agammaglobulinemia linfopenica del tipo svizzero.
La prima di queste sindromi, descritta da Bruton nel 1952, è un'agammaglobulinemia legata al sesso: ne sono colpiti solo i maschi, che non producono globuline o ne producono pochissime, e sono privi di plasmacellule e di centri germinativi nei tessuti linfatici. In questi soggetti, tuttavia, il timo e i linfociti circolanti nel sangue appaiono del tutto normali, così che le loro capacità immunitarie legate alla reazione di ipersensibilità ritardata sussistono inalterate.
È assai probabile che negli agammaglobulinemici tipo Bruton si determini, dopo la settima settimana della vita embrionale, un arresto nel processo di differenziazione delle cellule linfatiche, dal momento che come è noto i tessuti timici si formano prima di questo periodo, mentre le plasmacellule (sistema cellulare B) appaiono più tardi. Si è pertanto indotti a pensare che si tratti di un difetto genetico consistente nella perdita di enzimi necessari alla differenziazione del secondo sistema linfatico.
Di particolare interesse è il comportamento di questi agammaglobulinemici di fronte alle infezioni; nei primi mesi di vita, infatti, la loro capacità di reagire è assolutamente normale, grazie alla protezione fornita dagli anticorpi materni filtrati attraverso la placenta durante la vita intrauterina. Dopo questo primo periodo, però, quando tale protezione risulta insufficiente e la capacità reattiva è affidata interamente alloro sistema di difesa, i piccoli pazienti si rivelano assai sensibili alle infezioni, particolarmente a quelle sostenute da germi fortemente virulenti e tra questi soprattutto dai batteri capsulati. I bambini affetti da agammaglobulinemia di Bruton sono inoltre molto suscettibili all'infezione da virus dell'epatite virale e a quella da Pneumocistis carinii.
In questo tipo di agammaglobulinemia è possibile la terapia gammaglobulinica, la quale, tuttavia, lascia pur sempre i pazienti in una situazione insicura e di difficile controllo.
La immunodeficienza atasso-teleangectasica dipende invece dalla mancata maturazione del sistema T. Questa malattia è caratterizzata, dal punto di vista clinico, da atassia progressiva e da teleangectasie localizzate per lo più nella cute della regione oculare, mentre il quadro istopatologico comprende gravi alterazioni del timo, che possono giungere fino alla completa mancanza dell'organo.
In buona parte dei pazienti, inoltre, mancano del tutto le IgA, mentre solo pochi di essi risultano carenti di IgG. Queste alterazioni determinano una deficienza nell'immunità verso i trapianti e una particolare sensibilità verso le infezioni delle mucose, in particolare delle prime vie respiratorie, in evidente relazione con la mancanza di cellule formanti IgA.
Il trattamento profilattico e curativo di questi malati è molto problematico e si impernia sull'uso di antibiotici e sul drenaggio sistematico dell'albero bronchiale.
I bambini affetti dalla sindrome di Di George nascono senza timo e senza paratiroidi: essi, pertanto, presentano sintomi gravissimi di ipoparatiroidismo (tetania neonatale), che ne rendono possibile la diagnosi precoce. Questi pazienti, i cui livelli ematici di immunoglobuline sono normali e a volte più elevati della norma, reagiscono anche normalmente a una grande varietà di antigeni e producono plasmacellule e centri germinativi nei linfonodi; al contrario, sono incapaci di rigettare i trapianti e di dar luogo a tutte le altre manifestazioni di tipo ritardato, e pertanto risultano particolarmente sensibili alle infezioni da Mico- batteri e da Miceti. Particolarmente virulenti si dimostrano nei confronti ditali soggetti i Micobatteri atipici e anche i Micobatteri con virulenza attenuata e le Candide; conseguenze mortali possono avere diverse infezioni virali, fra le quali quella da virus citomègalici e il morbillo.
A scopo terapeutico è stato tentato in qualche caso il trapianto di timo con risultati abbastanza incoraggianti: il primo bambino sottoposto a questa operazione sopravvive da oltre tre anni.
L'agammaglobulinemia linfopenica di tipo svizzero, così chiamata perché i ricercatori svizzeri sono stati i primi a descriverla, è dovuta a un deficit che si manifesta in uno stadio molto primitivo dell'evoluzione degli organi linfatici, precisamente quello che precede la differenziazione della cellula staminale; nei bambini affetti da questa malattia, quindi, non si sviluppano i tessuti linfatici e non sono presenti cellule timodipendenti né cellule B. Il timo è ipoevoluto, mancano gli anticorpi nel sangue e le plasmacellule negli organi linfatici; i pazienti non sono capaci di ipersensibilità ritardata e presentano marcata suscettibilità alle infezioni sostenute da tutti i microrganismi (batteri, funghi, protozoi e virus), tanto che raramente possono compiere il primo anno di vita.
Quale terapia Good ha proposto in questi casi quello che egli chiama un procedimento di ingegneria cellulare, e cioè l'innesto di cellule linfatiche provenienti da altri organismi (innesti di tessuto epatico e di timo fetale). Nei pochi casi trattati si è ottenuto un rapido miglioramento delle condizioni del paziente, un aumento notevole dei linfociti che da 500 per mmc salgono ad oltre 5.000 e l'acquisizione della capacità di operare processi di ipersensibilità ritardata; ma a distanza di qualche giorno il paziente soccombe a causa di una graft versus host reaction.
Questa reazione, molto nota in patologia sperimentale, ha luogo quando linfociti competenti immunologicamente sono trasferiti da un individuo a un altro, fra animali non singenici. In questo caso, poiché il donatore e il ricevente hanno corredo antigenico diverso, si possono determinare due evenienze: o il ricevente ha cellule competenti per le cellule linfatiche estranee, che allora verranno distrutte; oppure il ricevente non ha competenza immunologica, ovvero manca del tutto di linfociti, e allora le cellule del donatore reagiranno contro gli antigeni dell'organismo in cui sono state trapiantate. In altre parole, o si instaura una reazione dell'ospite verso il trapianto, oppure si ha il processo inverso e cioè una reazione del trapianto linfocitario verso gli antigeni dell'ospite; ne consegue un vero e proprio stato patologico con conseguenze molto gravi.
b) Difetti della tolleranza: le malattie autoimmuni
I processi morbosi dipendenti da deficit della tolleranza si identificano con le malattie autoimmuni (v. immunologia e immunopatologia: Malattie autoimmuni).
Si è già più volte ricordato che i Vertebrati sono capaci di distinguere i propri costituenti, verso i quali acquisiscono una specifica tolleranza durante la vita fetale, dalle sostanze eterogenee. Lo stato di tolleranza normalmente viene mantenuto in tutto il corso della vita, ma i meccanismi omeostatici che lo rendono possibile a volte non si mantengono a un livello di perfetta funzionalità; in special modo coll'andare degli anni la tolleranza verso l'uno o l'altro dei propri costituenti può andare perduta e conseguentemente si possono formare anticorpi in grado di reagire contro i componenti dello stesso organismo, i cosiddetti autoanticorpi.
Questi in molti casi non provocano alcun danno all'organismo, anzi concorrono all'eliminazione di parte dei suoi costituenti modificati o comunque danneggiati: ad esempio, nel sangue di individui che hanno superato un infarto del miocardio si riscontrano anticorpi che reagiscono con componenti delle fibre miocardiche alterate dal processo morboso. In altri casi, invece, gli autoanticorpi possono provocare la comparsa di manifestazioni patologiche, che sono appunto conosciute come malattie autoimmuni.
Sulla base di tale impostazione teorica H. G. Kunkel e E. M. Tan suddividono gli autoanticorpi in due categorie: i patogeni e i fisiogeni, comprendendo questi ultimi non soltanto quelli alla cui presenza non corrisponde alcuna malattia, ma anche una parte di quelli che si riscontrano nelle malattie autoimmuni e che probabilmente costituiscono più un prodotto del fatto patologico che la causa della sindrome stessa.
J. Roitt divide le malattie autoimmuni in tre categorie: quelle organospecifiche, quelle generalizzate e infine un raggruppamento intermedio che non si può agevolmente identificare né con le prime, né con le seconde.
Esempio classico di forma organospecifica è la malattia di Hashimoto, una tiroidite autoimmune contrassegnata da una specifica lesione tiroidea con distruzione delle cellule, nella quale è dimostrata la produzione di anticorpi circolanti dotati di una specificità assoluta verso i costituenti della tiroide stessa.
Esempio di malattia autoimmune generalizzata è il lupus eritematoso sistemico, nel quale le lesioni da autoanticorpi non sono limitate a un solo organo ma diffuse al connettivo dei vari distretti dell'organismo: cute, rene, membrane sierose, vasi, articolazioni, tessuti linforeticolari ed emopoietici. La malattia è inoltre caratterizzata dalla enorme produzione dei cosiddetti fattori antinucleari, cioè anticorpi diretti contro i nuclei cellulari.
La possibilità di dimostrare diversi tipi di autoanticorpi non è esclusiva del lupus: ad esempio, nel 10% degli individui affetti da malattia di Hashimoto si può osservare l'insorgenza di un'anemia autoimmune, condizione che si verifica appena nello 0,2% dei soggetti normali; in molti addisoniani, inoltre, si sviluppano malattie autoimmuni della tiroide, e situazioni simili sono osservabili più o meno in tutte le sindromi da autoanticorpi. Sembrerebbe così dimostrata l'esistenza, negli individui affetti da malattie autoimmuni, di quella particolare labilità dei meccanismi di omeostasi ai quali si è accennato precedentemente e che rendono possibile il mantenimento dello stato di tolleranza.
I meccanismi coinvolti nella patogenesi di queste malattie sono quelli dell'ipersensibilità, essenzialmente quella citotossica, quella ritardata e quella mediata da complessi immuni.
In tutte le anemie da autoanticorpi predomina l'effetto citotossico, al quale è anche imputabile la tiroidite; autoanticorpi specifici verso le piastrine intervengono nella porpora trombocitopenica, così come alcune rare linfopenie essenziali dipendono appunto da autoanticorpi specifici ad attività citotossica sui linfociti.
Anche l'anemia perniciosa è prodotta da un autoanticorpo specifico verso il fattore intrinseco presente nel succo gastrico e prodotto da plasmacellule localizzate nella lesione gastritica.
All'azione di autoanticorpi umorali sono ascrivibili anche i rari casi di infertilità essenziale dell'uomo, in cui gli spermatozoi eiaculati insieme con autoanticorpi sono fra loro agglutinati e posti nell'impossibilità di muoversi e di penetrare nel muco cervicale.
Altro esempio di attività citotossica legata alla produzione di autoanticorpi è fornito da alcune glomerulonefriti, determinate dall'azione di autoanticorpi circolanti specifici verso la membrana basale del glomerulo, sulla quale si fissano legandovi anche il complemento; infatti, mediante le biopsie renali eseguite in individui affetti da queste malattie, è stato possibile dimostrare la deposizione a livello glomerulare di IgG e della proteina β1C, cioè del componente C3 dopo fissazione.
Un meccanismo di ipersensibilità mediata da complessi immuni è invece responsabile di altre malattie autoimmuni, fra le quali il lupus eritematoso sistemico (v. immunologia e immunopatologia: Malattie autoimmuni).
Il meccanismo dell'ipersensibilità ritardata con grande probabilità interviene, sebbene in grado diverso, nella patogenesi di molte malattie autoimmuni. Si ritiene attualmente che soprattutto, se non esclusivamente, attraverso questo meccanismo si determinino le lesioni della colite ulcerosa: recenti ricerche in vitro hanno consentito di dimostrare che linfociti prelevati a individui affetti da tale malattia sono in grado di distruggere le cellule del colon.
Si è già fatto cenno alla distinzione fra autoanticorpi contro costituenti normali e autoanticorpi verso costituenti che hanno subito un'alterazione: è bene precisare che questa deve essere considerata secondo un significato ampio, nel senso che può interessare anche soltanto alcuni determinanti specifici del componente normale. In altre parole, le modificazioni della molecola possono coinvolgere solo una minima parte della superficie esposta e in questo modo si spiegherebbe la relativa facilità con la quale si può avere una risposta autoimmune. A tale proposito è opportuno fare due considerazioni.
1. Almeno da un punto di vista generico è più semplice rendersi conto dell'esistenza di autoanticorpi verso costituenti alterati che non di quelli verso costituenti normali. Infatti, poiché i costituenti alterati si trasformano in veri e propri antigeni eterogenei per l'organismo, i meccanismi mediante i quali si formano gli autoanticorpi contro questi autoantigeni appaiono identici a quelli che sono alla base dell'immunogenesi normale, anche se l'alterazione riguarda soltanto una porzione infinitesima della molecola. Questa ipotesi ha ricevuto numerose conferme sperimentali, soprattutto per merito di W. C. Weigle, il quale ha affrontato il problema da oltre un decennio: egli è riuscito a interrompere la tolleranza immunitaria verso un determinato antigene a mezzo di iniezioni di altri antigeni in grado di dare col primo reazioni crociate, dimostrando così che è sufficiente che in un organismo giungano molecole aventi in comune con quelle tollerate solo alcuni determinanti, perché la tolleranza venga perduta.
2. Gli autoanticorpi verso costituenti alterati sembrano essere molto più frequenti di quanto non si immaginasse qualche anno fa.
Era noto da tempo che numerosi agenti fisici, chimici e biologici possono modificare la normale struttura delle proteine, tanto che il problema per lungo tempo non ha attratto l'attenzione dei ricercatori, i cui sforzi erano invece rivolti a fornire una spiegazione valida e documentata della formazione degli autoanticorpi verso i costituenti normali. Da alcuni anni, tuttavia, si è risvegliato l'interesse per lo studio degli autoanticorpi che si formano a seguito della comparsa di costituenti alterati e in breve tempo è stato possibile raccogliere e sottoporre al vaglio della critica numerosi dati sperimentali.
Si è potuto stabilire che nella maggior parte dei casi i fattori responsabili dell'alterazione dei costituenti normali degli organismi sono quelli biologici, in modo particolare batteri e virus. Varie sono le modalità secondo le quali in tali condizioni può avere inizio una risposta autoimmune: 1) liberazione di costituenti anche normali, che vengono smascherati dall'attività patogena dei microrganismi; 2) modificazioni determinate da enzimi elaborati da alcuni microrganismi (clostridi, micoplasmi, ecc.); 3) combinazione di piccole molecole derivate dai microrganismi con componenti dei tessuti che funzionano da carrier, con conseguente formazione di anticorpi sia verso l'aptene (di natura microbica), sia verso la proteina vettrice, questi ultimi quindi veri autoanticorpi; 4) reattività crociata, dovuta alla somiglianza, e talvolta all'identità, fra costituenti batterici e costituenti dell'organismo ospite: basti ricordare a questo proposito le numerose specie batteriche appartenenti ai generi Escherichia, Salmonella, Klebsiella ecc. che possiedono antigeni molto simili a quelli dei gruppi sanguigni dell'uomo. Alcuni ceppi di Escherichia coli hanno antigeni in comune con la mucosa del colon umano, ed è senza dubbio significativa a tale riguardo la dimostrazione fornita da E. J. Holborow e collaboratori che in conigli immunizzati con un ceppo di questo germe si formano anticorpi capaci di reagire con il proprio intestino crasso. Altrettanto note sono le correlazioni esistenti tra gli streptococchi beta-emolitici di gruppo A e alcuni costituenti del miocardio e quelle tra streptococchi beta-emolitici e il rene; 5) attività dei batteri come adiuvanti, che in tal modo possono favorire non solo la produzione di anticorpi nella normale risposta immune, ma anche l'induzione di processi di ipersensibilità ritardata e di vere e proprie sindromi autoimmuni.
Un discorso a parte va fatto per i virus e in modo particolare per tutti quelli a rivestimento lipoproteico. È noto che nel corso di un'infezione virale vengono prodotti anti- corpi circolanti la cui attività non sembra limitata esclusivamente all'eliminazione dei virioni dall'organismo: è stato infatti dimostrato che le lesioni della coriomeningite linfocitaria del topo sono conseguenti alla produzione degli anticorpi e intimamente correlate al loro intervento, e si ha ragione di ritenere che lo stesso avvenga anche nel corso di malattie del sistema nervoso centrale da virus lenti e da virus latenti. Tutti questi virus sono rivestiti da un pericapside di natura lipoproteica, la cui frazione lipidica proviene direttamente dalla membrana delle cellule ospiti; gli anticorpi che l'organismo formerà verso questa frazione reagiranno quindi non soltanto contro i virioni ma anche contro alcune strutture cellulari. Si può obiettare che il lipide è una sostanza propria dell'organismo infetto e pertanto dovrebbe essere tollerato, ma è noto che la vicinanza di due determinanti, l'uno eterogeneo e l'altro tollerato, può indurre la perdita dello stato di tolleranza nei confronti del secondo: in questo caso i presupposti teorici che possono spiegare l'evoluzione del fenomeno consistono nella contemporanea presenza sullo stesso vettore, cioè sul virione, di strutture virali, quindi estranee, e di strutture proprie dell'organismo interessato.
La comprensione dell'autoimmunità rimane molto più difficile per quei casi nei quali non sembra verosimile un'alterazione, pur anche parziale, dei costituenti dell'organismo. Per spiegare questo tipo di autoimmunità, il cui numero di casi peraltro sembra si possa sempre più restringere soprattutto per la difficoltà di escludere un pregresso intervento di agenti fisici e chimici, anche in assenza di qualsiasi noxa infettiva, si fa ricorso ad argomentazioni prevalentemente teoriche. Le due ipotesi più accreditate sono attualmente quella di Burnet e quella del superstimolo. Burnet ha invocato un turbamento dei meccanismi centrali dell'immunogenesi per spiegare la formazione degli autoanticorpi; tali disfunzioni comporterebbero l'insorgenza di doni di linfociti, capaci di rispondere allo stimolo dei costituenti normali. Questi doni, che Burnet chiama aberranti o interdetti, apparirebbero nei Vertebrati di continuo, ma verrebbero isteriliti per un processo di omeostasi, basato sulla contemporanea presenza nell'organismo di quantità rilevanti del costituente interessato; in qualche caso, però, il numero dei linfociti diverrebbe rilevante, ostacolando in tal modo il processo omeostatico e dando innesco alla malattia autoimmune. A sostegno di questa ipotesi sarebbe il frequente reperto di centri germinativi nel timo in diverse malattie autoimmuni dell'uomo (lupus eritematoso, miastenia grave, artrite reumatoide, ecc.) e del topo. In un ben noto ceppo di questi animali (NZB) si instaura spontaneamente un'anemia autoimmune; in tale condizione l'esame istologico consente di dimostrare l'insorgenza di centri germinativi nel timo.
Si deve tuttavia aggiungere che i topi di questo ceppo si ammalano anche se vengono timectomizzati dalla nascita, e che d'altro canto nell'uomo la timectomia, di notevole ausilio nella miastenia e in alcune anemie emolitiche, non ha alcun effetto nei casi di lupus e di artrite reumatoide. L'ipotesi di Burnet, pur così suggestiva, è quindi ben lungi dall'esser convalidata dalle osservazioni sperimentali e cliniche.
La seconda teoria ammette l'intervento di un superstimolo; esisterebbe cioè nell'autoimmunità un'anormalità dell'induzione più che della risposta immune. L'ipotesi viene suffragata dalla cognizione che in patologia sperimentale, per ottenere produzione di autoanticorpi, l'estratto dell'organo prescelto deve essere inoculato nell'animale insieme con l'adiuvante di Freund, costituito da un'emulsione di oli minerali miscelata con micobatteri uccisi o con altri microrganismi anche tassonomicamente molto distanti dai primi. Va ricordato, inoltre, che l'adiuvante provoca nell'animale la formazione di granulomi sterili intorno ai quali si costituiscono manicotti delle stesse cellule responsabili della risposta immune, e che anche nelle malattie granulomatose dell'uomo si instaurano frequentemente fenomeni di tipo autoimmune.
L'ipotesi del superstimolo quindi sembra trovare ragionevoli riscontri nelle osservazioni condotte sull'uomo e sugli animali, e indirettamente suffraga l'importanza attribuita agli agenti infettivi nella patogenesi delle malattie autoimmuni.
bibliografia
Abdou, N. I., Richter, M., The role of bone marrow in the immune response, in ‟Advances in immunology", 1970, XII, pp. 202-258.
Abramoff, P., La Via, M., Biology of the immune response, New York 1970.
Amos, B., Genetic and antigenic aspects of human histocompatibility systems, in ‟Advances in immunology", 1969, X, pp. 251-298.
Askonas, B. A., Rhodes, J. M., Immunogenicity of antigen-containing ribonucleic acid preparations from macrophages, in ‟Nature", 1965, CCV, pp. 470-474.
Boyd, W., Fundamentals of immunology, New York 1966.
Bretscher, P. A., Cohn, M., Minimal model for the mechanism of antibody induction and paralysis by antigen, in ‟Nature", 1968, CCXX, pp. 444-448.
Burnet, M., Cellular immunology, Melbourne-Cambridge 1969.
Califano, L., Elementi di microbiologia ed immunologia, Napoli 1966.
Campbell, D. H., Garvey, J. S., Nature of retained antigen and its role in immune mechanisms, in ‟Advances in immunology", 1963, III, pp. 261-313.
Cavallo, G., Elementi di immunologia, Parma 1970.
Cavallo, G., Forni, G., Considerazioni sulla genesi dell'autoimmunità, in ‟Giornale di bacteriologia, virologia e immunologia", 1971, LXIV, pp. 202-214.
Celada, F., The cellular basis of immunological memory, in ‟Progress in allergy", 1971, XV, pp. 223-258.
David, K. R., Mediators produced by sensitized lymphocytes, in ‟Federation proceedings", 1971, XXX, pp. 1730-1735.
Dresser, D. W., Mitchison, N. A., The mechanism of immunological paralysis, in ‟Advances in immunology", 1968, VIII, pp. 129-174.
Dumonde, D. C., The role of lymphocytes and macrophages in the immunological response, Berlin 1971.
Dumonde, D. C., Wolstencroft, R. A., Ponayi, G. S., Matthew, M., Morley, J., Howson, W. T., Lymphokines. Nonantibody mediators of cellular immunity generated by lymphocyte activation, in ‟Nature", 1969, CCXXIV, pp. 38-42.
Elkins, W. L., Cellular immunology and the pathogenesis of graft versus host reactions, in ‟Progress in allergy", 1971, XV, pp. 78-167.
Good, R. A., Fisher, D. W., Immunobiology, Stanford 1971.
Heidelberger, M., Plescia, O. J., Immunochemical approaches to problems in microbiology, New Brunswick, N. J., 1961.
Humphrey, J. H., Dourmashkin, R. R., The lesions in cell membranes caused by complement, in ‟Advances in immunology", 1969, XI, pp. 75-113.
Ivanyi, P., The major histocompatibility antigens in variations species, in ‟Current topics in microbiology and immunology", 1970, LIII, pp. 2-69.
Kinsky, S. C., Luse, S. A., Van Deenen, L. L. M., Interaction of polyene antibiotics with natural and artificial membrane systems, in ‟Federation proceedings", 1966, XXV, p. 1503.
Kunkel, H. G., Tan, E. M., Autoantibodies and disease, in ‟Advances in immunology", 1964, IV, pp. 351-396.
Lawrence, H. S., Landy, M., Mediators of cellular immunity, New York 1969.
Mäkelä, O., Cross, A. M., The diversity and specialization of immunocytes, in ‟Progress in allergy", 1970, XIV, pp. 145-194.
Mäkelä, O., Cross, A., Kosunen, T. U., Cell interactions and receptor antibodies in immune responses, New York 1971.
Miller, J. F. A. P., Effect of thymectomy in adult mice on immunological responsiveness, in ‟Nature", 1965, CCVIII, pp. 1337-1338.
Miller, J. F. A. P., Mitchell, G. F., Cell to cell interaction in the immune response. V. Target cells for tolerance induction, in ‟Journal of experimental medicine", 1970, CXXXI, pp. 675-699.
Mitchison, N. A., Induction of immunological paralysis in two zones of dosage, in ‟Proceedings of the Royal Society" (Series B), 1964, CLXI, pp. 275-292.
Möller, E., Contact induced cytotoxicity by lymphoid cells containing foreign isoantigens, in ‟Science", 1965, CXLVII, pp. 873-874.
Müller-Eberhard, H. J., Chemistry and reaction mechanisms of complement, in ‟Advances in immunology", 1968, VIII, pp. 2-72.
Müller-Eberhard, H. J., The molecular basis of the biologic function of complement, in ‟La ricerca", 1971, I, pp. 60-109.
Nossal, G. J. V., Ada, G. L., Antigens, lymphoid cells and the immune response, New York 1971.
Orange, R. P., Kaliner, M. A., Laraia, P. J., Austen, K. F., Immunological release of histamine and slow reacting substance of anaphylaxis from human lung. II. Influence of cellular levels of cyclic AMP, in ‟Federation proceedings", 1971, XXX, pp. 1725-1729.
Osler, A. G., Randall, H. G., Hill, B. M., Ovary, Z., Studies on the mechanism of hypersensitivity phenomena. III. The participation of complement in the formation of anaphylatoxin, in ‟Journal of experimental medicine", 1959, CX, pp. 311-339.
Pillemer, L., Blum, L., Lepow, I. H., Ross, O. A., Todd, E. W., Wardlaw, A. C., The properdin system and immunity. Demonstration and isolation of a new serum protein, properdin, and its role in immune phenomena, in ‟Science", 1954, CXX, pp. 279-285.
Plescia, O. J., The role of the carrier in antibody formation, in ‟Current topics in microbiology and immunology", 1969, L, pp. 78-100.
Plescia, O. J., Braun, W., Nucleic acids in immunology, New York 1968.
Plescia, O. J., Braun, W., Palczuk, N. C., Production of antibodies to denatured deoxiribonucleic acid (DNA), in ‟Proceedings of the National Academy of Sciences", 1964, LII, pp. 279-285.
Plescia, O. J., Palczuk, N. C., Cora-Figueroa, E., Mukheriee, A., Braun, W., Production of antibodies to soluble RNA, in ‟Proceedings of the National Academy of Sciences", 1965, LIV, pp. 1281-1285.
Rajewsky, K., Schirrmacher, V., Nase, S., Jerne, N. K., The requirement of more than one antigenic determinant for immunogenicity, in ‟Journal of experimental medicine", 1969, CXXIX, pp. 1131-1143.
Roitt, I., Essential immunology, Oxford 1971.
Rosse, W. F., Doumarshkin, R. R., Humphrey, J. M., Immune lysis of normal human red blood cells and paroxysmal nocturnal hemoglobinuria (PNH). III. The membrane defect caused by complement lysis, in ‟Journal of experimental medicine", 1966, CXXIII, pp. 969-984.
Schwartz, R. S., Ryder, R. J. W., Gottlieb, A. A., Macrophages and antibody synthesis, in ‟Progress in allergy", 1970, XIV, pp. 81-131.
Sela, M., Immunological studies with synthetic polypeptides, in ‟Advances in immunology", 1966, V, pp. 29-129.
Singhal, S. K., Wigzell, H., Cognition and recognition of antigen by cell associated receptors, in ‟Progress in allergy", 1971, XV, pp. 188-215.
Sterzl, J., Silverstein, A. M., Development aspects of immunity, in ‟Advances in immunology", 1967, VI, pp. 337-459.
Sulitzeanu, D., Antibody-like receptors on immunocompetent cells, in ‟Current topics in microbiology and immunology", 1971, LIV, pp. 1-14.
Talmage, D. W., Radovich, J., Hemmingsen, H., Cell interaction in antibody synthesis, in ‟Advances in immunology", 1970, XII, pp. 271-279.
Turk, J. L., Delayed hypersensitivity, Amsterdam 1967.
Van Furt, R., Schnit, H. R. E., Humans, W., The formation of immunoglobulins by human tissues ‛in vitro'. IV. Circulating lymphocytes in normal and pathological conditions, in ‟Immunology", 1966, XI, pp. 29-40.
Vaz, N. M., Prouvost-Danon, A., Behaviour of mouse mast cells during anaphylaxis ‛in vitro', in ‟Progress in allergy", 1969, XIII, pp. 111-159.
Malattie autoimmuni
di Antonio Ascenzi e Cesare Bosman
sommario: 1. Introduzione. 2. La tolleranza immunitaria. 3. Evasione e soppressione della tolleranza immunitaria. 4. Condizioni e situazioni determinanti la malattia autoimmune. 5. Criteri di identificazione e classificazione delle malattie autoimmuni. 6. Malattie autoimmuni sistemiche. 7. Malattie autoimmuni di singoli organi e apparati. 8. Conclusioni e prospettive. □ Bibliografia.
1. Introduzione
Si definiscono autoimmuni le malattie contrassegnate dai seguenti attributi: a) perdita della tolleranza immunitaria verso normali costituenti di organi e tessuti con comparsa di autoanticorpi; b) infiltrazione flogistica delle strutture interessate; c) prevenzione della produzione autoanticorpale e delle lesioni a questa associate con l'uso di agenti immunosoppressivi; d) eventuale trasmissione passiva del processo mediante inoculazione di siero o di linfociti (v. Asherson, 1967).
Sebbene la presente definizione faccia essenzialmente riferimento a criteri sperimentali, non se ne conosce a tutt'oggi una più adeguata ed esauriente. Infatti, se è vero che le malattie autoimmuni rappresentano uno dei capitoli più suggestivi della patologia, non si può d'altro canto non riconoscere che esso è ancora mal definito.
Per rendersi conto del significato eziopatogenetico delle malattie autoimmuni sarà opportuno ricordare come originariamente sia stato accettato il concetto che qualunque organismo suscettibile di risposta immunitaria rifiuta di reagire con un antigene autologo. Tale concetto, implicito nell'espressione horror autotoxicus, suggerita fin dal 1900 da P. Ehrlich e J. Morgenroth (v., 1900), è stato più tardi ribadito da F. M. Burnet e F. Fenner (v., 1941) con l'introduzione del termine autoidentificazione (self-recognition). Con tali denominazioni si vuole appunto intendere come in condizioni normali il sistema immunologico provveda alla conservazione dell'integrità dell'organismo, inducendo la formazione di anticorpi solo verso antigeni eterologhi, cioè estranei all'organismo medesimo.
Malgrado la categoricità dell'espressione horror autotoxicus, gli stessi Ehrlich e Morgenroth non esclusero la possibilità da parte dell'organismo di suscitare la formazione di autoanticorpi; per contro supposero l'esistenza di meccanismi omeostatici capaci di difenderlo da azioni nocive degli stessi anticorpi, avendo constatato come la loro presenza potesse risultare del tutto innocua.
I problemi fondamentali che si pongono in merito all'eziopatogenesi generale delle malattie autoimmuni concernono: a) le modalità attraverso le quali si inducono gli autoanticorpi; b) il ruolo degli autoanticorpi nel determinismo della malattia autoimmune; c) la definizione dei criteri intesi a identificare una malattia come autoimmune.
2. La tolleranza immunitaria
Il problema degli autoanticorpi e della loro genesi implica la conoscenza dell'alterazione del meccanismo immunitario che ne consente la formazione.
Se si parte dalla premessa che la mancata risposta immunitaria da parte dei normali componenti (o antigeni autologhi) dell'organismo costituisce uno stato di tolleranza immunitaria acquisita verso questi stessi antigeni, è lecito considerare l'autoimmunità sotto due profili patogenetici diversi. Si può perdere la tolleranza immunitaria per soppressione dei meccanismi normalmente preposti al suo mantenimento oppure può verificarsi che, malgrado il normale funzionamento di questi stessi meccanismi, taluni antigeni sfuggano al loro controllo, consentendo abnormi risposte autoimmuni.
Il problema della tolleranza immunitaria e delle sue turbe è strettamente connesso con quello dell'immunità, di cui, si può dire, costituisce l'‛altra faccia'. Torna pertanto opportuno accennare preliminarmente alle teorie fondamentali dell'immunità in riferimento alla tolleranza immunitaria.
Le teorie sull'immunità possono essere distinte in istruttive e selettive. Stando alle prime, gli stessi antigeni influenzano la formazione delle immunoglobuline, sicché ognuna di queste è dotata di specifica affinità per il proprio antigene. Le teorie selettive postulano l'esistenza di un numero sufficientemente elevato di cellule immunocompetenti, in modo che per ciascuno dei possibili antigeni presenti in natura vi siano cellule dotate di intrinseca capacità a reagire specificamente con loro. Secondo tale concezione l'antigene non è più l'induttore dell'anticorpo, ma seleziona la cellula che può produrre anticorpi specifici nei suoi confronti.
Le teorie istruttive possono essere a loro volta suddivise in due sottogruppi, quello dell'informazione diretta (direct template) e quello dell'informazione indiretta (indirect template).
Le teorie dell'informazione diretta riconoscono un ruolo fondamentale all'antigene, in quanto questo, fungendo da modello, conferirebbe alla molecola anticorpale una configurazione complementare alla propria struttura (v. Pauling, 1940; v. Karush, 1958). Queste teorie hanno il pregio di chiarire in modo semplice la specificità immunologica dell'anticorpo e permettono di spiegare come il numero di anticorpi producibili in funzione della specificità sia praticamente illimitato, in rapporto all'immenso numero di antigeni naturali e artificiali con i quali l'organismo può potenzialmente venire in contatto. Tuttavia le stesse teorie incontrano difficoltà ad essere accettate per quanto attiene alla spiegazione del fenomeno della tolleranza immunitaria, sebbene sia stata invocata l'esistenza di enzimi specifici preposti alla lisi degli anticorpi indotti da antigeni autologhi.
Per le deficienze insite nelle teorie dell'informazione diretta e per la necessità di ricondurre l'anticorpopoiesi al processo più generale delle sintesi proteiche, si sono formulate le teorie dette dell'informazione indiretta, la prima delle quali è stata avanzata da Burnet e Fenner (v., 1941). Questa prevede che nelle cellule immunocompetenti esista un'entità anticorpopoietica capace di replicazione e suscettibile di modificazioni da parte dell'antigene. Sono queste modificazioni che risultano responsabili della specificità dell'anticorpo, mentre la proprietà replicativa assicura la trasmissione ereditaria ditale specificità. In un primo tempo la mancanza di nozioni precise sulle modalità della sintesi proteica indusse Burnet e Fenner ad ipotizzare che l'entità suscettibile di replicazione corrispondesse al complesso degli enzimi preposti alla formazione degli anticorpi. Più tardi Burnet (v., 1956) corresse la teoria, identificando l'unità replicativa negli acidi desossiribonucleici (DNA) e supponendo, contemporaneamente a Schweet e Owen (v., 1957), che gli stessi acidi desossiribonucleici fossero suscettibili di mutazione genetica specifica per azione dell'antigene. Sulla stessa scia Goldstein (v., 1960) elaborò una teoria sull' azione modificatrice degli acidi ribonucleici (RNA) da parte dell'antigene. Le teorie dell'informazione indiretta spiegano la tolleranza immunitaria sulla base dell'ipotesi di Burnet (v. Burnet e Fenner, 1941) e cioè che gli antigeni autologhi sarebbero dotati di un contrassegno strutturale (self-marker) il quale ne consentirebbe il riconoscimento attivo da parte delle cellule del sistema immunitario.
La difficoltà di chiarire il meccanismo molecolare secondo il quale l'antigene provoca una mutazione degli acidi desossiribonucleici o degli acidi ribonucleici ha aperto la via all'elaborazione delle teorie dette selettive. La prima teoria del genere è stata proposta nel 1955 da N. K. Jerne. Egli postula che nel corso della vita embrionale vengano sintetizzate (probabilmente dal timo) all'incirca un milione di molecole di γ-globuline con caratteristiche immunochimiche differenti. Tali molecole, capaci di replicarsi e di reagire alla stregua di anticorpi, saranno poi usate dalle cellule anticorpopoietiche come modelli per produrne altri. Tuttavia quelle suscettibili di reagire con autoantigeni vengono eliminate già durante la vita fetale, cioè prima che si sviluppino le cellule anticorpopoietiche. Quando, dopo la nascita, l'organismo viene a contatto con antigeni eterologhi, questi si combinano elettivamente con le γ-globuline (anticorpi preformati) dotate di molecola a configurazione specifica complementare. Ne consegue un aumento della penetrazione nelle cellule di globuline che, essendo suscettibili di replicazione e fungendo da modello, danno origine a ulteriori anticorpi dotati della stessa specificità.
In definitiva, secondo la teoria di Jerne, la tolleranza immunitaria consegue all'eliminazione degli autoanticorpi nel corso della vita fetale.
Nel 1957 altre teorie selettive vennero sviluppate da D. W. Talmage e da Burnet. Particolare successo ha avuto quella di quest'ultimo autore, detta anche della ‛selezione clonale': in base ad essa l'antigene selezionerebbe direttamente la cellula immunopoietica portatrice dell'anticorpo specifico e la stimolerebbe a proliferare con sviluppo di cloni geneticamente condizionati a dare origine a nuovi anticorpi specifici capaci di reagire con antigeni dello stesso tipo. Secondo questa teoria, la tolleranza immunitaria non deriverebbe dalla scomparsa delle γ-globuline prima dello sviluppo degli elementi anticorpopoietici; sarebbe l'autoantigene che, venendo a contatto con l'anticorpo specifico nel contesto della cellula, provocherebbe la morte di questa, impedendole, quindi, di moltiplicarsi e di formare cloni, onde si giustifica l'appellativo di ‛cloni proibiti' (forbidden clones).
3. Evasione e soppressione della tolleranza immunitaria
Se, facendo riferimento all'ultima teoria immunitaria qui enunciata, si ammette che gli antigeni autologhi impediscano lo sviluppo di cloni di cellule immunocompetenti destinate alla produzione di anticorpi specifici contro di essi, sorge il problema del meccanismo attraverso il quale si può giungere alla formazione di autoanticorpi. In proposito sono state prospettate varie eventualità, riconducibili in sostanza a un processo di evasione ovvero di soppressione della tolleranza immunitaria.
Prendendo l'avvio dalle malattie autoimmuni coinvolgenti singoli organi (tiroide, nevrasse, testicolo), parrebbe convincente che l'evasione dalla tolleranza immunitaria possa realizzarsi ogniqualvolta l'antigene autologo sfugga alla propria condizione di sequestrazione. Questa vecchia concezione, che ha sempre suscitato un certo fascino tra gli studiosi per il fatto che trovava una giustificazione, per lo meno apparente, in taluni reperti anatomici ritenuti assiomatici, ha però allo stato attuale ben pochi dati in suo favore. Per quanto si riferisce alla tiroide, è noto che la tireoglobulina non è reclusa o sequestrata nella colloide, ma è normalmente presente nella linfa reflua dall'organo. Inoltre la stessa globulina è stata dimostrata nel sangue di gestanti all'ultimo trimestre. Così pure anticorpi antitiroidei sono stati rinvenuti nel plasma sanguigno di madri di cretini, senza che per questo tali donne risultassero affette da tiroidite autoimmune né durante né dopo la gravidanza. D'altro canto Rose (v. Rose e Witebsky, 1971) ha potuto stabilire che nel coniglio né le lesioni traumatiche della tiroide indotte sperimentalmente, né l'iniezione di tireoglobulina omologa erano seguite dalla comparsa in circolo di anticorpi antitireoglobulina. Nel caso, poi, del sistema nervoso centrale, non è affatto provato che l'encefalomielite acuta disseminata, ritenuta di natura autoimmune, consegua a infarti del nevrasse, a commozione cerebrale o a interventi neurochirurgici encefalici o spinali. Infine, nei riguardi del testicolo, è noto che nell'uomo l'occlusione o la lesione dei tubuli porta a stravasi di sperma nell'interstizio con sviluppo di anticorpi specifici i quali, per altro, non sono necessariamente motivo di malattia autoimmune a carico della gonade, anzi non sembra sussista alcun rapporto tra la loro presenza e l'azoospermia.
La scarsa consistenza dimostrata dalla teoria detta degli ‛antigeni sequestrati' ha indotto ad accogliere con favore ipotesi più generali, atte a chiarire i meccanismi di evasione dalla tolleranza immunitaria da parte degli antigeni autologhi. È così andata raccogliendo sempre maggior credito la teoria dell'‛immunizzazione crociata'. Essa prevede che antigeni eterologhi, aventi determinanti antigenici in comune con componenti dei tessuti dell'ospite, possano indurre la formazione di anticorpi capaci di reagire anche con questi ultimi, comportandosi in tal modo come autoanticorpi.
Questo tipo di evasione dalla tolleranza immunitaria ha suscitato particolare interesse soprattutto per quelle malattie autoimmuni che conseguono a infezioni. In tale ambito la sua scoperta può essere fatta risalire alle indagini di Landsteiner e collaboratori, i quali fin dal 1907 dimostrarono come l'anticorpo responsabile della reazione di Wassermann, riscontrabile nel siero di soggetti con infezione sifilitica, reagiva non solo con il fegato di feti eredoluetici, ma anche con estratti alcolici di fegato e di miocardio normali.
Oggi sappiamo che gli streptococchi emolitici di gruppo A possiedono un antigene suscettibile di reazione crociata con il miocardio umano. M. H. Kaplan (v., 1963) è stato infatti in grado di dimostrare che l'inoculazione in conigli di tali germi, coltivati in terreni non contenenti estratti di tessuti di Mammiferi, produce un siero antistreptococcico che si fissa specificamente sul miocardio. Per converso lo stesso autore ha potuto appurare che il siero di pazienti i quali avevano subito un'infezione da streptococco β-emolitico di gruppo A, contiene anticorpi antimiocardio e in grado di reagire contemporaneamente con l'antigene streptococcico.
Va pure ricordato come G. L. Asherson e E. J. Holborow (v., 1966) abbiano messo in evidenza che conigli resi immuni con vaccini preparati con germi di provenienza intestinale producono anticorpi i quali si comportano in vitro alla stregua di autoanticorpi capaci di reagire specificamente con taluni antigeni della mucosa intestinale di coniglio.
Le modalità secondo le quali i microrganismi sono in grado di suscitare una risposta autoimmune possono realizzarsi con meccanismi diversi a seconda dei casi. C'è innanzitutto da considerare l'eventualità della liberazione di componenti di tessuti normali o alterati, i quali sono a loro volta responsabili della comparsa di autoanticorpi. In secondo luogo può verificarsi che i germi, mediante i loro numerosi enzimi, provochino modificazioni dei normali componenti dei tessuti, i quali finiscono con il comportarsi da antigeni. Una terza eventualità è che costituenti dei tessuti, di per sé esenti da proprietà antigene, si possano legare a una sostanza microbica immunogena, provocando la formazione di anticorpi atti a reagire specificamente contro di essi. Un fattore da tener presente è, inoltre, la somiglianza tra antigeni di microrganismi e antigeni tessutali, come nel caso, ad esempio, degli streptococchi β-emolitici di gruppo A, tipo 12, e del rene. L'immunizzazione con membrane basali di glomeruli umani produce anticorpi in grado di reagire con lo streptococco e, per converso, l'immunizzazione con lo streptococco suscita anticorpi contro le membrane basali glomerulari.
Infine va tenuta presente la possibilità che microrganismi smascherino, rendendolo attivo, un determinante antigenico tessutale, normalmente criptico, in quanto incapace di esplicare la propria immunogenicità.
Se la tolleranza immunitaria può venire elusa attraverso l'immunizzazione con antigeni microbici che hanno determinanti antigenici identici a quelli dell'ospite ovvero sono capaci di interagire con gli stessi, non sorprenderà che anche antigeni eterologhi di natura differente possano concorrere a provocare reazioni autoimmuni. Molteplici sostanze chimiche aventi struttura semplice e, come tali, incapaci di suscitare formazione di anticorpi, quando vengono a contatto con i tessuti, si uniscono alle proteine, dando origine a complessi. Questi si comportano allora da antigeni, provocando risposte immunologiche dirette o contro la sola sostanza chimica semplice, la quale pertanto funge da aptene, ovvero contro il complesso in toto. Quest'ultima evenienza si verifica in seguito a somministrazione di quei farmaci che sono capaci di suscitare la formazione di autoanticorpi, come nel caso della porpora trombocitopenica indotta da somministrazione di un ipnotico, l'apronalide (Sedormid). Tale sostanza, venendo a contatto con le piastrine, le modifica, provocando la formazione di autoagglutinine responsabili dell'agglutinazione delle sole piastrine alterate.
Sempre in tema di malattie autoimmuni sostenute da farmaci vanno ricordate la sindrome lupoide, provocata da tutta una serie di sostanze e, in particolare, dall'idralazina e dall'ammide procainica (v. Vaughan e altri, 1969) e la malattia emolitica scatenata dal trattamento con α-metildopa (v. Worlledge e altri, 1966).
Sulla base dell'immunità crociata è stato altresì supposto, sebbene non ancora dimostrato, soprattutto nell'uomo, che componenti tessutali normali possano esplicare attività autoantigene a seguito di trasformazione neoplastica. Tale ipotesi potrebbe chiarire la comparsa di malattie autoimmuni durante lo sviluppo di tumori maligni.
Nel novero degli anticorpi indotti da strutture molecolari alterate vanno ricordati quelli suscitati dalle globuline anticorpali che hanno reagito con il proprio antigene. È questo il caso del fattore reumatoide, così denominato perché reperibile nel siero della maggior parte dei pazienti affetti dall'artrite omonima. La sua comparsa è conseguente al processo di denaturazione subito dall'anticorpo a seguito della sua reazione con l'antigene. Infatti tale denaturazione o trasformazione rende l'anticorpo immunogenico. È facile così rendersi conto di come il fattore reumatoide non sia specifico della malattia da cui prende il nome, ma si rinvenga anche in altre malattie nelle quali si verificano processi immunitari: bronchite cronica, tubercolosi, endocardite batterica subacuta, lebbra, tripanosomiasi, epatite virale.
Gli esperimenti di W. O. Weigle (v. Weigle e altri, 1967; v. Spiegelberg e Weigle, 1967) propongono un meccanismo di comparsa degli autoanticorpi per smascheramento di determinanti antigenici. Se viene iniettata in conigli tireoglobulina di animali della stessa specie, ma modificata per coniugazione con radicali arsenilici o sulfanilici, si ha formazione di anticorpi che reagiscono con tireoglobulina normale, onde si sviluppano in taluni animali lesioni tiroidee. Lo stato autoimmune specifico può essere successivamente mantenuto con somministrazione di tireoglobulina normale. Orbene la spiegazione che si dà di questo esperimento è che la coniugazione con gruppi arsenilici e sulfanilici possa aver provocato lo smascheramento nella tireoglobulina di determinanti antigenici che, pur essendo presenti nella proteina allo stato nativo, non hanno partecipato nel corso dello sviluppo al determinismo della tolleranza immunitaria.
È probabile che nei processi di degradazione della tireoglobulina possano avverarsi spontaneamente analoghi processi di smascheramento di determinanti antigenici, sicché, su questa base, potrebbe trovare chiarimento la genesi degli autoanticorpi antitiroidei.
Uno dei metodi più efficaci e comunemente applicati per produrre sperimentalmente una malattia autoimmune verso antigeni tessutali è quello che fa ricorso all'uso dell'adiuvante di J. Freund (v. Freund e McDermott, 1942). Tale metodo è stato introdotto in seguito alla constatazione che molti tipi di germi possiedono la capacità di incrementare l'intensità e di modificare il tipo della risposta immunitaria. Dei vari microrganismi cimentati sotto questo profilo risulta che quello più attivo è il micobatterio tubercolare. In definitiva, quindi, l'adiuvante di Freund nella forma detta completa consta di un'emulsione idro-oleosa di micobatteri tubercolari uccisi al calore.
Per rendersi conto dell'importanza patogenetica dell'adiuvante basterà ricordare come, ancora prima della sua introduzione, fosse nota la possibilità di provocare sperimentalmente nella scimmia e nel coniglio un'encefalite allergica mediante somministrazione parenterale di estratti di sistema nervoso centrale. Tuttavia l'insorgenza della malattia non costituiva un evento costante e richiedeva l'inoculazione ripetuta e protratta dell'antigene. Orbene, in seguito alla scoperta dell'adiuvante, si è potuto constatare come l'aggiunta del medesimo a un omogenato di sistema nervoso centrale susciti costantemente una grave encefalomielite che si sviluppa nel giro di appena due settimane; per ottenere questo effetto basta una singola dose.
Risultati analoghi si sono ottenuti usando come adiuvanti svariati altri tipi di germi. Così un'alta incidenza dell'encefalite allergica è stata ottenuta associando ad omogenato di cervello Nocardia asteroides ovvero bacilli acido-resistenti, rispettivamente gramnegativi (Escherichia coli, Pseudomonas, Salmonella, Haemophilus pertussis) e grampositivi (Corynebacterium parvum e Staphylococcus aureus).
P. A. e E. S. Cavelti (v., 1945) e P. A. Cavelti (v., 1947) indussero la produzione di autoanticorpi antirene nel coniglio e autoanticorpi anticuore, antirene, antimuscolo scheletrico e antitessuto connettivo nel ratto a mezzo del corrispondente tessuto omologo cui associavano, come adiuvante, usati di streptococco. Inoltre essi registrarono la comparsa di lesioni aventi somiglianza con quelle del reumatismo articolare acuto e con quelle della glomerulonefrite. L'interesse di questi studi deriva dal fatto che essi dimostrano la possibilità di ottenere una reazione autoimmune ricorrendo ad antigeni autologhi i quali, in assenza di adiuvante, sono immunologicamente inattivi per effetto della tolleranza.
Su questa scia E. Witebsky e N. R. Rose (v., 1956) hanno messo in evidenza come in ratti inoculati con tiroide omologa, cui era stato aggiunto adiuvante completo di Freund, si formavano prontamente anticorpi antitiroide e si sviluppava una tiroidite caratterizzata da abbondante infiltrazione di linfociti e da rottura degli otricoli.
Riguardo al meccanismo d'azione dell'adiuvante, la questione si presenta piuttosto complessa e si è ancora ben lungi da conclusioni definitive. Due sono le ipotesi che vengono prospettate: la prima prevede che l'adiuvante agisca trasformando l'antigene da omologo in eterologo; la seconda vuole che l'adiuvante induca nel sistema immunitario perdita della tolleranza verso l'antigene omologo. In virtù della prima ipotesi l'adiuvante, pur rendendo l'antigene eterogeneo e, quindi, immunogeno, gli conserva alcuni determinanti antigenici che consentono l'immunità crociata. Per quanto concerne la seconda ipotesi, al fine di un migliore intendimento, è opportuno accennare come, a seguito dell'inoculazione dell'adiuvante, si scateni una improvvisa e straordinaria proliferazione di elementi macrofagici, per cui, nello spazio di 2-3 settimane, sia la sede di somministrazione parenterale, sia i linfonodi regionali risultano gremiti di macrofagi, riconoscibili per la presenza nel citoplasma di minute gocciole corrispondenti all'emulsione di antigene in adiuvante. Compaiono anche in abbondanza elementi di differenziazione verso la serie plasmocitaria e verso quella linfocitaria. Orbene per quest'ultimo reperto che sta certamente a indicare un aumento assoluto delle cellule deputate alla produzione di anticorpi specifici verso l'autoantigene, si deve pensare alla evocazione ed alla moltiplicazione di nuovi doni cellulari precedentemente repressi, il che comporta perdita della tolleranza immunitaria. Questo secondo punto di vista, che implica l'istituirsi di una alterazione a carico dello stesso sistema immunitario per effetto dell'adiuvante, sembra avvalorato, tra l'altro, dall'osservazione che l'inoculazione di adiuvante di Freund senza antigene provoca nel ratto la comparsa di un basso titolo serico di anticorpi antitiroidei, nonché lo sviluppo di una flogosi di mininie proporzioni a livello della stessa tiroide (v. Roitt e altri, 1962).
Le notizie qui riferite circa la possibilità che l'adiuvante di Freund intervenga nella patogenesi delle malattie autoimmuni attraverso una turba del sistema immunitario, induce a postulare che un simile meccanismo possa formarsi ugualmente per via genetica o ereditaria. Un'ipotesi del genere è stata avanzata e sostenuta da Burnet (v., 1959) per tentare di chiarire il meccanismo di quel gruppo di malattie autoimmuni impropriamente denominate malattie del collagene. È noto infatti come tra queste affezioni ve n'è soprattutto una, il lupus eritematoso, che si caratterizza per la comparsa di autoanticorpi di vari tipi, diretti cioè verso strutture diverse.
Orbene, il Burnet, considerando che in più membri di una medesima famiglia si possono riscontrare alterazioni sierologiche e segni clinici dell'affezione, ha sostenuto che questa potesse derivare da una turba genetica consistente in una perdita della tolleranza immunitaria polivalente. L'ipotesi è confortata da due constatazioni sperimentali. Tentativi di riprodurre malattie autoimmuni a carattere sistematizzato, cioè sostenute da autoanticorpi diretti sia contro antigeni nucleari sia contro antigeni citoplasmatici, sono rimasti praticamente senza successo. Per converso, un tale tipo di affezione autoimmune si manifesta spontaneamente nel ceppo di topi neri neozelandesi denominato NZB (New Zealand Black), i quali sviluppano un'anemia emolitica, presentano positive le reazioni per anticorpi antiglobuline e per anticorpi antinucleari, rivelano una malattia glomerulare del rene sovrapponibile a quella del lupus eritematoso, presentano un elevato tasso serico di immunoglobuline e vanno soggetti a processi proliferativi, anche neoplastici, a carico degli organi linfatici.
Inoltre, negli incroci con animali di ceppo differente, gli ibridi mostrano le stesse manifestazioni morbose con una distribuzione statistica corrispondente a quella di un evento ereditario.
Se è vero che questi riscontri stanno effettivamente a comprovare la possibilità che talune malattie autoimmuni siano sostenute da un difetto ereditario, il quale si estrinseca con perdita della tolleranza immunitaria, bisogna tuttavia riconoscere che nel caso specifico dei topi NZB si sono andati accumulando ulteriori dati che lasciano intravedere come alla base del processo autoimmune sussista certamente una maggiore complessità eziopatogenetica. Così, dopo che R. C. Mellors e C. Y. Huang (v., 1966) hanno riscontrato che gli stessi topi NZB sono portatori di un virus, è stato sollevato il problema degli eventuali rapporti intercorrenti tra quest'ultimo, i processi proliferativi degli organi linfoidi e la comparsa di autoanticorpi. Fondamentali ricerche in tal senso sono quelle condotte da Dixon (v., 1972), il quale è stato in grado di dimostrare come l'infezione sia capace di facilitare o di ritardare la comparsa delle manifestazioni morbose immunologiche genetica- mente determinate.
4. Condizioni e situazioni determinanti la malattia autoimmune
La comparsa di autoanticorpi solubili non comporta di necessità lo sviluppo di una malattia autoimmune. È noto infatti come la presenza in circolo di autoanticorpi possa non associarsi a segni di compromissione di quelle strutture contro le quali gli stessi autoanticorpi sono diretti. Si può dare infatti il caso che gli autoanticorpi solubili siano incapaci di raggiungere il rispettivo antigene in quanto questo risulta inaccessibile. In altri termini verrebbe precluso all'anticorpo il raggiungimento dell'organo bersaglio, dato che questo sarebbe isolato o, per meglio dire, sequestrato nei confronti della circolazione sanguigna. In alternativa si considera che il mancato intervento dell'anticorpo nello sviluppo di una malattia autoimmune possa individuarsi nella sede intracellulare dell'antigene. In tale evenienza, poiché gli anticorpi non sono in grado di superare la membrana citoplasmatica quando la cellula è vitale e integra, viene loro preclusa la reazione con l'antigene. Altrimenti stanno le cose quando l'antigene è situato sulla superficie della cellula, cioè sulla membrana. Allora l'autoanticorpo può facilmente legarsi all'antigene e, se consegue fissazione del complemento, può aversi la lisi della membrana cellulare.
Accanto a lesioni provocate in via diretta dall'interazione antigene-anticorpo con successiva fissazione del complemento, si conoscono anche lesioni flogistiche tessutali prodotte in maniera indiretta. Ciò si verifica ogniqualvolta immunocomplessi solubili, cioè complessi antigene-anticorpo formatisi in eccesso di antigene, si depositano o si fissano per motivi diversi su strutture che possono non aver nulla a che vedere con quelle contro cui gli anticorpi sono diretti. In tal caso il deposito di immunocomplessi avvia il complicato meccanismo della fissazione del complemento. Questo, soprattutto con le componenti C5, C6, C7, provoca un'azione chemiotattica sui polinucleati neutrofili, i quali intervengono con gli enzimi proteolitici liberati dai loro granuli (lisosomi). L'attività enzimatica, oltre che sugli immunocomplessi, si esplica anche sulle strutture tessutali con cui questi sono in contatto.
Oltre ai meccanismi umorali riferiti, in talune lesioni osservate in corso di malattie autoimmuni intervengono anche manifestazioni di immunità cellulare (cosiddetta ipersensibilità ritardata). È stato infatti accertato che in talune malattie autoimmuni sperimentali, quali l'encefalomielite e l'orchite allergiche, il trasporto passivo può venire realizzato solo con l'inoculazione di linfociti vitali e non di antisiero. Inoltre i reperti istologici indicano come, negli organi specificamente interessati, siano presenti caratteristici infiltrati perivasali e interstiziali costituiti da linfociti commisti ad altri elementi mononucleati. Riscontri del genere inducono a riconoscere al linfocita una funzione di rilievo nel determinismo delle malattie autoimmunitarie (o meglio in talune malattie autoimmuni), sebbene siano molte ancora le incertezze in merito alle modalità con le quali il linfocita stesso esplica la propria attività. È stato prospettato che tale elemento, una volta che abbia reagito con l'antigene, liberi sostanze di varia natura (fattore inibitore dei macrofagi, fattore della permeabilità, citolinfotossine, ecc.) responsabili delle diverse lesioni a livello tessutale (v. Feldman, 1972).
5. Criteri di identificazione e classificazione delle malattie autoimmuni
L'impossibilità di identificare una malattia autoimmune semplicemente in base alla dimostrazione di autoanticorpi circolanti ha indotto a stabilire criteri per il riconoscimento di un tipo siffatto di malattia. Questi sono solo apparentemente diversi a seconda che ci si riferisca al campo sperimentale o a quello della patologia umana, in quanto talune metodiche attinenti agli stessi criteri non sono sempre applicabili all'uomo.
In campo sperimentale, per stabilire il carattere autoimmunitario delle malattie, si è fatto riferimento alle caratteristiche istologiche del processo, al tasso di autoanticorpi circolanti, alle reazioni intradermiche intese a valutare l'ipersensibilità ritardata, al trasporto passivo della malattia con linfociti, al controllo su colture in vitro dell' azione citotossica esercitata tanto da anticorpi solubili che dai linfociti.
In tema di patologia umana, quella cioè che ci interessa maggiormente, i criteri proposti da Asherson (v., 1967) sono fondamentalmente i seguenti: a) incremento delle γ-globuline sieriche, quale segno indiretto di esaltata attività immunitaria; b) prova di una risposta autoimmune attraverso la dimostrazione di autoanticorpi o di una condizione di ipersensibilità ritardata; c) lesioni istologiche sostenute da infiltrati flogistici e, in particolare, da linfociti, da istiociti e da plasmacellule; d) eventuale incidenza ereditaria della malattia e sua associazione, tanto in senso clinico che sierologico, con altre affezioni autoimmuni, sia nel medesimo paziente che in membri della sua famiglia; e) eventuale cointeressamento del timo sotto forma di iperplasia o di tumore (il significato di questo criterio è per altro incerto in quanto non è chiaro se si tratti di una compromissione primitiva dell'organo ovvero di una sua partecipazione a una turba dell'intero apparato linfo-reticolare o anticorpopoietico); f) effetto favorevole della terapia con cortisonici o, più generalmente, con farmaci immunosoppressivi; g) riproduzione sperimentale di un quadro morboso simile nell'animale.
Questi criteri integrano e completano i postulati di Witebsky (v., 1959): a) dimostrazione sia di anticorpi circolanti, attivi a temperatura corporea, sia di cellule sensibilizzate; b) caratterizzazione o eventuale isolamento dell'antigene contro il quale l'anticorpo è diretto; c) produzione nell'animale da esperimento di anticorpi diretti contro lo stesso antigene; d) riproduzione sperimentale di lesioni istologiche simili o identiche a quelle umane.
Non tutte le malattie fin qui ritenute autoimmuni rispondono completamente ai criteri elencati, per cui è difficile essere certi della loro definitiva identificazione. Ciò chiarisce come mai le varie classificazioni proposte siano discutibili e perché tutte presentino carattere di provvisorietà. Nell'esposizione che segue verrà fatto riferimento alla classificazione qui sotto riportata, accennando criticamente per ciascuna entità quali dati effettivamente sussistano per poterla annoverare come autoimmune.
A. malattie autoimmuni sistemiche
1. Lupus eritematoso (*)
2. Artrite reumatoide (*)
3. Sindrome di Sjögren (*)
4. Dermatomiosite
5. Sclerodermia
6. Angioiti necrotizzanti
7. Amiloidosi
B. malattie autoimmuni di singoli organi e apparati
1. Sistema emopoietico
a. Anemie emolitiche acquisite (*)
b. Leucopenia
c. Trombocitopenia
2. Sistema nervoso
a. Leucoencefalite acuta emorragica (*)
b. Leucoencefalite acuta disseminata (*)
c. Sclerosi a placche (*)
3. Apparato digerente
a. Anemia perniciosa o megaloblastica (*)
b. Colite ulcerosa criptogenetica (*)
c. Enterite regionale
d. Morbo celiaco e sprue nostrana
4. Fegato
a. Epatite cronica attiva
b. Cirrosi biliare primitiva
5. Organi endocrini
a. Tiroide
Tiroidite di Hashimoto (*)
Morbo di Flajani-Graves-Basedow (*)
b. Surrene
Iposurrenalismo primario (*)
Sindrome di Cushing
c. Paratiroidi
Ipoparatiroidismo idiopatico
d. Pancreas
Diabete mellito
6. Cute
a. Pemfigo (*)
b. Pemfigoide (*)
7. Occhio
a. Uveite facogenica (*)
b. Oftalmia simpatica (*)
8. Muscolatura scheletrica
a. Miastenia
9. Cuore
a. Sindrome postcardiotomica
b. Sindrome postinfartuale
c. Endomiocardiofibrosi
d. Cardiomiopatia idiopatica
e. Cardite reumatica
10. Organi della riproduzione
a. Sterilità
b. Orchite
11. Rene
a. Glomerulonefriti (*)
(*) L'asterisco contrassegna le malattie la cui natura autoimmunitaria è stata sufficientemente accertata.
6. Malattie autoimmuni sistemiche
Lupus eritematoso
È la più nota delle malattie autoimmuni, anche se rara e ancora assai problematica. L'eziologia è ignota e l'andamento ricorrente e febbrile. È prediletto il sesso femminile. Le lesioni infiammatorie della cute, delle sierose, dei reni, delle arteriole e dell'endocardio si accompagnano ad alterazioni ematologiche (anemia, leucopenia, trombocitopenia, diatesi emorragica) ed immunologiche (ipergammaglobulinemia, anticorpi antinucleari e antiDNA, fattore reumatoide, riduzione del complemento, autoanticorpi contro numerosi tessuti, positività del test di Coombs e della reazione di Wassermann).
In considerazione dell'incidenza familiare, si presume che la comparsa di autoanticorpi di varia natura dipenda da riduzione, fino a completa soppressione, della tolleranza immunitaria su basi genetiche che, secondo P. R. J. Burch e N. R. Rowell (v., 1965), vanno identificate in mutazioni a livello di tre loci del cromosoma X. Su questo terreno si ammette che agenti esterni di natura fisica (radiazioni attiniche e ultraviolette), chimico-farmacologica (metildopa, idralazina, idantoina, cloropromazina, ammide procainica, penicillina) o microbica (schizomiceti, virus) siano in grado di produrre temporanee e insignificanti modificazioni immunochimiche dei costituenti tessutali: queste, incapaci negli individui normali di superare la soglia della tolleranza immunitaria, si rivelerebbero sufficientemente attive in soggetti geneticamente inadatti a controllare i processi autoimmunitari (v., Miescher e Paronetto, 1969).
Non è esattamente noto il meccanismo del danno tessutale. Esso può essere attribuito all'azione diretta o indiretta (cioè mediata da immunocomplessi) degli autoanticorpi. Questi non sono per lo più patogeni; infatti quelli diretti contro antigeni sia nucleari che intracitoplasmatici non riescono a legarsi ad essi per l'incapacità di permeare la membrana citoplasmatica di cellule integre e vitali. Solo antigeni disposti sulla membrana cellulare e antigeni circolanti, come il fattore VIII della coagulazione (v. Shapiro, 1967), sono facilmente accessibili agli autoanticorpi. Ciò chiarisce il verificarsi di un'anemia emolitica nel 5% dei pazienti, nonché di turbe leuco- e piastrinopeniche, e di disordini emorragici. Per contro gli autoanticorpi possono reagire con antigeni all'interno di cellule danneggiate o devitalizzate. Questo è il caso dei cosiddetti corpi ematossilinofili dell'endocardio, costituiti da nuclei degenerati cui sono legati anticorpi contro i vari costituenti (istoni, DNA, nucleoproteine, glicoproteine). Analogo significato hanno le cellule LE o il fenomeno LE osservato nel midollo osseo e nel sangue. Gli immunocomplessi, eventualmente fissanti il complemento, svolgono attività chemiotattica sui granulociti neutrofili che circondano e fagocitano la cellula alterata.
Tuttavia la maggioranza delle lesioni tessutali nei pazienti con lupus è mediata da immunocomplessi. Infatti la continua esposizione a numerosi componenti citoplasmatici, quali microsomi, mitocondri, lisosomi (v. Kunkel e altri, 1960), e nucleari, divenuti autoantigenici, evoca una pressoché costante produzione di anticorpi e, quindi, di immunocomplessi. Orbene quelli solubili, formatisi cioè in eccesso di antigene, sono responsabili delle lesioni flogistiche tessutali con la mediazione del complemento.
Fra tali lesioni un posto dominante occupa quella del glomerulo renale, contrassegnata da ispessimento granulare delle membrane basali dei capillari per accumulo di immunocomplessi costituiti da antigeni nucleari, immunoglobuline, complemento e fibrinogeno (v. Paronetto e Koffler, 1965). Depositi di immunocomplessi sono stati anche rinvenuti nella ialinosi e nella necrosi fibrinoide delle arteriole (soprattutto spleniche) e nelle lesioni cutanee.
Non sono stati dimostrati con sicurezza fenomeni di ipersensibilità ritardata.
Artrite reumatoide
È affezione sistemica del connettivo collageno con predominante sintomatologia a carico delle piccole articolazioni distali degli arti. Occasionalmente possono risultare interessati il miocardio, i vasi sanguigni, il polmone e la cute. La malattia insorge nel quarto decennio, prediligendo il sesso femminile. Il decorso è progressivo con esito in anchilosi.
Se ne riconoscono alcune varianti cliniche e immunologiche: artrite reumatoide giovanile di Still, morbo di Felty, forme di artrite reumatoide variamente associate a psoriasi, a colite ulcerosa, a enterite regionale, a sindrome di Sjögren.
Istologicamente si rinvengono tre tipi di lesioni: a) in- filtrazione infiammatoria a carattere nodulare dei tessuti articolari da parte di linfociti, istiociti e plasmacellule fino all'organizzazione follicolare; b) noduli reumatoidi nel connettivo sottocutaneo, più frequentemente in sede iuxtaarticolare, ma anche nel cuore e nel polmone, formati da un'area centrale di necrosi fibrinoide, delimitata da istiociti disposti a palizzata; c) flogosi granulomatosa perivasculitica delle piccole arterie del miocardio, dei muscoli somatici e dei vasi del sottocutaneo con esito in nodulo reumatoide (v. Sokoloff e altri, 1953; v. Kulka, 1959).
Dal punto di vista immunitario, oltre all'aumento delle globuline sieriche, nel 70% dei pazienti si rinviene un'immunoglobulina (generalmente IgM) con proprietà anticorpali contro le γ-globuline, specie se queste sono sotto forma di immunocomplessi. Si tratta di un autoanticorpo originariamente denominato fattore reumatoide (FR), attivo contro γ-globuline denaturate o modificate dalla reazione anticorpale e specifico per il frammento Fc della globulina, il cui determinante antigenico è in prossimità della sede di legame con il complemento (v. Christian, 1971). Assente nelle varianti dell'artrite reumatoide e non esclusivo della medesima, il FR è ritenuto responsabile della perpetuazione delle lesioni articolari ed extra-articolari. Quivi, infatti, precipita in forma di immunocomplessi che, legando il complemento, esercitano azione chemiotattica sui polinucleati neutrofili (v. Hollander e altri, 1965).
Immunoglobuline sono state individuate nei linfociti e nelle plasmacellule degli infiltrati flogistici sinoviali (v. Kaplan e Vaughan, 1959). Immunocomplessi, FR e complemento sono stati dimostrati nei vacuoli (fagosomi) dei polinucleati neutrofili isolati dal liquido sinoviale (v. Rawson e altri, 1965). Analogamente, immunocomplessi con FR e complemento sono stati rinvenuti nella necrosi fibrinoide dei noduli reumatoidi e nelle arteriole sede di vasculite granulomatosa. Le lesioni arteriolari sono dominanti ed estese in talune forme di artrite reumatoide ad andamento maligno. Inoltre sono aggravate dal trattamento con cortisone, il quale, abbassando il tasso delle γ-globuline, facilita la precipitazione di complessi con il FR.
Il FR, in quanto elemento patogenetico di cronicizzazione del processo, necessita di un meccanismo immunitario di avvio. Questo, indicato originariamente nella risposta a infezioni batteriche da streptococchi (v. Cecil e altri, 1930) e, più recentemente, nella risposta a infezioni da forme atipiche (micoplasma) o virali, sembra debba identificarsi in un evento infettivo a decorso cronico (v. Lightfoot e Christian, 1969) che comporta non solo la formazione di anticorpi (γ-globuline), ma soprattutto, data la persistenza dell'agente eziologico, di complessi antigene-anticorpo. La globulina anticorpale, modificata dal legame con l'antigene, acquista proprietà immunogeniche non previste dalla tolleranza immunitaria che viene elusa con conseguente produzione di anti-globuline (FR). Queste perpetuano i danni tessutali formando immunocomplessi precipitanti e flogogeni con la mediazione del complemento.
Sindrome di Sjögren
È costituita dalla triade: cheratocongiuntivite secca, xerostomia e artrite reumatoide. Tuttavia l'artrite reumatoide può mancare o essere sostituita dal lupus eritematoso, ovvero dalla periarterite nodosa, dalla sclerodermia, dalla dermatomiosite. La disparità degli organi interessati rende ardua la collocazione nosografica della sindrome. Sono colpite in prevalenza donne (90%) nel corso del sesto decennio.
Le lesioni a carico delle ghiandole lacrimali e salivari corrispondono a intensa infiltrazione linfocitaria dell'interstizio a carattere sia diffuso che nodulare, addirittura con organizzazione in follicoli. Variabile è la partecipazione degli elementi istiocitari e delle plasmacellule. Si ha contemporanea atrofia degli acini ghiandolari, mentre i tubuli escretori possono presentare, accanto a fenomeni degenerativi degli epiteli, iperplasia delle cellule mioepiteliali. Nel siero si rinvengono anticorpi fissanti il complemento che reagiscono con estratti di numerosi organi (v. Bloch e altri, 1965) e che con la tecnica della immunofluorescenza indiretta dimostrano di legarsi agli epiteli dei dotti escretori delle ghiandole (v. Bertram e Halberg, 1965). È costante una condizione di iper-γ-globulinemia con presenza del fattore reumatoide, anche in assenza dell'artrite omonima (v. Bloch e altri, 1965) e di crioglobuline (complessi IgG e IgM), secondo K. J. Bloch e A. R. Myers (v., 1971). Spesso è positiva la ricerca dei fattori antinucleari e del fenomeno LE. Quest'ultimo è di regola spurio (v. Bäumer, 1965), in quanto i granulociti inglobano masse citoplasmatiche anziché nuclei degenerati. Il rinvenimento nel siero di anticorpi antitireoglobulina si accorda con l'associarsi frequente della tiroidite di Hashimoto (v. Bloch e altri, 1965). Sono stati infine segnalati linfomi, leucemia linfatica e macroglobulinemia.
I tentativi sperimentali intesi a giustificare per la sindrome di Sjögren la qualifica di affezione autoimmunitaria hanno dato finora risultati incerti o contraddittori.
Dermatomiosite
È affezione ad eziologia ignota caratterizzata da infiltrazione flogistica aspecifica dell'interstizio muscolare di tipo linfoplasmacellulare e istiocitario. La localizzazione è multipla e la distribuzione simmetrica, specie nei muscoli degli arti. È presente astenia e, talora, dolore. Nel 40% dei casi si associano lesioni cutanee eritematose e desquamative; come pure si registrano turbe vasomotorie del tipo fenomeno di Raynaud. Sono colpite di preferenza le donne di età compresa tra il quarto e il settimo decennio. Solo nel caso in cui la malattia insorga in concomitanza con una neoplasia, risulta prediletto il sesso maschile. L'evoluzione è progressiva e le lesioni evolvono verso la scleroialinosi. La patogenesi autoimmunitaria è solo presunta e suggerita dall'insorgenza dell'affezione in soggetti che presentano o ipersensibilità verso farmaci, quali sulfamidici (v. Sheard, 1951) e penicillina (v. Hyman e altri, 1956), o altre malattie autoimmuni (lupus eritematoso, artrite reumatoide, sindrome di Sjögren). Inoltre in una certa percentuale di pazienti è possibile evidenziare anticorpi antimiosina (v. Caspary e altri, 1964). La patologia sperimentale dimostra come sia possibile indurre una flogosi dell'interstizio muscolare in animali inoculati con estratti di muscolo eterologo (v. Dawkins, 1965). I linfociti provenienti dagli animali sensibilizzati sono capaci di trasmettere la malattia ad animali sani e di distruggere colture di muscolo: si tratterebbe pertanto di un processo autoimmune da immunità cellulare.
Sclerodermia
È malattia a eziologia ignota, a decorso cronico, che colpisce di preferenza donne tra il quarto e il sesto decennio. È caratterizzata da ispessimento sclerotico del derma cutaneo (arti e volto) e da interessamento infiammatorio, ad evoluzione fibrosa, delle articolazioni, dei muscoli, dei polmoni, del tubo digerente e dei reni. Le lesioni cutanee dell'estremità distale degli arti superiori sono precedute da turbe vasomotorie simili a quelle della sindrome di Raynaud. A carico del tubo digerente si registrano fenomeni disfagici da dilatazione dell'esofago distale per atrofia della muscolatura conseguente a ispessimento sderotico della mucosa. Lesioni similari del duodeno e del digiuno sono responsabili di malassorbimento. A livello del colon si rinvengono ampi diverticoli da atrofia muscolare con coprostasi. La fibrosi polmonare è diffusa, cioè alveolare, peribronchiale e perivascolare, e sostiene uno stato ipertensivo del piccolo circolo. Focolai di fibrosi sono descritti nel miocardio. A carico del rene si rinvengono lesioni arteriolari spesso responsabili di ipertensione maligna. Le interpretazioni patogenetiche sono molto incerte. La genesi autoimmunitaria è presunta in base alla constatazione che la malattia si può associare con il lupus eritematoso, con l'artrite reumatoide, con la sindrome di Sjögren, con la tiroidite di Hashimoto. Inoltre si riscontra ipergammaglobulinemia, eventualmente associata a positività della ricerca del fattore reumatoide, del fenomeno LE, degli anticorpi antinucleolari e delle crioglobuline.
Angioiti necrotizzanti
Provvisoriamente raggruppate sotto questo titolo si elencano le seguenti forme di vasculopatie: la periarterite nodosa di Kussmaul-Meier; l'arterite allergica (da farmaci, da agenti microbici, da parassiti, da allergeni vegetali); l'angioite granulomatosa di ChurgStrauss; la granulomatosi di Wegener; l'arterite da nefrosclerosi maligna; l'arterite a cellule giganti di Horton; l'arterite di Takayasu; l'angioite associata a lupus eritematoso sistemico, ad artrite reumatoide, a febbre reumatica, a porpora di Schönlein-Henoch, a dermatomiosite, a sclerodermia, a papulosi atrofica maligna, a malattia da siero. Si tratta di un gruppo assai eterogeneo di affezioni ad eziologia per lo più ignota, il cui accostamento è giustificato dalla natura flogistica delle lesioni a carico delle medie e delle piccole arterie (fa eccezione la malattia di Takayasu) con occasionale partecipazione venulare, che comporta inizialmente occlusione trombotica del vaso. L'infiltrazione infiammatoria si ordisce su alterazioni regressive, preferibilmente del tipo necrosi fibrinoide. Consegue trasformazione fibrosa della parete con eventuale dilatazione aneurismatica in caso di ricanalizzazione del lume. L'estensione e la distribuzione della vasculopatia sono abbastanza caratteristiche per ciascuna forma.
L'ipotesi patogenetica autoimmunitaria si basa sulla dimostrazione nel contesto delle pareti arteriose di immunoglobuline, di complemento e di fibrinogeno (v. Paronetto, 1969). Si tratta, per altro, di un rilievo di significato incerto, in quanto detto materiale potrebbe essere dovuto all'essudazione plasmatica.
Amiloidosi
Caratterizzata da deposizione di una sostanza proteica patologica nel connettivo, consegue sia spontaneamente che sperimentalmente a processi immunitari (infettivi) a lungo decorso ed in fase di esaurimento (v. Calkins, 1971). Questa connessione patogenetica, unitamente al riscontro nell'amiloide di gammaglobuline, ha indotto a formulare l'ipotesi che nella sostanza fondamentale del connettivo vadano depositandosi prodotti (probabilmente anticorpi) circolanti nel sangue (teoria della filtrazione) ovvero originati in situ (teoria della secrezione). Le varie suddivisioni in amiloidosi tipica e atipica, primitiva e secondaria e, più recentemente, in amiloidosi perireticolare e pericollagena, fanno riferimento alla verifica di tutte le caratteristiche istochimiche ed istofisiche della sostanza, ed alla sua diffusione e distribuzione macro- e microscopica nei vari organi. Indistintamente in tutte le varietà di amiloide è stato riconosciuto al microscopio elettronico un costituente morfologico comune e caratteristico, corrispondente a fibrille (v. Cohen e Calkins, 1959; v. Caesar, 1960) di lunghezza oscillante tra 300 e 1.000 Å, non ramificate, rettilinee o curvilinee, di diametro di poco inferiore a 100 Å. A forte risoluzione le fibrille sembrano composte da due subunità filamentose avvolte su se stesse. Oltre a questa componente è stata successivamente notata un'entità anulare pentamerica (v. Bladen e altri, 1966) del diametro di circa 100 Å, di composizione chimica differente (v. Cathcart e altri, 1965; v. Binette e altri, 1968). Controversa è l'origine delle due entità morfologiche: in particolare, per quanto concerne la componente fibrillare, si pensa che essa, prodotta da elementi reticolari ed istiocitari, sia in grado di trattenere aspecificamente sostanze varie come globuline, fibrinogeno, mucopolisaccaridi e lipidi. È stato accertato che depositi di amiloide si costituiscono oltre che in corso di esaurimento di processi immunitari, anche per effetto dell'immunosoppressione farmacologica, radiologica e biologica (timectomia). Ciò sembra accordarsi con le opinioni attuali sulla natura dell'affezione, che tendono a negare alla medesima una natogenesi immunitaria.
7. Malattie autoimmuni di singoli organi e apparati
Sistema emopoietico
Anemie emolitiche acquisite. Costituiscono il primo gruppo conosciuto di condizioni morbose indotte da autoanticorpi. Frequentemente esse insorgono senza un evidente motivo e vengono pertanto indicate come idiopatiche. Più di rado sono secondarie o sintomatiche, in quanto accompagnano disordini proliferativi del sistema linforeticolare, tumori, infezioni virali e da bedsonia, altre malattie autoimmuni, quali il lupus eritematoso e la colite ulcerosa. Poiché l'antigene disposto sulla membrana eritrocitaria è accessibile, conseguenza diretta della sua interazione con l'autoanticorpo è l'azione nociva sull'emazia. Si riconoscono tre tipi di anticorpi: anticorpi a caldo, non agglutinanti (incompleti); agglutinine da freddo; emolisine da freddo.
Gli anticorpi incompleti a caldo (optimun 37 °C) sono i più frequenti e corrispondono ad IgG. Essi reagiscono con gli antigeni e e c del sistema Rh (v. Dacie, 1962; v. Leddy, 1966). Gli stessi anticorpi sono svelabili solo con il test di Coombs perché sono così sporadicamente dispersi sull'emazia da risultare incapaci di fissare il complemento, se prima non raggiungono una certa concentrazione. In tal caso il complemento si lega fino alle componenti C4, C3 (v. Leddy e altri, 1963) ovvero anche con il terzetto C5, C6, C7. Nella prima evenienza, considerata fondamentale, le emazie sono suscettibili di fagocitosi se vengono in intimo contatto con macrofagi, come si verifica soprattutto nella polpa rossa della milza, donde la splenomegalia (v. Leddy e altri, 1962; v. Mollison e altri, 1965). Nella seconda evenienza, le emazie esercitano la chemiotassi sui macrofagi e sui polinucleati neutrofili.
Le agglutinine da freddo che si rinvengono nelle anemie emolitiche acquisite sono IgM. Esse si legano alla temperatura di 0-4 °C all'antigene I (v. Wiener e altri, 1956), che compare sulla superficie delle emazie a partire dal diciottesimo mese, e fissano il complemento; se riportate a 37 °C si distaccano però dall'emazia, lasciando ivi adese le componenti del complemento (v. Miescher e altri, 1962). Essendo attive a bassa temperatura, estrinsecano la loro funzione nelle parti del corpo refrigerate. Dal sangue circolante le emazie agglutinate sono prontamente rimosse per intervento del sistema reticolo-endoteliale, principalmente del distretto epatico (v. Miescher, 1969).
Infine le emolisine da freddo di Donath-Landsteiner, individuate originariamente in soggetti luetici, sono IgG. Si fissano a bassa temperatura all'antigene P della membrana eritrocitaria (v. Levine e altri, 1963), ma legano il complemento nella sua totalità fino alle componenti C8, C9, quando riportate a 37 °C. In tal caso si ha emolisi intravasale che, se intensa, è responsabile di emoglobinuria parossistica.
Se è chiaro il danno inflitto da questi autoanticorpi non è altrettanto nota la loro genesi che si presume non univo- ca. L'anemia emolitica autoimmune da anticorpi incompleti nel lupus eritematoso e nei topi NZB suggerisce una alterazione genetica dell'immunotolleranza (v. Miescher e altri, 1962). L'associazione della stessa anemia con malattie linfoproliferative e con tumori lascia presumere nelle prime il risorgere, per mutazione somatica, di cloni proibiti, e nei secondi l'esistenza di antigeni capaci di suscitare anticorpi crociati antieritrocitari (v. Brody e Beizer, 1963). Ugualmente una corrispondenza immunochimica tra antigeni microbici ed eritrocitari (antigene I) (v. Rosenfield e altri, 1965) viene invocata a spiegazione dei disordini emolitici da agglutinine da freddo in corso di virosi o di affezioni da micoplasmi.
Leucopenie. Rari sono i casi di dimostrata esistenza di condizioni leucopeniche sostenute da anticorpi antileucocitari (v. Miescher, 1953)0 leucoagglutinine (v. Dausset e Nenna, 1953). Trattandosi di solito di pazienti sottoposti a ripetute trasfusioni o di donne pluripare sussistono dubbi che si abbia a che fare con iso- o autoanticorpi (v. Miescher, 1969).
Trombocitopenia. Sono stati accertati processi immunitari che inducono trombocitopenia per azione di anticorpi antipiastrine: non è tuttavia provato in modo sicuro se siano dovuti a isoanticorpi o ad autoanticorpi.
Sistema nervoso
Il problema della patogenesi autoimmune per le malattie del sistema nervoso è attualmente circoscritto alle affezioni demielinizzanti. È questo un gruppo assai eterogeneo nel quale si annoverano forme iperacute, quale la leucoencefalite acuta emorragica, forme acute, come la leucoencefalite acuta disseminata, tanto post- che parainfettiva, e forme croniche, delle quali è prototipo la sclerosi a placche. Orbene il novero di queste malattie tra quelle a patogenesi autoimmune ha preso le mosse dalla constatazione che la vaccinazione antirabica a mezzo inoculazione di tessuto nervoso contenente il virus, attenuato o ucciso, può a volte complicarsi con un'encefalite acuta disseminata. Ne è scaturita l'idea che lo stesso tessuto nervoso potesse in qualche modo suscitare una reazione immunitaria, responsabile della complicanza nevrassitica (v. Condie e Good, 1959). Così, con l'inoculazione intradermica di sostanza nervosa sospesa in adiuvante di Freund (v. Freund e altri, 1947) si è riusciti a provocare un'encefalomielite allergica sperimentale i cui caratteri fondamentalmente si identificano con quelli delle nevrassiti demielinizzanti. Oggi tale encefalomielite costituisce un modello sul quale poggia la concezione della natura autoimmune delle surriferite malattie demielinizzanti umane.
L'encefalomielite allergica sperimentale si accompagna, oltre che a produzione di anticorpi IgG citotossici, demielinizzanti, fissanti il complemento e attivi su colture di tessuto nervoso (v. Patersoh, 1966), a uno stato di ipersensibilità ritardata (v. Waksman, 1956) con positività della cutireazione a estratti di sostanza nervosa. Inoltre è possibile trasmettere passivamente la malattia solo a mezzo di linfociti (v. Paterson, 1960) a animali integri, cioè non previamente sottoposti a irradiazione totale (v. Paterson e Beisaw, 1963) o a deplezione linfatica. L'antigene encefalitogeno è stato individuato in un peptide basico a basso peso molecolare, corrispondente a 4.000 (v. Lumsden e altri, 1966). Si ammette che nella patogenesi delle lesioni nervose intervengano soprattutto fenomeni di ipersensibilità ritardata: gli autoanticorpi circolanti, ad azione demielinizzante e fissanti il complemento in vitro, rivelano infatti una azione protettiva sull'animale preventivamente inoculato con essi (v. Paterson e Harwin, 1963), poiché, legandosi all'antigene encefalitogeno, ne bloccherebbero il potere sensibilizzante, evitando l'avvio dei fenomeni citologici di ipersensibilità ritardata.
Apparato digerente
La patogenesi autoimmunitaria è stata considerata per le lesioni gastriche dell'anemia megaloblastica, per la colite ulcerosa criptogenetica, per l'enterite regionale di Crohn, per le sprue nostrane e per la sindrome di Sjögren (limitatamente alle ghiandole salivari).
Anemia perniciosa o megaloblastica. La constatazione che il siero di soggetti con anemia perniciosa è capace di ridurre o di neutralizzare l'effetto del principio intrinseco (v. Schwartz, 1958; v. Taylor, 1959) attraverso la mediazione di una γ-globulina, ha portato rapidamente a postulare un meccanismo immunitario nella genesi della malattia. Attualmente si conoscono almeno due tipi di anticorpi contro il principio intrinseco (v. Jeffries, 1971): uno detto bloccante e diretto contro il recettore della vitamina B12, l'altro diretto contro quella frazione del principio intrinseco che si lega ai microvilli dell'epitelio intestinale, consentendo il passaggio della stessa vitamina nell'interno della cellula. Inoltre in molti anemici perniciosi e nei familiari esenti da malattia si rinvengono anticorpi diretti contro le cellule parietali delle ghiandole gastriche (v. Markson e Moore, 1962) e frequentemente anche anticorpi antimicrosomiali tiroidei (v. Irvine e altri, 1962). D'altro canto la malattia di Hashimoto non è rara tra i pazienti con anemia perniciosa (v. Doniach e Roitt, 1964). La possibilità di indurre sperimentalmente nel cane una gastrite cronica, iniettando estratti di mucosa gastrica in adiuvante di Freund, costituisce una prova sperimentale a sostegno della natura autoimmunitaria della gastrite (v. Krohn, 1968). Tuttavia, se appare chiaro che autoanticorpi sono responsabili della patogenesi dell'anemia perniciosa, insoluto rimane il problema di come il processo si avvii.
Colite ulcerosa criptogenetica. È caratterizzata da flogosi ulcerativa ad andamento per lo più cronico e può associarsi ad anemia autoimmune, ad artrite reumatoide, ad iridociclite, ad eritema nodoso, ad epatopatia cronica. Una patogenesi immunitaria è stata suggerita a più riprese e ha trovato sostegno in campo sperimentale dopo che lesioni analoghe sono state ottenute iniettando in ratti estratti di colon eterologo (v. Oriol-Palou e altri, 1966). D'altro canto il siero dei soggetti con colite ulcerosa si è dimostrato emoagglutinante verso emazie coniugate con estratto di colon di neonato e, come tale, prelevato con garanzia di completa sterilità (v. Broberger e Perlmann, 1959). L'anticorpo agglutinante è una IgM, di presumibile genesi locale, in quanto presente in alta concentrazione in linfonodi colici (v. Perlmann e Broberger, 1960). Esso si fissa al citoplasma delle cellule epiteliali mucosecernenti (v. Broberger e Perlmann, 1962). Quivi l'antigene è stato identificato con un mucopolisaccaride termostabile, reperibile anche nelle feci e chimicamente simile alle sostanze gruppo-specifiche del sistema ABO (v. Hammarström e altri, 1965). La presenza di autoanticorpi non è sufficiente a giustificare le lesioni ulcerative, dato che colture di epitelio di colon fetale esposte al siero di pazienti con colite ulcerosa non rivelano modificazioni citotossiche (v. Broberger e Perlmann, 1963), che invece risultano evidenti quando le stesse colture vengono cimentate con linfociti circolanti prelevati dai medesimi soggetti. Analogamente un'azione infiammatoria esercitano i linfociti di malati di colite ulcerosa quando iniettati sotto cute o sotto la mucosa rettale agli stessi pazienti (v. Fink e altri, 1967). Si deve pertanto supporre che le lesioni ulcerative siano indotte da immunità cellulare.
Aperto rimane il problema dell'avvio del processo immunitario. La concomitanza di altre malattie autoimmuni lascia adito al sospetto della perdita della tolleranza immunitaria per mutazione genetica. Per contro la stretta affinità chimica tra mucopolisaccaride immunogeno e lipopolisaccaridi del ceppo 014 di Escherichia coli suggerisce la possibilità dell'elusione della immunotolleranza per immunizzazione crociata. Tale ipotesi troverebbe conferma nella constatazione che estratti dello stesso ceppo di Escherichia coli inibiscono l'azione agglutinante del siero dei pazienti verso estratti di colon neonatale (v. Lagercrantz e altri, 1968).
Enterite regionale. Quest'affezione flogistica granulomatosa a localizzazione preferenziale nell'ileo può anch'essa presentarsi in concomitanza con altre malattie di natura autoimmune e con la stessa colite ulcerosa. Recentemente sono stati rinvenuti anticorpi anticolon nel sangue di pazienti con malattia di Crohn (v. Lagercrantz e altri, 1966), ma non sussistono dati sicuri in favore di una patogenesi autoimmunitaria del processo.
Morbo celiaco e sprue nostrana. Sono rappresentativi della sindrome da malassorbimento primitivo sostenuto da intolleranza alla gliadina, un peptide contenuto nel glutine. Accanto a una patogenesi tossica è stata avanzata l'ipotesi che le lesioni della mucosa intestinale siano la conseguenza di un processo immunitario da ipersensibilità, dato che nel siero di spruetici si sono rinvenuti anticorpi antigliadina (v. Berger, 1958). Tale riscontro non è però sufficiente a suffragare un meccanismo immunitario delle lesioni, sia perché anticorpi antigliadina sono stati rinvenuti anche nella colite ulcerosa, sia perché anticorpi contro altri antigeni dietetici sono stati dimostrati nel siero di spruetici (v. Kivel e altri, 1964). Per contro, in una minoranza di pazienti con morbo celiaco è stata osservata deficienza di IgA (v. Heremans e Crabbé, 1968), cioè di coproanticorpi che, secreti nel lume intestinale, provvederebbero a bloccare eventuali antigeni batterici e dietetici, prevenendo fenomeni di ipersensibilità. Se si dovesse confermare che questo è il motivo patogenetico delle sindromi da malassorbimento primitive, se ne dovrebbe trarre la conclusione che esse non sono affezioni autoimmuni.
Fegato
Specialmente in questi ultimi due decenni la letteratura si è arricchita di segnalazioni relative a fenomeni immunitari associati alla più varia patologia epatica; tuttavia, fra tanti fenomeni la natura autoimmune è stata sufficientemente comprovata in due sole forme morbose: l'epatite cronica attiva e la cirrosi biliare primitiva.
Epatite cronica attiva. Si raccolgono sotto questa denominazione almeno quattro entità; l'epatite lupoide, l'epatite virale cronica attiva con antigene Australia positivo, l'epatite tossica cronica attiva, l'epatite cronica attiva criptogenetica (cirrosi criptogenetica), le quali, sebbene siano accomunate da identiche lesioni istopatologiche, si ritiene abbiano un diverso movente eziologico. Di esse quella cui meglio si addice l'attributo di malattia autoimmune sembrerebbe essere l'epatite lupoide (v. Mackay e altri, 1965). L'affezione, che colpisce giovani donne, ha decorso cronico con recidive responsabili della persistenza del danno epatocellulare. Istologicamente il processo consta soprattutto di un'infiltrazione flogistica ricca di linfociti e di plasmacellule che si estrinseca prevalentemente alla periferia del lobulo, lungo la limiting plate e che può organizzarsi in follicoli. Concomitano focolai di necrosi parcellare perilobulare cui consegue sovvertimento di tipo cirrotico. Sussiste ipergammaglobulinemia e risulta positiva la ricerca del fenomeno LE. Nel siero sono dimostrabili, con elevata frequenza, anticorpi antinucleari (v. Smalley e altri, 1968), il fattore reumatoide (v. Howell e altri, 1960), anticorpi antimuscolo liscio (v. Whittingham e altri, 1966), anticitoplasmatici (antimitocondri, antiribosomi, antilisosomi) fissanti il complemento (v. Doniach e altri, 1966), antitiroidei e anticellule parietali gastriche. Può coesistere anemia autoimmune.
Cirrosi biliare primitiva. Detta anche cirrosi biliare xantomatosa, colpisce donne di media età e si manifesta con ittero ostruttivo, xantelasmi, epato-splenomegalia anascitica. Il quadro istopatologico si contrassegna per infiltrazione linfo-plasmacellulare degli spazi portobiliari con sclerosi perilobulare e abbondante sviluppo di capillari biliari. Nel siero si rinvengono quasi costantemente anticorpi antimitocondriali (v. Mackay e altri, 1965), mentre meno frequenti sono quelli antinucleari e antimuscolo liscio (v. Doniach e altri, 1966).
In entrambe le forme qui ricordate la concomitanza di lesioni epatiche e di autoanticorpi non denuncia un chiaro nesso patogenetico. Inoltre i numerosi tentativi di riprodurre sperimentalmente epatopatie autoimmuni si sono finora rivelati vani.
Organi endocrini
Le malattie spontanee umane delle ghiandole endocrine cui può essere riconosciuta patogenesi autoimmune concernono, oltre la tiroide, la corticale del surrene, le paratiroidi e le insule pancreatiche.
Tiroide. Fra le malattie autoimmuni della tiroide si annoverano la tiroidite o struma linfomatosa di Hashimoto e il morbo o gozzo tireotossico di Flajani-Graves-Basedow.
La tiroidite di Hashimoto è una struma caratterizzata da infiltrazione linfo-plasmacellulare con organizzazione follicolare. Ne consegue atrofia delle strutture otricolari responsabile dell'insufficienza funzionale. È in prevalenza colpito il sesso femminile. Nel sangue dei pazienti si rinvengono diversi tipi di autoanticorpi: precipitanti (v. Roitt e altri, 1956) ed emoagglutinanti diretti contro la tireoglobulina; anticorpi anticitoplasmatici fissanti il complemento e diretti contro la frazione microsomiale dell'epitelio tiroideo (v. Belyavin e Trotter, 1959), provvisti di proprietà citotossiche per la tiroide fetale in coltura; anticorpi diretti contro componenti colloidee non tireoglobuliniche (v. Balfour e altri, 1961). Non ha ancora trovato conferma l'ipotesi che le lesioni tiroidee umane siano sostenute da fenomeni di immunità cellulare. La malattia di Hashimoto si associa frequentemente ad anemia perniciosa e, per converso, nel sangue degli anemici perniciosi sono spesso presenti anticorpi antitiroidei (v. Doniach e altri, 1963). Sperimentalmente è possibile indurre una tiroidite praticamente identica a quella umana iniettando estratti di tiroide o semplicemente tireoglobulina in adiuvante di Freund (v. Rose e Witebsky, 1971): nel siero degli animali compaiono anticorpi di vario tipo e alcuni, fissanti il complemento, rivelano proprietà citotossiche verso colture di epitelio tiroideo embrionale. La malattia è trasferibile passivamente ad animali sani a mezzo di siero o di anticorpi di animali sensibilizzati (v. Nakamura e Weigle, 1969). Anche per la tiroidite sperimentale è discussa l'esistenza di un'immunità cellulare.
Il morbo di Flajani-Graves-Basedow colpisce di preferenza donne giovani appartenenti al secondo e terzo decennio. La lesione tiroidea è caratterizzata da iperplasia papillare dell'epitelio degli otricoli, i quali sono pressoché privi di colloide. Si rinvengono occasionalmente infiltrati di linfociti nell'interstizio. La dimostrazione che l'inoculazione in animali di siero di basedowiani stimola la tiroide a captare iodio per un tempo molto più lungo di quanto non avvenga con l'ormone tireotropo, ha portato alla scoperta di una γ-globulina anticorpale 7S dotata di capacità tireostimolante (v. McKenzie, 1968). È stato postulato che la sede di attacco di questa molecola sull'epitelio tiroideo sia prossima (o, addirittura, identica) a quella dell'ormone tireotropo. La parte attiva della globulina denominata LATS (Long Acting Thyroid Stimulator) è contenuta nella catena L del frammento Fab (v. McKenzie, 1968). Nel sangue dei basedowiani si rinvengono altresì anticorpi antitireoglobulinici e anticitoplasmatici (microsomiali), fissanti il complemento. Occasionalmente si evidenziano anticorpi anti-cellule parietali gastriche (v. Doniach e Roitt, 1965). Con opportuni accorgimenti è possibile provocare sperimentalmente la formazione di globuline LATS (v. Beall e Solomon, 1968).
Entrambe le tireopatie possono considerarsi di natura autoimmune per l'esistenza di autoanticorpi specifici responsabili delle lesioni morfologiche e funzionali della ghiandola e per la riproducibilità sperimentale dei processi. Inoltre nel morbo di Basedow il passaggio transplacentare dell'anticorpo è responsabile di manifestazioni tireotossiche transitorie nel neonato (v. McKenzie, 1964).
Surrene
L'esistenza di un iposurrenalismo cronico primario o malattia di Addison di natura autoimmune è stata postulata in seguito alla constatazione di casi non sostenuti da affezioni note e con reperto sierologico di anticorpi precipitanti, agglutinanti e fissanti il complemento nei confronti di estratti di corteccia surrenale omologa. Gli anticorpi antisurrene non sono esclusivi di questa forma, essendo stati dimostrati nella tiroidite di Hashimoto e nel morbo di Basedow. I caratteri morfologici del processo sono quelli di un'atrofia corticosurrenale a carattere settoriale o nodulare con formazione di sepimenti connettivali compenetrati da infiltrazione linfo-istiocitaria. Un reperto analogo, insieme a comparsa di anticorpi circolanti, è ottenibile sperimentalmente mediante trattamento con corteccia surrenale eterologa, omologa o anche autologa in adiuvante (v. Levine e Wenk, 1968). Mentre nel coniglio e nella cavia non si evidenziano fenomeni di ipersensibilità ritardata (v. Barnett e altri, 1963), nel ratto è possibile trasmettere passivamente l'affezione con l'inoculazione di linfociti ottenuti da animali sensibilizzati (v. Levine e Wenk, 1968). Sembra che l'antigene responsabile si identifichi con la frazione microsomiale (v. Blizzard e Kyle, 1963) o forse anche con quella mitocondriale delle cellule corticali. Questa forma di iposurrenalismo si può trovare associata con la tiroidite di Hashimoto, con il diabete mellito, con l'ipoparatiroidismo e con l'anemia perniciosa più frequentemente di quanto queste affezioni concomitino con l'iposurrenalismo.
Il raro rinvenimento di anticorpi antisurrene nella sindrome di Cushing da adenoma corticosurrenale (v. Wegienka e altri, 1966) ha suggerito la possibilità che gli stessi anticorpi siano in grado di esercitare un effetto simile a quello del LATS nel morbo di Basedow (v. Irvine, 1971).
Paratiroidi
L'ipotesi della genesi autoimmunitaria dell'ipoparatiroidismo idiopatico trae motivo dalla sua associazione con la tiroidite di Hashimoto e con l'anemia perniciosa (v. Irvine, 1971). Anticorpi antiparatiroidei sono stati rinvenuti nel 38% dei casi di ipoparatiroidismo idiopatico, ma anche nel 33% di adenomi paratiroidei (v. Bliz zard, 1969), nel 27% dei casi di Addison (esenti da concomitanti segni di ipoparatiroidismo), in 6 su 23 casi di malattia di Hashimoto. Per converso anticorpi antitiroidei e anti-cellule parietali gastriche sono stati dimostrati nel siero di soggetti con ipoparatiroidismo idiopatico (ibid.).
Dal punto di vista sperimentale l'inoculazione di omogenato di paratiroidi omologhe sospeso in adiuvante di Freund è seguita da infiltrazione linfocitaria paratiroidea (v. Lupulescu e altri, 1965). Non è stata però osservata comparsa di anticorpi circolanti, anche se è documentabile un'ipocalcemia con iperfosforemia. Attualmente, quindi, la patogenesi autoimmunitaria dell'ipoparatiroidismo non risulta sufficientemente suffragata.
Pancreas endocrino. L'ipotesi che il diabete mellito sia causato da un processo autoimmunitario avviato dall'insulina è sorta sulla base dei fenomeni di resistenza all'insulinoterapia che conseguono all'uso dell'ormone eterologo (v. Oakley e altri, 1967). Nei bovini e negli ovini l'inoculazione di insulina eterologa evoca la comparsa di anticorpi antiinsulina insieme con lesioni flogistiche insulari (insulite), senza, per altro, iperglicemia e glicosuria (v. Renold e altri, 1969), che invece sono manifeste nell'insulite linfocitaria da insulina eterologa del coniglio (v. Grodsky e altri, 1966). Nell'uomo anticorpi antunsulina si osserva- no frequentemente nei soggetti sottoposti da tempo a insulinoterapia (insulina eterologa), mentre si è in dubbio circa la loro presenza in soggetti non trattati (v. Renold e altri, 1969). Un'insulite umana è stata rinvenuta nelle fasi precoci del diabete giovanile (v. Le Compte, 1958). Tuttavia l'ipotesi che il diabetico sintetizzi insulina chimicamente abnorme (v. Elliot e altri, 1965) e, quindi, immunogena non ha trovato conferma alcuna. In sostanza la patogenesi autoimmunitaria del diabete umano è tuttora incerta.
Cute
Recentemente la genesi autoimmunitaria di due gruppi di dermatosi bollose, facenti capo al pemfigo e al pemfigoide, è stata sufficientemente provata, anche se rimane oscuro il meccanismo di avvio del processo di autoimmunizzazione.
Pemfigo. Rientrano in questo gruppo la forma più comune, denominata pemfigo volgare, con la sua varietà vegetante, e il pemfigo fogliaceo con la sua varietà eritematosa. Esiste poi una forma endemica di pemfigo fogliaceo tra le popolazioni sudamericane, specialmente brasiliane. La lesione elementare delle varie forme di pemfigo consta nell'accumulo di liquido intercellulare in seguito all'acantolisi, cioè al dissolvimento delle giunzioni cellulari o desmosomi (v. Hashimoto e Lever, 1967). Si formano così delle bolle intraepidermiche che nel pemfigo volgare sono delimitate, verso il derma, dal solo strato basale. Questo presenta escrescenze papillari nell'interno della bolla, chiamate villi, che sono particolarmente sviluppate nel pemfigo vegetante. Nel pemfigo fogliaceo le bolle intraepidermiche sono più superficiali. Le ricerche al microscopio elettronico hanno dimostrato che la dissoluzione dei desmosomi ha luogo per scomparsa della sostanza cementante intermembranosa di pertinenza del glicocalice, cioè dello strato glicoproteico che riveste la membrana cellulare. Nel siero di pazienti con pemfigo si rinvengono anticorpi che si fissano alla sostanza cementante dei desmosomi dell'epitelio malpighiano (v. Beutner e altri, 1965), infatti a livello di questi ultimi si mettono in evidenza IgG e complemento. Inoltre la fissazione ai desmosomi di globuline di coniglio immunizzato con estratti di epidermide umana viene impedita dalla preliminare incubazione del tessuto con siero di pemfigosi. Se questi rilievi inducono a ritenere che le lesioni epidermiche sono la diretta conseguenza di una reazione autoimmune a livello dei desmosomi, restano tuttavia ignoti i motivi di avvio del processo.
Il pemfigo fogliaceo endemico o brasiliano è ritenuto dagli indigeni essere trasmesso da un artropode (mosca nera). Esso sarebbe causato da un agente infettivo ignoto da considerarsi responsabile di immunità crociata verso la sostanza cementante dei desmosomi.
In favore della natura autoimmunitaria del pemfigo sta ancora la sua non rara associazione con la miastenia (v. Beutner e altri, 1968) e la coesistenza di anticorpi antinucleari e antimuscolo.
Pemfigoide. È una dermatite bollosa non acantolitica in quanto le lesioni si estrinsecano tra epidermide e derma, coinvolgendo inizialmente la membrana basale con dissoluzione degli emidesmosomi. Nel sangue dei pazienti si rinvengono anticorpi che si fissano alla membrana basale (v. Jordon e altri, 1967). Quivi, infatti, si possono dimostrare depositi di IgG e di complemento. Anche in questa forma non è noto il meccanismo di avvio del processo autoimmunitario.
Occhio
A tre affezioni aventi localizzazione oculare è stata riconosciuta una patogenesi autoimmune: la sindrome di Sjögren (v. sopra, cap. 6), l'uveite facogenica e l'oftalmia simpatica.
Uveite facogenica. È un'iridociclite suscitata da sostanze provenienti dal cristallino sia in corso di interventi per rimozione di cataratta che in seguito a rottura traumatica della capsula. La malattia si manifesta a distanza di 24 o 48 ore e di regola interessa il solo occhio previamente leso. Eccezionalmente è bilaterale. All'inizio si osserva iperemia e infiltrazione di granulociti, cui seguono linfociti, plasmacellule, macrofagi e cellule giganti con formazione di un tessuto di granulazione evolvente in sclerosi e demarcante residui del cristallino. La malattia recede solo dopo rimozione totale di quest'ultimo. Nel sangue e nell'umore acqueo dei pazienti si repertano anticorpi antilente (v. Witmer, 1957; v. Hackett e Thompson, 1964), cui si associa una condizione di ipersensibilità ritardata dimostrabile mediante iniezione intradermica di estratti di cristallino (v. Aronson e Maumenee, 1971). Sperimentalmente è possibile riprodurre un quadro analogo a quello umano, sensibilizzando preliminarmente l'animale con sospensioni di cristallino omologo o autologo in adiuvante di Freund e, quindi, traumatizzando la lente (v. Burky, 1934; v. Muller, 1952). Non è stata ancora individuata la componente immunogena del cristallino (v. Mansky e altri, 1961): essa sarebbe di natura polisaccaridica e le lesioni verrebbero indotte con il meccanismo dell'ipersensibilità ritardata.
Oftalmia simpatica. È un'affezione molto rara, sostenuta da una irido-corioretinite progressiva fino a cecità che interessa dapprima un occhio sede di trauma perforante (occhio eccitante) e, a distanza di tempo (10-21 giorni), anche l'altro (occhio simpatizzante). Talvolta l'evoluzione del processo nell'occhio simpatizzante può essere interrotta dall'ablazione dell'occhio eccitante. Soprattutto a livello del corpo ciliare e della coroide si riscontra intensa infiltrazione flogistica costituita da linfociti, da istiociti e da cellule giganti contenenti pigmento melanico (granuloma di Dalen e Fuch). La genesi autoimmunitaria dell'affezione è suggerita dalla sua riproducibilità sperimentale con l'inoculazione in animali di estratti omologhi o autologhi di uvea in adiuvante (v. Collins, 1949). Svolgerebbe azione antigene il pigmento (v. Wirostko e Halbert, 1969). La rarità della malattia ne limita lo studio nell'uomo.
Muscolatura scheletrica
Attualmente l'unica malattia della muscolatura scheletrica per la quale esistono indizi di una patogenesi immunitaria è la miastenia grave di Erb Goldflam, che colpisce preferenzialmente il sesso femminile nel corso del secondo e del terzo decennio. Si ritiene che la malattia derivi da una turba della conduzione a livello delle sinapsi neuromuscolari, sebbene tale opinione non sembri accordarsi facilmente con la variabilità delle sedi muscolari interessate. Sulla natura del processo sono state avanzate diverse ipotesi e, fra l'altro, quella che un meccanismo immunitario impedisca la trasmissione dell'acetilcolina. Nei muscoli interessati si osservano solo infiltrati linfocitari (linforragie), reperto per altro non specifico, anche se caratteristico, in quanto presente in numerose altre condizioni: lupus eritematoso, artrite reumatoide, morbo di Addison, ipertiroidismo. D'altro canto sindromi miasteniche si rinvengono in associazione con il lupus entematoso (v. Osserman, 1958), con la tireotossicosi (ibid.), con l'anemia perniciosa (v. Simpson, 1960), con la colite ulcerosa (v. Galbraith e altri, 1964), con il pemfigo (v. Beutner e altri, 1968), nonché in corso di sindrome di Eaton-Lambert-Rooke (v. Lambert e altri, 1956), in concomitanza con neoplasia polmonare (microcitoma). Nell'80% circa dei miastenici si riscontra un'iperpiasia o un tumore timico (v. Castelman e Norris, 1949), la cui ablazione provoca sensibile miglioramento della malattia (v. Osserman, 1968). Il verificarsi di miastenia transitoria in neonati da madri miasteniche ha fatto pensare all'azione di una sostanza capace di attraversare la placenta. Inoltre il fenomeno di Walker (scatenamento di crisi miastenica in seguito a rimozione di un laccio applicato a un arto sottoposto a esercizio muscolare prolungato) ha suggerito la eventualità di un fattore umorale. Si accorda con ciò il riscontro che il siero dei miastenici riduce l'ampiezza dei movimenti nei preparati neuromuscolari di rana (v. Nastuk e altri, 1959). Un fattore umorale potrebbe, fra l'altro, identificarsi, nel siero dei miastenici, con immunoglobuline che si legano al muscolo scheletrico, fissando il complemento (v. Strauss e altri, 1960). Su questa scia sono stati individuati altri anticorpi antimuscolo scheletrico che fissano il complemento e si legano solo alla muscolatura somatica e anticorpi antimuscolo scheletrico che si legano anche al miocardio senza fissare il complemento (v. Beutner e altri, 1962). Il titolo di questi anticorpi è più elevato nei miastenici con timoma. Inoltre gli anticorpi si legano a particolari cellule epiteliali del timo che, presentando miofibrille, vengono identificate come mioidi. Non è stato ancora stabilito a quale tratto delle miofibrille si leghino gli anticorpi: inizialmente è stato sostenuto che la sede del legame fosse la banda A (v. Strauss e altri, 1961), quindi è stata indicata la stria Z (v. Gottlieb e altri, 1966). Non sono mai stati riscontrati anticorpi sulle placche neuromuscolari. Mancano notizie attendibili sull'immunogeno responsabile degli anticorpi antimuscolo; si esclude che sia la miosina, si pensa piuttosto a una ribonucleina della frazione ribosomiale della fibra muscolare, avente affinità per l'acetilcolina e per la d-tubocurarina (v. Grob e altri, 1962). Nel siero dei miastenici è stata anche documentata l'esistenza di anticorpi antinucleari, antitiroidei, anticellule parietali gastriche e del fattore reumatoide. È stato però notato come la capacità delle fibrille muscolari di legare globuline e complemento possa esplicarsi anche per motivi non immunitari e, d'altro canto, non sono stati documentati fenomeni di ipersensibilità ritardata in corso di miastenia. Si è così sollevato il problema del significato patogenetico dei fenomeni immunitari, se cioè siano primitivi, secondari o provocati dal movente stesso dell'affezione. Poiché tali interrogativi restano tuttora insoluti, la genesi autoimmunitaria della malattia deve considerarsi tutta da dimostrare: ciò vale particolarmente per l'ipotesi che gli antigeni muscolari timici (attinenti alle cellule mioidi), liberati da processi infiammatori (timiti), possano indurre formazione di fattori antimuscolari, i quali, a loro volta, reagirebbero con le fibre muscolari, legandosi ai recettori dell'acetilcolina e bloccandone l'azione.
Cuore. - La presenza nel siero di anticorpi capaci di legarsi al miocardio è stata rilevata in varie affezioni cardiache: sindrome postcardiotomica e postinfartuale, endomiocardiofibrosi, cardiomiopatia idiopatica, cardite reumatica (v. Kaplan, 1969). Anticorpi antimiocardici sono tuttavia presenti anche nel lupus eritematoso e nell'artrite reumatoide (v. Kaplan e Rakita, 1971). Non si conoscono gli antigeni contenuti nelle fibre del miocardio responsabili della produzione anticorpale. Gli anticorpi presenti nel siero si rivelano precipitanti, emoagglutinanti e fissanti il complemento (v. Kaplan, 1969). La frazione globulinica di questi sieri, marcata con fluorescina, si fissa sulle sezioni di miocardio, inducendo una fluorescenza diffusa del sarcoplasma o una fluorescenza subsarcolemmatica o, ancora, una fluorescenza interfibrillare (Kaplan e altri, 1961); solo queste ultime due sono considerate specifiche. Si ammette che nelle affezioni cardiache menzionate l'origine di tali anticorpi sia da imputare a liberazione di antigeni in conseguenza di traumi chirurgici, di necrosi ischemica, o di lesioni di altra natura, e pertanto la comparsa di un movimento anticorpale rappresenterebbe un fenomeno collaterale o secondario. Nella cardiopatia reumatica si rinvengono nel siero anticorpi diretti verso sostanze dello streptococco e, in particolare, verso una proteina strettamente associata all'antigene di virulenza M della parete cellulare (v. Kaplan, 1963). Tali anticorpi sono altresì capaci di reagire con la fibra miocardica umana (v. Kaplan e Meyeserian, 1962), mentre non si rinvengono a livello dei granulomi di Aschoff. Ciò porta a ritenere che l'infezione streptococcica possa avviare un processo autoimmunitario contro antigeni autologhi miocardici. Una tale interpretazione attende conferma sperimentale.
Organi della riproduzione
Fin dal 1922 S. R. Meaker ha prospettato la possibilità che fenomeni immunitari intervengano nel compromettere la fertilità coniugale. Infatti in una percentuale significativamente elevata di donne sterili esistono anticorpi agglutinanti gli spermatozoi sia del coniuge che di altri uomini (v. Nakabayashi e altri, 1961), che invece non si rinvengono nelle donne vergini (v. Bodner e Kamniker, 1925). Inoltre il tasso di anticorpi antispermi è risultato crescere con la frequenza degli amplessi (v. Ardelt, 1933) e ridursi con la continenza o con l'uso di contraccettivi meccanici (v. Gennser, 1965). La successiva ripresa di normali rapporti è stata seguita da gravidanza regolare (v. Franklin e Dukes, 1964). D'altro canto nel siero di meretrici altissima è la frequenza di anticorpi antispermi (v. Schwimmer e altri, Sperm agglutinating ..., 1967). C'è per altro da rilevare che in donne sterili con anticorpi antispermi sussiste frequentemente incompatibilità gruppale ABO (v. Schwimmer e altri, An evaluation ..., 1967), il che suggerisce l'intervento di isoanticorpi.
In una piccola percentuale (3,3%) di infertilità maschile, con oligospermia o ipomobilità spermatica, è stata osservata presenza di anticorpi agglutinanti gli spermi (v. Rümke e Hellinga, 1959).
Ricerche sperimentali hanno dimostrato l'immunogenicità degli spermi e del liquido seminale sia nell'organismo femminile che in quello maschile.
Nelle femmine è possibile evocare anticorpi, inoculando spermi tanto per via parenterale che vaginale (v. Isojima e Ashitaka, 1964): quivi l'assorbimento varia in rapporto alla situazione ormonale. Gli anticorpi agglutinanti sono reperibili, oltre che nel siero, nel muco cervicale e in vagina. La percentuale di infecondità è proporzionale al tasso degli anticorpi (v. Behrman e Nakayama, 1965).
Negli animali maschi è possibile produrre un'orchite iniettando estratti di testicolo eterologo, omologo o autologo in adiuvante di Freund (v. Freund e altri, 1953). Si rinviene infiltrazione linfo-plasmacellulare e istiocitaria, prevalentemente perivascolare, con invasione dei tubuli seminiferi: ne consegue caduta e degenerazione degli elementi della linea seminale e delle cellule del Sertoli; l'animale diviene azoospermico ed è incapace di fecondare. In circolo si rinvengono anticorpi agglutinanti che reagiscono con l'acrosoma degli spermatozoi (v. Mancini e Andrada, 1971). Si istituisce nel contempo una condizione di immunità cellulare (ipersensibilità ritardata con cutireazione positiva a estratti di testicolo) ed è possibile indurre passivamente l'orchite in animali sani solo a mezzo di linfociti prelevati dall'animale sensibilizzato (ibid.). La complessità antigenica degli spermi non ha finora consentito di individuare gli antigeni responsabili dei fenomeni autoimmunitari. Si deve inoltre tener presente che durante il soggiorno nell'epididimo e nelle vescichette seminali agli spermi vengono ad aderire altre sostanze che possono a loro volta essere responsabili di fenomeni di sensibilizzazione. Nonostante i risultati delle ricerche sperimentali, la prova di una condizione di sterilità su base autoimmunitaria nell'uomo permane tuttora indiziaria.
Rene. - In nessun altro campo della patologia l'immunologia sperimentale ha portato un chiarimento così definitivo della patogenesi delle malattie autoimmuni, come in quello delle glomerulonefriti. È noto che la glomerulonefrite diffusa può essere ricondotta a due meccanismi immunitari (v. Dixon, 1971). Il primo si basa sulla produzione di anticorpi contro antigeni autologhi di origine renale, rappresentati da sostanze costitutive della membrana basale dei capillari glomerulari. Il secondo meccanismo concerne la produzione di anticorpi diretti contro antigeni non glomerulari, sia autologhi (per es. antigeni nucleari) che eterologhi (agenti infettivi), capaci di formare con essi immunocomplessi solubili e circolanti, i quali si accumulano sulla membrana basale dei capillari glomerulari durante il processo di ultrafiltrazione. Nell'uno e nell'altro meccanismo la fissazione del complemento agli immunocomplessi, giunta alle componenti C5, C6, C7, provoca un' azione chemiotattica sui polinucleati neutrofili che, richiamati così nel glomerulo, agiscono con i loro enzimi proteolitici liberati dai loro granuli (lisosomi). L'azione enzimatica, oltre a distruggere gli immunocomplessi, danneggia le stesse strutture glomerulari, in particolare le membrane basali, sicché il plasma con gli altri elementi dell'essudazione passa nella capsula di Bowman e nel mesangio. L'immunofluorescenza e la microscopia elettronica mostrano caratteristiche morfologiche differenziali proprie di ciascuno dei due meccanismi. In quello sostenuto da anticorpi antimembrana basale, questa si presenta ispessita in maniera continua e vi è accumulo di materiale amorfo tra la membrana stessa e l'endotelio. Nel secondo meccanismo, quello riguardante la ultrafiltrazione di immunocomplessi che hanno fissato il complemento, i depositi nella membrana basale appaiono discontinui, granulari e situati sotto i processi dei podociti. I prodotti derivanti dalla usi delle strutture glomerulari per effetto della flogosi e, in particolare, quelli che provengono dalla membrana basale sono a loro volta suscettibili di essere riassorbiti e, dato che sono immunogeni, possono amplificare e perpetuare il processo immunitario. In senso ristretto dovrebbe riservarsi la qualifica di ‛autoimmunitario' soltanto al primo meccanismo, cioè a quello avviato da antigeni renali. È però giustificato estendere la stessa qualifica anche al secondo meccanismo nel caso in cui si tratti di antigeni autologhi. Indotto da anticorpi antimembrana è il meccanismo nefritogeno che si realizza nel corso della sindrome di Goodpasture (polmonite emorragica associata a glomerulonefrite), in circa la metà dei casi di glomerulonefrite subacuta e nella glomerulonefrite cronica. Il meccanismo da eliminazione di immunocomplessi si osserva più frequentemente nella glomerulonefrite acuta post-streptococcica, nella nefrosi malarica e nella glomerulite membranosa del lupus eritematoso.
8. Conclusioni e prospettive
Dalla presente esposizione sintetica delle malattie autoimmuni appare evidente come queste siano l'effetto del danno inferto ai tessuti dall'intervento di meccanismi originariamente preposti alla difesa dell'organismo. È superfluo ribadire che la patologia autoimmunitaria mostra ancora oggi un numero ragguardevole di zone d'ombra le quali ne rendono incerti i limiti e il contenuto. Si può dire che fin qui i ricercatori si sono preoccupati di offrire di questo importante capitolo una costruzione in gran parte teorica. Sarà quindi compito degli studi futuri dare una valida conferma oppure sconfessare quelle concezioni che allo stato presente rivestono semplicemente carattere di ipotesi di lavoro. In sostanza si dovranno chiarire i moventi causali e approfondire i meccanismi patogenetici specifici dell'autoimmunità, come pure si dovranno ulteriormente definire i criteri di riconoscimento delle malattie autoimmuni.
Accanto alle malattie autoimmuni, intese alla stregua di un clamoroso evento occasionale indotto dall'evasione o dalla cessazione del normale controllo esercitato dalla tolleranza immunitaria, è lecito supporre l'esistenza di altre manifestazioni di tale mancato controllo. Da tempo, infatti, si è andata facendo strada l'idea che i fenomeni autoimmunitari abbiano un andamento praticamente ininterrotto nel tempo, anche se la loro limitata intensità non consente che essi raggiungano la soglia di evidenziazione clinica. In tal modo il controllo della tolleranza immunitaria non si eserciterebbe in maniera statica, nel senso, cioè, che verrebbe acquisito una volta per sempre nel periodo perinatale, ma realizzerebbe piuttosto una situazione dinamica soggetta a continua regolazione. Non è strano, quindi, che con l'avvento dell'involuzione biologica dell'organismo il controllo della tolleranza immunitaria possa deteriorarsi consentendo, come sostiene Waldford (v., 1962), un incremento di frequenza delle malattie autoimmuni (v. Sri Ram, 1966). Ciò può spiegare perché qualcuno, ispirandosi a siffatta prospettiva, abbia considerato le stesse manifestazioni della senescenza alla stregua di fenomeni autoimmunitari (v. Burch e Jackson, 1966) e come Burch (v., 1966) sia giunto alla formulazione in termini matematici di una teoria autoimmunitaria della senescenza. È prematuro affermare quanto di così suggestive concezioni rimarrà definitivamente dimostrato: tuttavia è evidente che, malgrado i numerosi quesiti che permangono insoluti in patologia, le teorie immunitarie coinvolgono sempre più la biologia generale, schiudendo così una nuova affascinante problematica per gli anni avvenire.
bibliografia
Ardelt, F., Spermoresorption bei gesunden und genital kranken Frauen, in ‟Archiv für Gynaekologie", 1933, CLVI, pp. 357-361.
Aronson, S. B., Maumenee, A. E., Uveitis and other intraocular inflammation, in Immunological diseases (a cura di M. Samter), vol. II, Boston 1971, pp. 1300-1313.
Asherson, G. L., Autoimmune disease, in ‟British medical journal", 1967, III, pp. 417-420, 479-482.
Asherson, G. L., The role of micro-organisms in autoimmune responses, in Progress in allergy (a cura di P. Kallos e B. H. Waksman), vol. XII, Basel-New York 1968, pp. 192-245.
Asherson, G. L., Holborow, E. J., Autoantibody production in rabbits. VII. Autoantibodies to gut produced by the injection of bacteria, in ‟Immunology", 1966, X, pp. 161-167.
Balfour, B. M., Doniach, D., Roitt, I. M., Couchman, K. G., Fluorescent antibody studies in human thyroidits. Autoantibodies to an antigen of the thyroid colloid distinct from thyroglobulin, in ‟British journal of experimental pathology", 1961, XLII, pp. 307-316.
Barnett, E. V., Dumonde, D. C., Glynn, L. E., Induction of autoimmunity to adrenal gland, in ‟Immunology", 1963, VI, pp. 382-402.
Bäumer, A., Immunozytologische Phänomene bei verschiedenen rheumatischen Krankheiten, in ‟Zeitschrift für Rheumaforschung", 1965, XXIV, pp. 326-332.
Beall, G. N., Solomon, D. H., Thyroid-stimulating activity in the serum of rabbits immunized with thyroid microsomes, in ‟Journal of clinical endocrinology and metabolism", 1968, XXVIII, pp. 508-510.
Behrman, S. J., Nakayama, M., Antitestis antibody. Its inhibition of pregnancy, in ‟Fertility and sterility", 1965, XVI, pp. 37-45.
Belyavin, G., Trotter, W. R., Investigation of thyroid antigens reacting with Hashimoto sera. Evidence for an antigen other than thyroglobulin, in ‟Lancet", 1959, I, pp. 648-652.
Berger, E., Zur allergischen Pathogenese der Cöliakie, mit Versuchen über die Spaltum pathogener Antigene durch Fermente, in ‟Bibliotheca paediatrica", 1958, LXVII, pp. 1-55.
Bertram, U., Halberg, P., Organ antibodies in Sjöghren's syndrome, in ‟Acta allergologica", 1965, XX, pp. 472-483.
Beutner, E. H., Chorzelski, P., Hale, W. L., Hausmanowa-Petrosewicz, I., Autoimmunity in concurrent myasthenia gravis and pemphigus erythematosus, in ‟Journal of the American Medical Association", 1968, CCIII, pp. 845-849.
Beutner, E. H., Lever, W. F., Witebsky, E., Jordon, R., Chertock, B., Autoantibodies in pemphigus vulgaris. Response to an intercellular substance of epidermis, in ‟Journal of the American Medical Association", 1965, CXCII, pp. 682-688.
Beutner, E. H., Witebsky, E., Ricken, D., Adler, R. H., Studies on autoantibodies in myasthenia gravis, in ‟Journal of the American Medical Association", 1962, CLXXXII, pp. 46-58.
Binette, J. P., Winzler, R. J., Calkins, E., Carbohydrate and amino acid analysis of amyloid components, in ‟Arthritis and rheumatism", 1968, XI, p. 468.
Bladen, H. A., Nylen, M. U., Glenner, G. C., The ultrastructure of human amyloid as revealed by the negative staining technique, in ‟Journal of ultrastructure research", 1966, XIV, pp. 449-459.
Blizzard, R. M., Idiopathic hypoparathyroidism. A probable autoimmune disease, in Textbook of immunopathology (a cura di P. A. Miescher e H. J. Müller-Eberhard), vol. II, New York 1969, pp. 547-550.
Blizzard, R. M., Kyle, M., Studies of the adrenal antigen and antibodies in Addison's disease, in ‟Journal of clinical investigation", 1963, XLII, pp. 1653-1660.
Bloch, K. J., Buchanan, W. W., Wohl, M. J., Bunim, J. J., Sjögren's syndrome. A clinical pathological and serological study of sixty-two cases, in ‟Medicine", 1965, XLIV, pp. 187-231.
Bloch, K. J., Myers, A. R., Sjögren's syndrome, in Immunological diseases (a cura di M. Samter), vol. II, Boston 1971, pp. 1172-1177.
Bodner, L., Kamniker, H., Zur Frage der Spermaimmunität, in ‟Zeitschrift für Geburtshilfe und Gynaekologie", 1925, LXXXIX, pp. 85-87.
Brobergher, O., Perlmann, P., Autoantibodies in human ulcerative colitis, in ‟Journal of experimental medicine", 1959, CX, pp. 657-674.
Broberger, O., Perlmann, P., Demonstration of an epithelial antigen in colon by means of fluorescent antibodies from children with ulcerative colitis, in ‟Journal of experimental medicine", 1962, CXV, pp. 13-26.
Broberger, O., Perlmann, P., In vitro studies of ulcerative colitis. I. Reactions of patients' serum with human fetal colon cells in tissue culture, in ‟Journal of experimental medicine", 1963, CXVII, pp. 706-716.
Brody, J. I., Beizer, L. N., Globulin coating of neoplastic lymphocytes in chronic lymphocytic leukemia, in ‟Blood", 1963, XXII, p. 139.
Burch, P. R. J., Spontaneous autoimmunity. Equations for age-specific prevalence and initiation-rates, in ‟Journal of theoretical biology", 1966, XII, pp. 397-409.
Burch, P. R. J., Jackson, D., The graying of hairs and the loss of permanent teeth considered in relation to an autoimmune theory of aging, in ‟Journal of gerontology", 1966, XXI, pp. 522-528.
Burch, P. R. J., Rowell, N. R., Systemic lupus erythematosus. Etiological aspects, in ‟American journal of medicine", 1965, XXXVIII, pp. 793-801.
Burky, E. L., Experimental endophthalmitis phacoanaphylactica in rabbits, in ‟Archives of ophthalmology", 1934, XII, pp. 536-546.
Burnet, F. M., Enzyme, antigen and virus. A study of macromolecular pattern in action, London 1956.
Burnet, F. M., A modification of Jerne's theory of antibody production using the concept of clonal selection, in ‟Australian journal of science", 1957, XX, pp. 67-69.
Burnet, F. M., Auto-immune disease. II. Pathology of the immune response, in ‟British medical journal", 1959, II, pp. 720-725.
Burnet, F. M., Fenner, F., The production of antibodies, London 1941, Melbourne 19492.
Caesar, R., Die Feinstruktur von Milz und Leber bei experimenteller Amiloidose, in ‟Zeitschrift für Zellforschung und mikroskopische Anatomie", 1960, LII, pp. 653-673.
Calkins, E., Amyloidosis, in Immunological diseases (a cura di M. Samter), vol. II, Boston 1971, pp. 1073-1082.
Caspary, E. A., Gubbay, S. S., Stern, G. M., Circulating antibodies in polymyositis and other muscle-wasting disorders, in ‟Lancet", 1964, II, p. 941.
Castelman, B., Norris, E. H., Pathology of the thymus in myasthenia gravis, in ‟Medicine", 1949, XXVIII, pp. 27-58.
Cathcart, E. S., Comerford, F. R., Cohen, A. S., Immunologic studies on a protein extracted from human secondary amyloid, in ‟New England journal of medicine", 1965, CCLXXIII, pp. 143-146.
Cavelti, P. A., Studies of the pathogenesis of rheumatic fever. I. Experimental production of autoantibodies to heart, skeletal muscle and connective tissue, in ‟Archives of pathology", 1947, XLIV, pp. 1-12.
Cavelti, P. A., Cavelti, E. S., Studies on the pathogenesis of glomerulonephritis. I. Production of autoantibodies to kidney in experimental animals, in ‟Archives of pathology", 1945, XXXIX, pp. 148-152.
Cecil, R. L., Nicholls, E. E., Stainsby, W. J., Characteristics of streptococci isolated from patients with rheumatic fever and chronic infectious arthritis, in ‟American journal of pathology", 1930, VI, pp. 619-621.
Christian, C. L., Rheumatoid arthritis, in Immunological diseases (a cura di M. Samter), vol. II, Boston 1971, pp. 1014-1028.
Cohen, A. S., Calkins, E., Electron microscopic observations on a fibrous component in amyloid of diverse origin, in ‟Nature", 1959, CLXXXIII, pp. 1202-1203.
Collins, R. C., Experimental studies on sympathetic ophthalmia, in ‟American journal of ophthalmology", 1949, XXXII, pp. 1687-1699.
Condie, R. M., Good, R. A., Experimental allergic encephalomyelitis. Its production, prevention, and pathology as studied by light and electron microscopy, in The biology of myelin (a cura di S. R. Korey), New York 1959, pp. 321-392.
Dacie, J. V., The haemolytic anemias, congenital and acquired, parte II, The auto-immune haemolytic anemias, New York 1962, pp. 341-718.
Dausset, J., Nenna, A., Présence d'une leucoagglutinine dans le sérum d'un cas d'agranulocytose chronique, in ‟Sang", 1953, XXIV, pp. 410-417.
Dawkins, R. L., Experimental myositis associated with hypersensitivity to muscle, in ‟Journal of pathology and bacteriology", 1965, XC, pp. 619-625.
Dixon, F. J., The immunopathology of glomerulonephritis, in Immunological diseases (a cura di M. Samter), vol. II, Boston 1971, pp. 1125-1133.
Dixon, F. J., Pathogenesis of immunologic disease, in ‟Journal of immunology", 1972, CIX, pp. 187-192.
Doniach, D., Roitt, I. M., An evaluation of gastric and thyroid autoimmunity in relation to haematologic disorders, in ‟Seminars in hematology", 1964, I, pp. 313-343.
Doniach, D., Roitt, I. M., Auto-immune thyroid disease, in Autoimmunity (a cura di R. W. Baldwin e J. H. Humphrey), Oxford 1965, pp. 42-51.
Doniach, D., Roitt, I. M., Taylor, K. B., Autoimmune phenomena in pernicious anemia. Serological overlap with thyroiditis, thyrotoxicosis and systemic lupus erythematosus, in ‟British medical journal", 1963, I, pp. 134-139.
Doniach, D., Roitt, I. M., Walker, J. G., Sherlock, S., Tissue antibodies in primary biliary cirrhosis, active chronic (lupoid) hepatits, cryptogenic cirrhosis and other liver diseases and their clinical implications, in ‟Clinical and experimental immunology", 1966, I, pp. 237-262.
Ehrlich, P., Morgenroth, J., Über Hämolysine. Dritte Mitteilung, in ‟Berliner klinische Wochenschrift", 1900, XXXVII, pp. 453-458.
Elliot, R. B., O'Brien, D., Roy, C. C., An abnormal insulin juvenile diabetes mellitus, in ‟Diabetes", 1965, XIV, pp. 780-787.
Feldman, J. D., Morphology of lymphocytes, in Hematology (a cura di W. J. Williams, E. Beutler, A. J. Erslev e R. W. Rundles), New York 1972, pp. 752-771.
Fink, S., Donnelly, W. J., Jablokow, V. R., Rectal reaction to injected ulcerative colitis leukocytes and plasma, in ‟Gut", 1967, VIII, pp. 20-23.
Franklin, R. R., Dukes, D. C., Further studies on spermagglutinating antibody and unexplained infertility, in ‟Journal of the American Medical Association", 1964, CXC, pp. 682-683.
Freund, J., Lipton, M. M., Thompson, G. E., Aspermatogenesis in guinea pig induced by testicular tissue and adjuvant, in ‟Journal of experimental medicine", 1953, XCVII, pp. 711-726.
Freund, J., McDermott, K., Sensitization to horse serum by means of adiuvants, in ‟Proceedings of the Society of Experimental Biology and Medicine", 1942, IL, pp. 548-553.
Freund, J., Stern, E. R., Pisani, T. M., Isoallergic encephalomyelitis and radiculitis in guinea pigs after one injection of brain and mycobacteria in water-in-oil emulsion, in ‟Journal of immunology", 1947, LVII, pp. 179-194.
Galbraith, R. F., Summerskill, M. A., Murray, J., Systemic lupus erythematosus, cirrhosis and ulcerative colitis after thymectomy for myasthenia gravis, in ‟New England journal of medicine", 1964, CCLXX, pp. 229-231.
Gennser, G., Spermagglutinins and contraceptives, in ‟Lancet", 1965, II, p. 491.
Goldstein, D. J., Theoretical mechanisms of immunological tolerance, in ‟Annals of allergy", 1960, XVIII, pp. 1081-1106.
Gottlieb, A. J., Douglas, S. D., Strauss, A. J. L., Spicer, S. S., Ultrastructural localization of gammaglobulin binding to skeletal muscle, in ‟Annals of the New York Academy of Sciences", 1966, CXXXV, pp. 638-643.
Grob, O., Namba, T., Solomon, N. A., Feldman, D. S., Isolation of d-tubocurarine-binding protein from skeletal muscle, in ‟Journal of clinical investigation", 1962, XLI, p. 1363.
Grodsky, G. M., Feldman, R., Toreson, W. E., Lee, J. C., Diabetes mellitus in rabbits immunized with insulin, in ‟Dibetes", 1966, XV, pp. 579-585.
Hackett, E., Thompson, A., Anti-lens antibody in human sera, in ‟Lancet", 1964, II, pp. 633-666.
Hammarström, S., Lagercrantz, R., Perlmann, P., Gustafsson, B. E., Immunological studies in ulcerative colitis. II. ‛Colon' antigen and human blood group A- and H- like antigens in germfree rats, in ‟Journal of experimental medicine", 1965, CXXII, pp. 1075-1085.
Hashimoto, K., Lever, W. F., An electron microscopic study of pemphigus vulgaris of the mouth and the skin with special reference to the intercellular cement, in ‟Journal of investigative dermatology", 1967, XLVIII, pp. 540-552.
Heremans, J. F., Crabbé, P. A., IgA deficiency. General consideration and relation to human diseases, in Immunological deficiency diseases in man (a cura di R. A. Good, P. Miescher e R. T. Smith), New York 1968, pp. 298-307.
Hollander, J. L., McCarty, D. J., Astorga, G., Castro-Murillo, E., Studies on the pathogenesis of rheumatoid joint inflammation. I. The ‛R.A. cell' and a working hypothesis, in ‟Annals of internal medicine", 1965, LXII, pp. 271-280.
Howell, D. S., Malcom, J. M., Pike, R., The F-II agglutinating factor in serum of patients, in ‟American journal of medicine", 1960, XXIX, pp. 662-671.
Hyman, I., Arbesman, C. E., Terplan, K. L., Dermatomyositis following penicillin injections, in ‟Neurology", 1956, VI, pp. 63-67.
Irvine, W. J., Adrenalitis, hypoparathyroidism and associated diseases, in Immunological diseases (a cura di M. Samter), vol. II, Boston 1971, pp. 1214-1227.
Irvine, W. J., Davies, S. H., Delamore, I. W., Williams, A. W., Immunological relationship between pernicious anemia and thyroid disease, in ‟British medical journal", 1962, II, pp. 454-456.
Isojima, S., Ashitaka, Y., Absorption of sperm antigen from the vagina in guinea pigs, in ‟American journal of obstetrics and gynecology", 1964, LXXXVIII, pp. 433-438.
Jeffries, G. H., Pernicious anemia and athropic gastritis, in Immunological diseases (a cura di M. Samter), vol. II, Boston 1971, pp. 1228-1239.
Jerne, N. K., The natural-selection theory of antibody formation, in ‟Proceedings of the National Academy of Sciences", 1955, XLI, pp. 849-857.
Jordon, R. E., Beutner, E. H., Witebsky, E., Blumental, G., Hale, W. L., Lever, W. F., Basement zone antibodies in bollous pemphigoid, in ‟Journal of the American Medical Association", 1967, CC, pp. 751-756.
Kaplan, M. H., Immunologic relation of streptococcal and tissue antigens. I. Properties of an antigen in certain strain of group streptococci exhibiting an immunologic cross-reaction with human tissue, in ‟Journal of immunology", 1963, XC, pp. 595-606.
Kaplan, M. H., Autoimmunity to heart, in Textbook of immunopathology (a cura di P. A. Miescher e H. J. Müller-Eberhard), vol. II, New York 1969, pp. 641-650.
Kaplan, M. H., Meyeserian, M., An immunological cross-reaction between group A streptococcal cells and human heart tissue, in ‟Lancet", 1962, I, pp. 706-710.
Kaplan, M. H., Meyeserian, M., Kushner, I., Immunologic studies of heart tissue. IV. Serologic reactions with human heart tissue as revealed by immunofluorescent methods: isoimmune, Wassermann, and autoimmune reactions, in ‟Journal of experimental medicine", 1961, CXIII, pp. 17-36.
Kaplan, M. H., Rakita, L., Myocardial disease, in Immunological diseases (a cura di M. Samter), vol. II, Boston 1971, pp. 1367-1384.
Kaplan, M. H., Vaughan, J. H., Reaction of rheumatoid sera with synovial tissue as revealed by fluorescent antibody studies. Abstract, in ‟Arthritis and rheumatism", 1959, II, pp. 356-358.
Karush, F., Specificity of antibodies, in ‟Transactions of the New York Academy of Sciences", 1958, XX, pp. 581-592.
Kivel, R. M., Kearns, D. H., Liebowitz, D., Significance of antibodies to dietary proteins in the serums of patients with nontropical sprue, in ‟New England journal of medicine", 1964, CCLXXI, pp. 769-772.
Krohn, K., Experimental gastritis in the dog. I. Production of atrophic gastritis and antibodies to parietal cells, in ‟Annales medicinae experimentalis et biologiae fennicae", 1968, XLVI, pp. 249-258.
Kulka, J. P., The pathogenesis of rheumatoid arthritis, in ‟Journal of chronic diseases", 1959, X, pp. 388-402.
Kunkel, H. G., Holman, H. R., Deicher, H. R. G., Multiple ‛autoantibodies' to cell constituents in systemic lupus erythematosus, in Cellular aspects of immunity, Ciba Foundation Symposium, London 1960, pp. 429-449.
Lagercrantz, R., Hammarström, S., Perlmann, P., Gustafsson, B. E., Immunological studies in ulcerative colitis. III. Incidence of antibodies to colon antigen in ulcerative colitis and other gastrointestinal diseases, in ‟Clinical and experimental immunology", 1966, I, pp. 263-276.
Lagercrantz, R., Hammarström, S., Perlmann, P., Gustafsson, B. E., Immunological studies in ulcerative colitis. IV. Origin of autoantibodies, in ‟Journal of experimental medicine", 1968, CXXVIII, pp. 1339-1352.
Lambert, E. H., Eaton, L. M., Rooke, E. D., Defect of neuromuscular conduction associated with malignant neoplasm, in ‟American journal of physiology", 1956, CLXXXVII, pp. 612-613.
Landsteiner, K., Müller, R., Pötzl, O., Über Komplementbindungsreactionen mit dem Serum von Dourinetieren, in ‟Wiener klinische Wochenschrift", 1907, XX, pp. 1421-1424.
Le Compte, P. M., ‛Insulitis' in early juvenile diabetes, in ‟Archives of pathology", 1958, LXVI, pp. 450-457.
Leddy, J. P., Immunological aspects of red cell injury in man, in ‟Seminars in hematology", 1966, III, pp. 48-73.
Leddy, J. P., Hill, R. W., Swisher, S. N., Vaughan, J. H., Observation on the immunochemical nature of red cell autosensitization, in III international symposium of immunopathology (a cura di P. Grabar e P. A. Miescher), Basel 1963, pp. 318-331.
Leddy, J. P., Trabold, J. H., Vaughan, J. H., Swisher, S. N., The unitary nature of complete and incomplete pathologic cold hemoagglutinins, in ‟Blood", 1962, XIX, pp. 379-398.
Levine, P., Celano, B. S., Falkowski, F., The specificity of the antibody in paroxysmal cold hemoglobinuria (P.C.H), in ‟Transfusion", 1963, III, pp. 278-280.
Levine, S., Wenk, E. J., The production and passive transfer of allergic adrenalitis, in ‟American journal of pathology", 1968, LII, pp. 41-54.
Lightfoot, R. W., Christian, C. L., Rheumatoid arthritis, in Textbook of immunopathology (a cura di P. A. Miescher e H. J. Müller-Eberhard), vol. II, New York 1969, pp. 733-744.
Lumsden, C. E., Robertson, S. M., Blight, R., Chemical studies on experimental allergic encephalomyelitis. Peptide as the common denominator in encephalitogenic ‛antigens', in ‟Journal of neurochemistry", 1966, XIII, pp. 127-162.
Lupulescu, A., Pop, A., Merculiev, E., Neascu, C., Heitmane, K. C., Experimental isoimmune hypoparathyroidism in rats, in ‟Nature", 1965, CCVI, pp. 415-416.
Mackay, I. R., Primary biliary cirrhosis showing a high titer of autoantibodies, in ‟New England journal of medicine", 1958, CCLVIII, pp. 185-189.
Mackay, I. R., Weiden, S., Hasker, J., Autoimmune hepatitis, in ‟Annals of the New York Academy of Sciences", 1965, CXXIV, pp. 767-780.
McKenzie, J. M., Neonatal Graves' disease, in ‟Journal of clinical endocrinology and metabolism", 1964, XXIV, pp. 660-668.
McKenzie, J. M., Humoral factors in the pathogenesis of Graves' disease, in ‟Physiological reviews", 1968, XLVIII, pp. 252-310.
Mancini, R. E., Andrada, J. A., Immunological factors in human male and female infertility, in Immunological diseases (a cura di M. Samter), vol. II, Boston 1971, pp. 1240-1256.
Mansky, W., Halbert, S. P., Auerbach, T., Immunochemical analyses of lens protein separations, in ‟Archives of biochemistry and biophysics", 1961, XCII, pp. 512-524.
Markson, J. L., Moore, J. M., Autoimmunity in pernicious anemia and iron deficiency anemia. A complement fixation test using gastric mucosa, in ‟Lancet", 1962, II, pp. 1240-1243.
Meaker, S. R., Some aspects of the problem of sterility, in ‟Boston medical and surgical journal", 1922, CLXXXVII, pp. 535-539.
Mellors, R. C., Huang, C. Y., Immunopathology of NZB/BL mice. V. Virus-like (filtrable) agent separable from lymphoma cells and identificable by electron microscopy, in ‟Journal of experimental medicine", 1966, CXXIV, pp. 1031-1038.
Miescher, P. A., Leucopénie chronique par autoanticorps, in ‟Helvetica medica acta", 1953, XX, pp. 421-427.
Miescher, P. A., Autoimmune hemolytic anemias, in Textbook of immunopathology (a cura di P. A. Miescher e H. J. Müller-Eberhard), vol. II, New York 1969, pp. 458-468.
Miescher, P. A., Autoantibodies against thrombocytes and leukocytes, in Textbook of immunopathology (a cura di P. A. Miescher e H. J. Müller-Eberhard), vol. II, New York 1969, pp. 500-506.
Miescher, P. A., Barker, L., Gervirtz, N. R., Enkins, D., Meltzer, M., Koeppen, M., Étude du mécanisme de l'érythroclasie dans un cas d'anémie hémolitique provoquée par des autoanticorps froids, in ‟Comptes rendus de la Société de Biologie", 1962, CLVI, pp. 1017-1021.
Miescher, P. A., Paronetto, F., Systemic lupus erythematosus, in Textbook of immunopathology (a cura di P. A. Miescher e H. J. Müller-Eberhard), vol. II, New York 1969, pp. 675-712.
Mollison, P. L., Crome, P., Hughes Jones, N. C., Rochna, E., Rate of removal from the circulation of red cells sensitized with different amounts of antibody, in ‟British journal of haematology", 1965, XI, pp. 461-470.
Muller, H., Tier experimentelle Untersuchungen zur Ophthalmia phakogenetica, in ‟Graefes Archiv für klinische und experimentelle Ophthalmologie", 1952, CLIII, pp. 1-35.
Nakabayashi, N. T., Tyler, E. T., Tyler, A., Immunological aspect of human infertility, in ‟Fertility and sterility", 1961, XII, pp. 544-550.
Nakamura, R. M., Weigle, W. O., Transfer of experimental thyroiditis by serum from thyroidectomized donors, in ‟Journal of experimental medicine", 1969, CXXX, pp. 263-285.
Nastuk, W. L., Strauss, A. J. L., Osserman, K. E., Search for a neuromuscular blocking agent in the blood of patients with myasthenia gravis, in ‟American journal of medicine", 1959, XXVI, pp. 394-409.
Oakley, W. G., Jones, V. E., Cunliffe, A. C., Insulin resistance, in ‟British medical journal", 1967, II, pp. 134-138.
Oriol-Palou, R., Halpern, B., Zweibaum, A., Morard, J. C., Veyre, C., Abadie, A., Production expérimentale d'une colite ulcéro-hémorragique avec autoanticorps, in ‟Comptes rendus hebdomadaires des séances de l'Académie des Sciences", 1966, CCLXIII, pp. 1184-1188.
Osserman, K. E., Myasthenia gravis, New York 1958.
Osserman, K. E., Thymectomy for myasthenia gravis, in ‟Annals of internal medicine", 1968, LXIX, pp. 398-399.
Paronetto, F., Systemic nonsuppurative necrotizing angiitis, in Textbook of immunopathology (a cura di P. A. Miescher e H. J. Müller-Eberhard), vol. II, New York 1969, pp. 722-732.
Paronetto, F., Koffler, D., Immunofluorescent localization of immunoglobulins, complement and fibrinogen in human diseases. I. Systemic lupus eryuthematosus, in ‟Journal of clinical investigation", 1965, XLIV, pp. 1657-1664.
Paterson, P. Y., Transfer of allergic encephalomyelitis in rats by means of lymph node cells, in ‟Journal of experimental medicine", 1960, CXI, pp. 119-136.
Paterson, P. Y., Experimental allergic encephalomyelitis and autoimmune disease, in ‟Advances in immunology", 1966, V, pp. 131-208.
Paterson, P. Y., Beisaw, N. E., Effect of whole body irradiation on induction of allergic encephalomyelitis in rats, in ‟Journal of immunology", 1963, XC, pp. 532-539.
Paterson, P. Y., Harwin, S. M., Suppression of allergic encephalomyelitis in rats by means of antibrain serum, in ‟Journal of experimental medicine", 1963, CXVII, pp. 755-774.
Pauling, L., A theory of the structure and process of formation of antibody, in ‟Journal of the American Chemical Society", 1940, LXII, pp. 2643-2657.
Perlmann, P., Broberger, O., Autoantibodies against antigen derived from colon in microsomes of regional colonic lymph glands in human ulcerative colitis, in ‟Nature", 1960, CLXXXVIII, pp. 749-751.
Rawson, A. J., Abelson, N. M., Hollander, J. L., Studies on the pathogenesis of rheumatoid joint inflammation. II. Intracytoplasmic particulate complexes in rheumatoid synovial fluids, in ‟Annals of internal medicine", 1965, LXII, pp. 281-284.
Renold, A. E., Gonet, A. E., Vecchio, D., Immunopathology of the endocrine pancreas, in Textbook of immunopathology (a cura di P. A. Miescher e H. J. Müller-Eberhard), vol. II, New York 1969, pp. 595-601.
Roitt, I. M., Doniach, D., Campbell, P. N., Hudson, R. V., Autoantibodies in Hashimoto's disease (lymphadenoide goitre), in ‟Lancet", 1956, II, pp. 820-821.
Roitt, I. M., Jones, H. E. H., Doniach, D., Mechanisms of tissue damage in human and experimental autoimmune thyroiditis, in Mechanisms of cell and tissue damage produced by immune reactions (a cura di P. Grabar e P.A. Miescher), Basel 1962, pp. 174-183.
Rose, N. R., Witebsky, E., Experimental thyroiditis, in Immunological diseases (a cura di M. Samter), vol. II, Boston 1971, pp. 1179-1197.
Rosenfield, R. E., Schmidt, P. J., Calvo, R. C., McGinnis, M. H., Anti-i, a frequent cold agglutinin in infectious mononucleosis, in ‟Vox sanguinis", 1965, X, pp. 631-634.
Rümke, P., Hellinga, G., Autoantibodies against spermatozoa in sterile men, in ‟American journal of clinical pathology", 1959, XXXII, pp. 357-363.
Schwartz, M., Intrinsic-factor-inhibiting substance in serum of orally treated patients with pernicious anemia, in ‟Lancet", 1958, II, pp. 61-62.
Schweet, R., Owen, R. D., Concepts of protein synthesis in relation to antibody formation, in ‟Journal of cellular and comparative physiology", 1957, L, suppl. 1, pp. 199-228.
Schwimmer, W. B., Ustay, K., Behrman, S. J., An evaluation of immunologic factors of infertility, in ‟Fertility and sterility", 1967, XVIII, pp. 167-180.
Schwimmer, W. B., Ustay, K. A., Behrman, S. J., Sperm agglutinating antibodies and decresed fertility in prostitutes, in ‟Obstetrics and gynecology", 1967, XXX, pp. 192-200.
Shapiro, S. S., The immunologic character of acquired inhibitors of antihemophilic globulin (factor VIII) and the kinetics of their interaction with factor VIII, in ‟Journal of clinical investigation", 1967, XLVI, pp. 147-156.
Sheard, C., Dermatomyositis, in ‟Archives of internal medicine", 1951, LXXXVIII, pp. 640-658.
Simpson, J. A., Myasthenia gravis. A new hypothesis, in ‟Scottish medical journal", 1960, V, pp. 419-436.
Smalley, M. J., Mackay, I. R., Whittingham, S., Antinuclear facors and human leukocytes. Reactions with granulocytes and lymphocytes, in ‟Australasian annals of medicine", 1968, XVII, pp. 28-32.
Sokoloff, L., McCluskey, R. T., Bunim, J. J., Vascularity of the early subcutaneous nodules of rheumatoid arthritis, in ‟American Medical Association archivse of pathology", 1953, LV, pp. 475-495.
Spiegelberg, H. L., Weigle, W. O., The immune response in guinea pigs injected with heterologous and altered homologous thyroglobulin, in ‟International archives of allergy and applied immunology", 1967, XXXI, pp. 559-567.
Sri Ram, J., Aging and immunological phenomena. A review, in ‟Journal of gerontology", 1966, XXII, pp. 92-107.
Strauss, A. J., Deitch, A., Hsu, K., Further observations on the localization of a muscle binding, complement-fixing serum globulin fraction in myasthenia gravis, in ‟Federation proceedings", 1961, XX, p. 30.
Strauss, A. J., Seegal, B. C., Hsu, K. C., Burkholder, P. M., Nastuk, W. L., Osserman, K. E., Immunofluorescence demonstration of a muscle-binding, complement-fixing serum globulin fraction in myasthenia gravis, in ‟Proceedings of the Society of Experimental Biology and Medicine", 1960, CV, pp. 184-191.
Talmage, D. W., Allergy and immunology, in ‟Annual review of medicine", 1957, VIII, pp. 239-256.
Taylor, K. B., Inhibition of intrinsic factor by pernicious anaemia sera, in ‟Lancet", 1959, II, pp. 106-108.
Vaughan, J. H., Bodman, S. F., Condemi, J. J., Drug-induced systemic lupus erythematosus, in Proceedings of the 4th Pan-American congress of rheumatology (a cura di G. Katona e J. Robles Gil), Amsterdam 1969, pp. 91-97.
Waksman, B. H., Further study of skin reactions in rabbits with experimental allergic encephalomyelitis, in ‟Journal of infectious diseases", 1956, IC, pp. 258-269.
Waldford, R. L., Autoimmunity and aging, in ‟Journal of gerontology", 1962, XVII, pp. 281-285.
Wegienka, L. C., Komarmy, L. E., Wuepper, K. D., Forsham, P. H., Cushing's syndrome with adrenal medullary insufficiency and adrenal autoantibodies, in ‟Lancet", 1966, I, pp. 741-743.
Weigle, W. O., Nakamura, R. M., Spiegelberg, H. L., Golub, E. S., High, G. J., Autoimmunity and termination of immunological unresponsiveness, in ‟Archives of pathology", 1967, LXXXIV, pp. 647-658.
Whittingham, S., Irwin, J., Mackay, I. R., Smalley, M., Smooth muscle autoantibodies (SMA) in ‛autoimmune' hepatitis, in ‟Gastroenterology", 1966, LI, pp. 499-505.
Wiener, A. S., Unger, L. J., Cohen, L., Feldman, J., Type-specific cold autoantibodies as a case of acquired hemolytic-anemia and hemolytic-transfusion reactions. Biologic test with bovine red cells, in ‟Annals of internal medicine", 1956, XLIV, pp. 221-240.
Wirostko, E., Halbert, S. P., Autoimmune phenomena in the eye, in Textbook of immunopathlogy (a cura di P.A. Miescher e H. J. Müller-Eberhard), vol. II, New York 1969, pp. 624-640.
Witesbky, E., Historical roots of present concepts of immunopathology, in Immunopathology (a cura di P. Grabar e P.A. Miescher), Basel 1959, pp. 1-13
Witebsky, E., Rose, N. R., Studies on organ specificity. IV. Production of rabbit thyroid antibodies in the rabbit, in ‟Journal of immunology", 1956, LXXVI, pp. 408-416.
Witmer, R., Phacogenic uveitis, in ‟Ophthalmologica", 1957, CXXXIII, pp. 326-329.
Worlledge, S. M., Castairs, K. C., Dacie, J. V., Autoimmune haemolytic anaemia associated with α-methyldopa therapy, in ‟Lancet", 1966, II, pp. 135-139.
Malattie immunoproliferative
di Jan G. Waldenström
sommario: 1. Introduzione. 2. Biochimica delle immunoglobuline. 3. Malattie immunoproliferative: a) mieloma; b) gammapatie benigne non progressive; c) macroglobulinemia; d) leucemia linfatica. 4. Problemi inerenti ai trapianti. 5. Terapia delle malattie immunoproliferative. 6. Principi di importanza biologica generale tratti dallo studio di queste malattie. □ Bibliografia.
1. Introduzione
Non è facile dare una definizione di condizione immunoproliferativa. Esistono particolari cellule che possono essere chiamate immunociti in quanto connesse con la produzione di immunoglobuline (anticorpi). È stato osservato già dall'inizio del 1940 che le plasmacellule sono attive nella sintesi delle immunoglobuline, le quali, essendo proteine, sono costituite da amminoacidi uniti tra di loro in catene polipeptidiche. All'incirca nello stesso periodo si è potuto anche mettere in evidenza che le immunoglobuline sono elettroforeticamente situate nel gruppo delle globuline seriche, caratterizzate dalla più bassa mobilità: ciò significa che esse, elettroforeticamente, sono gammaglobuline.
A Uppsala, A. Tiselius ha elaborato un metodo per la separazione delle proteine del plasma sanguigno, basato sulla loro capacità di migrare se sono esposte a un campo elettrico. Questo metodo, chiamato elettroforesi, è risultato della massima importanza nello studio dei complessi proteici. La separazione elettroforetica mostra la presenza, nel siero, di albumina e di tre frazioni giobuliniche (α, β, γ). In seguito useremo come sinonimi i termini immunoglobuline (Ig) e gammaglobuline (γ), pur non essendo del tutto certi che queste due frazioni coincidano completamente. Recentemente è stato possibile giungere a un buon livello di chiarificazione della struttura della molecola delle immunoglobuline e ora sappiamo che esse sono strutturalmente differenti dalle altre proteine.
La definizione secondo cui un immunocita è una cellula che produce immunoglobuline appare logica. È stato chiarito che non soltanto le plasmacellule ma anche i linfociti producono queste globuline. Molte osservazioni cliniche sembrano indicare che anche un terzo tipo di cellule, cioè le cellule reticolari, possono, almeno in particolari condizioni, partecipare alla sintesi delle immunoglobuline.
I processi morbosi caratterizzati dalla proliferazione, cioè da un abnorme aumento, di plasmacellule, di linfociti e forse anche di cellule reticolari dovrebbero quindi essere considerati malattie immunoproliferative. Per quanto riguarda le plasmacellule, vi sono due tipi di proliferazione: a) un tipo maligno, illimitato, che chiamiamo plasmocitoma o, più comunemente, mieloma; b) un tipo più statico, benigno, non progressivo, che deve essere distinto dal mieloma in quanto non necessita di alcun trattamento (v. sotto, cap. 3,§ b). Le malattie immunoproliferative sono di molti tipi e una denominazione che le comprende tutte è quella di linfoma. Alcune di queste proliferazioni linfocitarie producono un gran numero di linfociti, che si riversano nel torrente circolatorio: poiché quando i globuli bianchi sono fortemente aumentati di numero si parla di leucemia questo tipo di linfoma è chiamato leucemia linfatica. Vi sono poi dei linfomi che non determinano un aumento dei globuli bianchi, ma per il resto presentano un quadro che somiglia moltissimo a quello della leucemia linfatica. Queste proliferazioni linfocitarie possono avere aspetti clinici e andamenti differenti: una è chiamata linfoadenosi aleucemica; un altro tipo è il linfosarcoma, nel quale i linfociti si ammassano in determinate localizzazioni e formano tumori discreti; gli altri linfomi mostrano proliferazioni di elementi linfatici secondo altri aspetti e talvolta con partecipazione di altre cellule come cellule reticolari e cellule giganti. Queste condizioni per solito assolutamente maligne sono variamente designate: morbo di Hodgkin, iperplasia giganto-follicolare, reticolosarcoma, ecc. In quest'ultimo gruppo ritroviamo proliferazioni di cellule che possono o meno produrre immunoglobuline; è raro osservare modificazioni specifiche del quadro immunoglobulinico del siero, ma in alcuni casi si osservano modificazioni che possono essere connesse con la proliferazione di queste cellule.
2. Biochimica delle immunoglobuline
Durante gli ultimi anni, le nostre conoscenze sulla chimica delle immunoglobuline sono aumentate in modo veramente sorprendente; possiamo ora affermare che soltanto la molecola dell'emoglobina è stata disegnata più dettagliatamente, fino alla composizione in amminoacidi e alla loro sequenza costitutiva. La determinazione conclusiva della sequenza di amminoacidi di un'intera molecola immunoglobulinica è stata compiuta da Edelmann nel 1969. È necessario ora illustrare la struttura chimica di tali molecole, la quale è intimamente connessa con molti aspetti delle malattie immunoproliferative. Dal lavoro di Porter è risultato chiaramente che ciascuna molecola immunoglobulinica è costituita da due metà simmetriche, ciascuna formata da una catena lunga, pesante (H), e da una catena più breve, leggera (L). Per ragioni che più avanti spiegheremo, è stato agevole isolare catene L omogenee in grande quantità, e ora conosciamo esattamente la sequenza di amminoacidi in un gran numero di differenti catene L. Ciò ha reso possibile chiarire che una parte della catena L ha una composizione pressoché costante, mentre l'altra metà è altamente variabile. Un amminoacido in una determinata posizione nella parte costante può essere scambiato con un altro, certamente come risultato di una primitiva mutazione, e questo fenomeno è alla base di un metodo di raggruppamento immunologico delle catene L. Un'altra differenza nella composizione consente ancora di distinguere i tipi κ e λ. La catena pesante pesa circa il doppio della catena leggera. Vi è una parte costante relativamente breve e una parte variabile apparentemente molto simile alla stessa parte della catena L. Recenti lavori dimostrano che le due parti variabili sono responsabili dell'estrema specificità della molecola anticorpale nei confronti degli antigeni.
A seconda della struttura della catena H, una molecola immunoglobulinica può appartenere a una delle varie classi distinte dal punto di vista immunologico. La più comune è denominata γG o IgG: questa, all'ultracentrifugazione, costituisce la maggior parte del componente 7S e ha un peso molecolare di 160.000. Vi sono anche altre classi chiamate IgA, IgD e IgE. La globulina prodotta dalle cellule mielomatose in un determinato paziente è monotipica e omogenea. La maggior parte delle nostre cognizioni in questo campo ci viene dagli studi sulla malattia mielomatosa (v. sotto, cap. 3, È a). È probabile che tutte queste molecole con differenti pesi molecolari siano attive come anticorpi.
Per mezzo dell'ultracentrifuga fu per prima individuata una globulina di elevato peso molecolare, di circa 1.000.000, appartenente alla frazione 19-20 S, che fu chiamata macroglobulina o, con termine immunologico, IgM (v. sotto). La più recente acquisizione nella famiglia delle Ig è la IgE, che è stata scoperta alcuni anni fa in un paziente mielomatoso di Uppsala, in Svezia. Successivamente è stato possibile stabilire che questa classe di immunoglobuline deve essere identica a quella delle cosiddette reagine allergiche, che sono responsabili delle manifestazioni allergiche. Gli studi sulla biochimica di questa globulina mielomatosa aprirono perciò nuovi orizzonti alle ricerche sull'allergia (v. sotto, cap. 6).
Vi sono molti modi di esaminare le proteine seriche. Si sa da lungo tempo che ve ne sono due gruppi, albumine e globuline: queste possono essere separate mediante precipitazione con elettroliti. Recentemente è stato dimostrato che nel siero le albumine sono relativamente omogenee, mentre le globuline sono composte almeno da sessanta differenti proteine. Un certo numero di queste sono gammaglobuline, ma molte hanno una struttura completamente differente e la loro funzione non ha nulla a che vedere con l'immunità. L'elettroforesi in fase libera secondo Tiselius mostra che le gammaglobuline sono le frazioni globuliniche maggiori. Il successivo metodo di separare le proteine seriche in campo elettrico su alcuni materiali solidi, come la carta da filtro, il gel di agar o l'acetato di cellulosa, costituisce tuttora la base per l'esame del quadro immunoglobulinico del sangue. Molti altri progressi sono derivati dalla preparazione di antisieri specifici contro determinate classi di globuline seriche, che si ottengono iniettando in un animale una determinata immunoglobulina purificata, per esempio una proteina isolata da un siero mielomatoso. In tal modo sono stati preparati antisieri specifici reagenti con molti altri componenti proteici del sangue. Con l'aiuto di questi antisieri, è stato osservato che le immunoglobuline contengono molte sottoclassi con differenti proprietà antigeniche: è stato così possibile dividere le gammaglobuline in molti gruppi e sottogruppi, alcuni dei quali con speciali funzioni, ma tutti con la struttura a quattro catene di una immunoglobulina.
Il metodo della immunoelettroforesi ci ha dato la maggior parte di queste nuove informazioni sulle differenti molecole delle proteine seriche. Esso è stato elaborato da Grabar nell'istituto Pasteur di Parigi ed è stato poi modificato e usato estensivamente da molti gruppi di ricercatori. Anche il metodo di precipitazione specifica in agar per diffusione doppia in piastra, introdotto per la prima volta da Ouchterlony in Svezia, ha rappresentato un importante strumento in questo lavoro.
Già prima che l'elettroforesi e la ricerca con gli antisieri fossero sviluppati, era stato messo a punto un altro importante metodo per lo studio delle immunoglobuline. Th. Svedberg di Uppsala costruì l'ultracentrifuga per determinare la grandezza molecolare delle proteine. Noi ci dedicammo allo studio di queste caratteristiche delle gammaglobuline nel mieloma e trovammo - insieme con K. O. Pedersen - che determinati pazienti con un particolare quadro clinico presentavano un massiccio aumento di una gammaglobulina a elevato peso molecolare, di circa 1.000.000, mentre per solito il peso molecolare della gammaglobulina è 160.000. Ulteriori ricerche hanno mostrato che il peso molecolare è più vicino a 900.000 e che questa molecola macroglobulinica contiene cinque unità simili. Noi indicammo la malattia nella quale si formano queste grosse globuline con il nome di macroglobulinemia, e mettemmo in evidenza che essa deve essere interpretata come una malattia linfatica in relazione con la leucemia linfatica, ma differente dal mieloma (v. sotto, cap. 3, È c). Illustreremo più avanti alcuni punti di grande rilievo riguardanti la connessione fra certe classi di gammaglobuline e la loro funzione.
3. Malattie immunoproliferative
Tratterò prima dei tre classici tipi maligni di immunoproliferazione, cioè il mieloma (plasmocitoma), la macroglobulinemia e la leucemia linfatica: in queste condizioni un particolare tipo di cellula prolifera più o meno rapidamente e forma quella che i medici definiscono una neoplasia, cioè si sviluppa come un tumore. Le plasmacellule sono normalmente presenti soprattutto nel midollo rosso delle ossa, dove si formano anche le altre cellule del sangue; i linfociti sono presenti nei linfonodi e sino a un certo grado anche nella milza.
a) Mieloma
Quadro clinico. - Il mieloma è una proliferazione maligna del principale immunocita, cioè la plasmacellula, che è normalmente presente nel midollo osseo in una quota, calcolata rispetto a tutte le cellule nucleate, non superiore al 3%. Nel mieloma vi può essere sia una proliferazione localizzata di queste cellule, simile a un tumore, sia una più diffusa plasmocitosi. Quando si sviluppano tumori localizzati il quadro radiologico è spesso caratterizzato da tipiche lesioni osteolitiche: questi focolai sono pieni di plasmacellule, ed è chiaro che la distruzione dell'osso è conseguente all'accrescimento del tumore. In alcuni pazienti, quando le cellule neoplastiche proliferano più diffusamente, l'unico reperto osseo può essere rappresentato da una diminuzione di densità, da quella condizione cioè che noi chiamiamo osteoporosi. Questi quadri sono comunemente osservati in molte malattie e non consentono quindi la diagnosi. In tutte queste situazioni, la diminuita resistenza delle ossa determina lo sviluppo di fratture. Questa è una malattia osteo-distruttiva: le vertebre e tutto lo scheletro assile dal cranio al bacino sono le sedi comuni del tumore. Il dolore alla schiena, un sintomo molto comune, è spesso causato da fratture vertebrali; il dolore osseo è anche in relazione all'accrescimento del tumore. Per mezzo della puntura sternale, cioè con l'aspirazione del midollo dallo sterno, è possibile mettere in evidenza l'aumento delle plasmacellule nel midollo osseo: questo metodo, oltre a rappresentare un ulteriore sussidio diagnostico, è di notevole importanza per seguire i progressi degli effetti terapeutici (v. sangue: Organi emopoietici).
I pazienti con distruzione ossea determinata da differenti tumori vanno spesso incontro a ipercalcemia, cioè a una condizione caratterizzata da un contenuto ematico troppo elevato di ioni calcio, oltremodo importanti per i processi fisiologici e il cui livello è normalmente regolato con molta precisione. Anche altri tumori ossei, specialmente le metastasi da carcinomi, possono provocare ipercalcemia, e appare probabile che la demolizione ossea renda libere quantità progressivamente crescenti di calcio. La possibile partecipazione a questo processo di meccanismi ormonali, inoltre, potrebbe spiegare la comparsa di ipercalcemia in pazienti non affetti da tumori ossei: questo fenomeno, recentemente studiato a fondo, è designato come paraneoplasia, in quanto è una condizione che accompagna l'accrescimento di alcuni carcinomi che producono polipeptidi dotati di effetto ormonale. Infatti, tali prodotti si comportano, dal punto di vista dell'attività metabolica, come il paratormone, che ha la proprietà di mobilizzare il calcio. In tal modo, non tutti i pazienti con tumori ossei e ipercalcemia sono necessariamente mielomatosi. Discuteremo più avanti questo problema della paraneoplasia.
Gli effetti dell'ipercalcemia possono essere molto tossici, e quando vengono raggiunti alti livelli i pazienti entrano in coma. L'immobilità e la sete aumentano i livelli ematici del calcio e inizia così un circolo vizioso letale: individui immobilizzati a letto, ad esempio colpiti dalla poliomielite, possono andare incontro alla mobilizzazione del calcio dalle ossa, con ipercalcemia e formazione di calcoli renali.
Vi è un'altra complicazione del mieloma che può essere molto seria per il paziente, specialmente se l'ipercalcemia determina, mediante il vomito, la diminuzione dell'assunzione dei liquidi e/o la riduzione dell'attività cerebrale: questa complicazione è l'uremia, cioè la ritenzione nel sangue di sostanze tossiche, causata da un'alterata escrezione renale. Sono state proposte molte teorie per spiegare questo danno renale: attualmente la teoria dominante sostiene che il principale meccanismo è connesso con la comparsa nelle urine di catene leggere libere. In realtà, sono ben pochi i pazienti con mieloma che vanno incontro a uremia, senza mostrare la presenza nelle urine di catene leggere. Tali catene L, caratterizzate da un piccolo peso molecolare, possono attraversare il filtro renale, così che quando l'ultrafiltrato è concentrato vi può essere una precipitazione di questi polipeptidi, con conseguente ostruzione degli angusti tubuli renali. Questa teoria, detta del ‛condotto ostruito', sembra attualmente quella più accettata per spiegare l'uremia nel mieloma. Anche in questa situazione si può determinare un circolo vizioso, in quanto una diminuita produzione di urine determina un aumento della concentrazione urinaria e accresce quindi il rischio di precipitazione. Per fronteggiare questo pericolo occorre somministrare liquidi in larga quantità e questo è sicuramente il più efficace trattamento della uremia nel mieloma.
Se i pazienti non sono sottoposti a terapia, la malattia progredisce, inesorabilmente con aumento della distruzione ossea, esacerbazione del dolore e riduzione della statura corporea conseguente al collasso di numerose vertebre; nello stesso tempo i pazienti diminuiscono di peso, divengono progressivamente più anemici e, come tutti i portatori di tumori, vanno incontro a cachessia, cioè a una condizione caratterizzata da depressione globale della vitalità. Lo stadio finale della malattia è rappresentato appunto o dalla cachessia, o dall'uremia, o dall'ipercalcemia, o dalla combinazione di queste complicazioni. Prima dell'avvento degli antibiotici, molti di questi pazienti morivano per infezioni, principalmente per polmonite: questo problema dell'abbassamento paradosso della produzione di anticorpi in molte condizioni immunoproliferative è trattato più oltre.
Aspetti chimici. - Per mezzo dell'elettroforesi e dell'analisi con differenti tipi di antisieri, è stato possibile dimostrare che l'immunoglobulina formata in un determinato caso di mieloma è completamente omogenea, come era stato rivelato già dall'ordinaria elettroforesi libera in soluzione, nella quale il picco delle gammaglobubline appare molto stretto e denso. La successiva classificazione della molecola con gli antisieri mostra che non vi sono mai due differenti classi o sottotipi di catene L, ma che ne è presente soltanto una. Quando vi è aumento di una completa molecola gammaglobulinica nel siero ed escrezione, con le urine, di catene leggere, queste sono sempre dello stesso tipo. La condizione di biclonalità, cioè il fenomeno della proliferazione di due cloni, è raro ma non eccezionale. In conclusione, la proliferazione delle plasmacellule nel mieloma è usualmente monotipica e monoclonale: con tutta probabilità, una cellula inizia a proliferare e dà allora origine a tutte quelle cellule figlie - un clone - che formano la proliferazione maligna. Un aspetto molto caratteristico dei disordini immunoproliferativi consiste nel fatto che, insieme con l'aumento della massa delle cellule, aumenta la capacità di formare una maggiore quantità di immunoglobuline.
C'è ragione di ritenere che le cellule neoplastiche proliferanti derivino tutte da un solo clone, il che ha grande importanza dal punto di vista biologico. Quando un animale è sensibilizzato da un antigene, per esempio di origine batterica o virale, ha inizio la proliferazione di numerosi e differenti immunociti. La prima risposta abitualmente è di tipo macroglobulinico, e successivamente inizia la formazione delle immunoglobuline di più basso peso molecolare: ciò implica una prima reazione linfocitaria, seguita più tardi dalla proliferazione delle plasmacellule. Durante le prime settimane la quantità delle immunoglobuline aumenta costantemente, quindi raggiunge un plateau, e abitualmente diminuisce quando l'infezione è terminata. Tuttavia, in alcune infezioni croniche, il livello delle immunoglobuline si mantiene costantemente elevato e la frazione gamma è ampia: questo è caratteristico di molte malattie tropicali, come la lebbra e il kala-azar, ma anche di alcuni tipi di tubercolosi e di stati settici. Anche un esiguo numero di malattie virali mostra questo andamento che noi definiamo policlonale. Questa, in generale, viene considerata come la normale funzione degli immunociti e costituisce la risposta anticorpale a un'infezione, uno dei più importanti meccanismi di difesa in patologia umana. In questo caso, un gran numero di differenti molecole immunoglobuliniche è sintetizzato in quantità crescenti da numerosi cloni cellulari; quando viene raggiunto il livello massimo, vi è un continuo decremento e l'anticorpo può mantenersi a titoli cosi bassi da essere assolutamente indimostrabile per il resto della vita dell'individuo. Vi sono molte condizioni in patologia umana caratterizzate da un simile aumento policlonale di una grande quantità di molecole anticorpali, persistente per molti anni e senza causa apparente: è possibile che in alcuni di questi casi si tratti di infezioni virali.
La relazione fra fattori virali e proliferazione immunocitica è complicata e probabilmente di grande importanza. Negli animali è possibile provocare, mediante infezioni virali, condizioni simili alla leucemia linfatica; esistono altri agenti infettivi in grado di produrre ipergammaglobulinemia di tipo policlonale in certe specie animali, ma non in altre; infine è possibile riprodurre una condizione somigliante a una malattia immunoproliferativa con produzione monoclonale di immunoglobuline (si veda la letteratura sulla malattia del visone Aleutiano e sul topo NZB, che fornisce anche preziose informazioni riguardo alla ‛autoimmunita'). I fattori genetici (ceppi di animali) sono poco importanti.
Nella maggior parte delle malattie di questo tipo, i fattori causali sono completamente sconosciuti. Molte di queste condizioni sono state classificate come autoimmuni, perché comprendono malattie nelle quali si è riusciti a scoprire la presenza di anticorpi agenti contro i costituenti dell'organismo stesso del paziente, come gli anticorpi antitiroide, antimucosa gastrica o contro alcune strutture dei nuclei cellulari, ecc. (v. immunologia e immunopatologia: Malattie autoimmuni).
b) Gammapatie benigne non progressive
Molti ricercatori tendono a considerare le condizioni autoimmuni quali il lupus eritematoso sistemico o disseminato, con la sua quasi costante ipergammaglobulinemia policlonale, come un disordine immunoproliferativo. Ma questo uso della terminologia non è accettabile. Va sottolineato che la letteratura recente riporta osservazioni secondo le quali malattie autoimmuni possono trasformarsi in neoplasie immunoproliferative.
Dobbiamo ora discutere dell'importanza diagnostica di certe immunoglobuline quali componenti omogenee del siero. Un recente lavoro in questo settore ha dimostrato che aumenti globulinici monoclonali isolati simili al mieloma o alla macroglobulinemia sono molto comuni anche in una popolazione normale. Uno studio sistematico di 7.000 di tali sieri ha messo in evidenza che questo sintomo diviene progressivamente più comune in persone appartenenti a gruppi di età più avanzata, ed è quindi chiaro che il controllo della sintesi proteica diviene meno rigido con l'aumentare dell'età. Dapprima si è pensato che tutti questi soggetti dovessero essere considerati come mielomatosi in fase iniziale, ma questa ipotesi è stata dimostrata falsa quando si sono ottenute corrette curve di frequenza: in non meno del 3% di tutti gli individui al disopra dei 70 anni di età erano chiaramente visibili queste frazioni globuliniche, e possiamo ritenere che un simile aumento monoclonale sia presente in misura più piccola, e quindi non apprezzabile, in una percentuale più alta di soggetti. Il mieloma non è raro, ma su 100.000 individui si ha ogni anno la comparsa di solo 4 nuovi pazienti mielomatosi; inoltre, prima della scoperta di un trattamento efficace, il tempo medio di sopravvivenza di un mielomatoso era inferiore ai 2 anni, così che in una comunità vi erano annualmente meno di 8 mielomatosi viventi su 100.000 individui. È quindi chiaro che non era possibile che in tutte queste persone si sviluppasse un mieloma, in quanto la condizione benigna ha un'incidenza, in un largo strato di popolazione, di circa 700/100.000. Tale condizione è stata chiamata gammapatia monoclonale benigna, ed è caratteristico che il livello della componente globulinica persista costante per anni o decenni. Tuttavia, sono stati osservati dei casi nei quali, dopo un lungo periodo iniziale benigno, non progressivo, si è rapidamente sviluppato un vero mieloma progressivo. È quindi possibile che in alcuni di questi pazienti si sviluppi una condizione clinica quale il mieloma, ma non sappiamo se il mieloma inizi abitualmente in questo modo. Tali pazienti prima di questo stadio possono soltanto essere seguiti, ma non trattati.
Per quanto riguarda la condizione benigna, sembra probabile che essa si manifesti come sintomo dell'invecchiamento dal momento che la malattia diviene più frequente con l'aumentare dell'età. Molti dati parlano in favore del fatto che gli inattivi, ‛quiescenti' stampi (DNA, RNA) per la sintesi delle proteine possono essere risvegliati per esempio nell'accrescimento dei tumori, quando le cellule di un epatoma o quelle di un carcinoma del polmone iniziano a produrre un polipeptide che ha una certa attività e può quindi essere individuato: è questo il fenomeno che è stato chiamato produzione ormonale ectopica o paraneoplasia. In alcuni casi sembra quasi che un modello quiescente per la formazione di una α-fetoproteina, che normalmente è attivo soltanto nella vita fetale, sia riattivato nelle cellule neoplastiche. La presenza di questa α-fetoproteina nel sangue potrebbe quindi avere grande importanza per la diagnosi dei tumori del fegato. È possibile che il risveglio dei modelli a riposo negli immunociti, così come nelle altre cellule somatiche, sia un fenomeno generale dell'invecchiamento e che sia anche connesso con la condizione paraneoplastica nei tumori maligni.
c) Macroglobulinemia
Quadro clinico. - La macroglobulinemia è per molti versi analoga al mieloma: in quest'ultima malattia le plasmacellule proliferano e producono immunoglobuline di normale peso molecolare oppure soltanto catene leggere, nella macroglobulinemia proliferano nello stesso modo le cellule linfatiche capaci di produrre anticorpi ad alto peso molecolare. È possibile osservare la localizzazione di queste cellule linfocitoidi principalmente nei linfonodi, nella milza e diffusamente nel midollo osseo. Tali cellule sono prive della capacità posseduta dalle plasmacellule di distruggere le ossa, e i pazienti quindi non vanno soggetti a dolore osseo né a fratture: da questo punto di vista la macroglobulinemia è una condizione meno seria del mieloma, e nel lungo decorso della malattia il paziente che ne è affetto può aspettarsi una vita migliore di quello affetto da mieloma. Tutti i pazienti portatori di linfoma possono soffrire di anemia, mancanza di piastrine nel sangue e cachessia, e ciò si verifica anche nella macroglobulinemia. La puntura del midollo osseo con l'esame delle cellule è importante nella macroglobulinemia come nel mieloma: vi è un quadro di infiltrazione linfatica, talvolta con commistione di plasmacellule, e spesso si osservano numerose mastcellule. È necessario ricercare la presenza di linfonodi aumentati di volume e di splenomegalia.
In alcuni pazienti il sangue contiene una tale quantità di macromolecole che diviene molto denso (viscoso): si determina perciò una grande resistenza allo scorrimento del sangue nei piccoli vasi e questa sindrome di iperviscosità può avere conseguenze molto serie e anche costituire un pericolo per la vita. Il solo modo di curare questi pazienti consiste in una massiva sottrazione di sangue e nella reinfusione dei loro globuli rossi (plasmaferesi); per ottenere una normale viscosità è spesso necessario rimuovere 20.000 ml di plasma in 8-10 settimane. È sorprendente che gli altri costituenti proteici del sangue possano formarsi in quantità tali come quelle necessarie alla loro sostituzione. La sindrome di iperviscosità è un concetto relativamente nuovo. Questi pazienti hanno tutti una tendenza all'emorragia: ciò è particolarmente grave a livello degli occhi, e molti pazienti sono divenuti ciechi per disturbi circolatori della retina. Stranamente tuttavia anche altre emorragie, per esempio quella della mucosa del naso e della bocca, scompaiono dopo intensa plasmaferesi.
Un altro peculiare aspetto della macroglobulinemia è l'interessamento dei nervi periferici, un processo che causa gravi sintomi invalidanti in molti pazienti. In complesso, gli individui affetti da macroblogulinemia possono vivere molto a lungo anche senza trattamento; alla fine essi vanno incontro a grave anemia, perdita di peso e morte per cachessia.
La immunoglobulina che è presente nel sangue di questi pazienti ha un alto peso molecolare e mostra sovente la proprietà di rendere il plasma molto più viscoso quando il sangue è raffreddato. Questa sensibilità alla temperatura è talvolta, sebbene molto raramente, presente anche nelle globuline del mieloma. In alcuni casi le globuline sono estremamente sensibili al freddo, fino a precipitare quando la temperatura della soluzione è bassa: queste proteine sono state chiamate crioglobuline e possono causare una quantità di sintomi allarmanti, in quanto determinano un'ostruzione dei vasi periferici di piccolo calibro.
Un altro importante processo connesso con la presenza di macroglobuline sensibili al freddo è l'agglutinazione dei globuli rossi. I pazienti con questa sindrome da aggiutinazione da freddo sono anzitutto dei macroglobulinemici, nei quali un clone cellulare prolifera formando una macroglobulina monotipica che agisce come un'agglutinina da freddo. Questa ha differenti temperature critiche: alcune volte i globuli rossi si ammassano nei vasi già alla temperatura stessa dell'organismo. È chiaro che le dita, il naso e l'orecchio sono particolarmente soggetti a questo ammassarsi di globuli rossi. Si conoscono pazienti che hanno avuto una gran quantità di agglutinine da freddo. Queste agglutinine, causando una maggiore distruzione di globuli rossi, determinano in questi pazienti la comparsa di quella che noi chiamiamo anemia emolitica: in alcuni rari casi sono distrutti tanti globuli rossi, e conseguentemente tanto grande è la quantità di emoglobina escreta attraverso i reni, che le urine diventano rosse.
In conclusione, possiamo senz'altro affermare che la presenza di macroglobuline nel sangue può di per se stessa causare tre differenti sindromi: a) iperviscosità; b) precipitazione come crioglobuline nei vasi sanguigni; c) ammassamento dei globuli rossi nei vasi sanguigni da agglutinazione da freddo.
Biochimica. - La molecola macroglobulinica, la cui struttura biochimica è stata di difficile interpretazione, risulta chiaramente costituita da 5 unità uguali tenute insieme da un anello, come si è potuto dimostrare con la microscopia elettronica. Fanno parte della molecola catene leggere e si sa da tempo che moderate quantità di catene leggere possono apparire nelle urine come proteina di Bence Jones; d'altra parte, non si vede mai un danno renale provocato dalle catene leggere. Queste catene leggere appartengono agli stessi tipi immunologici cui appartengono quelle del mieloma. È interessante notare che anche chimicamente vi è una differenza tra la molecola macroglobulinica e gli altri anticorpi, in quanto la macroglobulina contiene molti più carboidrati. Nulla si sa circa il ruolo del carboidrato contenuto negli anticorpi, ma è stato supposto che esso sia aggiunto tardi nel corso della sintesi e che sia importante per il trasporto (‛secrezione') delle globuline attraverso il citoplasma degli immunociti.
Anche tra le malattie da cellule produttrici di macroglobuline è possibile individuare una forma simile alle gammapatie monoclonali benigne. Molte persone, seguite per lungo tempo, non hanno mostrato una progressione della loro malattia o un incremento delle macroglobuline. Alcuni di questi pazienti hanno immunoglobuline dotate di una certa attività, per esempio come agglutinine da freddo, e in tal caso essi possono andare incontro a un'anemia emolitica che può anche essere letale. Altre macroglobuline hanno la facoltà di precipitare a freddo le molecole γG come crioglobuline complesse, con possibili conseguenti disturbi della circolazione di notevole gravità. Molti ricercatori hanno osservato che le macroglobuline in queste condizioni sembrano prodotte da un clone di cellule. Abitualmente un aumento di macroglobuline di lieve entità non provoca segni di malattia.
d) Leucemia linfatica
La quarta malattia tra le proliferazioni immunocitiche è la leucemia linfatica. È noto che i linfociti proliferano in loco (linfonodi, milza), ma anche che abbandonano gli organi e migrano nella corrente sanguigna; vi sono, comunque, dei linfomi con proliferazione di linfociti soltanto in loco, che anatomicamente e clinicamente si comportano in modo assai simile alla leucemia linfatica ma senza ‛secrezione' di cellule nel sangue, i quali sono chiamati linfomi aleucemici o talvolta linfosarcomi. In tutti questi disturbi linfatici può talvolta formarsi una macroglobulina monoclonale: è difficile dire se in questi casi si deve parlare di macroglobulinemia con quadro ematico leucemico o di leucemia linfatica con macroblobulinemia. Abbiamo ragione di ritenere che questi processi siano connessi molto strettamente dal punto di vista anatomico, ma con molte forme di transizione.
Ancora più interessante e veramente sconcertante è il fatto che, per esempio, la leucemia linfatica sia spesso accompagnata da bassi livelli di immunoglobuline: in materiale non selezionato si è trovato che più della metà dei pazienti presentavano una diminuzione della frazione gamma. Se ciò fosse vero, si potrebbe sospettare un'aumentata tendenza allo sviluppo di infezioni: e questo costituisce in realtà uno dei grandi problemi clinici in molti pazienti affetti da linfoma.
4. Problemi inerenti ai trapianti
Sin dall'inizio degli anni cinquanta si è osservato che soggetti in giovanissima età possono soffrire di insufficiente sintesi di anticorpi: questa malattia, la agammaglobulinemia, è ereditata come un carattere legato al sesso, cioè soltanto nei maschi, e si manifesta all'inizio della vita. Vi sono altre condizioni ereditarie con grave ipogammaglobulinemia evidentemente causate da un'eredità autosomica recessiva: una forma, correlata con la completa mancanza del timo e dei linfociti, si manifesta già dalla prima infanzia e i bambini che ne sono affetti muoiono molto precocemente. Al di fuori di queste condizioni geneticamente determinate, molto rare, l'ipogammaglobulinemia si osserva principalmente nelle malattie linfatiche e nel mieloma, unitamente quindi allo stato immunoproliferativo: quest'ultima affermazione, apparentemente paradossale, è basata sul fatto che la maggior parte dei pazienti con mieloma e macroglobulinemia ha contemporaneamente un incremento di un tipo di immunoglobuline e un basso livello di gammaglobuline, così che essi sono nello stesso tempo iper- e ipogammaglobulinemici. I soggetti affetti da leucemia linfatica sono di regola soprattutto ipogammaglobulinemici. Ovviamente la proliferazione di un clone linfocitario o plasmacellulare può causare l'inibizione di altri cloni e quindi la diminuzione della produzione di anticorpi: questa relazione fra differenti cloni cellulari, proliferanti e a riposo, repressi, è certamente un importante problema della medicina di domani e costituisce inoltre un aspetto dei fondamentali problemi dei trapianti.
Gli anticorpi circolanti rivestono un ruolo di grande importanza in relazione al rigetto di un trapianto: è stata dimostrata la possibilità di attecchimento di frammenti di pelle di altre persone trapiantati nella pelle di un bambino agammaglobulinemico. Quindi non soltanto la formazione ma anche la repressione degli anticorpi può costituire un argomento importante nello studio delle malattie linfoproliferative.
Uno dei grandi capitoli della medicina degli ultimi anni riguarda il trapianto di organi da un individuo a un altro. Molti fattori decidono il successo o il fallimento di una simile impresa. Le forze immunologiche esercitano la massima influenza, ed è divenuto sempre più chiaro che i modelli genetici sono responsabili della presenza di antigeni tessutali la cui importanza per il trapianto di organi è probabilmente tanto grande quanto lo è quella dei gruppi sanguigni per la trasfusione. Un antigene estraneo presente nell'organo trapiantato dà inizio alla produzione di anticorpi e al rigetto: la soppressione della formazione di immunoglobuline è quindi uno dei compiti più importanti nella preparazione di un paziente per l'accettazione di un etero-trapianto. Lo studio delle risposte anticorpali dal punto di vista chimico e soprattutto da quello immunologico è necessario tanto quanto l'introduzione dei metodi che possono causare l'immunosoppressione. È quindi chiaro che la terapia delle malattie immunoproliferative ha assunto negli anni recenti un duplice valore: anzitutto ci ha insegnato in quale modo trattare queste malattie, secondariamente ha posto le basi per la immunosoppressione terapeutica nei trapianti.
5. Terapia delle malattie immunoproliferative
È noto ormai da tempo che l'irradiazione è un eccellente mezzo per curare molti linfomi: nel trattamento degli stadi iniziali della malattia di Hodgkin rappresenta il metodo di elezione, e può anche determinare la completa guarigione; è di grande valore nella leucemia linfatica, perché può agire direttamente su certe localizzazioni del processo linfomatoso; anche nel mieloma localizzato un'intensa irradiazione può dare risultati perfino curativi. È quindi chiaro che l'irradiazione può costituire uno dei principali metodi di trattamento di queste condizioni morbose, e tale tecnica è tuttora largamente impiegata con pazienti ben selezionati.
Noi ora sappiamo che queste malattie sono soltanto raramente localizzate e che debbono piuttosto essere interpretate come malattie di interi sistemi: plasmacellule, linfociti, cellule reticolari o loro precursori. Questa cognizione rende imperativa la necessità di colpire le cellule maligne ovunque si trovino: il modo migliore per ottenere tale risultato è iniziare precocemente una terapia basata sull'uso di medicamenti in grado di circolare liberamente nell'organismo.
Non appena è stato introdotto l'uso del cortisone come agente terapeutico, sono stati ottenuti buoni risultati nei riguardi di molti linfomi. Si è anche notato che tutti i pazienti trattati con alte dosi di cortisone tendono a sviluppare peculiari infezioni, per esempio da funghi, e che ovviamente presentano un basso livello di resistenza naturale contro alcuni dei comuni batteri, per esempio quelli della tubercolosi. Individui affetti dalla malattia di Cushing - una condizione causata da una naturale iperproduzione di cortisone - hanno bassi livelli di immunoglobuline. Da quando questi ormoni e i loro derivati sono stati introdotti nella terapia della immunoproliferazione, si sono affermati come una delle nostre armi più efficienti. Questo gruppo di ormoni steroidi è importante anche per la preparazione dei soggetti che dovranno ricevere un trapianto.
Durante il secondo conflitto mondiale sono stati condotti molti studi sui tossici usati in guerra. Le ricerche sulle mostarde azotate hanno dimostrato che questi terribili composti chimici, se somministrati agli animali per via orale o endovenosa, provocano grave danno al midollo osseo e rapidamente conducono a morte. Si pensò allora che questo potesse essere un modo di trattare la proliferazione neoplastica delle cellule ematiche, purché le dosi fossero tenute tanto basse da non causare seri danni: questi esperimenti costituiscono il fondamento dell'attuale terapia delle condizioni immunoproliferative e le mostarde azotate sono ancora, in differenti combinazioni, le nostre più potenti armi in questa battaglia. Non parlerò qui della biochimica di questi farmaci: è sufficiente far rilevare che lo stesso gruppo attivo è presente in un gran numero di differenti preparati, uno più attivo nel mieloma (Melphalan), un altro nella leucemia linfatica (Chlorambucil) e altri in altre condizioni neoplastiche, quali la malattia di Hodgkin, il reticolosarcoma, alcuni carcinomi (per es., la Ciclophosphammide).
Il recente grande interesse suscitato dal problema della divisione cellulare (mitosi) ha dato origine a un intenso studio sui cosiddetti veleni mitotici, sostanze che influenzano tale processo e, inibendolo, possono esercitare un' azione citostatica, cioè antiproliferativa: l'uretano, un potente farmaco per la cura della leucemia mieloide, ne è un esempio, come pure i derivati della colchicina. In altri casi i biochimici hanno sintetizzato sostanze dalle quali, per ragioni teoriche, è lecito aspettarsi che interferiscano nei normali processi della divisione cellulare. Noi sappiamo che la duplicazione del DNA nel nucleo è un presupposto indispensabile per la successiva divisione cellulare: i farmaci contenenti elementi costitutivi di base simili, anche se non identici, alle molecole che sono combinate a formare il DNA o l'RNA possono interferire con tale divisione e con la reduplicazione, in molti passaggi. Le cellule che si dividono più rapidamente, per esempio le cellule ematiche normali, sono più vulnerabili: quindi è necessario seguire con la massima attenzione gli effetti di questo trattamento proprio sulle cellule ematiche normali. Il farmaco immunosoppressivo probabilmente più potente - almeno quello di uso più comune - è stato ricavato da un composto antileucemico. La mercaptopurina ha una costituzione analoga alla purina, cioè è simile ma non identica alle molecole della purina che fanno parte dell'acido nucleico. Si ritiene generalmente che queste false purine entrino nella costituzione delle molecole dell'acido nucleico e in tal modo distruggano la vita della cellula. Molti pazienti affetti da leucemia acuta, specialmente di tipo linfatico, traggono giovamento da questo trattamento, anche se il risultato è soltanto temporaneo. Un'ulteriore evoluzione di questo medicamento porta alla sostanza chiamata Imuran, che attualmente è largamente usata a scopo immunosoppressivo sia nei trapianti, sia nelle cosiddette condizioni autoimmuni. Gli esempi dati ci dimostrano come la medicina sia strettamente legata alle discipline scientifiche basilari, chimica, botanica, zoologia, e anche che le varie scienze mediche sono indivisibili di fronte a molti problemi fondamentali. Malattie contrassegnate da sintomi caratteristici ben misurabili nel sangue, come il mieloma, la macroglobulinemia e le leucemie, costituiscono eccellenti campioni per sperimentare i farmaci antitumorali. I tumori solidi, consistenti in una ‛massa', possono rispondere bene alla terapia con una notevole riduzione di volume senza tuttavia che si sia in grado di rilevare l'esatto risultato terapeutico con i radiogrammi o con la palpazione. Per quanto riguarda molti dei farmaci impiegati contro il cancro, le nuove sostanze chimiche sono state dapprima saggiate in condizioni immunoproliferative e poi applicate anche ai carcinomi solidi. La terapia delle malattie immunoproliferative ci ha quindi aiutato a migliorare il trattamento dei tumori maligni in generale (v. chemioterapia antineoplastica).
Per quanto riguarda i risultati che si possono ottenere, bisogna premettere che tutte queste condizioni morbose sono più comuni nei gruppi di età più avanzata: sia per il mieloma, sia per le malattie del sistema linfatico, è infatti possibile dimostrare, con l'attenta analisi di campioni ben selezionati di popolazioni, che la loro incidenza aumenta con l'aumentare dell'età.
Il fatto che questi pazienti siano tutti in età avanzata implica la necessità di procedere ad analisi statistiche piuttosto complicate degli effetti terapeutici. Anche con queste limitazioni, e tenendo presente il fatto che soltanto negli ultimi dieci anni abbiamo acquisito un'efficace terapia del mieloma, è ora chiaro che il moderno trattamento di questa malattia consente di prolungare considerevolmente la vita dei pazienti: in realtà il mieloma è una delle poche malattie neoplastiche nelle quali è stato dimostrato che la chemioterapia determina un aumento della sopravvivenza. È anche chiaro, tuttavia, che è difficile salvare, anche con l'impiego della moderna terapia, quei pazienti che giungono in ospedale già in condizioni disperate, ed è quindi divenuto importante diagnosticare la malattia in uno stadio precoce. Anche se i risultati sembrano essere molto buoni in pazienti selezionati, per esempio quelli affetti da mieloma, i quali sono costretti a letto con grande sofferenza, dobbiamo ricordare che molto raramente si ottiene la guarigione definitiva.
Dobbiamo sperare che le esperienze in questo campo contribuiscano a migliorare i risultati nel trattamento delle altre condizioni maligne.
6. Principi di importanza biologica generale tratti dallo studio di queste malattie
Durante l'ultimo decennio abbiamo assistito a un rapido aumento dell'interesse per lo studio delle malattie immunoproliferative, quali il mieloma e la macroglobulinemia, determinato da molte ragioni. Se si isola la speciale proteina prodotta dalle cellule neoplastiche, essa risulta completamente omogenea: queste globuline costituiscono un impareggiabile materiale per lo studio della costituzione chimica delle singole molecole anticorpali e su di esse sono stati fatti quasi tutti i lavori riguardanti la biochimica degli anticorpi. Con le moderne tecniche è possibile isolare differenti parti della molecola anticorpale, sia le cosiddette catene pesanti, sia le leggere, e determinare la sequenza di amminoacidi nella catena. Le catene L libere che si rinvengono nell'urina come proteina di Bence Jones sono già ‛preparate' pure e possono essere studiate dopo l'isolamento: esse sono completamente omogenee, ma ancora non sono stati osservati due pazienti affetti da mieloma aventi nell'urina la stessa catena L. Possiamo paragonare questi amminoacidi alle perle di una collana, in cui vari amminoacidi possono occupare posizioni diverse; complessivamente, vi sono 214 perle nella catena leggera e 440 perle in quella pesante. Considerando tutte le catene leggere finora esaminate, noi ora sappiamo che una metà della molecola ha una struttura costante, in essa cioè le perle si alternano sempre nello stesso modo, mentre nella parte incostante le perle possono essere riunite in molti modi differenti; lo stesso vale per la catena pesante, la cui parte incostante è molto più lunga. Paragonando fra loro le sequenze delle catene leggere e pesanti, è possibile trarre conclusioni di larga portata circa lo sviluppo filogenetico delle catene stesse e dei modelli che regolano il programma della loro sintesi. Non occorreranno molti anni per arrivare a conoscere le differenze nella composizione chimica completa delle quattro o cinque principali classi di anticorpi (G, A, D, E, M).
Per lungo tempo si era supposto che le globuline del mieloma e le macroglobuline di pazienti affetti da malattie immunoproliferative fossero proteine patologiche, e furono denominate paraproteine. L'autore di questo articolo è sempre stato riluttante ad ammettere ciò. Sembrava molto più probabile che le cellule neoplastiche sintetizzassero una delle molecole anticorpali già da esse normalmente prodotta, il che vorrebbe dire che dovremmo reperire in grande quantità immunoglobuline isolate con funzioni di anticorpi. Una tale ipotesi rende necessario supporre che esista una produzione anticorpale al di fuori di una stimolazione antigenica; ciò tuttavia non sembra più strano del fatto che le cellule cancerose, derivanti per esempio dal polmone o dal rene, incomincino a sintetizzare polipeptidi con attività ormonale probabilmente attraverso la riattivazione di un modello quiesciente, represso, del loro genoma. Saggi sistematici con i sieri Ig monoclonali hanno dimostrato che i sieri mielomatosi possono dare titoli estremamente alti di una speciale reazione, per esempio antistreptolisinica o antistafilolisinica: tali attività sono connesse con la globulina mielomatosa.
Con lo studio dei prodotti di demolizione delle globuline formate dalle cellule mielomatose, dotate di attività anticorpale, è stato possibile dimostrare che ambedue le parti incostanti, sia quella della catena pesante sia quella della catena leggera, sono necessarie per l'attività specifica; da sole le catene pesanti e leggere non sono attive, e la ricombinazione di molecole complete da catene pesanti attive e da catene leggere inattive, o viceversa, non ripristina l'attività, come è stato dimostrato negli esperimenti con molte globuline mielomatose.
Se desideriamo considerare il problema in modo semplificato, possiamo dire che vi deve essere un ‛aggancio' con una certa configurazione in ambedue le catene, pesante e leggera, che consente di adattare la parte critica dell'antigene. Uno dei più importanti e inaspettati risultati che sono finora scaturiti dallo studio della funzione della globulina mielomatosa indirizza verso una direzione completamente nuova. Molte migliaia di globuline mielomatose sono state caratterizzate e tutte classificate nei tre tipi già descritti, G, A e D. Nel 1965 è stato osservato a Uppsala un paziente con una globulina mielomatosa non classificabile: questa gammaglobulina era, ovviamente, di un nuovo tipo, non ancora scoperto, e certi fatti indicavano la possibilità che questa classe di proteine potesse comprendere le cosiddette reagine allergiche. In precedenza altri autori, soprattutto Ishisaka, avevano dimostrato la presenza nel siero di molti individui allergici di una maggiore quantità di una speciale globulina; si trattava, comunque, di quantità estremamente piccole, così che la preparazione di questa frazione risultava molto laboriosa. D'altra parte il nuovo paziente mielomatoso produceva in breve tempo molti grammi di questo prezioso materiale, che poté quindi essere preparato dal suo siero quasi allo stato puro: ciò fu di grande importanza, perché da allora fu possibile produrre un anticorpo contro questa molecola anticorpale, e con l'aiuto di questo antisiero e grazie all'adozione di metodi immunologici del tutto particolari è stato possibile effettuare specifiche determinazioni quantitative di questa nuova molecola immunoglobulinica.
È così stato possibile determinare il titolo di questa Ig nel sangue normale e in quello di pazienti sofferenti di diversi tipi di allergia, e inoltre fondamentali fenomeni allergici sono stati spiegati in modo semplice dopo che questa nuova globulina mielomatosa è stata ottenuta in quantità sufficiente allo stato puro.
Qualcuno ha detto che gli ‛esperimenti della natura' sono importanti se sono osservati da una persona che ne riconosca il significato e ne segua la guida, cioè un uomo con una mente preparata. La sintesi proteica in queste malattie rappresenta un esperimento della natura che ci ha impartito lezioni oltremodo importanti su differenti, fondamentali problemi. È anche interessante rendersi conto che lo studio delle proteine mielomatose può risolvere molti problemi connessi con campi completamente differenti della medicina, quali l'allergia o gli effetti del freddo. È stato anche studiato l'effetto di questa globulina su certi sintomi connessi con l'allergia, e molti ricercatori sperano che la delucidazione definitiva della struttura molecolare ci darà informazioni che potranno essere importanti per la comprensione dei meccanismi dei processi allergici: questa è la valida base per un effettivo trattamento causale.
Il problema del cancro è intimamente connesso con il quesito se una sola cellula inizi a comportarsi malignamente e tutte le sue discendenti formino poi il tumore. Per quanto riguarda le malattie immunoproliferative, lo studio delle molecole immunoglobuliniche marcate sembra aver dimostrato l'esattezza dell'ipotesi monoclonale. Nel cancro, esperimenti molto ingegnosi basati sull'impiego di marcatori genetici a livello cellulare hanno messo in evidenza la possibilità che siano in gioco differenti meccanismi. Tutto ciò può sembrare di scarsa importanza, ma probabilmente è vero il contrario. Se la malattia neoplastica (tumore) è causata da una infezione virale, è probabile che molte cellule debbano esserne affette; se d'altra parte soltanto una cellula è la madre di tutte le successive cellule cancerose, ciò può significare che un qualunque evento metabolico in quella cellula ne abbia determinato una modificazione dell'accrescimento e dei meccanismi di sintesi proteica. La teoria che il cancro possa essere causato da un'infezione virale è attualmente largamente accettata, ma dovrà essere oggetto di indagini anche la possibilità che una modificazione endogena cellulare (derepressione) determini una speciale capacità di accrescimento. Il problema dell'accrescimento maligno rappresenta la più grande sfida alla ricerca medica moderna.
Bibliografia
Burnet, M., The clonal selection theory of acquired immunity, Cambridge 1959.
Park, B. H., Good, R. A., Principles of modern immunobiology: basic and clinical, Philadelphia 1974.
Samter, M., Alexander, H. L., Immunological diseases, London 1965.
Waldenström, J. G., Monoclonal and polyclonal hypergammaglobulinemia, Cambridge 1968 (tr. it.: Ipergammaglobulinemia monoclonale e policlonale, Padova 1972).
Waldenström, J. G., Diagnosis and treatment of multiple myeloma, New York 1970.