Genetica. Diagnosi genetiche
Genetica. Diagnosi genetiche
L'identificazione e la diagnosi di malattia ereditaria sono la prerogativa essenziale per il controllo di quella patologia, per il suo trattamento e la sua prevenzione. I progressi sulle conoscenze delle malattie ereditarie e l'accresciuta disponibilità di tecnologie avanzate rendono possibile l'analisi di numerosi geni-malattia. L'elevato numero delle patologie diagnosticabili, l'eterogeneità molecolare delle malattie stesse e la diversità tecnologica necessaria per il loro studio rendono tuttavia difficile la diagnosi genetica secondo le tradizionali tecnologie di laboratorio.
La ricerca e lo screening di mutazioni vengono oggi effettuati nel nostro Paese da centri che effettuano diagnosi per patologie comuni, fornendo interventi diagnostici solo per geni di piccole dimensioni, o soltanto per alcune mutazioni, soprattutto quelle facilmente identificabili o già caratterizzate in una determinata famiglia. È infatti ormai chiaro che la prevenzione delle malattie genetiche è la prerogativa necessaria per avviare tempestivamente trattamenti terapeutici finalizzati a prevenire complicanze spesso irreversibili.
La possibilità di individuare, diagnosticare e caratterizzare una malattia a livello molecolare permette anche di trarre informazioni di valore biologico sul genotipo delle persone. La maggiore conoscenza del genoma umano ha permesso di identificare anche i cosiddetti alleli 'comuni' di suscettibilità, responsabili della stragrande maggioranza delle malattie dell'uomo (malattie poligeniche o multifattoriali). L'identificazione di questi alleli ha permesso per la prima volta di individuare genotipi di suscettibilità ('a rischio'), di sviluppare la cosiddetta diagnosi predittiva e/o di formulare rischi prognostici accurati. Ciò ha creato ansie e la somministrazione di test genetici in modo sproporzionato e spesso inutile.
D'altra parte in numerose situazioni il test genetico non può essere somministrato per difficoltà intrinseche, come nel caso di patologie rare (per es., retinoblastoma ereditario), geni di grandi dimensioni (per es., gene della neurofibromatosi di tipo 1), elevato numero di alleli e complessità genomica del gene stesso, tardivo arrivo della paziente al centro clinico (per es., in fase avanzata di diagnosi prenatale), soggetti portatori di mutazioni de novo, per i quali non vi è stata una preliminare indagine familiare e quindi ogni preventiva analisi di screening. Queste situazioni interessano fasce sempre più estese di popolazione come conseguenza della sempre maggiore offerta di test genetici che per la loro natura non si limitano all'individuo ma sono estesi ai suoi familiari e alla comunità in cui egli vive.
I. Test genetici
Per test genetici s'intendono comunemente le analisi di specifici geni, del loro prodotto o della loro funzione, nonché ogni altro tipo d'indagine del DNA, dell'RNA o dei cromosomi, finalizzata a individuare o a escludere mutazioni associate a patologie genetiche. I test diagnostici si basano su protocolli di laboratorio accurati e specifici, che debbono essere caratterizzati da validità analitica, validità clinica, utilità clinica e valutazione delle eventuali implicazioni di tipo etico, legale e sociale. La validità analitica di un test genetico è data dalla sua abilità a definire in modo accurato e attendibile il genotipo in esame. La validità clinica è definita come la capacità di un test a individuare o prevedere la presenza o l'assenza di una caratteristica fenotipica, fisica, di uno stato di malattia, o predisposizione a una precisa malattia. La valutazione dell'efficacia di un test genetico si basa sui parametri di sensibilità, della precisione (specificità) e riproducibilità. La sensibilità è definita dalla probabilità che il test eseguito evidenzi la/e mutazione/i per cui è stato sviluppato; la specificità riguarda invece la probabilità che il test non evidenzi mutazione/i che non sono presenti nel campione in esame.
Questi parametri, tradotti nella pratica clinica, permettono di definire il valore predittivo positivo o negativo (PPV, NPV) di un test. Con PPV si intende perciò la proporzione di pazienti con test positivo che presentano una determinata malattia, e con NPV la proporzione di pazienti con test negativo che non hanno la malattia. L'accuratezza dei test genetici è fortemente influenzata dalla popolazione presso la quale il test è eseguito e dalla prevalenza della malattia in esame in quella popolazione. Infatti, sebbene la sensibilità e la specificità del test rimangano costanti al variare della prevalenza di una malattia, i valori di PPV e NPV variano anche di molto in ragione della prevalenza, specialmente per i test con bassa sensibilità e bassa sensitività. È perciò fondamentale stabilire con esattezza la validità analitica e clinica di un test prima che lo stesso venga somministrato. I test genetici, analogamente a quelli non genetici, difficilmente raggiungono una sensibilità e specificità del 100%. Risultati falsi negativi, falsi positivi o semplicemente errori di genotipizzazione sono possibili come conseguenza di problemi tecnici o di interpretazione. Uno studio pilota basato sul controllo di qualità dei test genetici, effettuato a livello europeo relativamente alla fibrosi cistica, ha rivelato una frequenza di errori di circa il 10%, dovuta a problemi tecnici, interpretativi e soprattutto a inesattezze riportate nel referto (www.cfnetwork.be). I test genetici, in rapporto alla loro finalità, vengono applicati a diversi scopi e sono classificati come segue.
Test diagnostici. Consentono di effettuare una diagnosi o di confermare, in una persona affetta, un sospetto clinico. Possono essere eseguiti dal momento della formazione dello zigote (diagnosi preimpianto), durante lo sviluppo fetale (diagnosi prenatale), alla nascita (screening diagnostici neonatali) o nel corso della vita.
Test di identificazione dei portatori sani. Permettono di individuare mutazioni comuni in specifici gruppi etnici, attraverso screening di popolazione (anche in epoca neonatale), oppure indagini 'a cascata' sui familiari a rischio di soggetti affetti da patologie genetiche più o meno rare.
Test preclinici o presintomatici. Permettono di individuare il gene responsabile di malattie genetiche, i cui sintomi non sono presenti alla nascita, ma compaiono successivamente, anche in età avanzata. Possono fornire informazioni utili a pianificare scelte individuali e familiari.
Test di suscettibilità. Consentono di individuare i genotipi che di per sé non causano una malattia, ma comportano un aumento del rischio di svilupparla, in seguito all'esposizione a fattori ambientali favorenti o alla presenza di altri fattori genetici scatenanti. Rientra in questo ambito la maggior parte delle malattie multifattoriali dell'adulto.
Test per lo studio della variabilità individuale. Si basano sull'analisi di una serie di regioni del DNA polimorfiche (cioè differenti tra gli individui), finalizzata a definire un rapporto di consanguineità o ad attribuire una traccia biologica a una specifica persona. Questi test sono utili per verificare i rapporti di paternità, negli studi di linkage, nello studio dei trapianti e della zigosità e trovano applicazioni anche in ambito forense.
Test farmacogenetici. Riguardano le analisi finalizzate all'identificazione di variazioni di sequenza nel DNA, in grado di predire la risposta 'individuale' ai farmaci, in termini di efficacia e di rischio relativo di eventi avversi.
La maggior parte delle diagnosi genetiche, oggi, viene effettuata mediante la tecnologia della reazione a catena della polimerasi (PCR), seguita da un'analisi accurata di scanning genomico (individuazione rapida di varianti genetiche) e quindi dal sequenziamento diretto delle basi nucleotidiche del DNA con metodi automatici e standardizzati. Una recente ricerca OCSE ha rivelato che circa l'80% dei laboratori che effettuano diagnosi genetiche utilizzano procedure sviluppate in proprio, mentre solo il 14% adopera sistemi di kit commerciali. Quindi molti test genetici, oggi, vengono somministrati da laboratori che sviluppano, assemblano ed effettuano in proprio test diagnostici. La ragione della scarsa diffusione di sistemi commerciali di analisi è da attribuire alla complessità intrinseca dei test genetici: numero limitato di mutazioni nel kit, differenze di popolazione, ecc. La tecnologia dei chip genomici probabilmente cambierà questa situazione nei prossimi anni.
La possibilità di individuare e perciò di caratterizzare le malattie a livello molecolare ha aumentato, negli ultimi anni, le possibilità di un loro controllo, attraverso l'identificazione di alcune migliaia di alleli 'rari', globalmente responsabili di circa il 2% delle patologie umane (monogeniche o semplici). Un carattere genetico è 'monogenico' (o semplice) quando un solo gene è responsabile del fenomeno osservato (fenotipo), per esempio la malattia. Si conoscono 7000-10.000 malattie monogeniche (note anche come malattie genetiche 'rare' o 'mendeliane' o 'ereditarie'), che si manifestano con frequenze normalmente inferiori a 1 su 1000 (recentemente, la American Society of Human Genetics ha introdotto il termine di malattia 'ultrarara' per indicare quelle patologie con una prevalenza inferiore a 1 individuo su 200.000). La caratteristica fondamentale di queste malattie è di essere causate da un unico gene, denominato 'gene-malattia' (oggi sono stati identificati 1700 geni-malattia). Dal punto di vista diagnostico trovare una mutazione nel gene che causa la malattia comporta la possibilità di fare una diagnosi di malattia genetica, già presente o che si svilupperà certamente in futuro. Nella maggior parte dei casi questa malattia è congenita, cioè è presente alla nascita, e la diagnosi genetica eseguita in ambito clinico consente di confermare o precisare una diagnosi o un'ipotesi basata su criteri clinici. Molto più raramente la malattia non è presente alla nascita ma si sviluppa in età adulta. In questi casi, come per esempio nella corea di Huntington, una malattia neurologica, un test genetico può predire in maniera sicura che la persona svilupperà la malattia più avanti nella sua vita. Nella larga maggioranza dei casi non vi sono a oggi terapie adeguate per le malattie monogeniche. Queste sono malattie che, una volta diagnosticate, si svolgono secondo modalità che sono nelle grandi linee prevedibili. Un altro aspetto fondamentale è che queste malattie sono ereditate secondo le leggi codificate da Mendel e cioè seguono un pattern di trasmissione prevedibile. Si configura quindi una diretta correlazione tra la presenza del gene e la sua espressione diretta sul fenotipo; ciò potrebbe essere alla base di possibili discriminazioni per la persona stessa e per i suoi familiari.
Un carattere genetico è invece multifattoriale (o complesso) quando il fenotipo osservato, una malattia o la risposta a un farmaco, è la risultante dell'effetto di più geni e della loro interazione con l'ambiente. Sono caratteri genetici multifattoriali tutte le malattie comuni, quali le patologie cardiovascolari e psichiatriche, l'asma e le altre malattie respiratorie, il diabete, alcuni tumori. Queste malattie costituiscono la larga maggioranza della morbilità osservata e colpiscono una persona su due nel mondo occidentale; vengono dette 'malattie multifattoriali' o 'malattie complesse', o 'malattie comuni'. Il test genetico permetterà solo una diagnosi di suscettibilità, cioè di predire un rischio genetico aumentato o ridotto. Questa suscettibilità, e non la malattia, può essere trasmessa, in ogni caso secondo un pattern non mendeliano e non prevedibile. Le informazioni generate dai test genetici relativi a caratteri multifattoriali si prestano meno di quelle generate da test relativi a caratteri mendeliani a essere sfruttate per possibili discriminazioni. Infatti, anche se si conoscessero tutti i geni che rendono un soggetto predisposto a una certa malattia, cosa che è già di per sé difficile, non si potrebbe essere certi che la malattia si sviluppi. Inoltre, il soggetto può influire con il suo stile di vita sulla probabilità che ciò accada, riducendo la quota del rischio totale dovuta all'ambiente e non ai geni.
Recenti acquisizioni indicano che l'influenza genetica nelle malattie rare è molto più complessa di quanto si riteneva e che la distinzione tra caratteri monogenici e multifattoriali è meno categorica di quanto ipotizzato. Si è scoperto infatti che altri geni, oltre a quello che determina la malattia, entrano in gioco e ne influenzano il decorso o la gravità, e che anche i fattori ambientali esercitano un effetto, seppure molto modesto. A questo si aggiunge la capacità di una proteina codificata da uno specifico gene di svolgere più funzioni e influenzare pertanto più aspetti fenotipici contemporaneamente (per es., i geni codificanti gli enzimi moonlighting, ovvero proteine che svolgono due funzioni differenti in tessuti diversi o in momenti diversi, come nelle varie fasi dello sviluppo). Queste e altre osservazioni portano a inquadrare diversamente i caratteri genetici e le malattie: tutte le malattie sono in realtà complesse, cioè date da più geni e dall'ambiente, e le patologie monogeniche sono quelle in cui un gene ha un effetto largamente prevalente sugli altri geni e sull'ambiente, tanto da determinare da solo la malattia. È infatti chiaro che esiste una discrepanza tra il fenotipo atteso e quello osservato nel singolo paziente. Questa discrepanza è dovuta a differenti meccanismi biologici e ambientali non del tutto compresi e quantificabili. Si pensi, per esempio, ai casi di mosaicismo somatico, una condizione per cui si possono riscontrare mutazioni differenti nelle cellule dei diversi organi del paziente. Le difficoltà poste dalla presenza del mosaicismo non sono di facile soluzione, se si considera che non sempre è possibile disporre dei diversi tessuti del paziente che sarebbe necessario analizzare. Nella maggior parte dei casi, però, gli strumenti per studiare il genoma sono buoni e permettono un'indagine rapida e in tempi relativamente brevi con costi contenuti.
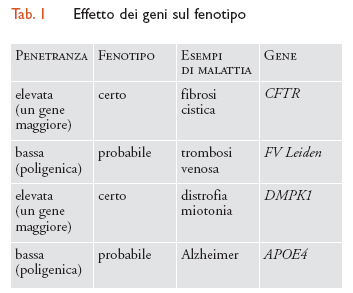
È necessario pertanto considerare sempre quando si effettua un test genetico: (a) l'obiettivo e lo scopo del test; (b) la popolazione per il quale il test è stato messo a punto; (c) le caratteristiche intrinseche del test stesso. La sensibilità clinica e il PPV di un test genetico per il tumore della mammella (il BRCA test), per esempio, dipenderanno considerevolmente dall'eventualità in cui il test comprenda l'analisi simultanea dei geni BRCA1 e BRCA2 e dalla porzione di DNA codificante analizzata per ognuno di essi. È auspicabile quindi che ogni test contenga e definisca in modo chiaro e inequivocabile il set di mutazioni che esso è in grado di rivelare e le sue limitazioni. La capacità di un test genetico di predire in maniera certa il fenotipo studiato, per esempio se il soggetto svilupperà o meno la malattia, dipende dalla penetranza della mutazione/polimorfismo analizzato. Solo test per caratteri semplici hanno una penetranza elevata, mentre quelli per caratteri complessi ne hanno una bassa. Un test genetico per un carattere semplice, ad alta penetranza, permette una diagnosi certa del fenotipo e la conoscenza del meccanismo con cui il carattere viene ereditato. Al contrario, un test genetico per un carattere complesso, a bassa penetranza, consente solo di stimare una variazione del rischio che il fenotipo si presenti e non permette di conoscere il meccanismo con cui il fenotipo viene ereditato (tab. 1). Un censimento OCSE pubblicato nel 2005 ha rivelato che il 61% dei test genetici offerti nei Paesi industrializzati riguarda test diagnostici per malattie semplici, il 35% per malattie complesse e circa il 10% test di farmacogenomica. Sebbene vi sia una diretta correlazione tra frequenza della malattia e numero di test effettuati, esistono notevoli differenze a seconda del gruppo etnico in esame (per es., talassemia in Italia e test per la malattia di Tay-Sachs negli ebrei aschenaziti).
Interpretazioni di una diagnosi genetica
Una delle difficoltà principali dell'applicazione dei test genetici alla diagnostica medica è di natura concettuale e riguarda proprio la definizione stessa di 'malattia genetica'. Una malattia genetica è talvolta definita dal punto di vista fenotipico dalla presenza di specifici sintomi e segni clinici, e altre volte precisata su base genotipica dall'esistenza di mutazioni tipiche della malattia. Su questa base alcuni genetisti ritengono che una malattia genetica sia definita da un particolare fenotipo associato a uno specifico genotipo, altri invece considerano soltanto le manifestazioni fenotipiche (o le mutazioni genotipiche) sufficienti per una definitiva diagnosi di malattia genetica. Per esempio, nella corea di Huntington, la presenza di alcune caratteristiche cliniche di tipo neurologico o psichiatrico permette di sostenere che il paziente è affetto da tale patologia, ma è possibile affermare la stessa cosa se un soggetto asintomatico presenta la mutazione (CAG) del gene HD, che inevitabilmente causerà la malattia in questo soggetto magari tra dieci anni? Deve essere considerato un soggetto presintomatico o predisposto alla malattia?
Molti genetisti considerano il test per la corea di Huntington un test presintomatico, ma ritengono i soggetti positivi come persone predisposte alla malattia. D'altro canto, è noto che non tutti gli individui omozigoti (pertanto considerati affetti, essendo questa una malattia recessiva) per la mutazione C282 del gene HFE che predispone all'emocromatosi ‒ malattia da accumulo di ferro che colpisce una persona su duecento della popolazione generale con una frequenza di portatori sani (eterozigoti) di circa uno su otto ‒ svilupperanno la patologia. Altri esempi riguardano il cancro non poliposico del colon (HNPCC), per il quale vengono considerati affetti dalla patologia individui asintomatici portatori di mutazioni dei geni MLH1, MSH2 e PMS2. Questi pochi esempi dimostrano quanto sia difficile definire una malattia genetica secondo criteri standard.
Ai fini di un test genetico, la diagnosi clinica e quindi fenotipica deve costituire l'elemento principale per la definizione di malattia in un soggetto. Tutte le malattie genetiche possono essere definite clinicamente con qualche eccezione (sclerosi tuberosa). La diagnosi fenotipica consente talvolta di superare anche certi limiti del test genetico dovuti all'impossibilità di distinguere tra una mutazione (che direttamente influenza il fenotipo) e un polimorfismo (privo di effetti fenotipici). In queste situazioni può essere ragionevole riportare nel referto 'risultato non interpretabile'. Diversa è la situazione quando la discrepanza tra genotipo e fenotipo è dovuta a un difetto di penetranza del gene mutato, ovvero quando il genotipo chiaramente e inequivocabilmente rivela una particolare mutazione, ma nel fenotipo non vi è alcun effetto e questo non è legato all'esordio tardivo della malattia come nella corea di Huntington. Analogamente, un gene mutato può esprimersi in maniera differente (espressività variabile) con individui che presentano forme gravi e altri con forme lievi della stessa malattia. Questo può dipendere dalla presenza di altri geni mutati nella stessa persona o dalla presenza di complicate combinazioni alleliche in uno stesso genoma. Per interpretare correttamente un genotipo occorre conoscere in modo approfondito la malattia che si sta analizzando, la natura della mutazione e le caratteristiche del test che si sta utilizzando. Al genetista spetta il compito di tradurre le potenzialità delle conoscenze genotipiche in realtà applicative agli occhi del paziente.
Eccezionalità della diagnosi genetica?
Molto spesso si associa il risultato di un test genetico al significato di 'determinato' o 'ineluttabile', in quanto l'informazione genetica è permanente, personale, potente e in grado di suscitare razzismo. Ciò ha spesso causato problemi nei pazienti sottoposti al test, che si sono rivelati a volte anche controproducenti, se non dannosi, per la loro salute. Ed è per questa ragione che molte persone predisposte, considerata la storia medica della loro famiglia, ad avere la malattia di Huntington scelgono di non fare il test, che direbbe loro quasi con certezza se ne saranno colpiti o meno. Ma è importante osservare che quando si troverà una cura per questa terribile malattia, le stesse persone che oggi rifiutano il test saranno le prime a chiedere di farlo. Un altro esempio riguarda la fibrosi cistica: la malattia è ancora oggi non guaribile, ma tutti concordano che la diagnosi precoce attraverso lo screening genetico è fondamentale per stabilire il miglior trattamento nutrizionale nella prima decade di vita, il miglior trattamento respiratorio possibile, per raggiungere una sopravvivenza più lunga e prevenire complicazioni con trattamenti adeguati, oltre che per aumentare la possibilità di successo di trial clinici e di trattamenti presintomatici.
Quando diciamo che un particolare risultato è ineluttabile, dovremmo specificare per chi e per cosa, e soprattutto per quando. Si pensi per esempio allo screening genetico della galattosemia nei neonati. Se la diagnosi viene fatta tempestivamente e si elimina il galattosio dalla dieta dei piccoli affetti, si evitano i disturbi successivi (possibili ritardi mentali o, in alcuni casi, come è emerso recentemente, cancro dell'ovaio). Un altro esempio illustrativo è la fenilchetonuria, una malattia monogenica, autosomica recessiva: se si elimina l'amminoacido fenilalanina dalla dieta dei piccoli pazienti si evitano i danni successivi (ritardo mentale). Più recentemente, sono state fornite evidenze che malattie genetiche metaboliche, come la malattia di Gaucher, la malattia di Fabry, la glicogenosi di tipo II e la gangliosidosi, considerate fino a pochi anni fa non curabili e quindi ineluttabili, oggi possono essere curate grazie a enzimi ricombinanti prodotti con tecniche di ingegneria genetica. Ma è cruciale iniziare la terapia il più precocemente possibile. Una situazione analoga riguarda la sordità congenita che, riconosciuta precocemente attraverso un test genetico alla nascita, potrebbe consentire il recupero pressoché totale del difetto di linguaggio e di comprensione di molti di questi pazienti. Proprio per questa ragione, attualmente 26 Stati americani effettuano su tutti i neonati lo screening genetico per 35 diverse malattie ereditarie. Tali programmi non hanno suscitato espressioni di 'razzismo' o altre forme di discriminazione, semplicemente perché sono stati ben organizzati e gestiti in termini di corretta informazione all'opinione pubblica, soprattutto per quanto riguarda la consapevolezza che tutte le malattie hanno una base genetica e, quindi, che tutti siamo a rischio di sviluppare una malattia genetica. È evidente pertanto che non esiste una base genetica della discriminazione, in quanto tutti siamo nella stessa situazione di rischio. La presunta eccezionalità della diagnosi genetica rispetto alle tipologie diagnostiche della medicina moderna è fuorviante e generatrice di confusione. Il fatto che il dato genetico sia permanente non comporta di per sé un effetto ineluttabile sul rischio di malattia. Se una persona con una variante genetica che la predispone a un aumentato rischio di malattie cardiovascolari, venuta a conoscenza di questa sua predisposizione, adotta stili di vita opportuni (per es., smette di fumare, inizia a fare esercizio fisico, si sottopone a una dieta corretta), il rischio globale diminuisce, nonostante il rischio genetico resti inalterato.
Diagnosi predittiva e/o di suscettibilità
Di diversa natura e più difficili da comprendere sono i test genetici predittivi o di suscettibilità (tab. 2). Riguardano indagini molecolari capaci di identificare una mutazione o una variazione genetica comune (polimorfismo), che costituisce un potenziale fattore di rischio per lo sviluppo di una patologia, a condizione che la sua insorgenza non sia di fatto impedita da altri fattori genetici o ambientali. Il test predittivo dovrebbe consentire l'identificazione delle persone a rischio in una fase molto precoce, in modo da prevenire la comparsa del fenotipo patologico. Il valore della predittività può essere diverso se il test è applicato a gruppi selezionati di persone (per es., famiglie nelle quali segrega la malattia da più generazioni, gruppi etnici particolari), rispetto alla popolazione generale. Questo guadagno di informazione è da attribuirsi alla minore eterogeneità genetica di gruppi definiti rispetto alla popolazione globalmente considerata. Quando si sente dire che è stato scoperto il gene del tumore al seno, o il gene responsabile di altre patologie tumorali, significa che è stato individuato un gene che potrebbe essere coinvolto nella malattia.
Attualmente, solo una percentuale molto bassa di tumori può essere ricondotta all'azione di singoli geni (5÷10% di tutti i tumori). Appartengono a questa classe i tumori insorti in soggetti che appartengono a famiglie nelle quali la segregazione è chiaramente mendeliana, e che pertanto non vanno confusi con le forme ben più comuni di tumori che mostrano una concentrazione familiare non necessariamente legata a singoli fattori ereditari. Il rischio di cancro, attribuibile alla presenza di mutazioni ereditarie in singoli geni associati al tumore stesso, deve essere valutato con appropriati indagini familiari e di popolazione. Pertanto, in ambito clinico, le stime del rischio predittivo, derivate da particolari sottogruppi (come le famiglie ad alta incidenza di cancro), non possono essere utilizzate per definire il rischio di tumore nei soggetti sani della popolazione generale. Attualmente, nessun test genetico di predittività tumorale è appropriato per lo screening dei soggetti sani della popolazione generale. Questo non significa che i test genetici tumorali non abbiano significato clinico, ma semplicemente che vanno applicati con criterio. Una persona che possiede una mutazione in uno dei sei geni conosciuti correlati al cancro del colon presenta fino al 100% di possibilità di sviluppare la malattia. Ignorare questo dato comporta un rischio quasi certo di sviluppare il cancro del colon. La caratterizzazione della mutazione 'costringerà' il soggetto positivo a programmare una serie di controlli regolari e a rimuovere ogni lesione che dovesse formarsi nel colon, prima della sua degenerazione maligna e/o della sua disseminazione. In questo caso la probabilità di ammalarsi di una malattia clinicamente conclamata si avvicina allo zero. Un recente studio olandese effettuato su un campione di donne (tra 35 e 68 anni di età) a rischio di cancro della mammella (stimato in ca. 25÷50%) da mutazioni dei geni BRCA1 e BRCA2 che, essendo risultate positive al test, si erano sottoposte a mastectomia bilaterale preventiva, non ha rivelato alcun caso di diffusione del tumore in un arco di tempo superiore a 27 mesi, periodo che risulta statisticamente significativo in base all'attesa. L'identificazione della mutazione ha inoltre indirizzato al test gli altri familiari e portato a intraprendere scelte preventive, come quella farmacologica e chirurgica, anche nei parenti stretti dei pazienti.
Maggior cautela è oggi opportuno osservare invece nella somministrazione di test di suscettibilità, che, inizialmente riferiti all'identificazione di persone propense a sviluppare una sintomatologia, a volte grave, dopo esposizione a particolari sostanze chimiche, sono oggi tesi all'individuazione di soggetti portatori di genotipi a rischio di sviluppare un determinato fenotipo patologico. Largo interesse suscitano in questo contesto i test che misurano il deficit di α-1-antitripsina e il rischio di enfisema polmonare; gli alleli APOE4 (apoliproteina E) e A2M (α-2-microglobulina) e il rischio di malattia di Alzheimer; il gene LOX-1 e il rischio di infarto, i polimorfismi dei recettori delle chemochine e la resistenza al virus HIV o una progressione più lenta della malattia. È possibile che nell'immediato futuro questi test troveranno una larga applicazione per quasi tutte le malattie a elevata frequenza nella popolazione, come il diabete, l'arterosclerosi, la psoriasi, l'epilessia, l'ipertensione e l'asma. Attualmente, il problema principale è la definizione di 'rischio genetico' basato sulla presenza o assenza di un determinato polimorfismo genetico. Il fatto che a una persona sia stato riferito che ha un rischio del 23% di sviluppare la malattia di Alzheimer non significa che essa abbia una probabilità del 23% superiore alla popolazione generale di ammalarsi, oppure un rischio 23 volte superiore agli altri di ammalarsi, ma che 23 persone su 100 sottoposte a questo test si ammaleranno. Questo concetto è piuttosto difficile da capire da parte di molti operatori e complicato da far comprendere al soggetto sottoposto a un esame. La stima esatta del valore di rischio genetico non è semplice da calcolare. Questo varia infatti secondo la conoscenza del gene, la sua struttura, la sua funzione e la sua storia evolutiva. Un gene non è un'entità isolata e immodificabile, ma è parte integrante del genoma di una persona.
La presenza di un gene di suscettibilità in una persona ne accentua un particolare fenotipo, mentre in altre l'effetto è quasi nullo. Ciò è da attribuirsi a fenomeni intrinseci del gene stesso (effetto qualitativo degli alleli), alla presenza di altri geni e all'ambiente (malattie a fenotipo complesso). Per esempio, la trombosi venosa è fortemente influenzata dalla presenza, in uno stesso individuo, dei polimorfismi FVL e PT, come lo sono i danni all'endotelio, la stasi postoperatoria o postpartum, l'immobilità prolungata, uno sforzo fisico intenso e i contraccettivi orali. Le mutazioni FVL e PT sono comuni nella popolazione generale (5% ca.) quando considerati singolarmente, ma comportano un rischio genetico del 20% quando coesistono in uno stesso soggetto. Malgrado un test positivo a entrambi identifichi con un buon margine di accuratezza i soggetti a rischio, si discute molto sull'opportunità di effettuare tale test a persone asintomatiche e senza precedenti episodi trombotici, in considerazione delle possibili complicanze cliniche (emorragie) della terapia con anticoagulanti a cui queste persone potranno essere sottoposte. Alcuni studi recenti hanno poi dimostrato che, dopo un episodio trombotico, il rischio è praticamente identico in soggetti positivi al test genetico e in quelli negativi allo stesso. Pertanto i benefici di questo test sono praticamente nulli e ingiustificati. Al contrario, il test potrebbe essere efficace e perfino indispensabile in persone giovani con più episodi trombotici (anche familiari), che identificano soggetti a elevato rischio e suscettibili perciò di trattamento farmacologico.
La diversa suscettibilità di ogni persona ai continui stimoli ambientali è un presupposto necessario per la selezione naturale. Infatti, gran parte della suscettibilità alle malattie attuali potrebbe spiegarsi con l'inadeguatezza dei nostri sistemi cellulari a fronteggiare situazioni del tutto o in parte nuove e, spesso, addirittura opposte a quelle che sono state, invece, la base della selezione naturale attraverso la quale gli organismi si sono evoluti nel corso di milioni di anni. Ciò è confermato dalla presenza di alleli responsabili di gravi malattie ereditarie, che si sono selezionati in quanto rari o perché conferivano vantaggi in alcune situazioni (per es., alleli della fibrosi cistica e colera/tifo, fenilchetonuria e riduzione dell'abortività, tubercolosi e alleli responsabili della malattia di Tay-Sachs). Accanto a essi coesistono nel genoma alleli 'buoni', che conferiscono resistenza o comunque influenzano e ritardano alcuni processi morbosi, come per esempio il cancro. La presenza nel nostro genoma di alleli 'buoni' e 'nocivi' è tra l'altro documentata dalla risposta individuale ai farmaci (farmacogenetica).
Esiste una grande eterogeneità nel modo in cui ogni individuo risponde alla somministrazione di un farmaco in termini di tossicità ed efficacia del trattamento. La risposta individuale in termini farmacocinetici e di effetto farmacologico è in genere attribuibile a singoli geni (per es., CYP2D6) o all'interazione di più geni che producono proteine coinvolte in uno stesso metabolismo (www.sciencemag.org/feature/data/1044449.shl) (tab. 1). Poiché è attualmente impossibile esaminare gli alleli buoni e cattivi di tutti i geni all'interno del genoma di un individuo, la ricerca si limita a studiare gli alleli della suscettibilità a particolari malattie attraverso la valutazione del rischio individuale di sviluppare (in termini probabilistici) il fenotipo-malattia, stabilito mediante studi di familiari e di popolazione che dovrebbero essere rigorosi e più completi possibili. Quando fare, quindi, un test predittivo? Quando il test è disponibile, quando il rischio genetico è accertato, quando vi sono le indicazioni per la selezione del gruppo di persone che possono sottoporsi al test e quando sussistono possibili misure per la riduzione del rischio genetico.
Il futuro della diagnosi genetica
La diagnosi genetica delle malattie ereditarie sarà considerata una componente importante nel campo della profilassi e della prevenzione delle malattie dell'uomo. Non è neanche troppo difficile immaginare che verrà un giorno in cui ognuno di noi potrebbe avere una carta genetica di identità. Il completamento del Progetto genoma umano (HGP) e della mappa degli aplotipi (HapMap) hanno consentito l'identificazione di tutti i geni umani e delle loro più comuni forme alleliche. La conoscenza dettagliata del genoma umano e delle sue variazioni, unitamente allo sviluppo di tecnologie come per esempio il genechip, consentiranno il monitoraggio genotipico per valutare la suscettibilità alle malattie, il tipo di risposta ai farmaci, la suscettibilità agli agenti infettivi. Tutto ciò esigerà l'emanazione di nuove norme legislative e la costruzione di nuovi rapporti tra medico e paziente. Infatti, malgrado non vi sia alcun dubbio sui benefici dei test genetici in termini di qualità della vita dell'individuo, della sua famiglia e della popolazione in generale, è opportuno procedere con cautela alla loro somministrazione. L'obiettivo di avere nell'anno 2010 una carta di identità genetica individuale per 1000 euro è certamente affascinante, a condizione che l'avvento biotecnologico non prevarichi la figura del medico e che la medicina salvaguardi le sue radici ippocratiche.
Bibliografia
Andersson 2002: Andersson, Hans C. e altri, Medical genetic test reporting for cystic fibrosis (dF508) and factor V Leiden in North American laboratories, "Genetics in medicine", 4, 2002, pp. 324-327.
Andersson 2003: Andersson, Hans C. e altri, Physicians' perceived usefulness of and satisfaction with test reports for cystic fibrosis (dF508) and factor V Leiden, "Genetics in medicine", 5, 2003, pp. 166-171.
Bakker 1999: Bakker, Bert e altri, A European pilot quality assessment scheme for molecular diagnosis of Huntington's disease, "European journal of human genetics", 7, 1999, pp. 217-222.
Benach 1999: Benach, Marta O. e altri, Quality assurance in molecular genetic testing laboratories, "Journal of the American Medical Association", 281, 1999, pp. 835-840.
Cappelli 1998: Cappelli, Mark e altri, Physician knowledge and attitudes toward molecular genetic (DNA) testing of their patients, "Clinical genetics", 53, 1998, pp. 447-455.
Dawson 2001: Dawson, Neal V., Reporting BRCA test results to primary care physicians, "Genetics in medicine", 3, 2001, pp. 327-334.
Maddalena 2005: Maddalena, Anne e altri, Technical standards and guidelines: molecular genetic testing for ultra-rare disorders, "Genetics in medicine", 7, 2005, pp. 571-583.
Molecular diagnostic methods for genetic diseases; approved guideline, NCCLS document MM1-A, edited by National Committee for Clinical Laboratory Standards, Wayne (Pa.), NCCLS, 2000.
Preconception and prenatal carrier screening for cystic fibrosis: clinical and laboratory guidelines, edited by American College of Obstetricians and Gynecologists, American College of Medical Genetics, Washington D.C., ACOG, 2001.
Vastag 2003: Vastag, Brian, Cystic fibrosis gene testing a challenge, "Journal of the American Medical Association", 289, 2003, pp. 2923-2924.
Wilkins-Haug 2000: Wilkins-Haug, Louise e altri, Obstetrician-gynecologists' opinions and attitudes on the role of genetics in women's health, "Journal of women's health & gender-based medicine", 9, 2000, pp. 873-879.