Fonti energetiche della vita primordiale
Fonti energetiche della vita primordiale
The Rockfeller University New York, New York, USA
Fonti energetiche della vita primordiale
Alla memoria di Fritz Lipmann (1899-1986)
Feodor Lynen (1911-1979)
Efraim Racker (1913-1991)
Theodor Wieland (1913-1995)
I pionieri del 'mondo dei tioesteri'
In questo saggio si parte dalla premessa che i fabbisogni energetici della vita primordiale fossero simili a quelli odierni e che venissero soddisfatti da fonti energetiche dell'ambiente, con meccanismi che prefiguravano quelli operanti attualmente (regola di congruenza). Secondo tale ipotesi, erano necessarie due distinte forme di energia: quella associata a elettroni, per le reazioni di riduzione, e quella associata a gruppi chimici, per le reazioni di condensazione con eliminazione di acqua. Le possibili fonti di elettroni comprendevano lo ione ferroso, il solfuro ferroso-solfuro di idrogeno e diversi tipi di molecole organiche. Gli agenti condensanti potrebbero essere stati il pirofosfato inorganico e i polifosfati, in seguito sostituiti dall'ATP, e i tioesteri, che potrebbero aver svolto un ruolo molto importante nelle interconversioni energetiche. Nel saggio viene avanzata la tesi che i processi biochimici primordiali siano stati inizialmente alimentati da molecole organiche preesistenti (eterotrofia) e che i meccanismi si siano successivamente adattati all'uso del diossido di carbonio e di altri precursori minerali (chemotrofia), fino all'utilizzo dell'energia derivante dalla luce solare (fototrofia).
Introduzione
Se la vita è sorta seguendo principi naturali - e questa è la sola ipotesi scientificamente sostenibile - ciò deve essersi verificato attraverso lo sviluppo lungo e articolato di reazioni chimiche sempre più complesse, in grado di permettere l'evoluzione di sistemi operanti in condizioni sempre più lontane da quelle di equilibrio. Per verificarsi spontaneamente, tale processo deve essere stato costantemente rifornito di energia. In questo modo funzionano gli organismi attuali, e le forme di vita primordiali non avrebbero potuto seguire principi diversi. Il tema dell' energia prebiotica è stato affrontato da una serie di differenti punti di vista: cosmologico, geochimico, chimico fisico, chimico organico e biochimico. Questo breve saggio, in cui non sarà possibile trattare esaurientemente una materia così vasta, sarà impostato soprattutto su considerazioni di tipo biochimico. Alla base di questa scelta vi è quella che ho chiamato regola di congruenza, il principio, cioè, secondo il quale i primi meccanismi prebiotici devono, per molti aspetti, aver prefigurato alcune delle principali vie! metaboliche attualmente presenti. Questo punto di vista, non condiviso da alcuni esperti del settore, è a mio avviso una conseguenza implicita del modo in cui il metabolismo attuale si è presumibilmente sviluppato. Se, come sembra probabile, le proteine enzimatiche sono comparse inizialmente come prodotti di un 'mondo a RNA', ciò deve essere avvenuto per stadi successivi, ciascun nuovo enzima trovando nella chimica esistente uno o più substrati su cui agire e, nel contempo, una o più vie d'uscita per i prodotti di reazione. In caso contrario, tali proteine non sarebbero state di alcuna utilità e non sarebbero state selezionate nel corso dell'evoluzione. Da ciò deriva la necessità che esista conformità fra chimica prebiotica e metabolismo catalizzato da enzimi (de Duve, 1993; 1995a; 1995b). Questo saggio tratta soprattutto gli aspetti energetici, ossia i composti e i processi che, in teoria, potrebbero aver fornito l'energia libera necessaria allo sviluppo della vita nelle condizioni primordiali terrestri. Gli aspetti relativi all'effettiva realizzabilità di questi processi, riguardanti soprattutto la catalisi, saranno considerati solo marginalmente. Entro questi limiti, cercherò di dare priorità ai risultati sperimentali, al di là dei modelli teorici. Nonostante ciò, questa materia rimane essenzialmente speculativa, perché il problema più serio è sempre l'incertezza che ancora affligge la nostra conoscenza delle condizioni fisiche in cui la vita si è originata. Nel discutere gli argomenti più controversi, tenterò di riportare in modo obiettivo le diverse opinioni, ma le valutazioni e le conclusioni sono del tutto personali. l lettori più interessati potranno trovare ulteriori informazioni, nonché dati sul retroterra storico dell'argomento, nelle bibliografie dei lavori citati e nei libri e nelle rassegne dedicati all'origine della vita (Miller e Orgel, 1974; Dillon, 1978; Folsome, 1979; Caims-Smith, 1982; Schopf, 1983; Day, 1984; Shapiro, 1986; de Duve, 1991, 1995a; Deamer e Fleischaker, 1994; Chyba e McDonald, 1995).
Elementi essenziali di bioenergetica
Coerentemente con l'impostazione utilizzata, sarà utile premettere una breve rassegna sui principali meccanismi mediante i quali viene prodotta l'energia necessaria alla vita negli organismi attuali. Maggiori dettagli si possono trovare in qualsiasi testo di biochimica e nei lavori di E. Broda (1975), C.R. de Duve (1984; 1991) e F.M. Harold (1986). Sugli aspetti termodinamici è da consigliare la rassegna di R.K. Thauer e collaboratori (1977).
Le due forme di bioenergia
La vita si basa sostanzialmente su due forme di energia chimica: quella associata agli elettroni e quella associata a gruppi chimici. La prima è necessaria per la riduzione dei composti grezzi provenienti dal mondo minerale (principalmente diossido di carbonio, nitrati o azoto molecolare e solfati), allo scopo di formare zuccheri, amminoacidi, purine, pirimidine, acidi grassi e altri costituenti organici delle molecole biologiche. La seconda è necessaria per le reazioni di condensazione con eliminazione di molecole d'acqua, attraverso le quali questi costituenti vengono assemblati in polisaccaridi, proteine, acidi nucleici, lipidi e altre macromolecole biologiche. Esistono inoltre specifici trasduttori per l'interconversione delle due forme di energia e per il loro utilizzo nella produzione di altre forme di lavoro, come il trasporto attivo di molecole o ioni, il lavoro osmotico, il lavoro elettrico, il lavoro meccanico e l'emissione di luce.
La cascata di elettroni
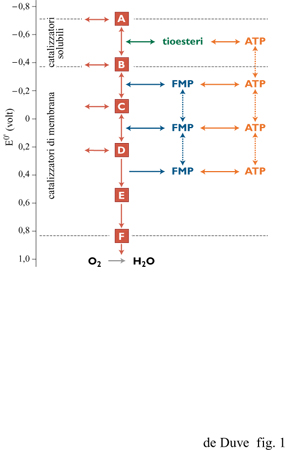
Le due suddette forme di energia non sono equivalenti; infatti, gli organismi si procurano l'energia dall'ambiente (compresa l'energia luminosa) quasi esclusivamente nella forma associata agli elettroni. Per il loro fabbisogno di energia associata a gruppi chimici, le cellule dipendono principalmente dall'energia associata agli elettroni che esse utilizzano per formare l'ATP, il cofattore universale delle reazioni biochimiche di condensazione e anche il principale donatore di energia per gli altri tipi di lavoro cellulare. Il punto centrale di questa organizzazione è costituito da ciò che possiamo chiamare la cascata fosforilante di elettroni (fig. 1). Questa consta di una serie di catalizzatori capaci di trasferire elettroni e di determinarne la caduta da elevati a bassi livelli di energia (ossia essi operano il trasferimento elettronico esoergonico da trasportatori a basso potenziale redox a trasportatori a elevato potenziale redox). Così viene forzata, con l'aiuto dell' energia rilasciata durante il trasferimento elettronico, la simultanea condensazione endoergonica tra ADP e fosfato inorganico (Pi) per formare ATP, con eliminazione di una molecola d'acqua. Pur esistendo molte varianti, questi sistemi sono tutti organizzati secondo lo stesso principio funzionale e coinvolgono gli stessi tipi di catalizzatori.
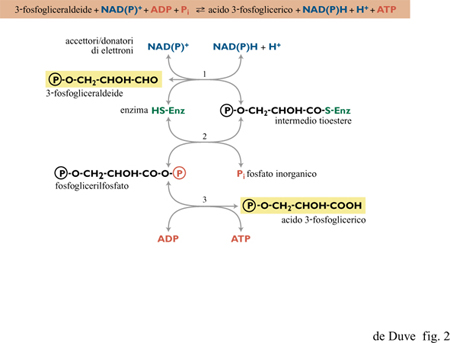
La cascata di elettroni può essere schematicamente suddivisa in sei livelli, separati da cinque intervalli di potenziale di circa 300 m V, ciascuno corrispondente alla differenza di potenziale redox necessaria alla formazione di una molecola di ATP per ogni coppia di elettroni trasferiti. Il flusso di elettroni attraverso la cascata è mediato da catalizzatori di membrana, a eccezione del processo al livello energetico più alto, che segue un meccanismo differente dagli altri e dipendente da catalizzatori solubili. In una forma o nell'altra, questo processo è presente in tutti gli organismi viventi e collega certi metaboliti, a potenziale redox particolarmente basso, a trasportatori solubili di elettroni, in genere NAD o NADP. In tale processo l'accoppiamento tra trasferimento elettronico e formazione di ATP avviene tramite intermedi chimici, quasi sempre tioesteri. Queste reazioni, dette fosforilazioni a livello di substrato, possono anche avvenire in senso inverso, con la sintesi riducente e ATP-dipendente di metaboliti a basso potenziale, utilizzando NADH o NADPH come donatori di elettroni (fig. 2).
Nei rimanenti passaggi della cascata, gli elettroni sono trasferiti lungo una catena di trasportatori di membrana, generando un potenziale protonico attraverso la membrana stessa. La forza motrice protonica che ne risulta sostiene la sintesi di A TP (fosforilazione a livello di trasportatore). Nella sua forma più completa questo sistema, che è detto anche catena respiratoria, e che ritroviamo nella membrana pIasmatica di alcuni batteri aerobi e nella membrana interna dei mitocondri delle cellule eucarioti, guida il passaggio di elettroni dal NADH all'ossigeno, con pochi punti di accesso e di uscita. In diversi casi (per es., organismi anaerobi, apparati fotosintetici), esiste invece solo una catena interrotta, connessa a specifici donatori o accettori di elettroni. I due processi al livello energetico più alto della catena associati alla membrana sono del tutto reversibili: essi possono operare all'inverso, trasportando elettroni da livelli energetici più bassi a livelli più alti, con l'ausilio della forza motrice protonica, dell'ATP generato più a valle, o dell' A TP prodotto con qualche altro meccanismo. La parte finale della catena, in cui è sintetizzata una singola molecola di A TP per coppia di elettroni trasferiti, anziché le due teoricamente possibili, è invece irreversibile: il trasferimento elettronico inverso, a partire dall'acqua, non può avvenire attraverso la catena respiratoria.
Per poter funzionare, le cascate fosforilanti di elettroni devono utilizzare elettroni provenienti da un'appropriata fonte (donatore) ed essere in diretta connessione con uno specifico componente in uscita (accettore), separato dal donatore da un dislivello di potenziale di almeno 300 mV, che viene così sfruttato per formare ATP. Le diverse classi di organismi si differenziano, essenzialmente, per il modo in cui questi requisiti sono soddisfatti.
Eterotrofia
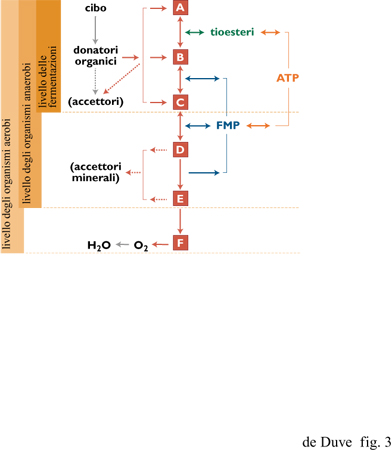
Negli organismi eterotrofi, gli elettroni coinvolti nei processi metabolici sono forniti da alimenti organici e sono, alla fine, trasferiti all'ossigeno o, in certi batteri anaerobi, ad altri accettori esterni come solfati, nitrati o ione ferrico (fig. 3). Un certo numero di organismi può fare a meno degli accettori esterni di elettroni - o lo fa obbligatoriamente - utilizzando un metabolita (per es., etanolo o lattato), che funge da veicolo per gli elettroni in uscita (fermentazioni). Gli eterotrofi attingono dagli alimenti anche i componenti necessari per la crescita e il mantenimento. Questi processi sono alimentati dall'ATP e, in alcuni casi (per esempio la sintesi degli acidi grassi), da un supplemento addizionale di elettroni metabolici, portati, se necessario, all'appropriato livello energetico tramite trasferimenti elettronici inversi. Se privati del cibo, gli eterotrofi continuano a sopravvivere utilizzando i propri costituenti come fonte di elettroni. Lo stesso avviene per organismi autotrofi ai quali venga tolto l'accesso alle usuali fonti di energia (per es., le piante al buio). Il modello eterotrofico è universale.
Chemotrofia
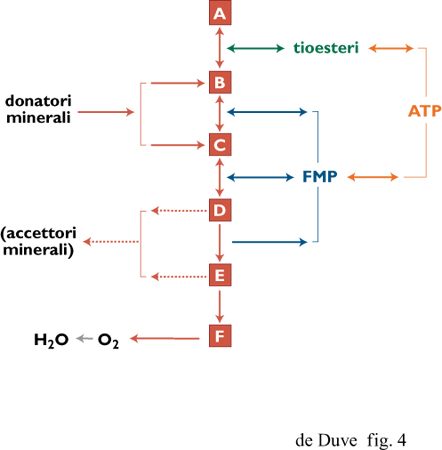
Gli organismi chemotrofi (litotrofi) funzionano in maniera molto simile agli eterotrofi, con la differenza che essi si procurano gli elettroni da donatori minerali, come l'idrogeno molecolare o il solfuro di idrogeno, e necessitano di maggiori quantità di elettroni per le riduzioni bio sintetiche (fig. 4). Il trasferimento elettronico inverso è necessariamente coinvolto in questi processi riduttivi, specialmente attraverso i componenti solubili della cascata di elettroni associati ai tioesteri, poiché gli elettroni provenienti da donatori minerali entrano nella cascata a un livello energetico intermedio.
Fototrofia
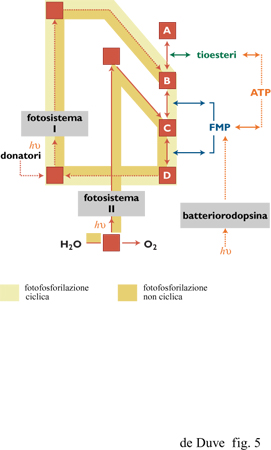
La maggioranza degli organismi fototrofi (tutti quelli che utilizzano le clorofille come fotocatalizzatori) ricavano gli elettroni da donatori a bassa energia e utilizzano la luce per portare gli elettroni a un livello energetico elevato. Alcuni degli elettroni attivati sono indirizzati verso le reazioni bio sintetiche riduttive; gli altri passano attraverso una catena di trasportatori associati alla membrana, sostenendo così la sintesi accoppiata di ATP tramite forza motrice protonica, e tornano poi al foto sistema per un nuovo ciclo di attivazione da parte della luce. In questo modo non è necessario alcun accettore di elettroni ed è richiesto un donatore esterno solo per fornire gli elettroni utilizzati per le riduzioni bio sintetiche che, come nei chemotrofi, sono di fondamentale importanza (fig. 5).
Nei batteri foto sintetici più primitivi un unico sistema (fotosistema I), situato nella membrana cellulare o in sacche membranose derivanti dalla membrana cellulare (cromatofori), effettua l'intero processo utilizzando elettroni provenienti da alcuni donatori minerali come il solfuro di idrogeno. Alcuni organismi utilizzano un donatore di elettroni organico, proprietà che li rende parzialmente eterotrofio I fototrofi superiori (cianobatteri, alghe eucarioti e piante verdi) hanno un secondo foto sistema (fotosistema II) situato, in stretta associazione al fotosistema I, nei cromato fori batterici o in sacche membranose (tilacoidi) presenti all'interno dei cloroplasti delle cellule eucarioti. Il fotosistema II assume elettroni dall'acqua producendo ossigeno molecolare. Dopo l'attivazione da parte della luce, questi elettroni vengono ceduti al foto sistema I tramite la catena fosforilante di trasportatori per poter essere utilizzati nelle riduzioni biosintetiche che, in tal modo, ottengono gli elettroni necessari interamente dall'acqua. Come negli organismi chemotrofi, i sistemi solubili associati ai tioesteri sono necessariamente coinvolti nelle reazioni bio sintetiche riduttive di tutti i fototrofi, non perché gli elettroni attivati dalla luce siano portati a livelli di energia non sufficientemente alti, ma perché non esiste un'altra via catalitica per la riduzione dei componenti ai livelli energetici più alti.
Esiste un'eccezione, di minore importanza ma forse ricca di significato per la chimica prebiotica, alla regola che gli organismi viventi sono universalmente dipendenti, per il loro fabbisogno energetico, da trasferimenti elettronici verso livelli energetici più bassi sostenuti fotochimicamente o chimicamente. Il piccolo gruppo degli alobatteri utilizza l'energia luminosa per generare una forza motrice protonica (o ionica), e quindi ATP, direttamente, senza la partecipazione di elettroni. Invece di una clorofilla essi utilizzano una rodopsina come fotocatalizzatore e un carotenoide come cromoforo (Oesterhelt e Tittor, 1989).
ATP, l'agente condensante universale
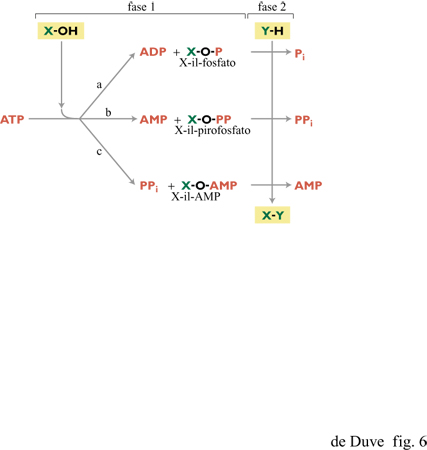
La scissione idrolitica dell'ATP in ADP e Pi, o AMP e pirofosfato inorganico, sostiene la gran parte delle reazioni di condensazione con disidratazione, poiché in esse il trasferimento di energia è assicurato dal trasferimento sequenziale di gruppi chimici (fig. 6).
Una parte della molecola di ATP, di solito un gruppo fosforile o un gruppo adenilico (il radicale dell'AMP), raramente un gruppo pirofosforile, viene trasferita a un precursore bio sintetico che è, a sua volta, trasferito sotto forma di gruppo attivato (per es., gruppo acilico da un acido o gruppo glicosilico da uno zucchero) al secondo substrato della reazione di sintesi. Questo secondo trasferimento avviene direttamente oppure tramite uno o più trasportatori di gruppi. Talvolta l'ATP è sostituito da un altro nucleoside trifosfato, come l'UTP, il CTP, o il GTP. Tutte le molecole implicate nella donazione di energia sono collegate, in questi processi, da reazioni reversibili di trasferimento fosforico, in modo che la fonte ultima di energia sia la scissione dell'ATP in ADP e Pi. Questa reazione inoltre favorisce la maggior parte delle altre forme di lavoro cellulare attraverso l'opera di specifici trasduttori. La ricostituzione di ATP da ADP e Pi rappresenta a sua volta la reazione centrale per rigenerare l'ATP utilizzato, ed è universalmente sostenuta dall'energia derivante dalla cascata di trasferimento elettronico. Sono noti pochi casi in cui è la forza motrice protonica, piuttosto che l'ATP, a permettere certe forme di lavoro, come il trasferimento elettronico inverso, il trasporto attivo di ioni o il movimento flagellare nei batteri. Il pirofosfato (PPi) è di particolare importanza per l'origine della vita poiché esso può sostituire l'ATP sia come donatore di gruppi fosforici in una varietà di reazioni che avvengono in cellule procarioti ed eucarioti sia, in alcuni batteri, come prodotto di processi di fotofosforilazione accoppiati al trasferimento elettronico tramite una forza motrice protonica (Baltscheffskye Baltscheffsky, 1992; Baltscheffsky, 1996). Un altro sostituto dell'ATP è il polifosfato inorganico (poliP), un costituente batterico ampiamente diffuso che può fungere da donatore di gruppi fosforici in alcune reazioni (Kulaev, 1979; Kornberg, 1995).
La fonte degli elettroni prebiotici
L'atmosfera riducente di Oparin-Urey
Secondo il modello di formazione della Terra proposto da H. Urey (1952), l'atmosfera primordiale era fortemente riducente e consisteva di un miscuglio di metano, idrogeno, ammoniaca e vapore acqueo. Questa ipotesi, già proposta da A.l. Oparin (1924), pioniere in questo campo, ispirò gli storici esperimenti di S.L. Miller (1953) che riuscì a ottenere una serie di amminoacidi e altre molecole organiche, con una resa sorprendente, producendo ripetute scariche elettriche in un miscuglio di gas simile all'atmosfera prebiotica postulata da Urey. Se si considera corretta l'ipotesi di Oparin-Urey, una grande quantità di gruppi riducenti ricchi di energia era a disposizione degli organismi primordiali, l'energia essendo necessaria soprattutto per l'attivazione dei diversi processi.
Si sta diffondendo (anche se non in modo unanime) l'ipotesi che ritiene l'atmosfera prebiotica molto meno riducente rispetto a quella ipotizzata da Urey e consistente, in gran parte, di diossido di carbonio e azoto molecolare, con pochissimo idrogeno molecolare (Walker, 1977; Holland, 1984; Mattioli e W ood, 1986; Kasting, 1990). Gli esperimenti condotti su tali miscugli gassosi, utilizzando scariche elettriche, hanno prodotto quantità trascurabili di composti organici (Stribling e Miller, 1987). È interessante, dunque, cercare di individuare altre possibili fonti di elettroni sulla Terra prebiotica.
Ione ferroso
Un possibile candidato per questo ruolo è lo ione ferroso, che si ritiene fosse abbondante negli oceani del periodo archeano. L'ossidazione dello ione ferro so a ione ferrico, con formazione di idrogeno molecolare, può avvenire tramite tre differenti meccanismi (Mauzerall et al., 1993). Sono possibili due reazioni fotochimiche, una a bassi valori di pH (1,0 ÷ 2,0), che richiede radiazione ultravioletta a breve lunghezza d'onda (200 ÷ 300 nm), l'altra a valori di pH più elevati, con un plateau a pH 7,5 o maggiore, e radiazione ottimale nel vicino ultravioletto (320 ÷ 370 nm). Inoltre vi è una lenta reazione di ossidazione termica, che avviene al buio, a un pH ottimale pari a 8,5. Dei due processi fotochimici, la reazione a pH neutro è, probabilmente, la più interessante per l'origine della vita. Essa utilizza un intervallo di lunghezza d'onda della luce solare nel quale la radiazione è circa venti volte più intensa rispetto a quella delle lunghezze d'onda più corte utilizzate dalla reazione acida, essendo assorbita molto meno dall' acqua (Mauzerall, l 992b). Il pH dell'oceano - stimato tra 5,0 e 6,0 - probabilmente non era ottimale, ma avrebbe comunque permesso la formazione di idrogeno a velocità apprezzabili. C'è però una difficoltà. Per far avvenire la reazione, gli ioni ferro si devono sicuramente essere coordinati con ioni ossidrile in una sorta di polimero solubile. Con il fosfato o con l'idrogenocarbonato ferroso il processo è molto più lento (Mauzerall et al., 1993). Esistono varie ragioni per ritenere che il contenuto di diossido di carbonio dell'atmosfera, e dunque la concentrazione di idrogenocarbonati nell'oceano, fosse assai più elevato (circa cento volte maggiori) nelle fasi prebiotiche rispetto a oggi (Kasting, 1993) e ciò può aver influenzato la velocità di produzione fotochimica di idrogeno. Non andrebbe trascurata la produzione termica di idrogeno associata all'ossidazione dello ione ferroso. Essa potrebbe essersi verificata, notte e giorno, nelle sorgenti idrotermali delle profondità oceaniche e sarebbe stata particolarmente intensa nelle zone di emissione di acqua calda e nelle sorgenti vulcaniche. È probabile che tali ambienti fossero più diffusi nei periodi prebiotici di quanto lo sono nell'epoca attuale. La reazione termica, inoltre, è meno influenzata dagli idrogenocarbonati rispetto alla reazione fotochimica (Mauzerall et al., 1993). Vi sono prove che la reazione termica si verifichi ancora adesso, per esempio nei basalti contenenti ferrosilicati a contatto con acque sotterranee, ove l'idrogeno prodotto serve per numerose reazioni che avvengono in organismi anaerobi chemotrofi (Stevens e McKinley, 1995). Una dimostrazione dell'ossidazione dello ione ferroso su ampia scala nei periodi prebiotici deriva dalle formazioni stratificate di rocce ricche di ferro, composte soprattutto da magnetite (un ossido misto ferroso-ferrico), e originate dai depositi formatisi in molte parti della Terra in un periodo compreso tra 1,5 e 3,8 miliardi di anni fa (Schopf, 1983). In generale si ritiene che il responsabile dell' ossidazione dello ione ferroso a ione ferrico sia stato l'ossigeno prodotto fotosinteticamente, e si presume che ciò abbia portato alla formazione delle stratificazioni di rocce ferrose. Tuttavia, evidenze geochimiche indicano che il contenuto di ossigeno nell'atmosfera è cominciato ad aumentare solo 2,0 miliardi di anni fa. Come spiegazione alternativa, P.S. Braterman e collaboratori (1983) hanno suggerito che l'ossidazione fotochimica dello ione ferro so possa essere stata responsabile della deposizione delle suddette formazioni rocciose. Più recentemente, tracce microfossili scoperte da Schopf (1993) hanno fornito l'indicazione che i cianobatteri potrebbero essere stati presenti sulla Terra 3,5 miliardi di anni fa, riproponendo così il possibile ruolo svolto dall'ossigeno prodotto foto sinteticamente nella formazione delle stratificazioni. Si può assumere che lo ione ferroso abbia agito efficientemente come reagente primario per l'utilizzazione dell'ossigeno e che quest'ultimo sia aumentato significativamente neII'atmosfera solo dopo che lo ione ferro so disponibile era stato saturato. È possibile anche che i cianobatteri che hanno lasciato tracce fossili non avessero ancora sviluppato i processi fototrofici in grado di produrre ossigeno. Evidentemente, l'ossidazione da parte dell'ossigeno, così come i processi termici e fotochimici di produzione di idrogeno, potrebbero aver contribuito in modo cooperativo alla deposizione degli ossidi che hanno dato origine alle formazioni stratificate di rocce ferrose.
Contrariamente a quanto talvolta si ritiene (de Duve, 1991), nell'ossidazione foto chimica dello ione ferroso la luce ultravioletta svolgerebbe un ruolo essenzialmente catalitico piuttosto che energetico. Il fatto che la reazione termica abbia luogo spontaneamente indica che il processo è intrinsecamente esoergonico nelle condizioni sperimentali utilizzate. Ciò è sorprendente, perché la differenza di potenziale standard corretta a pH 7,0 tra le coppie Fe²+/Fé+ e H₂/ H+ è dell'ordine di 1200 mV (Thauer et al., 1977), il che corrisponde a una variazione di energia libera di + 114,2 kJ per equivalente di elettroni trasferiti dallo ione ferroso ai protoni. Secondo D. Mauzerall (1992b), la maggiore energia del legame tra Fe³+ e OH- rispetto a quello tra Fe²+ e OH- (62,8 kJ/mol), e la minore solubilità dell'idrossido ferrico rispetto all'idrossido ferroso (di circa 15 ordini di grandezza) sono fattori ampiamente sufficienti a far divenire la reazione fortemente esoergonica, considerando anche l'elevata pressione parziale dell'idrogeno.
Qualunque sia stato il contributo relativo dei processi fotochimici e termici, i dati geochimici e sperimentali fanno ritenere che gli immensi depositi di ione ferroso dell'Archeano abbiano alimentato una costante produzione di idrogeno che sarebbe persistita per due miliardi di anni. Alla luce delle attuali conoscenze, rimane aperto il problema di stabilire in quale misura la vita nascente abbia ottenuto un'effettiva disponibilità di equivalenti riducenti da questo tipo di produzione. Al momento, i tentativi di dimostrare una riduzione del diossido di carbonio o del formiato a formaldeide a spese dell'ossidazione fotochimica dello ione ferroso, a pH quasi neutro, non hanno avuto successo (Mauzerall et al., 1993). Perciò, il principale beneficio che la vita nascente potrebbe aver avuto da questa reazione sarebbe stata la produzione di idrogeno molecolare. In questo caso, come in tutte le congetture riguardanti la composizione dell'atmosfera prebiotica, una questione cruciale, e tuttora dibattuta, riguarda il livello di idrogeno molecolare effettivamente presente nell' atmosfera, data la sua continua fuga verso lo spazio esterno.
Il sistema solfuro ferroso-solfuro di idrogeno
Un meccanismo alternativo per la produzione di equivalenti riducenti, prima della nascita della vita, che include anch'esso lo ione ferro so ma non come donatore di elettroni, è stato proposto da G. Wächtershäuser (1988b). In questo processo, il solfuro ferro so (FeS) reagisce col solfuro di idrogeno (H₂S) per formare disolfuro ferroso (FeS2), costituente altamente insolubile del minerale pirite. Inoltre, esso fornisce gli equivalenti riducenti a potenziale redox sufficientemente basso (-620 m V in condizioni standard: pH 7,0, temperatura 25°C) in grado di sostenere gran parte delle riduzioni biosintetiche. La produzione di idrogeno molecolare tramite questo processo è stata realmente osservata (Drobner et al., 1990). Vi è anche la prova che questo meccanismo possa favorire la riduzione del nitrato e di numerosi composti organici (Blochl et al., 1992; Keller et al., 1995), così come certe amminazioni riduttive (Hafenbradl et al., 1995) e reazioni di formazione di gruppi tiolici (Kaschke et al., 1994; Keller et al., 1995; Heinen e Lauwers, 1996), ma non la formazione di amminoacidi, purine e pirimidine da diossido di carbonio e ammoniaca (Keefe et al., 1995a). Tuttavia, le condizioni in cui sono stati ottenuti risultati positivi variano fortemente, e i meccanismi delle reazioni non sono affatto chiari. Quali che siano questi meccanismi, un grande merito della proposta di Wächtershäuser è stato quello di aver indirizzato l'attenzione sull'importanza dello zolfo nella chimica prebiotica, come si vedrà nel seguito.
Composti organici terrestri ed extraterrestri
In quale misura le stime del potere riducente nell' ambiente prebiotico debbano essere riviste alla luce delle nuove scoperte è una decisione da lasciare agli esperti. Vanno anche valutati possibili contributi di molecole come la formaldeide o il cianuro di idrogeno, formatisi foto chimicamente o in altro modo nell'atmosfera prebiotica. Qualunque sia il risultato di questi modelli, vi è un motivo fondato per credere che i risultati dell' esperimento di Miller siano significativi al fine della comprensione dell'origine della vita. Attualmente si sa dall'analisi spettroscopica dello spazio interstellare (Green, 1981; Hollenbach e Thronson, 1987), da quella delle comete realizzata con varie metodiche, incluse quelle utilizzate dalle sonde spaziali (Allen e Wickramasinghe, 1987; Huebner, 1987; Mitchell et al., 1987), e da quella delle meteoriti, che le molecole organiche sono ampiamente distribuite nel cosmo (vedi anche il saggio di P. Thaddeus, Le molecole organiche nel gas interstellare). I risultati ottenuti dalle meteoriti sono particolarmente sorprendenti. È stato trovato che la meteorite di Murchison conteneva gli stessi amminoacidi, all'incirca nelle stesse proporzioni, ottenuti da Miller nel suo esperimento con le scariche elettriche (Miller, 1987).
Queste scoperte hanno suggerito la possibilità alternativa che le reazioni prebiotiche, che hanno portato alla formazione dei primi costituenti della materia vivente, siano avvenute non sulla Terra ma su comete e asteroidi e che i loro prodotti siano stati portati sulla Terra da questi corpi celesti nella fase di sviluppo finale del pianeta (Chyba e Sagan, 1992; Delsemme, 1992). Quali che siano stati la sede delle reazioni (terrestre, extraterrestre o entrambe), i loro meccanismi e le fonti di elettroni e di energia su cui si sono basate, è verosimile che la Terra prebiotica fosse abbondantemente fornita di amminoacidi e di altre molecole organiche. Sembra ragionevole supporre che la vita abbia avuto origine da queste molecole e, dunque, sia iniziata in maniera eterotrofica. Tuttavia questa ipotesi non è affatto accettata all'unanimità, giacché molti autori dubitano che le molecole possano aver raggiunto una concentrazione locale sufficientemente alta da essere coinvolte in processi biogenici. Anche se così fosse, appare evidente che la vita deve aver sviluppato l'autotrofia prima che il rifornimento di composti organici prebiotici si esaurisse. Tale questione verrà esaminata più oltre.
Agenti condensanti prebiotici
Pirofosfati e polifosfati
A causa della sofisticata complessità della molecola di ATP, essa stessa prodotto di quattro reazioni di condensazione con eliminazione d'acqua, è assai improbabile che questo trasportatore universale dell' energia associata a gruppi chimici agisse come tale già nelle fasi prebiotiche. Tuttavia il pirofosfato (PPi) che, come precedentemente ricordato, può sostituire l'ATP in numerosi processi biologici, è un possibile candidato per questa funzione (Baltscheffsky e Baltscheffsky, 1992; Baltscheffsky, 1996). Lo stesso vale per il polifosfato (poli-P), un polimero costituito da molecole di fosfato unite da legami pirofosforici, che è, come già detto, un componente molto comune nei batteri, ove è in grado di scambiare reversibilmente gruppi fosforici con l'ATP (Kulaev, 1979; Kornberg, 1995).
La notevole abbondanza di fosfati in costituenti biologici chiave, come acidi nucleici e fosfolipidi, e nei metaboliti intermedi, suggerisce un importante ruolo prebiotico di PPi e poli-P. Il fosfato è uno dei principali componenti per la costruzione degli organismi viventi e la sua disponibilità sotto forma di gruppi fosforile attivati avrebbe notevolmente facilitato la sua incorporazione nei composti organici. Di conseguenza, vi sono stati molti tentativi di riprodurre in laboratorio i possibili meccanismi prebiotici per la condensazione del Pi in PPi e altri pirofosfati, o per la sua associazione con sostanze organiche. Secondo A.D. Keefe e S.L. Miller (1995), alcuni di questi meccanismi potrebbero essere classificati come prebiotici se non fosse per la concentrazione di Pi richiesta (almeno millimolare), molto più elevata rispetto a quelle che si presume fossero presenti. Oggi, in natura, il fosfato è incorporato soprattutto nella forma altamente insolubile del minerale apatite, Ca5[F,Cl,OH(PO4)3]. La concentrazione di Pi libero negli oceani e nelle acque dolci è molto bassa, dell' ordine di 3 flM o inferiore, al punto che spesso limita la velocità di proliferazione degli organismi viventi. Sulla base di queste e altre considerazioni, Keefe e Miller hanno giudicato assai improbabile la disponibilità prebiotica di PPi e poli-P in quantità adeguate e hanno concluso che le prime forme di vita probabilmente non sono dipese dal legame pirofosforico come fonte di energia. Questi autori si spingono fino al punto di suggerire che i materiali prebiotici non comprendessero alcun composto contenente fosfato. Bisogna notare, tuttavia, che le argomentazioni sulla concentrazione del Pi vanno estese a tutti i componenti del brodo primordiale. Come è stato puntualizzato (de Duve, 1991), la concentrazione prebiotica di Pi potrebbe essere stata più elevata di quella attuale, se la vita si fosse originata in un mezzo acido. Tuttavia in questo caso la sensibilità del legame pirofosforico nei confronti dell'idrolisi acida avrebbe di molto ridotto il ruolo del PPi e del poli-P come fornitori di energia prebiotica, a meno che questi fragili composti non venissero utilizzati con grande efficienza. Un'altra obiezione contro l'ipotesi di un ruolo determinante da parte del PPi e del poli-P nel mondo prebiotico è la rarità di questi composti nel mondo minerale. Il PPi è stato trovato solo in un singolo campione di rocce (Rouse et al., 1988). Comunque, piccole concentrazioni di PPi e tri-poli-P, che si ritiene derivino dall'idrolisi di condensati termici magmatici, sono stati recentemente scoperti in una fumarola giapponese da Y. Yamagata e collaboratori (1991), e ciò suggerisce che i pirofosfati potrebbero essere stati più abbondanti nei periodi prebiotici, quando l'attività vulcanica era maggiore rispetto a oggi. Successivi esperimenti di G. Arrhenius e collaboratori hanno gettato nuova luce su questi problemi (Arrhenius et al., 1993; Gedulin e Arrhenius, 1994). Analizzando criticamente precedenti studi, e basandosi anche su alcune loro scoperte, questi ricercatori hanno posto nuovamente in primo piano il fatto che la geochimica del fosfato deve essere stata molto differente nei periodi prebiotici rispetto a oggi. In particolare, essi hanno proposto che le condizioni prebiotiche avrebbero favorito la formazione di sedimenti contenenti fosfati protonati (contrariamente all'apatite, che non è protonata) in grado di condensare rapidamente a PPi e poli-P a catena più lunga, se riscaldati alla temperatura di almeno 250°C. Riguardo all'utilizzazione di tali prodotti di condensazione nelle reazioni di fosforilazione prebiotiche, gli autori attribuiscono un ruolo chiave ai minerali stratificati in cui la presenza di ioni metallici trivalenti vicino a ioni bivalenti crea cariche positive nette. Utilizzando la idrotalcite (idrossido di magnesio e alluminio) come composto rappresentativo di questa classe, essi hanno mostrato che tali minerali sono in grado di assorbire i composti fosforici e altri anioni da soluzioni molto diluite e di concentrarli a livelli di sovrasaturazione negli spazi acquosi che separano gli strati minerali. In tal modo, i minerali sono in grado di catalizzare reazioni come la condensazione aldolica della glicolaldeide fosfato a tetrosodifosfati ed esosotrifosfati (Pitsch et al., 1995), o la fosforilazione del glicolato per mezzo del trimetafosfato (Kolb et al., 1997).
Tioesteri
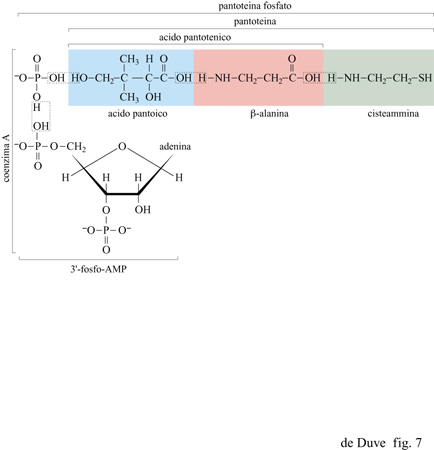
La biochimica degli organismi viventi attuali suggerisce, come possibili agenti condensanti prebiotici, un secondo tipo di composti: i tioesteri (Racker, 1965; 1976; Lipmann, 1971; Hartman, 1975; de Duve, 1991). Con un'importante eccezione (quella della sintesi proteica, in cui gli esteri del tRNA adempiono a questa funzione), i tioesteri sono i donatori immediati di gruppi acilici attivati nelle biosintesi. Essi hanno un ruolo chiave nella sintesi dei gliceridi e di altri esteri, di una vasta gamma di peptidi batterici, degli acidi grassi, dell'ampia famiglia degli steroli e dei terpeni formati dal mevalonato, delle porfirine animali (tramite la via del o-amminolevulinato), del citrato nel ciclo degli acidi tricarbossilici e del citrato e del malato nella conversione dei grassi in carboidrati attraverso il ciclo del gliossalato. In tutte queste reazioni, il trasportatore tiolico è la pantoteina fosfato, associata a una proteina enzimatica (sintesi di acidi grassi e peptidi) oppure al 3'-fosfo-AMP nel coenzima A (fig. 7).
L'energia libera di idrolisi (potenziale di gruppo) del legame tioestere in condizioni fisiologiche è equivalente a quella dei legami pirofosforici dell'ATP. l due tipi di legame sono interconvertibili reversibilmente dato che il legame acilfosfato è energeticamente equivalente. Sono noti due differenti tipi di queste reazioni, a seconda di quale dei due legami pirofosforici dell'ATP sia coinvolto:
ATP + RCOOH ⇄ ADP + RCOP
RCOP + R'SH ⇄ R'SCOR + Pi [1]
oppure
ATP + RCOOH ⇄ PPi + RCOAMP
RCOAMP + R'SH ⇄ R'SCOR + AMP. [2]
Si può notare come queste due reazioni corrispondano alla prima e alla terza modalità di trasferimento sequenziale di gruppi illustrato nella figura 6, in cui XOH è rappresentato da RCOOH e YH da R'SH. Un esempio della reazione [l] è rappresentato in figura 2 dalla sequenza (3 )-(2), con l'acido 3-fosfoglicerico come RCOOH e un enzima contenente un gruppo tiolico come R'SH. L'abbondanza di acidi organici tra i possibili costituenti primari della vita, e la possibile produzione di tioli in un contesto vulcanico ricco di solfuro di idrogeno, suggeriscono un significativo coinvolgimento dei tioesteri nella chimica prebiotica. È stata già menzionata la formazione rapida di tioli, in relazione al sistema FeS/H₂S di Wächtershäuser (Kaschke et al., 1994; Keller et al., 1995). Particolarmente rilevanti sono i risultati ottenuti nel laboratorio di Miller, che indicano che i tre costituenti della pantoteina (acido pantoico, β-alanina e cisteammina, si veda la figura 7) si formano rapidamente in condizioni semplici e si assemblano correttamente in seguito a semplice concentrazione per evaporazione (Keefe et al., 1995b). Rimane comunque argomento dibattuto se la Terra primordiale potesse offrire condizioni che permettessero tale processo. T. Wieland e W. Schiifer (1951; 1952) hanno mostrato che i tioesteri degli amminoacidi condensano prontamente in peptidi in soluzione acquosa. Se una reazione del genere, che non richiede catalizzatori, fosse avvenuta nei periodi prebiotici, nei prodotti risultanti sarebbero stati inclusi numerosi catalizzatori di tipo enzimatico; questi potrebbero aver avuto un ruolo basilare nelle vie biochimiche prebiotiche che hanno prodotto il cosiddetto mondo a RNA e lo avrebbero sostenuto per tutto il periodo di evoluzione verso il mondo a RNA-proteine (de Duve, 1991). Un'altra importante funzione prebiotica dei tioesteri sarebbe stata quella di permettere gli accoppiamenti tra energia associata a elettroni e energia associata a gruppi chimici (come si discuterà più oltre). La produzione di tioesteri senza l'ausilio dell'energia associata al fosfato si presenta, tuttavia, come un problema difficile da risolvere. In soluzione acquosa, a 25°C e a pH neutro, possono coesistere solo tracce di tioestere all'equilibrio con l'acido libero e il tiolo corrispondenti. In accordo con i dati termodinamici di W.P. Jencks e M. Gilchrist (1964), anche con concentrazioni molari di acido e tiolo, la concentrazione di tioestere all'equilibrio sarebbe solo 3 ÷ 5 μM; con acido e tiolo 0,01 M sarebbe 10.000 volte più bassa. Ci si può attendere un incremento di 500 volte a 100 °C e a pH 2,0 (de Duve, 1991). La variazione di potenziale chimico che ne risulta (circa 15,9 kJ/mol), assumendo un trasferimento veloce a basse temperature e a pH neutro, sarebbe tuttavia ancora troppo bassa perché il tioestere possa espletare una funzione energetica. Quindi, qualche altro tipo di concentrazione selettiva sarebbe ancora necessario. La sintesi di tioesteri in fase vapore o in condizioni di progressiva evaporazione del solvente non è stata ancora studiata. Un meccanismo plausibile sarebbe la sintesi ossidativa (v. oltre). Quale che sia (pirofosfato o tioestere) il gruppo re attivo apparso per primo (assumendo che essi non fossero presenti simultaneamente), una variante prebiotica della reazione [l], col PPi al posto dell'ATP, potrebbe aver assicurato la formazione dell'uno a spese dell'altro:
PPi + RCOOH ⇄ Pi + RCOP
RCOP + R'SH ⇄ R'SCOR + Pi [3]
A.L. Weber (1981; 1982) ha mostrato che tale processo può verificarsi spontaneamente in assenza di catalizzatori, almeno nella direzione inversa. Vi è una barriera termodinamica per il primo passaggio da sinistra a destra, ma non è insormontabile. In alternativa, la sostituzione del PPi con il poli-P renderebbe la reazione termodinamicamente più favorita.
La comparsa dell'ATP
Come proposto nel mio modello del mondo dei tioesteri (de Duve, 1991; 1995b), la chimica prebiotica, sostenuta dai due agenti condensanti e probabilmente catalizzata da peptidi e da altre macromolecole derivate dai tioesteri, potrebbe ragionevolmente essersi sviluppata fino allo stadio di formazione dell'AMP e di altri nucleosidi monofosfati. L'inverso della reazione [2] potrebbe poi aver condotto alla prima sintesi di ATP e, indirettamente, di altri nucleotidi trifosfati:
R'SCOR + AMP ⇄ RCOAMP + R'SH
RCOAMP + PPi ⇄ ATP + RCOOH. [4]
L'ATP potrebbe essere entrato nel proto-metabolismo in questo modo, sostituendo progressivamente il PPi come trasportatore di energia associata al fosfato. Altri nucleosidi trifosfati, che includono GTP, CTP e UTP, potrebbero avere fatto la loro comparsa in modo simile all'ATP. Per inaugurare il mondo a RNA era necessario soltanto che queste molecole iniziassero ad assemblarsi con rilascio di PPi. Quest'evento, tuttavia, difficilmente coincise con la fine del primo proto-metabolismo il quale, tranne che per la possibile partecipazione dei ribozimi, dovette ancora sostenere il mondo a RNA per tutto il lungo periodo necessario allo sviluppo progressivo della replicazione dell 'RNA, della sintesi proteica, della traduzione e del codice genetico, e infine guidare la nascita, a una a una, delle proteine enzimatiche codificate dall'RNA, che hanno costituito la premessa del metabolismo attuale (de Duve, 1991; 1993; 1995b).
Meccanismi prebiotici di accoppiamento
Accoppiamento da parte dei tioesteri
Escludendo la presenza di meccanismi che non hanno lasciato tracce nella vita attuale, il primo accoppiamento tra energia associata a elettroni e energia associata a gruppi chimici deve essere stato a livello di substrato o a livello di trasportatore. In termini di requisiti chimici e strutturali, il primo tipo ha una maggiore probabilità di avvenire spontaneamente in condizioni prebiotiche, e in particolare nel 'mondo dei tioesteri' (de Duve, 1991). Tutti i componenti necessari sarebbero stati presenti e le reazioni potrebbero essere avvenute interamente in soluzione. Inoltre, nella vita attuale, la fosforilazione a livello di substrato prevale nettamente su quella a livello di trasportatore. Essa è stata trovata in tutti gli organismi senza eccezioni, e include gli unici sistemi conosciuti che operano a un elevato livello energetico (basso potenziale redox), necessario per le reazioni bio sintetiche riduttive (si vedano le figure da 1 a 5). Differenti modelli prebiotici sono possibili per questo tipo di meccanismo.
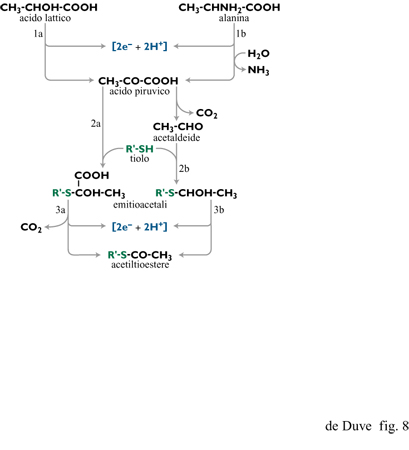
Cominciando, per esempio, con l'acido lattico o l'alanina (entrambi importanti prodotti negli esperimenti di simulazione di Miller) si può rapidamente costruire un modello ossidativo, basato sulle reazioni chiave che avvengono nel metabolismo degli organismi attuali (fig. 8), che porta prima all'acido piruvico e da questo a un acetiltioestere e diossido di carbonio passando per un addotto emitioacetalico di un tiolo con l'acido piruvico oppure con il suo prodotto di decarbossilazione, l' acetaldeide (de Duve, 1991). Il tioestere potrebbe poi essere un reagente chiave per la formazione di PPi tramite la reazione [3] operante in senso inverso.
Un'altra possibile reazione viene suggerita dal passaggio centrale, che immagazzina energia, della via glicolitica, ovvero l' ossidazione, in presenza di un tiolo, della gliceraldeide (o del suo estere 3-fosfato) a (fosfo)gliceriltioestere, a spese del quale avverrebbe la formazione di PPi tramite il (fosfo) glicerilfosfato (vedi la figura 2). Come mostrato da Weber (1984; 1987), una tale reazione può verificarsi in condizioni semplici. La formazione prebiotica di gliceraldeide o del suo fosfato crea comunque un problema, così come la formazione di altri zuccheri e, in particolare, del ribosio. La discussione di questo problema va, comunque, al di là degli scopi di questa rassegna (si vedano, per es., Shapiro, 1988; Larralde et al., 1995; Pitsch et al., 1995).
Oltre ai substrati disponibili, le reazioni considerate avrebbero avuto bisogno di un appropriato accettore di elettroni e, forse, di un catalizzatore efficace. Considerando il basso potenziale redox a cui gli elettroni dovrebbero essere trasferiti, è presumibile che accettori di elettroni termodinamicamente compatibili non mancassero nella Terra prebiotica, anche se l'ossigeno potrebbe essere stato assente. È stato suggerito il ruolo dello ione ferrico come parte di un ciclo del ferro favorito dalla radiazione ultravioletta (de Duve, 1991), ma ciò avrebbe richiesto la separazione dallo ione ferroso. Numerosi composti dello zolfo o dell'azoto potrebbero aver svolto questa funzione. Come catalizzatore, si è tentati di pensare ad alcuni raggruppamenti ferro-zolfo progenitori delle proteine ferro-zolfo, che sono probabilmente i più antichi catalizzatori di trasferimento elettronico ancora presenti negli organismi attuali (Cammack, 1983). Va considerata anche la possibile partecipazione di altri metalli, come rame, manganese, nichel o molibdeno. In alcune fasi successive potrebbe essere stato coinvolto come trasportatore di elettroni anche un derivato della nicotinammide.
Analoghi prebiotici delle fosforilazioni a livello di substrato potrebbero aver dato inizio al 'mondo dei tioesteri' permettendo la loro sintesi e, quindi, la sintesi dei pirofosfati, e rifornendo così le vie sintetiche prebiotiche a spese dei processi esoergonici di trasferimento elettronico. Essendo reversibili, queste reazioni potrebbero anche aver avuto la funzione di favorire reazioni critiche di riduzione, richiedenti energia, a spese della scissione di tioesteri o pirofosfati, provenienti da altre fonti. Come negli organismi attuali, le reazioni potrebbero essere avvenute in una direzione o nell' altra, a seconda delle condizioni. Il loro principale vantaggio è che sarebbero potute avvenire in soluzione, con un minimo aiuto da parte di catalizzatori e di cofattori.
Accoppiamento da parte della forza motrice protonica
A un certo punto devono essere comparsi sistemi dipendenti dalla forza motrice protonica; la vita attuale fornisce pochi suggerimenti sulle modalità attraverso cui questa evoluzione cruciale possa essersi verificata. l requisiti funzionali minimi per sistemi come quelli attualmente presenti appaiono piuttosto complessi per la chimica prebiotica. Per prima cosa, è necessaria una membrana impermeabile ai protoni in grado di contenere i catalizzatori coinvolti. Le valutazioni su quale sia stato il primo momento in cui la vita nascente iniziò a organizzarsi in un gran numero di protocellule delimitate da membrane variano da scenari (Deamer, 1986; Harold, 1986; Morowitz et al., 1988) che vedono le membrane essersi evolute in fasi primitive (membranes first) alle teorie (Eigen et al., 1981; de Duve, 1991) che postulano una loro comparsa più tarda (membranes as late as possible), con un limite fissato al momento in cui, in uno stadio iniziale nel mondo a RNA, l'evoluzione è dipesa dalla competizione darwiniana tra protocellule (de Duve, 1995a; 1995b). Anche la natura chimica delle membrane è una questione dibattuta ma sembra verosimile che composti di tipo fosfolipidico (o, forse, proteolipidico) siano stati necessari per soddisfare i requisiti strutturali e di permeabilità dei sistemi in grado di produrre forze motrici protoniche. La formazione prebiotica di membrane è stata trattata da D.W. Deamer (1986).
Una volta presente una membrana con le caratteristiche richieste, sarebbero dovute comparire, inserite in essa con orientamento simile, due pompe protoniche, una funzionante grazie all'idrolisi di PPi (o ATP), un'altra tramite il trasferimento elettronico. La mutazione di un enzima solubile che avrebbe portato alla formazione di un segmento proteico idrofobico transmembrana avrebbe potuto originare la pompa guidata dal PPi. Per ciò che riguarda la pompa elettronica, verosimilmente in qualche momento sarebbe stato coinvolto un citocromo. A questo proposito Mauzerall (1992a), riprendendo un'ipotesi postulata in origine da S. Granick (1957), che coniò il detto "la bio sintesi ricapitola la bio genesi", ha fatto notare che la via universale di sintesi delle porfrrine comprende una sequenza di intermedi ciascuno dei quali potrebbe aver svolto una sua propria funzione. Pur con una notevole eccezione (la sintesi dell'anello pirrolico, per la quale non esiste ancora un modello compatibile con le possibili condizioni prebiotiche) i diversi passaggi sono perfettamente in grado di avvenire spontaneamente in un contesto relativamente semplice.
Qualunque sia la natura delle due pompe protoniche, è improbabile che esse si siano originate simultaneamente per favorire un processo di accoppiamento. Ci si chiede, dunque, quale vantaggio evolutivo ricavassero le protocellule dalla capacità di associare la traslocazione attiva di protoni solo all'idrolisi di PPi o solo al trasferimento di elettroni. Come è stato suggerito (de Duve, 1991), la capacità di espellere attivamente protoni potrebbe aver permesso alle protocellule di adattarsi a un mezzo acido. O, viceversa, protocellule presenti in un mezzo acido che mantenessero una minore concentrazione interna di protoni sarebbero state in grado, con l'aiuto di un sistema operante all'inverso, di approfittare del potenziale protonico risultante per formare PPi o per effettuare trasferimenti elettronici inversi verso componenti a basso potenziale redox. Nel modello proposto da M.J. Russell e collaboratori (1994), che sarà trattato più avanti, si considera che una differenza di pH tra le superfici di una membrana primitiva possa aver contribuito allo sviluppo di una forza motrice protonica.
Un'altra possibilità è che le pompe protoniche fossero inizialmente inserite in una matrice di vescicole vuote, simili ai liposomi, e che funzionassero dapprima come depositi energetici temporanei, sotto forma di un potenziale protonico reversibilmente associato all'idrolisi di PPi o al trasferimento elettronico. Una volta comparsi i due tipi di pompe, le vescicole avrebbero potuto funzionare in un processo di accoppiamento. È noto, dallo studio di numerosi sistemi riprodotti artificialmente con liposomi, che tali associazioni sono in grado di funzionare (Nyrén e Baltscheffsky, 1983). Concludendo, come postulato da G. Blobel (1980), vescicole che pompano protoni potrebbero generare un involucro cellulare a doppio strato, il cui strato più interno diverrebbe la membrana plasmatica della cellula e la lamina esterna scomparirebbe, o evolverebbe nella parete esterna, tipica dei batteri gram-negativi. Se il pompaggio protonico fosse diretto verso l'interno nelle vescicole isolate, come ci si attenderebbe se queste reagissero col PPi e coi componenti redox esterni, allora in una cellula completa esso risulterebbe diretto all'esterno così come avviene nei batteri attuali.
L'acquisizione dell'autotrofia
Malgrado esistano prove a favore dell'ipotesi che sulla Terra prebiotica vi fossero grandi quantità di composti organici, i modelli di tipo eterotrofico sull'origine della vita sono stati spesso criticati, in genere basandosi sul fatto che nel brodo primordiale non si sarebbero potute raggiungere concentrazioni sufficientemente elevate dei costituenti necessari per sostenere processi biogenici (Woese, 1979; Cairns-Smith, 1982; Wächtershäuser, 1988a). In risposta a queste critiche, è stata proposta una serie di meccanismi, secondo i quali la concentrazione dei reagenti sarebbe aumentata localmente per evaporazione, congelamento, adsorbimento o imprigionamento. È comunque evidente che, alla fine, il rifornimento di composti organici si deve essere arrestato, e da quel momento devono essere comparsi meccanismi strettamente autotrofi. Non è noto quando e come ciò sia avvenuto. Tuttavia, l'autotrofia non si è ovviamente sviluppata come una risposta teleologica all'incombente scarsità di composti utilizzabili. Essa deve essersi originata con processi spontanei, che furono determinati dalle condizioni prevalenti e che, probabilmente, risalgono ai primi stati prebiotici. Sono stati considerati due tipi di meccanismi, per spiegare l'origine della autotrofia, basati uno sulla fototrofia e l'altro sulla chemotrofia.
Fototrofia primitiva
La luce solare è stata di gran lunga la più abbondante fonte di energia a disposizione nella Terra prebiotica (Miller, 1986) ed è l'unica in grado di mantenere la vita nella sua ricchezza attuale (Mauzerall, 1992a; 1992b). Comprensibilmente, è stato perciò proposto che la vita sia iniziata in forma difotobionti primitivi, vescicole lipidiche di natura indefinita, con una porfirina o altri cromofori incorporati, e in grado di utilizzare l'energia della luce solare per creare una sorta di dislivello di carica attraverso cui potessero alimentare reazioni chimiche endoergoniche (Folsome, 1979; Morowitz, 1987). La chimica di questi sistemi ipotetici è stata tuttavia abbozzata solo in termini molto generici. Lo stesso vale per il modo in cui essi possono aver generato i successivi sistemi fotochimici, dipendenti dalla clorofilla e dalla forza motrice protonica. Fotocellule minerali del tipo postulato da Granick (Granick, 1957; Mauzerall, 1992a) non si prestano a un tale tipo di evoluzione.
Tutti i sistemi attuali dipendenti da clorofille convertono l'energia dei fotoni in energia elettronica che viene utilizzata per le riduzioni bio sintetiche oppure convertita in energia associata a gruppi chimici (ATP), tramite forza motrice protonica (si veda la figura 5). Ciò suggerisce che le catene di trasferimento elettronico, con gradiente di protoni, fossero già presenti quando apparve la clorofilla. Se così fosse, è possibile che la clorofilla sia derivata da un citocromo, attraverso una modificazione della molecola di porfirina che portò, tra l'altro, all'introduzione di un atomo di magnesio nella posizione centrale della molecola, al posto di un atomo di ferro (de Duve, 1991).
Tuttavia, non è detto che la clorofilla sia stato il primo trasduttore dell'energia luminosa. Essa potrebbe essere stata preceduta da una rodopsina. La batteriorodopsina e l'alorodopsina utilizzano un semplice carotenoide (il retinale) come cromoforo, e convertono l'energia luminosa direttamente in forza motrice protonica, o ionica, senza la partecipazione di elettroni (Oesterhelt e Tittor, 1989). Questi ultimi potrebbero essere stati gli strumenti per imbrigliare questa forma di energia. Un'obiezione verso questa ipotesi è che un foto sistema dipendente da rodopsina è stato trovato solo in una piccola classe di archeobatteri (alobatteri), suggerendo che esso possa essersi originato dopo la separazione degli archeobatteri (Archaea) e degli eubatteri (Bacteria). Comunque, carotenoidi sono stati trovati anche in organismi foto sintetici dipendenti da clorofilla, ove sembrano essere funzionalmente correlati all'apparato foto sintetico (Baltscheffsky, 1969). L'evento più recente, dunque, potrebbe essere stato la comparsa della clorofilla, presumibilmente aggiuntasi nella linea evolutiva degli eubatteri a un sistema rodopsina-dipendente.
Volendo riassumere questa parte della discussione, non esiste alcun modello convincente di un sistema fotochimico che possa aver dato inizio alla vita sulla Terra. Ciò non vuoI dire che numerose reazioni fotochimiche non abbiano avuto un ruolo importante nelle prime sintesi prebiotiche. Il possibile intervento della luce nella produzione di idrogeno e di una serie di composti organici è stato ben documentato. Non sono però stati formulati modelli soddisfacenti di un trasduttore fotochimico primitivo in grado di promuovere l'instaurarsi delle successive reazioni chimiche complesse. Ciò che è noto dei sistemi attuali, anche quelli dipendenti dalla rodopsina, indica una serie di requisiti chimici e strutturali minimi che probabilmente non potevano essere soddisfatti negli stadi precoci della biogenesi. Forse l'obiezione più forte contro i fotobionti primitivi è che il loro rifornimento energetico sarebbe stato intermittente. l fototrofi attuali sopravvivono in maniera eterotrofica durante la notte grazie a una parte dei prodotti che hanno sintetizzato fototroficamente durante il giorno. Non è facile capire come i sistemi primitivi potessero evitare questa necessità, il che rende verosimile il fatto che l'eterotrofia abbia preceduto la fototrofia. Se l' autotrofia si è originata per prima, allora è più probabile che sia stata di tipo chemotrofo.
Chemotrofia primitiva
L'assertore più chiaro e convinto dell' origine chemotrofica della vita è Wiichtershiiuser, che ha elaborato la sua teoria in una serie di pubblicazioni teoriche (Wächtershäuser, 1988a; 1988b; 1990; 1992; 1994) e sperimentali (Drobner et al., 1990; Blöchl et al., 1992; Keller et al., 1994). Un valido riassunto di questa teoria è stato realizzato da B.E.H. Maden (1995). Il punto centrale è che la vita sarebbe iniziata sotto forma di uno strato monomolecolare di composti anionici, interagenti tra loro e legati elettrostaticamente alla superficie carica positivamente di cristalli di pirite (FeS2)' Cominciando con semplici substrati minerali, come l'idrogenocarbonato e il nitrato provenienti dalle acque (calde) circostanti, questo sistema si sarebbe evoluto autocataliticamente in una rete chimica, divenuta progressivamente sempre più complessa, tramite vie riduttive che sarebbero state simili, anche se funzionanti in senso inverso, alle principali vie metaboliche, come il ciclo degli acidi tricarbossilici. La principale fonte di energia per questa evoluzione sarebbe stata costituita dagli equivalenti riducenti derivanti dalla conversione del solfuro ferroso e del solfuro di idrogeno in disolfuro ferroso, il costituente della pirite (vedi sopra). Si ritiene anche che le differenze tra i legami alla superficie della pirite abbiano contribuito all'utilizzazione dell' energia, per esempio per reazioni di condensazione, poiché qualsiasi molecola non legata o debolmente legata sarebbe stata rilasciata nell' acqua circostante e irrimediabilmente perduta. Dato il ruolo preminente attribuito allo zolfo e al ferro nell'origine della vita, il modello di Wächtershäuser si accorda con numerosi modelli eterotrofici (de Duve, 1991). La sua presunta relazione col metabolismo attuale, in virtù di ciò che l'autore chiama retrodiction, è conforme alla regola di congruenza (vedi sopra). Altri aspetti del modello, tuttavia, sono stati oggetto di critica (de Duve e Miller, 1991) e confutazione (Wächtershäuser, 1994).
Non è possibile effettuare una discussione approfondita dei punti di questo argomento nell'ambito di questa breve rassegna. Come già detto, l'ossidazione del solfuro a disolfuro, che genera la pirite, reazione ipotizzata da Wiichtershiiuser come fonte efficace di equivalenti riducenti per le riduzioni prebiotiche, è un meccanismo che è in grado effettivamente di permettere la produzione di idrogeno molecolare (Drobner et al., 1990) e di numerosi processi riduttivi (Blöchl et al., 1992; Kaschke et al., 1994; Hafenbradl et al., 1995; Keller et al., 1995). Esiste anche la dimostrazione, importante per un possibile processo di accoppiamento, che la reazione possa favorire la formazione di ammidi (Keller et al., 1994), ma non è chiaro il meccanismo di queste reazioni. È rimarchevole che questi risultati siano stati tutti ottenuti in un mezzo acquoso o in solventi organici (Kaschke et al., 1994), con polvere di FeS come unico solido. Sino a ora, nessuna delle reazioni che presumibilmente avvengono in uno strato monomolecolare bidimensionale è stata riprodotta nelle condizioni di un possibile modello prebiotico.
Un altro modello, che coinvolge anch'esso i solfuri di ferro, ma che include altri metalli di origine idrotermale come nichel e molibdeno, è stato proposto da Russel e collaboratori (1994). In sostanza, esso prevede che la vita si sia sviluppata sul fondo oceanico, all'interfaccia tra sorgenti d'acqua alcaline, ricche di solfuro e altamente riducenti, e acque oceaniche moderatamente ossidanti, ricche di ferro e acide. La pellicola di monosolfuro di ferro, che si forma spontaneamente in questa interfaccia, si accrescerebbe sotto forma di bolle (probotrioidi) da cui potrebbero derivare le bolle (botrioidi) di pirite (disolfuro di ferro) trovate in certi depositi minerali. Nel modello si assume che i probotrioidi accumulino composti organici, formatisi al loro interno da idrogeno e ammoniaca di provenienza idrotermale e da carbonato e fosfato provenienti dall'oceano. Anche le membrane limitanti si arricchirebbero di composti organici, si accrescerebbero e si espanderebbero. Alla fine si creerebbe un accumulo organico, che coinvolgerebbe gran parte delle membrane, e la conseguente miniaturizzazione porterebbe dalla iniziale 'camera di coltura' alla 'protocellula'. Reazioni di trasferimento elettronico, catalizzate da complessi ferro(nichel/lmolibdeno)-zolfo, precursori delle proteine ferro-zolfo, si verificherebbero attraverso le membrane grazie alla differenza di potenziale redox, mentre la differenza di pH produrrebbe la primitiva forza motrice protonica giungendo, alla fine, all'accoppiamento tra i due fenomeni. Il modello, sostenuto da numerosi dati sperimentali, include alcune caratteristiche del modello di Wächtershäuser, ma è chiaramente tridimensionale e si basa, almeno parzialmente, su reazioni che avvengono in soluzione acquosa.
l modelli proposti, pur interessanti, lasciano insolute due questioni rilevanti. Per prima cosa, anche se sono state identificate molte fonti potenziali di idrogeno molecolare, non è ancora stata osservata riduzione di diossido di carbonio associata a questi sistemi. La barriera non è di tipo termodinamico, dato che si conoscono batteri capaci di crescere in condizioni anaerobiche in un mezzo totalmente minerale rifornito solo di idrogeno (Stevens e McKinley, 1995). Dunque si tratterebbe soltanto di trovare l'appropriato catalizzatore. Un'altra, più grave difficoltà riguarda le modalità con cui si sono originate le prime pompe protoniche, in particolare quelle alimentate dal trasferimento elettronico. Non sono stati ancora formulati modelli di sistemi primitivi di questo tipo.
Se la vera chemotrofia avesse dovuto attendere lo sviluppo di catene respiratorie altamente complesse, allora la partecipazione di meccanismi di accoppiamento più semplici, come quelli a livello di substrato, ma che includessero solo reagenti minerali, sarebbe stata utile per la vita nascente, fungendo anche da tramite tra l'eterotrofia prebiotica e la chemotrofia del tipo attuale. Una reazione del genere è nota: si tratta dell'ossidazione enzimatica del solfito a solfato che si verifica tramite l'adenilsolfato, un intermedio ad alta energia che può reagire con il PPi, per formare ATP e solfato (Michaels et al., 1971). L'enzima che catalizza questa reazione è una proteina ferro-zolfo, che utilizza il FAD come coenzlma.
La culla della vita: calda o fredda?
l due modelli chemotrofici considerati implicano un contesto idrotermale per l'origine della vita. Questo assunto si accorda con numerose ipotesi attuali (Holm, 1992) e con risultati derivanti dall'analisi comparata di sequenze geniche, i quali indicano che i più antichi organismi, nelle due linee evolutive degli archeobatteri e degli eubatteri, sono termofili (Woese, 1987). Contro l'ipotesi della 'culla calda' vi sono gli effetti negativi dell'alta temperatura sulla stabilità delle molecole organiche (Miller e Orgel, 1974; Miller e Bada, 1988; Miller e Lazcano, 1995), nonché la possibilità, da alcuni ritenuta verosimile, che gli oceani prebiotici fossero interamente coperti da ghiaccio (Bada et al., 1994). La vita, è stato suggerito, potrebbe essersi sviluppata sotto questo rifugio protettivo, ed essere stata periodicamente rilasciata grazie a impatti di meteore in grado di provocare la fusione dell'oceano ghiacciato (Bada et al., 1994). Bisogna notare che le due possibilità non si escludono a vicenda. Un'attività idrotermale potrebbe essere presente sotto una coltre di ghiaccio. Per quanto riguarda la discussione sulla instabilità al calore, la sua validità dipende dagli effetti relativi della temperatura su reazioni di sintesi e di degradazione. Senza informazioni su questo punto, non si può escludere la possibilità che la concentrazione di importanti composti allo stato stazionario non sia stata alterata dall'aumento della temperatura, o addirittura che ne sia stata favorevolmente influenzata.
Conclusioni
Da questa rapida rassegna si può tentare di trarre alcune conclusioni:
1) La luce solare può aver sostenuto i primi organismi viventi indirettamente, tramite la produzione di idrogeno e molecole organiche formatisi fotochimicamente. La fototrofia, molto probabilmente, si è sviluppata in seguito.
2) È possibile, in teoria, che la vita si sia sviluppata per via strettamente chemotrofica, ma un inizio di tipo eterotrofico sembra più probabile, date le evidenze che indicano come la Terra prebiotica fosse ampiamente fornita di composti organici di origine terrestre ed extraterrestre. La principale obiezione contro questa ipotesi è che il brodo primordiale potrebbe non aver mai raggiunto una concentrazione di reagenti sufficientemente elevata. La possibilità di una loro concentrazione per evaporazione o congelamento è stata tuttavia ammessa da alcuni autori, mentre altri ritengono che fossero coinvolti meccanismi basati sull'adsorbimento o sull'imprigionamento localizzato.
3) Se l' eterotrofia si è originata per prima, essa deve essersi sviluppata in modo da espandersi velocemente verso modalità autotrofiche, più verosimilmente a carattere chemotrofico.
4) Zolfo e ferro da un lato, e pirofosfati e polifosfati dall'altro, hanno avuto probabilmente un ruolo predominante nella bioenergetica prebiotica, così come accade in quella attuale. Un'ipotesi affascinante prevede un ruolo centrale dei tioesteri come primi gruppi capaci di collegare energia associata a elettroni e energia associata a gruppi chimici.
5) Fonti idrotermali e sorgenti vulcaniche nelle profondità marine sono i possibili ambienti nei quali, secondo numerosi autori, si è probabilmente originata la vita; altri autori rigettano questa ipotesi, in considerazione del fatto che le fragili molecole organiche primitive non avrebbero potuto resistere a lungo in tali ambienti. Il principale punto da chiarire a questo proposito riguarda il modo in cui la temperatura può aver influenzato le reazioni di sintesi, competitive rispetto a quelle di degradazione.
6) Tra i numerosi problemi che ancora sfidano la nostra immaginazione, la questione della comparsa della forza motrice protonica, come trasduttore energetico universalmente predominante, si presenta particolarmente difficile da risolvere. Ringraziamenti Desidero ringraziare Gustaf Arrhenius, Herrick e Margareta Baltscheffsky, David Mauzerall, Stanley Miller, Michael Russell, Glinther Wachtershauser e Arthur Weber per le utili informazioni, conunenti, critiche e suggerimenti forniti; ciò non implica in alcun modo l'approvazione da parte loro delle idee espresse in questo articolo. Anche Jeffrey Bada e Arthur Kornberg hanno fornito preziose informazioni.
Bibliografia citata
ALLEN, D.A., WICKRAMASINGHE, D.T. (1987) Discovery of organic grains in comet Wilson. Nature, 329, 615-616.
ARRHENIUS, G., GEDULIN, B., MOJZSIS, S. (1993) In Chemical evolution: origin of life. Proceedings of the Trieste conJerence on chemical evolution and the origin of life, 26-30 October 1992, a c. di Ponnamperuma C., Chelo-Flores, l, Hampton, VA, Deepak Publishing, pp. 25-50.
BADA, IL., BIGHAM, C., MILLER, S.L. (1994) Impact melting of frozen oceans on the early Earth: implications for the origin of life. Proc. Natl. Acad. Sci. USA 91, 1248-1250.
BALTSCHEFFSKY, H. (1996) In Origin and evolution of biological energy conversion, a c. di Baltcheffsky H., New Y ork, VCH Publishers.
BALTSCHEFFSKY, M. (1969) Arch. Biochem. Biophys. 130,646-652.
BALTSCHEFFSKY, M., BALTSCHEFFSKY, H. (1992) In Molecular mechanisms in bioenergetics, a c. di Ernster L., Amsterdam, Elsevier Science Publishers B.V., pp. 331-348.
BLOBEL, G. (1980) Proc. Natl. Acad. Sci. USA, 77, 1496-1500.
BLÖCHL, E., KELLER, M., WACHTERSHAUSER, G., STETTER, K.O. (1992) Proc. Natl. Acad. Sci. USA, 89, 8117-8120.
BRATERMAN, P.S., CAIRNS-SMITH, A.G., SLOPER, R.W. (1983) Photo-oxydation of hydrated Fe2+ - significance for banded iron formations. Nature, 303, 163-164.
BRODA, E. (1975) The evolution of the bioenergetic processes. Oxford, Pergamon Press.
CAIRNS-SMITH, A.G. (1982) Genetic takeover and the mineraI origins of life. Cambridge, Cambridge University Press.
CAMMACK, R. (1983) Chem. Scr., 21, 87-95.
CHYBA, C., McDONALD, G.D. (1995) Annu. Rev. Earth Planet. Sci., 23, 215-249.
CHYBA, C., SAGAN, C. (1992) Endogenous production, exogenous delivery and impact shock synthesis of organic molecules: an inventory for the origins oflife. Nature, 355,125-131.
DAY, W. (1984) Genesis on planet Earth: the search for life's beginning. 2a ed., New Haven, Yale University Press.
DEAMER, D.W. (1986) Orig. Life Evol., Biosp., 17, 3-25.
DEAMER, D.W., FLEISCHAKER, G.R. a c. di (1994) Origins of life: the centraI concepts. Boston, Jones & Bartlett.
DE DUVE, C.R. (1984) A guided tour of the living celI. New York, Scientific American Books, Inc.
DE DUVE, C.R. (1991) Blueprint for a celI: the nature and origin of life. Burlington, Neil Patterson Publishers, Carolina Biological Supply Company.
DE DUVE, C.R. (1993) Co-chairman's remarks: the RNA world befor and after. Gene, 135, 29-31.
DE DUVE, C.R. (1995a) Vital dust: life as a cosmic imperative. New York, Basic Books.
DE DUVE, C.R. (1995b) Am. Scient., 83, 428-437.
DE DUVE, C.R., MILLER, S.L. (1991) ProC. Natl. Acad. Sci. USA, 88, 10014-10017.
DELSEMME, A.H. (1992) Orig. Life Evol., Biosp., 21, 279-298.
DILLON, L.S. (1978) The genetic mechanism and the origin of life. New York, Plenum Press.
DROBNER, E., HUBER, H., WÄCHTERSHÄUSER, G., ROSE, D., STETTER, K.O. (1990) Pyrite formation linked with hydrogen evolution under anaerobic conditions. Nature, 346, 742-744.
EIGEN, M., GARDINER, W., SCHUSTER, P., WINKLER-OSWATITSCH, R. (1981) The origin of genetic information. Sci. Am., 244, 78-95.
FOLSOME, C.E. (1979) The origin of life: a warm little pond. San Francisco, W. H. Freeman and Company.
GEDULIN, B., ARRHENIUS, G. (1994) In Early life on Earth, Nobel symposium 84, a c. di Bengtson S., New York, Columbia University Press, pp. 91-106.
GRANICK, S. (1957) Ann. NY Acad. Sci., 69, 292-308.
GREEN, S. (1981) Annu. Rev. Phys. Chem., 32, 103-138.
HAFENBRADL, D., KELLER, M., WÄCHTERSHÄUSER, G., STETTER, K.O. (1995) Tetrahedron Letters, 36, 5179-5182.
HAROLD, F.M. (1986) The vital force: a study of bioenergetics. New York, W.H. Freeman and Company.
HARTMAN, H. (1975) Speculations on the origin and evolution of metabolismo J. Mol. Evol., 4, 359-370.
HEINEN, W., LAUWERS, A.M. (1996) Orig. Life Evol., Biosp., 26, 131-150.
HOLLAND, H.D. (1984) The chemical evolution oJthe atmosphere and oceans. Princeton, Princeton University Press.
HOLLENBACH, D.J., THRONSON, IH.A., a c. di (1987) InterstelIar processes. Proceedings of the symposium on interstelIar processes, Gran Teton National Park, July 1986. Dordrecht e Holland; Boston, D. Reidel Publishing Company.
HOLM, N.G., a c. di (1992) Marine hydrothermal systems and the origin of life. Dordrecht. Boston, Kluwer.
HUEBNER, W.F. (1987) First polymer in space identified in Comet Halley. Science, 237, 628-630.
JENCKS, W.P., GILCHRIST, M. (1964) J. Amer. Chem. Soc., 86, 4651-4654.
KASCHKE, M., RUSSELL, M.I., COLE, W.J. (1994) Orig. Life Evol. Biosp., 24, 43-56.
KASTING, lF. (1993) Earth's early atmosphere. Science, 259, 920-926.
KASTING, lF. (1990) Orig. Life Evol. Biosp., 20, 199-231.
KEEFE, AD., MILLER, S.L. (1995) J. Mol. Evol., 41, 693-702.
KEEFE, A.D., MILLER, S.L., McDONALD, G., BADA, J. (l995a) Investigation of the prebiotic synthesis of amino acids and RNA bases from CO₂ using FeS/H₂S as a reducing agent. Proc. Natl. Acad. Sci. USA, 92, 11904-11906.
KEEFE, AD., NEWTON, G.L., MILLER, S.L. (1995b) A possible prebiotic synthesis of pantetheine, a precursor to coenzyme A Nature, 373, 683-685.
KELLER, M., BLÖCHL, E., WÄCHTERSHÄUSER, G., STETTER, K.O. (1994) Formation of amide bonds without a condensation agent and implications for origin of life. Nature, 368, 836-838.
KELLER, M., HAFENBRADL, D., STETTER, K.O., TELLER, G., NAKATANI, Y., OURISSON, G. (1995) Angew. Chem., 107, 2015-2017.
KOLB, V., ZHANG, S., Xu, Y., ARRHENIUS, G. (1997) MineraI induced phosphorylation of glycolate ion - a metafor in chemical evolution. In corso di stampa.
KORNBERG, A (1995) Inorganic polyphosphate toward making a forgotten unforgettable. J. Bacteriol., 177,491-496.
KULAEV, I.S. (1979) The biochemistry of inorganic polyphosphateso Chichester, New York, John Wiley & Sons, Inc.
LARRALDE, R., ROBERTSON, M.P., MILLER, S.L. (1995) Rates of decomposition of ribose and other sugars; implications for chemical evolution. ProC. Natl. Acad. Sci. USA, 92, 8158-8160.
LIPMANN, F. (1971) Attemps to map a process evolution of peptide biosynthesis. Science, 173, 875-884.
MADEN, B.E.H. (1995), No soup for starters? Antotrophy and the origins of metabolismo Trends Biochem. Sci., 20, 337-341.
MATTIOLI, G.S., WOOD, B.I. (1986) Upper mantI e oxygen fugacity recorded by spinel lherzolites. Nature, 322, 626-628.
MAUZERALL, D. (1992a) Photosyn. Res., 33, 163-170.
MAUZERALL, D. (1992b) In Encyclopedia of Earth system science (voI. 3). San Diego, Academic Press, pp. 445-453.
MAUZERALL, D., BOROWSKA, Z., ZIELINSKI, I. (1993) Orig. Life Evol, Biosp., 23, 105-114.
MICHAELS, G.B., DAVIDSON, lT., PECK, H.D. JR. (1971) In Flavins and flavoproteins, a c. di Kamin H., Baltimore, University Park Press, pp. 555-580.
MILLER, S.L. (1953) Science, 117, 528-529.
MILLER, S.L. (1986) Chem. Scr., 26B, 5-11.
MILLER, S.L. (1987) Cold Spring Harbor Symp. Quant. Biol., 52, 17-27.
MILLER, S.L., BADA, J.L. (1988) Submarine hotsprings and the origin of life. Nature, 334, 609-611.
MILLER, S.L., LAZCANO, M. (1995) J. Mol. Evol., 41, 689-692.
MILLER, S.L., ORGEL, L.E. (1974) The origins oJlife on the Earth. Englewood Cliffs, Prentice Hall.
MITCHELL, D.L., LIN, R.P., ANDERSON, K.A., CARLSON, C.W., CURTIS, D.W., KORTH, A., REME, H., SAUVAUD, LA., D'USTON, C., MENDIS, D.A (1987) Evidence for chain molecules enriched in carbon, hydrogen and oxygen in comet Halley. Science, 237, 626-628.
MOROWITZ, H.I. (1987) Cosmic joy and local pain: musings of a mystic scientist. New York, Charles Scribner's Sons.
MOROWITZ, H.I., HEINZ, B., DEAMER, D.W. (1988) Orig. Life Evol. Biosp., 18,281-287.
NYREN, P., BALTSCHEFFSKY, M. (1983) FEBS Lett., 155, 125-130.
OESTERHELT, D., TITTOR, J. (1989) Two pumps, one principle: light-driven ion transport in halobacteria. Trends Biochem. Sci., 14, 57-61.
OPARIN, AI. (1924) The origin of life. Moscow, Moskovskij Rabocij; trad. ingl., 3a. ed. (1957), New York, Academic Press.
PITSCH, S., ESCHENMOSER, A., GEDULIN, B., HUI, S., ARRHENIUS, G. (1995) Orig. Life Evol, Biosp., 25, 297-334.
RACKER, E. (1965) Mechanisms in bioenergetics. New York, Academic Press.
RACKER, E. (1976) A new look at mechanisms in bioenergetics. New Y ork, Academic Press.
ROUSE, R.C., PEACOR, D.R., FREED, R.L. (1988) Am. MineraI., 73, 168-171.
RUSSELL, M.I., DANIEL, R.M., HALL, A.J., SHERRINGHAM, J.A. (1994) J. Mol. Evol., 39, 231-243.
SCHOPF, J.W., a c. di (1983) Earth's earliest biosphere: its origin and evolution. Princeton, Princeton University Press.
SCHOPF, J.W. (1993) Microphossils of the early Archean Apex Chert; new evidence of the antiquity of life. Science, 260, 640-646.
SHAPIRO, R. (1986) Origins, a skeptic's guide to the creation of life on Earth. New York, Summit Books.
SHAPIRO, R. (1988) Prebiotic ribose synthesis: a criticaI analysis. Orig. Life Evol. Biosp., 18, 71-85.
STEVENS, T.O., McKINLEY, J.P. (1995) Litioautotrophic microbial ecosystems in deep basalt aquifers. Science, 270, 450-454.
STRIBLING, R., MILLER, S.L. (1987) Energy yields for hydrogen cyanide and formaldehyde syntheses: the HCN and amino acid concentrations in the primitive oceano Orig. Life Evol. Biosp., 17, 261-273.
THAUER, R.K., JUNGERMANN, K., DEcKER, K. (1977) Energy conservation in chemiotrophic anaerobic bacteria. Bacteriol. Rev., 41, 100-180.
UREY, H. (1952) The planets: their origin and development. New Haven, Yale University Press.
WÄCHTERSHÄUSER, G. (l988a) Microbiol. Rev., 52, 452-484.
WÄCHTERSHÄUSER, G. (l988b) System. Appl. Microbiol., 10, 207-210.
WÄCHTERSHÄUSER, G. (l990) Proc. Natl. Acad. Sci. USA, 87, 200-204.
WÄCHTERSHÄUSER, G. (1992) Prog. Biophys. Mol. Biol., 58, 85-201.
WÄCHTERSHÄUSER, G. (1994) Life in a ligand sphere. Proc. Natl. Acad. Sci. USA, 91, 4283-4287.
WALKER, J.C.G. (1977) Evolution of the atmosphere. New York, Macmillan.
WEBER, AL. (1981) Formation of pyrophosphate, trypolyphosphate and phosphorylimidazole with the thioester, n, s-diacetylcyteamine, as the condensing agent. J. Mol. Evol., 18,24-29.
WEBER, AL. (1982) Formation of pyrophosphate on hydroxyapatite with thioesters as condensing agents. BioSystems, 15, 183-189.
WEBER, A.L. (1984) Orig. Life, 15, 17-27.
WEBER, A.L. (1987) Orig. Life Evol, Biosp., 17, 107-119.
WIELAND, T., SCHAFER, W. (1951) Angew. Chem., 63, 146-147.
WIELAND, T., SCHAFER, W. (1952) Liebigs Annal. Chem., 576, 104-109.
WOESE, C.R. (1979) A proposal conceming the origin oflife on the planet Earth. J. Mol. Evol., 13, 95-101.
WOESE, C.R. (1987) Bacterial evolution. Microbiol. Rev., 51, 221-271.
YAMAGATA, Y., WATANABE, H., SAITOH, M., NAMBA, T. (1991) Volcanic production of polyphosphates and its relevance to prebiotic evolution. Nature, 352, 516-519