Fattori di crescita
Fattori di crescita
Gli organismi pluricellulari hanno la necessità di specificare il numero e le caratteristiche funzionali delle singole cellule che li compongono, di organizzarle in tessuti e organi e di orchestrare la loro funzione. Regolatori importanti di questi processi sono i fattori di crescita, che controllano i seguenti processi: (a) la sopravvivenza cellulare, tramite l'inibizione del processo di morte cellulare programmata detto 'apoptosi'; (b) l'induzione della proliferazione o al contrario l'arresto del ciclo cellulare; (c) la riorganizzazione del citoscheletro con conseguente cambio di morfologia; (d) la modulazione dell'adesione tra cellula e cellula e tra cellula e matrice extracellulare; (e) il controllo della migrazione cellulare; (f) la regolazione dell'espressione genica con conseguente definizione del fenotipo differenziato.
I fattori di crescita, secreti nel mezzo extracellulare, possono agire sulla stessa cellula che li ha prodotti, e in questo caso si parla di un meccanismo d'azione autocrino, sulle cellule vicine, con meccanismo paracrino, oppure a distanza. Una volta raggiunta la cellula bersaglio i fattori di crescita si legano a uno o più tipi di recettori, esposti sulla superficie cellulare, con un'affinità che può variare anche di tre ordini di grandezza (in genere recettori a bassa affinità legano i fattori di crescita con una costante di legame nanomolare, e quelli ad alta affinità con una costante di legame picomolare). A seguito della formazione del complesso fattore di crescita-recettore sono generati all'interno della cellula bersaglio un numero limitato di 'secondi messaggeri', che a loro volta controllano una serie di vie biochimiche all'interno della cellula, regolando l'attività di enzimi e fattori di trascrizione.
La specificità della risposta cellulare a un determinato fattore di crescita dipende dall'opportuna combinazione dei segnali attivati dai secondi messaggeri. Se da una parte la stessa cellula risponde in modo diverso a differenti fattori di crescita, dall'altra lo stesso fattore di crescita induce risposte diverse in tipi cellulari distinti. Infine ci sono casi in cui fattori di crescita differenti inducono la stessa risposta nella stessa cellula. Considerando l'importanza dei fenomeni controllati dai fattori di crescita non sorprende che durante l'evoluzione si siano sviluppati vari meccanismi che regolano tutti i livelli della produzione e dell'azione dei fattori di crescita. In primo luogo sono modulate la loro sintesi e la loro maturazione (molti fattori di crescita sono sintetizzati sotto forma di un precursore inattivo, che deve essere processato per essere funzionale). Spesso ne è regolata la secrezione ed eventuali modificazioni covalenti condizionano la diffusione e la vita media dei fattori di crescita messi in circolo. Infine il legame con i recettori può essere regolato dalla funzione di proteine 'carrier', che trasportano i fattori di crescita all'interno della cellula, o da ligandi antagonisti che competono con essi per il sito di legame sul recettore. Occorre infine sottolineare che spesso i recettori per i fattori di crescita interagiscono fisicamente e/o funzionalmente con molecole di adesione alla matrice extracellulare quali le integrine o con molecole di adesione tra cellule quali le caderine.
I fattori di crescita nella formazione neoplastica
Considerando l'importanza delle risposte cellulari controllate dai fattori di crescita, non stupisce che la loro mancata regolazione sia causa di gravi patologie, prima tra tutte il cancro. In effetti, proliferazione incontrollata, capacità di sopravvivere ai segnali di morte programmata, motilità e capacità di invadere tessuti circostanti, caratteristiche tipiche delle cellule cancerose metastatiche, sono tutti processi sotto il controllo dei fattori di crescita. A partire dalla metà degli anni Ottanta del Novecento un crescente numero di pubblicazioni scientifiche ha dimostrato che nella maggioranza delle cellule neoplastiche vengono impropriamente espressi fattori di crescita, o loro recettori, o sono deregolate le proteine che mediano la trasduzione del segnale dei fattori di crescita all'interno della cellula. In effetti, le cellule cancerose, da cui è spesso facile ottenere in coltura una popolazione omogenea capace di proliferazione illimitata, hanno spesso rappresentato lo strumento d'elezione per lo studio biochimico del meccanismo d'azione dei fattori di crescita. D'altro canto il ruolo svolto da particolari fattori di crescita nel controllo o nella progressione tumorale non è sempre d'immediata comprensione.
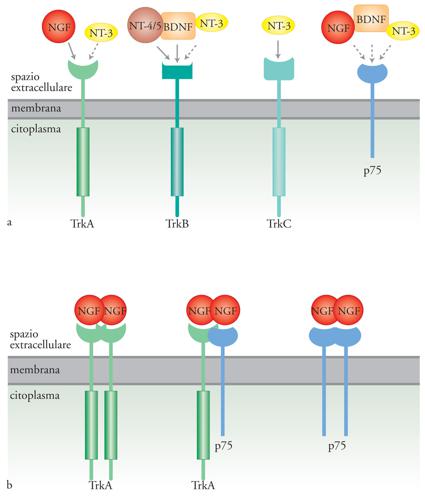
Le neurotrofine
Le neurotrofine sono una piccola famiglia di fattori che agiscono principalmente, ma non esclusivamente, sulle cellule nervose. Nei Mammiferi la famiglia è composta da quattro membri: NGF (Nerve growth factor), BDNF (Brain-derived neurotrophic factor), NT-3 (Neurotrofina 3) e NT-4/5 (Neurotrofina 4/5). L'NGF è stato il primo fattore di crescita descritto; è stato identificato nel 1951 da Rita Levi Montalcini e Victor Hamburger come una sostanza, rilasciata da un tumore (un sarcoma di topo), in grado di stimolare la crescita di cellule nervose del sistema simpatico e sensoriale dell'embrione di pollo. Durante lo sviluppo del sistema nervoso le neurotrofine hanno principalmente tre funzioni. In primo luogo sono fattori trofici, che permettono la sopravvivenza di cellule bersaglio. Cellule nervose immature, neurotrofina-dipendenti, competono tra loro per questi fattori, prodotti in quantità limitate dagli organi bersaglio. Ne consegue che i neuroni soprannumerari, che non riescono a legare una quantità sufficiente di neurotrofine, vanno incontro a morte cellulare programmata. In questo modo le neurotrofine partecipano alla formazione dei circuiti nervosi. Una seconda funzione delle neurotrofine è l'azione tropica, che determina la crescita delle fibre nervose nella direzione di maggiore concentrazione del fattore di crescita stesso. Infine, le neurotrofine esercitano una funzione differenziativa su alcune cellule immature modulandone il repertorio di geni espressi.
L'attività delle neurotrofine non è limitata al sistema nervoso immaturo; nell'organismo adulto le neurotrofine regolano la funzione di circuiti sinaptici già formati, modulando la risposta ai neurotrasmettitori. Da questo punto di vista la neurotrofina maggiormente studiata è il BDNF, che regola il processo noto come 'potenziamento a lungo termine' (Long term potentiation, o LTP). Il potenziamento a lungo termine è quel fenomeno che permette a una sinapsi stimolata ripetutamente in un breve intervallo di tempo di restare, per un certo periodo, più sensibile a una successiva stimolazione. Sembra che questo meccanismo contribuisca alla formazione della memoria. Le neurotrofine, inoltre, agiscono su cellule non neuronali: per esempio, modulano la motilità delle cellule di Schwann, cellule gliali che formano la guaina mielinica nel sistema nervoso periferico. È stato anche dimostrato che le neurotrofine hanno un effetto antiapoptotico su cellule del sistema immunitario, quali mastociti e linfociti B, e si suppone che esse regolino funzioni fisiologiche che necessitano di una risposta coordinata tra sistema nervoso e sistema immunitario.
Le neurotrofine, che nella forma attiva sono proteine di piccole dimensioni (ca. un centinaio di amminoacidi per un peso molecolare di poco maggiore a 10.000 Da) sono sintetizzate come precursori inattivi, pro-neurotrofine, processati tramite un taglio proteolitico a opera di proteasi specifiche presenti nelle vescicole di secrezione. Questo processo avviene con un'efficienza minore del 100% e come conseguenza sia pro-NGF che pro-BDNF possono essere rilasciati nello spazio extracellulare. La maturazione del pro-BDNF a opera di proteasi extracellulari quali la plasmina è un meccanismo che modula l'induzione dell'LTP. Il pro-NGF esercita una sua funzione indipendentemente dalla forma matura dell'NGF; in particolare il proNGF induce morte cellulare in sottopopolazioni neuronali che esprimono il recettore p75, un fenomeno che sembra rilevante nell'Alzheimer.
Esistono due tipi di recettori per le neurotrofine: p75, che appartiene alla famiglia dei recettori per il TNF (Tumor necrosis factor) e lega indistintamente tutte le neurotrofine con bassa affinità, e i recettori Trk, con attività tirosinchinasica (le tirosine-chinasi sono enzimi che aggiungono un gruppo fosfato ai residui di tirosina presenti nella sequenza di proteine substrato). I recettori Trk hanno per le neurotrofine un'affinità maggiore di p75 e sono tre: Trk-A che lega principalmente il NGF, e con minore affinità NT-3; Trk-B in grado di legare sia BDNF che NT-4/5; Trk-C che lega specificamente NT-3 (fig. 2). Animali in cui i recettori Trk sono stati inattivati per knock out genico manifestano deficit durante lo sviluppo del sistema nervoso assai più gravi di quelli presenti in animali privati del recettore p75. Per questa ragione p75 è generalmente considerato un corecettore che modula l'affinità con cui le neurotrofine si legano al recettore Trk. Gli RNA messaggeri per i recettori Trk sono soggetti a processi di splicing alternativo, meccanismo per cui da un singolo gene originano più trascritti e di conseguenza diverse proteine. Si hanno così recettori varianti nella porzione extracellulare e, di conseguenza, con una differente affinità per le neurotrofine, e recettori che mancano della porzione intracellulare, con attività tirosinchinasica e quindi incapaci di generare una risposta biologica. Il legame delle neurotrofine ai recettori Trk induce la formazione di dimeri o multimeri degli stessi recettori e ne stimola l'attività tirosinchinasica. La fosforilazione dei residui di tirosina, nella porzione citoplasmatica del recettore, crea siti di legame ad alta affinità per una serie di molecole con varie attività enzimatiche o per proteine adattatrici, che a loro volta reclutano proteine in grado di trasdurre il segnale. In altre parole, si crea una piattaforma su cui si assembla la macchina molecolare di trasduzione del segnale. Le proteine reclutate in un determinato e specifico insieme sono alla base della specificità della risposta cellulare. L'analogia che viene spesso utilizzata è quella delle costruzioni fatte con i pezzi Lego (le tirosine fosforilate farebbero la funzione dei dentini nei mattoncini) che possono dare luogo a costruzioni di diverso tipo.
In cellule polarizzate e con morfologia complessa, quali le cellule nervose, i recettori possono non essere distribuiti in modo uniforme sulla superficie cellulare, e quindi la produzione di secondi messaggeri può essere localizzata in distretti specifici della cellula, con conseguenze importanti sulla risposta cellulare. Nel caso in cui le neurotrofine si leghino a recettori Trk presenti sulla membrana cellulare che circonda il corpo cellulare, la distanza tra la macchina di trasduzione del segnale e il nucleo è breve. Nel caso in cui le neurotrofine siano rilasciate dall'organo bersaglio e leghino recettori presenti sulla punta dell'assone, il segnale deve invece viaggiare per distanze grandi rispetto al diametro cellulare. In questo caso il complesso neurotrofine-recettori-molecole di trasduzione è internalizzato e trasportato in maniera retrograda dalla periferia verso il nucleo. Durante questo processo esistono ampi margini per modulare la risposta cellulare alterando l'assemblaggio delle proteine che trasducono il segnale. Le neurotrofine costituiscono un esempio di fattori di crescita che agiscono tramite recettori tirosina-chinasi. La lista dei fattori che utilizzano un meccanismo di trasduzione del segnale simile comprende anche la superfamiglia dell'EGF (Epidermal growth factor), costituita da 8 geni EGF-simili e dalle 4 neureguline; l'insulina e i fattori insulino-simili (IGF); i fattori angiogenetici della famiglia del VEGF (Vascular endothelial growth factor); i 23 componenti della famiglia dell'FGF (Fibroblast growth factor); le eferine, fattori di crescita ancorati alla membrana che mediano interazioni cellula-cellula e guidano la migrazione cellulare e la crescita direzionale dei prolungamenti nervosi.
La superfamiglia del TGF-β
I componenti di questa famiglia, comprendente il TGF-β (Transforming growth factor-β), le activine e le proteine BMP (Bone morphogenic protein), segnalano attraverso l'attivazione di recettori serina/treonina-chinasi. Nei Mammiferi la famiglia è composta da 29 membri e ha due tipi di recettori: 7 recettori di tipo I e 5 di tipo II. Il complesso recettoriale funzionale è composto dall'associazione tra un omodimero di recettori di tipo I e un omodimero di recettori di tipo II (35 possibili combinazioni). Questi fattori di crescita esercitano una pletora di effetti durante il differenziamento dell'animale, dall'induzione del mesoderma alla determinazione dell'asse destro-sinistro e antero-posteriore nell'embrione, alla morfogenesi dell'osso. A livello cellulare controllano processi quali proliferazione, sopravvivenza cellulare, cambio di morfologia, migrazione e differenziamento cellulare. Il membro della famiglia maggiormente studiato è il TGF-β originariamente isolato dal terreno di coltura di cellule tumorali. Contrariamente a quanto suggerito dal suo nome, il TGF-β ha spesso un'azione citostatica e apoptotica, almeno su cellule epiteliali.
Questo fenomeno è stato osservato sia in vitro sia in vari modelli animali transgenici. Per esempio, la sovraespressione di TGF-β nelle cellule della ghiandola mammaria, nelle cellule β del pancreas (quelle che producono insulina), nel fegato o nella prostata induce arresto della divisione cellulare e/o morte cellulare in vivo. Allo stesso modo il TGF-β esercita una funzione citostatica su cellule del sistema immunitario, in particolare su linfociti T, tanto che, nel topo, il knock out del gene per il TGF-β provoca la morte nel periodo immediatamente successivo alla nascita, a causa di una severa infiammazione conseguente all'iperattività del sistema immunitario. Più ambigua è la risposta delle cellule endoteliali: se da una parte il TGF-β è chiaramente citostatico e pro-apoptotico per le cellule endoteliali in vitro, questo fattore è necessario per la formazione della vasculatura e l'angiogenesi durante lo sviluppo e, nell'adulto, l'iniezione di TGF-β induce neoangiogenesi in vivo. Una possibile spiegazione per questi risultati è fornita dal fatto che le cellule endoteliali esprimono contemporaneamente due diversi recettori di tipo I: ALK1 e ALK5. Il primo induce un segnale di proliferazione e migrazione, mentre il secondo induce un segnale antagonista. Considerando che i complessi recettoriali legano il TGF-β con affinità differenti, è possibile che la risposta cellulare vari a seconda della concentrazione di questo fattore. Considerando gli effetti citostatici del TGF-β, non sorprendono il suo ruolo come soppressore tumorale, nonché la presenza di mutazioni a carico di questo fattore, o di un suo recettore o di proteine che ne mediano la funzione all'interno della cellula, in alcuni tumori. Paradossalmente, in altri tumori il TGF-β è sovraespresso. Una possibile spiegazione nasce dal fatto che elevati livelli di TGF-β possono creare un microambiente favorevole allo sviluppo tumorale influenzando la crescita di differenti tipi cellulari quali fibroblasti, cellule del sistema immunitario e cellule endoteliali presenti in prossimità del tumore. Per esempio, l'inibizione dei linfociti T e la promozione dell'angiogenesi possono da soli spiegare il ruolo del TGF-β nel promuovere la progressione del tumore e la formazione di metastasi.
Il meccanismo di trasduzione del segnale dei membri della famiglia è stato approfonditamente studiato. Il legame del fattore di crescita con il recettore induce la formazione di un complesso, contenente una coppia di recettori di tipo I e una coppia di recettori di tipo II. Questi ultimi fosforilano una regione regolatrice nella porzione intracellulare della sequenza dei recettori di tipo I. I recettori di tipo I così attivati, a loro volta, fosforilano e attivano i componenti di una famiglia di proteine chiamate Smad associate alla porzione citoplasmatica dei recettori. Nelle cellule di Mammiferi sono presenti otto Smad distinte. Una volta fosforilate Smad1, Smad2, Smad3, Smad5 e Smad8 (dette R-Smad), si associano con Smad4 e insieme traslocano nel nucleo dove regolano la trascrizione genica. Smad6 e Smad7 (dette I-Smad) sono invece degli inibitori, che competono con gli R-Smad per il legame sia ai recettori, impedendone la fosforilazione, sia a Smad4, prevenendo la formazione di complessi trascrizionalmente attivi. I complessi R-Smad e Smad4 legano il DNA con bassa affinità e pertanto devono reclutare altri fattori di trascrizione sequenza-specifici e una serie di coattivatori o corepressori. Il fatto che i complessi R-Smad/Smad4 necessitino di partner per regolare l'espressione genica spiega come differenti tipi cellulari, che per definizione hanno distinti repertori di fattori trascrizionali, rispondano in modo diverso al TGF-β.
Sono numerosi i meccanismi che regolano la trasduzione del segnale della famiglia del TGF-β. In primo luogo l'espressione dei recettori di tipo I e di tipo II è tessuto-specifica e la loro localizzazione in specifici distretti della superficie cellulare, così come le loro internalizzazione e degradazione, sono regolate dall'associazione a proteine specifiche. Inoltre, se le R-Smad e Smad4 sono proteine ubiquitarie, l'espressione delle I-Smad è cellula-specifica e regolata in risposta a vari segnali, primo fra tutti lo stesso segnale del TGF-β, fornendo in questo modo un feedback negativo. La vita media delle R-Smad è modulata dall'associazione con due proteine chiamate Smurf1 e Smurf2, due enzimi della famiglia delle ubiquitina-ligasi, che modificano covalentemente i loro bersagli indirizzandoli alla degradazione. Infine altre chinasi sono in grado di modificare con fosforilazioni attivatrici o inibitorie i complessi Smad. Queste chinasi comprendono serine/treonine-chinasi, a loro volta attivate dalla trasduzione del segnale di recettori tirosina-chinasi. In questo modo fattori di crescita quali EGF, FGF, IGF e altri ancora modulano la risposta cellulare al TGF-β. Accanto a questo tipo di trasduzione del segnale relativamente diretta (legame del fattore di crescita, fosforilazione di fattori di trascrizione, controllo dell'espressione genica), i recettori per la famiglia del TGF-β trasducono il segnale anche attraverso meccanismi, ancora in parte da chiarire, indipendenti dalla funzione delle proteine Smad. In particolare si è osservata l'attivazione di molti di quegli stessi effettori intracellulari che trasducono i segnali a valle dell'attivazione dei recettori tirosina-chinasi. Come conseguenza di questa trasduzione del segnale non canonica del TGF-β si hanno, tra l'altro, riorganizzazione del citoscheletro e modulazione dell'adesione cellulare.
La famiglia Wnt
I fattori di crescita Wnt costituiscono una famiglia composta nei Mammiferi da 19 proteine distinte, modificate post-trasduzionalmente dall'aggiunta di un lipide a una specifica cisteina. Il significato funzionale di questa modificazione non è del tutto chiaro, ma la rimozione del lipide porta a perdita di attività. Il nome della famiglia è stato coniato quando si è riconosciuto che il gene wingless, originariamente identificato nel moscerino della frutta, era l'omologo del gene int-1, un protooncogene attivato dall'inserzione di un virus in un tumore mammario di topo. Le proteine Wnt sono potenti regolatori della proliferazione e del differenziamento e la trasduzione del loro segnale è in gran parte mediata da una proteina intracellulare, la β-catenina, coinvolta anche nell'adesione tra cellule. Da questo punto di vista, quindi, la trasduzione del segnale delle proteine Wnt è l'esempio più diretto della cooperazione funzionale tra fattori di crescita e molecole di adesione. Le proteine Wnt giocano un ruolo essenziale nella crescita delle cellule staminali embrionali, promuovendo la loro capacità di rinnovarsi e di mantenere uno stato pluripotente. Un ruolo simile è esercitato dalle proteine Wnt sulle cellule staminali dell'intestino, della pelle e del sistema ematopoietico. La possibilità di ricorrere a questi fattori di crescita per espandere popolazioni di cellule staminali da utilizzare in terapie cellulari ha di recente risvegliato un forte interesse biotecnologico. Per quanto riguarda il sistema nervoso, disfunzioni di Wnt1 portano a severe malformazioni del mesencefalo, del cervelletto e del midollo spinale, mentre l'inibizione della funzione di Wnt3A provoca la scomparsa completa dell'ippocampo. Queste malformazioni sono probabilmente da ascrivere alla ridotta proliferazione di cellule staminali o di precursori neuronali.
Anche le proteine Wnt e le proteine che ne trasducono il segnale all'interno della cellula sono spesso implicate nella formazione e nella progressione di alcuni tipi di tumori, quali carcinomi del colon e del retto, medulloblastomi, tumori del polmone, melanomi e leucemie. Le proteine Wnt, però, possono anche promuovere il differenziamento di cellule staminali a spese della loro proliferazione e influenzare il tipo di cellule prodotte. Per esempio, cellule staminali della cresta neurale in cui si abbia un'elevata attività di β-catenina danno luogo soltanto a cellule nervose sensoriali, invece di produrre una progenie composta da diverse cellule quali melanociti, cellule gliali e vari tipi di neuroni. Recentemente è stato dimostrato che Wnt3A favorisce la neurogenesi non solo durante lo sviluppo, ma anche nell'adulto. Wnt3A, infatti, promuove la proliferazione della popolazione staminale neurale nell'ippocampo del ratto adulto e ne canalizza il differenziamento verso un fenotipo neuronale. La risposta delle cellule a Wnt è contesto-dipendente e modulata dall'azione di altri fattori di crescita, quali quelli che attivano recettori tirosina-chinasi, per esempio FGF, o membri della famiglia del TGF-β.
La trasduzione del segnale delle proteine Wnt è piuttosto complessa e recentemente sono stati individuati altri meccanismi di trasduzione del segnale accanto a quello canonico, mediato dalla β-catenina. Questa proteina è stata inizialmente identificata come partner delle caderine, molecole transmembrana che mediano l'adesione tra cellule. La β-catenina stabilizza l'interazione cellula-cellula e nei complessi di adesione collega la porzione intracellulare delle caderine al citoscheletro. In assenza di segnale da parte di Wnt le molecole di β-catenina che non sono legate alle caderine vengono rapidamente degradate. Quando un fattore di crescita Wnt si lega a uno dei suoi recettori chiamati Frizzled (una piccola famiglia di proteine costituita nell'uomo da dieci membri) e a uno dei due corecettori chiamati LRP5 e LRP6, la degradazione della β-catenina viene inibita. La β-catenina si accumula e trasloca dal citoplasma al nucleo, dove lega un fattore di trascrizione chiamato TCF/LEF. Quest'ultimo, che da solo funziona come repressore, a seguito del legame con la β-catenina diventa un attivatore della trascrizione e induce l'espressione dei geni bersaglio della trasduzione del segnale di Wnt. Ci sono almeno due modi attraverso i quali fattori di crescita che regolano l'adesione tra cellule modulano la trasduzione del segnale di Wnt. Da una parte, l'attivazione di recettori tirosina-chinasi può promuovere la dissociazione della β-catenina dai complessi di adesione e renderla, quindi, disponibile per partecipare alla via di trasduzione del segnale di Wnt. Dall'altra parte, l'attivazione di recettori tirosina-chinasi come pure l'azione del TGF-β spesso portano a una minore espressione genica delle caderine, in quanto inducono la sintesi di repressori della loro trascrizione. Diminuendo il numero di molecole di caderina espresse dalla cellula cresce il livello di β-catenina libera.
Lo studio dei fattori di crescita va avanti da più di mezzo secolo ed è ancora in rapida evoluzione. Nuove conoscenze si aggiungono di anno in anno. Tuttavia, alcuni principî generali sembrano ormai chiaramente definiti e difficilmente andranno incontro a revisione in tempi brevi: il repertorio funzionale dei fattori di crescita si è accresciuto nel corso dell'evoluzione grazie a duplicazioni e diversificazioni dei geni codificanti per i fattori di crescita stessi e per i loro recettori; una volta stabilito un modulo funzionale, costituito da un fattore di crescita e dal suo recettore, questo tende a essere impiegato in più circostanze, sia durante il differenziamento sia nell'adulto (da questo punto di vista un tale modulo può essere paragonato a un hardware, utilizzato in più programmi distinti); la risposta a un fattore di crescita dipende dal contesto cellulare; a valle del recettore attivato, le vie biochimiche che trasducono il segnale tendono a divaricarsi, per cui di rado la risposta a un fattore di crescita può essere rappresentata da una cascata lineare di eventi, piuttosto essa somiglia a un network; generalmente alla risposta trascrizionale si accompagnano risposte non trascrizionali, quali riorganizzazione del citoscheletro, modulazione dell'adesione, regolazione dei primi eventi del processo apoptotico; infine, fattori di crescita distinti, così come fattori di crescita e proteine di adesione, interagiscono tra loro funzionalmente e si influenzano reciprocamente.
bibliografia
Chao 2003: Chao, Moses V., Neurotrophins and their receptors: a convergence point for many signalling pathways, "Nature reviews. Neuroscience", 4, 2003, pp. 299-309.
Nelson, Nusse 2004: Nelson, W. James - Nusse, Roel, Convergence of Wnt, beta-catenin, and cadherin pathways, "Science", 303, 2004, pp. 1483-1487.
Schlessinger 2000: Schlessinger, Joseph, Cell signaling by receptor tyrosine kinases, "Cell", 103, 2000, pp. 211-225.
Shi, Massagué 2003: Shi, Ygong - Massagué, Joan, Mechanisms of TGF-beta signaling from cell membrane to the nucleus, "Cell", 113, 2003, pp. 685-700.