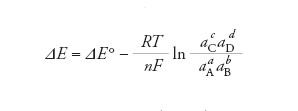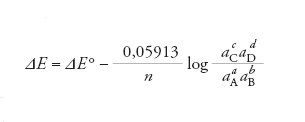equazione di Nernst
equazione di Nernst
Equazione che esprime la dipendenza della forza elettromotrice di una cella elettrochimica dalle attività termodinamiche dei composti coinvolti nella reazione di ossidoriduzione responsabile del suo funzionamento (processo elettromotore). Dato il seguente processo elettromotore generico
AA + BB → CC + DD
l’equazione di Nernst ha la seguente forma:
dove ΔE (pari alla differenza tra i potenziali catodico e anodico) è la forza elettromotrice della cella, aA, aB, aC, aD sono le attività delle specie A, B, C e D, T è la temperatura assoluta, R la costante universale dei gas, F la costante di Faraday, n il numero di elettroni scambiati nella reazione e ΔE° il valore che la forza elettromotrice assume nel caso in cui le attività di tutte le specie siano unitarie, cioè le specie si trovino tutte nei rispettivi stati standard. Come stati standard vengono solitamente definiti per i gas lo stato corrispondente alla pressione di 1 bar, per le sostanze disciolte in soluzione lo stato a concentrazione molale o molare unitaria. Quando il comportamento dei gas o delle soluzioni è ben approssimato da quello ideale, nell’equazione di Nernst le attività vengono sostituite, rispettivamente, dalle pressioni parziali espresse in bar e dalle concentrazioni molali o molari. Nelle applicazioni a temperatura ambiente spesso l’equazione viene scritta ponendo T=298 K e sostituendo il logaritmo naturale con quello decimale, per dare la forma numerica (forza elettromotrice espressa in volt):
L’equazione di Nernst e le sue varianti valide per sistemi elettrochimici più complessi sono alla base di molti dispositivi analitici usati per misurare valori di attività, concentrazione, pressione parziale di sostanze in vari sistemi applicativi (per es., misura del pH in soluzioni acquose, misure di ossigeno in miscele aria/combustibile, misure di concentrazione di ioni metallici in sistemi biologici).
→ Elettrochimica; Sistemi chimico-fisici: autorganizzazione