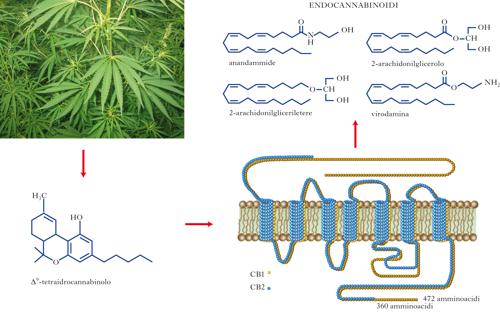
endocannabinoidi
endocannabinoidi
Gli endocannabinoidi sono piccole molecole segnale che utilizzano gli stessi recettori di membrana a cui si lega anche il principale costituente psicotropo della cannabis, il THC (Δ9-tetraidrocannabinolo). Gli endocannabinoidi hanno natura lipidica e derivano da un acido grasso polinsaturo, l’acido arachidonico. Essi vengono prodotti a partire da precursori biosintetici di tipo fosfolipidico e attivano i recettori dei cannabinoidi di tipo 1 (CB1), molto abbondanti nel cervello ma anche in tessuti periferici, e di tipo 2 (CB2), espressi invece principalmente in cellule del sistema immunitario. Nel sistema nervoso centrale gli endocannabinoidi svolgono una funzione neuromodulatoria, molto spesso di tipo retrogrado. In tal modo, essi ricoprono un ruolo importante in vari tipi di plasticità sinaptica e nei processi cognitivi, motori, sensoriali e affettivi a essi correlati. Inoltre, in alcune condizioni patologiche, acute o croniche, dell’SNC, come durante l’epilessia o nelle malattie neuroinfiammatorie e neurodegenerative, gli endocannabinoidi, attivando recettori sia CB1 sia CB2, possono svolgere un ruolo pro-omeostatico e neuroprotettivo. Come tutti i segnali chimici, anche gli endocannabinoidi sono soggetti a mancata regolazione, così da contribuire all’eziologia o ai sintomi di alcune patologie. [➔ cervello, sviluppo del; differenziamento neuronale; dolore; neurodegenerazione; neurotrasmettitori; recettore nervoso; stress e adattamento]
Tutti gli organismi viventi e le cellule che li compongono sono dotati di molecole segnale che, legandosi a macromolecole (recettori, enzimi, acidi nucleici) attraverso specifici meccanismi di riconoscimento molecolare, regolano processi vitali quali il differenziamento, il metabolismo, la replicazione, la migrazione e la comunicazione tra vari dipartimenti subcellulari (segnali chimici, o mediatori, intracellulari) o con altre cellule più o meno distanti (mediatori extracellulari autocrini, paracrini e ormonali). I neurotrasmettitori (➔) e le citochine sono due tipici esempi di segnali chimici extracellulari con azione paracrina (effettuata su cellule adiacenti) o autocrina (effettuata sulla stessa cellula che li produce). I neurotrasmettitori sono responsabili della trasmissione dei segnali nervosi e le citochine della regolazione dell’attività delle cellule del sistema immunitario, ivi incluse quelle residenti nell’SNC (come glia e microglia). I neurotrasmettitori sono prima biosintetizzati e poi conservati in vescicole secretorie; se stimolato, il neurone li rilascia all’esterno attraverso un processo noto come esocitosi. Numerose patologie sono accompagnate o determinate dalla mancata regolazione (per difetti di produzione, di rilascio, di attivazione o disattivazione) dei segnali chimici, regolazione che in alcuni casi è affidata ad altri mediatori. Questi entrano in gioco principalmente in seguito a perturbazioni fisiologiche o patologiche dell’attività cellulare e svolgono una funzione pro-omeostatica, ossia regolano i livelli o l’azione dei mediatori chimici fondamentali per riportarli a uno stato quanto più vicino a quello esistente prima della perturbazione (➔ omeostasi, controllo nervoso della). Tutto quello che attualmente (2010), a quasi vent’anni dalla loro scoperta, si conosce del sistema degli e. e dei recettori CB1 e CB2 indica che essi svolgono una funzione pro-omeostatica locale. I due principali e., la N-arachidonil-etanolammina (meglio nota come anandammide) e il 2-AG (2-arachidonilglicerolo), sono infatti biosintetizzati attraverso l’azione di enzimi calcio-sensibili. Essi vengono biosintetizzati ‘a richiesta’, cioè solo quando l’aumento della concentrazione del calcio citoplasmatico (che accompagna gran parte delle perturbazioni fisiopatologiche delle cellule) oltrepassa una soglia tale da attivare gli enzimi biosintetici. Questi, agendo su fosfolipidi di membrana, producono gli e. per l’immediato rilascio all’esterno della cellula. Anche a causa della natura fortemente lipidica, che non consente loro una facile diffusione nella matrice extracellulare, gli e. svolgono un’azione principalmente locale, sia sulla stessa cellula che li ha prodotti, sia su cellule limitrofe, a seconda di dove siano localizzati i recettori CB1 e CB2. Questi ultimi appartengono alla famiglia dei recettori accoppiati a proteine G, localizzati sulla membrana citoplasmatica, con un sito di legame, specifico per gli e., situato in un dominio extracellulare immerso nel doppio strato lipidico; in questo modo si spiega perché molecole di natura lipidica, quali gli e. e il THC, possano legarvisi con alta affinità.
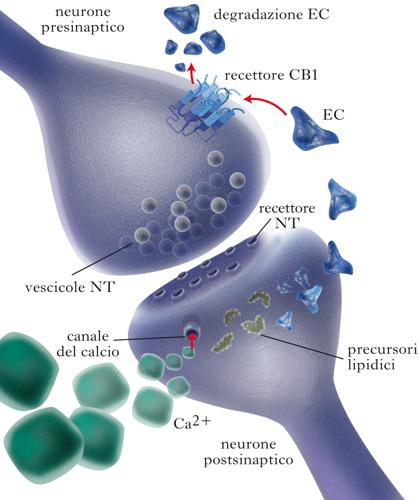
Endocannabinoidi come neuromodulatori retrogradi e neuroimmunomodulatori nell’SNC
Il principale enzima biosintetico del 2-AG, la diacilglicerololipasi α, è spesso situato, nell’SNC, sulle spine dendritiche postsinaptiche. Il CB1, unitamente al principale enzima che degrada il 2-AG, la monoacilglicerolo lipasi, è invece localizzato nei pressi delle terminazioni assonali che stabiliscono contatti sinaptici con le suddette spine dendritiche. Questa giustapposizione di enzimi metabolici e recettori per il 2-AG è in perfetto accordo con il ruolo di neuromodulatore retrogrado proposto per questo e., prevalentemente sulla base di esperimenti di elettrofisiologia. Tale meccanismo può essere indotto sia dalla forte depolarizzazione del neurone postsinaptico (che, essendo accompagnata dall’ingresso di ioni calcio, stimola direttamente la diacilglicerololipasi a e quindi la produzione e il rilascio del 2-AG), sia dalla stimolazione dei recettori metabotropici postsinaptici di alcuni neurotrasmettitori, quali il glutammato (recettori mGluR1, mGluR5) e l’acetilcolina (recettori muscarinici M1, M3). Tali recettori, di contro, stimolano la cascata della fosfolipasi C, con produzione di diacilgliceroli precursori per il 2-AG, e di inositolo-trifosfato che mobilizza il calcio intracellulare dal reticolo endoplasmatico. Mediante questo meccanismo, la forte depolarizzazione del neurone postsinaptico, o anche la sua stimolazione da parte di neurotrasmettitori rilasciati da una particolare terminazione assonale, produce e. che possono agire a ‘ritroso’ su recettori CB1 localizzati sulla stessa terminazione (meccanismo omosinaptico) o su quelle adiacenti (meccanismo eterosinaptico). La stimolazione del recettore CB1, a sua volta, inibisce l’attività dei canali del calcio voltaggio-dipendenti e quindi riduce l’ingresso di calcio; ciò inibisce l’esocitosi di vescicole secretorie, con conseguente riduzione del rilascio dei neurotrasmettitori dalla terminazione assonale. Tale meccanismo può sia potenziare (mediante inibizione del rilascio del neurotrasmettitore inibitorio GABA) sia deprimere (mediante inibizione del rilascio del neurotrasmettitore eccitatorio glutammato), la neurotrasmissione tra due o tre neuroni, per un periodo di tempo breve (secondi) o anche a lungo termine, partecipando a fenomeni di plasticità sinaptica quali il potenziamento a lungo termine (➔) o la depressione a lungo termine (➔). Qualora l’azione locale degli e. abbia invece come bersaglio non i neuroni, ma cellule gliali e microglia, la stimolazione di recettori CB1 e soprattutto CB2 ne regola numerose importanti funzioni, quali la migrazione e l’attivazione, il rilascio di citochine pro- e antinfiammatorie e la capacità di regolare la neurotrasmissione mediante rilascio o sequestro di neurotrasmettitori.
Endocannabinoidi e malattie dell’SNC
Gli e. sono coinvolti in tutte le patologie dell’SNC che coinvolgono mediatori (neurotrasmettitori, citochine, ormoni, ecc.) la cui omeostasi, perturbata dalla patologia, è proprio regolata dagli endocannabinoidi. Poiché la biosintesi degli e. è sovente sotto il controllo degli stessi mediatori, ciò spiega perché l’attivazione del sistema endocannabinoide, e quindi i segnali convogliati dai recettori CB1 o CB2 (questi ultimi spesso sovraespressi durante la patologia), si verifichino solo ‘sul luogo del delitto’ e per un periodo di tempo limitato, almeno nelle prime fasi della malattia. Per es., il ruolo di neuromodulatore retrogrado del 2-AG consente a tale molecola di contrastare l’eccitotossicità da glutammato; l’eccesso di rilascio di glutammato, infatti, da un lato provoca un eccessivo aumento del calcio intracellulare, che può innescare il processo di apoptosi nel neurone postsinaptico determinando il danneggiamento delle fibre nervose, e dall’altro induce la biosintesi di endocannabinoidi. Ciò si verifica tipicamente nell’epilessia, dove si riscontra nell’ippocampo un aumento dei livelli di e. causato proprio dall’azione dello stesso glutammato sui suoi recettori ionotropici; d’altra parte, negli stadi più avanzati della malattia, si può anche verificare un difetto del sistema degli endocannabinoidi. Anche in modelli animali di ictus cerebrale e trauma cranico si osserva un aumento dei livelli locali di e. o dei loro recettori, la cui stimolazione, oltre a mitigare l’eccitotossicità da glutammato, inibisce l’iperattivazione di glia (➔ gliosi) e microglia; tale iperattivazione, se protratta nel tempo, provoca la distruzione della barriera ematoencefalica e l’ingresso nell’SNC di linfociti e macrofagi, con successivo danno infiammatorio irreversibile. Queste stesse funzioni vengono svolte anche al manifestarsi di malattie neurodegenerative e neuroinfiammatorie, quali la sclerosi multipla, la malattia di Parkinson e quella di Alzheimer. In ogni caso, il sistema endocannabinoide viene attivato allo scopo di mitigare il danno neuronale e l’infiammazione, inizialmente nelle aree nervose più fortemente interessate dalla patologia, quali il midollo spinale nella sclerosi multipla, i gangli della base (corpo striato e globo pallido) nella malattia di Parkinson, e l’ippocampo e la corteccia cerebrale nella malattia di Alzheimer. Nella corea di Huntington, invece, sono danneggiate per prime le fibre pallidostriatali, che sono quelle che più contribuiscono a produrre e. e recettori CB1, i cui livelli diminuiscono quindi sin dal primo manifestarsi dei sintomi e non sono sufficienti a svolgere un ruolo protettivo. La diminuzione del ‘tono’ endocannabinoide in questo caso può addirittura contribuire ai movimenti coreici, perché partecipa alla malregolazione del sistema dopamminergico indotto dalle lesioni. Nel caso della malattia di Parkinson e di quella di Alzheimer, invece, pur rappresentando inizialmente un segnale pro-omeostatico neuroprotettivo e antinfiammatorio, l’attivazione del sistema endocannabinoide, da quanto si è evidenziato in modelli animali, nelle fasi più avanzate del disordine finisce per coinvolgere anche neuroni non direttamente danneggiati dalla patologia, inibendo rispettivamente il movimento e la memoria a breve termine, e contribuendo ai sintomi di queste due malattie. Sebbene la progressiva non-selettività d’azione durante condizioni patologiche croniche sia un fenomeno comune ad altri mediatori pro-omeostatici, quali quelli che controllano la risposta immunitaria, nel caso degli e., in virtù della pleiotropicità della loro funzione, la perdita di specificità spazio-temporale può avere conseguenze molto gravi sulla salute.
Endocannabinoidi, stress e disordini mentali
Il THC e i preparati della cannabis causano ben noti effetti sull’umore, sul ciclo veglia-sonno, sulla circolazione sanguigna, sul sistema immunitario e sul metabolismo, e gli e. svolgono un ruolo pro-omeostatico. Su queste basi, sin dalla loro scoperta è stata ipotizzata una funzione degli e. come mediatori per il recupero da stress (la stessa parola anandammide deriva dal sanscrito ananda, «stato di grazia») e per l’adattamento a nuove condizioni esterne, funzione finora dimostrata solo in animali di laboratorio. Secondo questo paradigma, situazioni che inducono stress, sia acuto sia prolungato, di tipo omotipico (stesso stimolo ripetuto in maniera prevedibile) o eterotipico (con stimoli stressori sempre diversi), sono in grado di modulare l’espressione del recettore CB1 e le concentrazioni tissutali degli e. in aree cerebrali coinvolte nelle risposte adattative a tali condizioni, quali l’ipotalamo, con conseguente regolazione dell’asse ipotalamico-ipofisario-surrenale (➔ HPA), e l’ippocampo. Ciò avrebbe la funzione, inter alia, di regolare l’espressione del fattore di rilascio delle corticotropine dall’ipotalamo, e quindi di riportare a valori omeostatici i livelli di cortisolo, elevati durante situazioni di stress. Il sistema endocannabinoide, pertanto, verrebbe attivato per ripristinare la normale attività dell’asse ipotalamico-ipofisario-surrenale e consentire l’adattamento allo stress, contrastando quelle conseguenze che contribuiscono, nell’uomo, a far precipitare i sintomi di malattie mentali affettive, quali la depressione, i disordini da stress postraumatico e i disturbi ossessivo-compulsivi. In quest’ambito, in condizioni ansiogene i recettori CB1 e gli e. entrerebbero in azione anche in aree quali l’ippocampo, l’amigdala e la corteccia prefrontale, potenziando il rilascio di GABA e, in modelli animali di depressione, innalzando il rilascio di serotonina dal rafe dorsale.
Endocannabinoidi e neurogenesi
Gli e. regolano la neurogenesi (➔) sia durante lo sviluppo embrionale sia nell’adulto. I recettori CB1 sono espressi in cellule progenitrici neuronali e sono coinvolti nella proliferazione e nella specializzazione dei neuroni piramidali, in quanto essi regolano la migrazione radiale di neuroni in via di maturazione, l’allungamento assonale, il direzionamento dei circuiti che controlla le proiezioni a lungo raggio dei neuroni subcorticali e il corretto posizionamento sia di interneuroni inibitori sia di neuroni eccitatori. Differentemente da quanto osservato nel cervello adulto, l’enzima diacilglicerololipasi α, che biosintetizza il 2-AG, è localizzato sulle terminazioni assonali insieme al recettore CB1. Ciò suggerisce che durante lo sviluppo neuronale il 2-AG svolga un’azione autocrina piuttosto che paracrina. Nel cervello postnatale i recettori CB1 sono coinvolti anche nella formazione di cellule della linea gliale, quali astrociti e oligodendrociti. Nel cervello adulto, infine, essi sono responsabili del mantenimento e della proliferazione di cellule progenitrici in aree cerebrali deputate alla neurogenesi adulta, quali il giro dentato dell’ippocampo e la zona subventricolare. Quest’ultima funzione sembra svolgere un ruolo importante nella protezione, da parte del sistema endocannabinoide, dalle conseguenze dello stress e dall’ansia. Infatti, queste due perturbazioni dell’omeostasi neuronale, se prolungate nel tempo, sono accompagnate dalla morte di neuroni in aree cerebrali deputate a funzioni cognitive e affettive, un fenomeno compensato dalla formazione di nuovi neuroni, mediata, almeno in parte, dai recettori CB1.
Endocannabinoidi e nuove terapie
Si parla spesso dell’uso terapeutico del THC e della cannabis. Tale possibilità, oltre che da secoli di citazioni aneddotiche, è supportata anche da quanto si è appreso sin dalla fine del 20° sec. sul ruolo protettivo degli endocannabinoidi. Tuttavia, la somministrazione sistemica di THC non può sempre riprodurre l’elegante selettività spazio-temporale dell’azione pro-omeostatica degli endocannabinoidi. L’attivazione dei recettori CB2 e, in partic., CB1 in aree cerebrali e tessuti diversi da quelli interessati dalla patologia può provocare importanti effetti collaterali (quali gli effetti psicotropi tipici di alcuni preparati della cannabis). Si stanno quindi sperimentando strategie più selettive per lo sfruttamento terapeutico degli endocannabinoidi. Per es., gli inibitori degli enzimi FAAH (Fatty Acid Amide Hydrolase) e MAGL (MonoAcylGlycerolLipase), che catalizzano la degradazione rispettivamente dell’anandammide e del 2-AG, sono in grado di potenziarne l’effetto protettivo specificamente ‘quando e dove’ esso si sta verificando, ossia nei tessuti interessati dalla malattia in esame, che producono e. localmente. Tali inibitori hanno funzionato bene in studi preclinici su sclerosi multipla, ansia, depressione e dolore neuropatico. Viceversa, in quelle condizioni croniche in cui gli e., spesso attraverso i recettori CB1, contribuiscono al decorso o ai sintomi di una patologia (come in modelli animali di Parkinson, Alzheimer e obesità), l’uso di antagonisti si è rivelato più utile. Infine, molecole sintetiche che attivino selettivamente i recettori CB2, e quindi non psicotrope, sono allo studio per il dolore cronico e alcune malattie neuroinfiammatorie.Vincenzo Di Marzo