elica
elica
Struttura ordinata caratteristica di alcune macromolecole biologiche (proteine, DNA) caratterizzata da un passo, inteso come la distanza tra due successive spire, e da un periodo di ripetizione dell’unità monomerica. In particolare, nelle proteine fibrose e in molte proteine globulari si possono distinguere tre tipi principali di struttura secondaria a e.: l’alfa-e., l’e. del collageno e l’e. superavvolta.
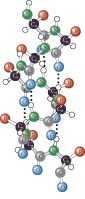
Alfa-elica (o α-elica)
La catena principale, che costituisce la parte interna, risulta strettamente spiralizzata, ed è formata dagli atomi coinvolti nel legame peptidico tra due amminoacidi adiacenti (carbonio e azoto) e dall’atomo di carbonio che lega il gruppo amminico e il gruppo carbossilico in ciascun amminoacido (carbonio α). Le catene laterali dei singoli amminoacidi costituenti l’α-e. si estendono verso l’esterno, conferendo una conformazione elicoidale. I legami idrogeno intramolecolari contribuiscono fortemente alla stabilizzazione della struttura. L’α-e. può essere sia destrogira che levogira, ma nelle proteine è risultata sempre destrogira. La struttura ad α-e. si può combinare con altre strutture secondarie (per es., foglietti β) dando origine a motivi e domini strutturali caratteristici. Molte proteine globulari possiedono un’alta percentuale di tratti ad α-e. (emoglobina, mioglobina) mentre altre ne sono totalmente prive (chimotripsina), e vi sono alcune proteine fibrose la cui conformazione spaziale è esclusivamente ad α-e. (miosina).
Elica del collageno
Ha una struttura di tipo particolare, che si può riscontrare soltanto in questa proteina; è formata da tre catene polipeptidiche avvolte l’una sull’altra a formare una triplice e., stabilizzata da legami idrogeno intermolecolari. Ciascuna delle tre catene possiede una struttura a e. caratterizzata da un passo molto più ampio rispetto all’α-elica. Inoltre, la stabilizzazione della struttura non avviene mediante formazione di legami idrogeno, ma a causa della repulsione sterica tra gli anelli pirrolidinici della prolina e della idrossiprolina, che sono presenti in sequenza ordinata lungo l’asse della molecola proteica.
Elica superavvolta (o coiled-coil)
Questa struttura si riscontra in alcune proteine fibrose (miosina, actina), nelle quali due catene polipeptidiche, con struttura ad α-e., si avvolgono tra di loro a formare un’unica doppia catena ad α-elica.