diabete
diabete
Quadro clinico connesso ad alterazioni del metabolismo, caratterizzato da aumento della diuresi per deficit dell’ormone antidiuretico (d. insipido, ➔ insipido, di abete) o per accumulo e successiva eliminazione di sostanze con le urine, nel la maggior par te dei casi di glucosio ( d. mellito, d. renale).
Diabete mellito
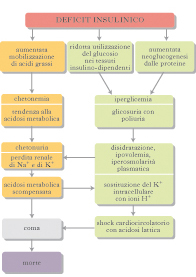
Il d. mellito rappresenta un gruppo di patologie metaboliche caratterizzate da iperglicemia conseguente a difetto di produzione o di azione insulinica: l’iperglicemia cronica si associa a lungo termine a danneggiamento, disfunzione ed insufficienza di vari organi. I meccanismi responsabili dello sviluppo di d. sono molteplici e sostanzialmente riconducibili a processi di distruzione autoimmune delle cellule pancreatiche sintetizzanti insulina (cellule beta) che portano a deficit ormonale o a fenomeni di resistenza dei tessuti bersaglio all’azione insulinica. I sintomi di marcata iperglicemia includono poliuria, polidipsia e perdita di peso, a volte con iperfagia ed oftalmopatia. Il d. non controllato può condurre a due gravi condizioni acute, la chetoacidosi diabetica e il coma iperosmolare non chetosico (coma diabetico), entrambe pericolose per la vita del paziente. Le complicanze a lungo termine del d. includono: retinopatia, con potenziale perdita del visus; nefropatia, che può condurre a insufficienza renale; neuropatia periferica, con rischio di comparsa di ulcere agli arti inferiori; neuropatia autonomica, responsabile di disturbi gastrointestinali, genitourinari e cardiovascolari, nonché di disfunzioni sessuali. I soggetti affetti da d. sono a maggior rischio di insorgenza di patologia ateromatosa e dunque fortemente esposti ad eventi ischemici a carico dei distretti vascolari coronarico, cerebrale e periferico; frequenti sono l’ipertensione arteriosa e le alterazioni del metabolismo dei grassi. La maggior parte dei casi di d. rientra in una delle seguenti due principali categorie eziopatogenetiche: il d. di tipo I, precedentemente denominato d. insulino-dipendente o d. giovanile; il d. di tipo II, precedentemente definito d. non insulino-dipendente o d. dell’età adulta.
Diabete mellito di tipo I
Questo tipo di d. è legato a un processo autoimmune cellulo-mediato di distruzione delle cellule beta-pancreatiche e costituisce il 10÷15% di tutti i casi di d.; sebbene possa insorgere a qualunque età, si sviluppa più com. durante l’infanzia o l’adolescenza ed è la forma predominante di d. mellito diagnosticato prima dei 30 anni. Dimostra forte associazione con altre patologie autoimmuni (tiroidite di Hashimoto, morbo di Addison, vitiligine, miastenia grave, morbo celiaco, ecc.) ed è caratterizzato clinicamente da iperglicemia e tendenza alla chetoacidosi diabetica. La maggior parte dei pazienti con d. mellito di tipo 1 presenta specifici aplotipi HLA (DR3 o DR4) associati a elevato titolo sierico di anticorpi diretti contro componenti citoplasmatiche e di superficie delle cellule insulari.
Diabete mellito di tipo II
Il d. di tipo II è solitamente diagnosticato in soggetti di età superiore a 30 anni; tale d. di tipo adulto può anche riscontrarsi in età infantile o adolescenziale (Maturity-Onset Diabetes of the Young, MODY), in tale caso la malattia è autosomica dominante, dovuta a mutazione del gene della glucochinasi (cromosoma 7). Il d. tipo II è caratterizzato clinicamente da iperglicemia e insulino-resistenza e conduce raramente a chetoacidosi. Questo tipo di d. raggruppa condizioni dismetaboliche eterogenee, nelle quali l’iperglicemia rappresenta il risultato sia di un’alterazione della risposta secretoria insulinica al glucosio introdotto con la dieta, sia di una riduzione della capacità dell’insulina di stimolare la captazione del glucosio da parte del muscolo scheletrico e di inibire la produzione epatica di glucosio. La maggior parte dei pazienti affetti da tale forma presenta obesità, con adiposità prevalentemente localizzata a livello addominale. La riduzione ponderale, raggiunta mediante correzione di stili di vita non favorevoli e di abitudini alimentari non corrette, può almeno in parte migliorare l’insulino-resistenza, ma frequentemente si ricorre all’utilizzo di ipoglicemizzanti orali. I fattori genetici sembrano giocare un ruolo importante nel determinare lo sviluppo di d. di tipo II, anche se non è stata dimostrata associazione certa tra tale forma di malattia e specifici aplotipi HLA, o presenza di autoanticorpi specifici. Svariate altre condizioni possono condurre al d. mellito (d. secondario): le patologie acquisite del pancreas esocrino (pancreatiti, traumi, infezioni, carcinoma pancreatico, ecc.), numerose endocrinopatie (acromegalia, sindrome di Cushing, glucagonoma, feocromocitoma, fibrosi cistica, ecc.) e l’assunzione di farmaci capaci di interferire con la funzione delle cellule beta-pancreatiche. Esiste inoltre un’ulteriore forma di diabete che può verificarsi durante la gravidanza: il d. gestazionale. Questo insorge in circa il 2% delle gravidanze e viene generalmente diagnosticato nel II-III trimestre, dovuto alla secrezione placentare di ormoni che favoriscono una iperglicemia; la tolleranza glucidica tende generalmente a normalizzarsi dopo il parto.
Diagnosi e terapia del diabete mellito
La diagnosi, secondo i criteri stabiliti dall’American Diabetes Association, si basa sulla misurazione dei livelli di glicemia a digiuno (valori patologici: ≥126 mg/dl) o dopo carico glicidico orale (OGTT, Oral Glucose Tolerance Test, valori patologici a 2 ore: ≥200 mg/dl). La terapia medica, sempre da associare alla modifica dello stile di vita e alla correzione delle errate abitudini alimentari, si avvale dell’utilizzo di ipoglicemizzanti orali (sulfoniluree, biguanidi, glinidi, glitazoni, inibitori dell’alfa-glucosidasi) e di insulina (insulina umana, analoghi dell’insulina).
Diabete e trapianti cellulari
Il diabete comprende una pletora di condizioni patologiche caratterizzate da una insufficienza relativa o completa nella produzione o nell’azione dell’insulina, il principale ormone prodotto dalle isole pancreatiche (isole di Langerhans). Nei casi piu gravi di diabete di tipo I, la distruzione selettiva delle cellule che secernono insulina (cellule beta delle isole di Langerhans), da parte di una reazione autoimmune, comporta una deficienza completa della capacità pancreatica di produzione di insulina endogena.
Il trapianto di cellule insulino-secernenti
Le terapie cellulari per il trattamento del diabete sono ancora a livello sperimentale e hanno l’obiettivo di trapiantare cellule insulino-secernenti prelevate dal pancreas di donatori multiorgano deceduti. La tecnologia per l’estrazione su larga scala delle isole di Langerhans dal pancreas umano è stata sviluppata alla fine degli anni Ottanta del 20° secolo e rimane tuttora alla base delle tecniche utilizzate in trial clinici correnti. Il metodo include la perfusione del pancreas, attraverso il dotto pancreatico, con una miscela di enzimi proteolitici e collagenasi, che distendono l’organo permettendone la successiva digestione enzimatica in una camera di digestione a flusso continuo. Una fase finale di purificazione su gradienti permette poi di concentrare il tessuto pancreatico endocrino (isole) scartando la maggior parte del tessuto esocrino pancreatico. Il prodotto cellulare è quindi sottoposto a diversi controlli di qualità, prima del trapianto, che viene generalmente effettuato in radiologia interventistica, via cateterizzazione percutanea, transepatica, della vena porta, in anestesia locale. Le isole vengono poi infuse nel ricevente in maniera simile a una trasfusione di sangue, collegando al catetere intraportale una sacca con il prodotto cellulare in soluzione.
Evoluzione delle tecniche
La prima serie di allotrapianti (trapianto tra un donatore e un ricevente geneticamente diversi) di isole di Langerhans che hanno avuto successo nel trattamento di pazienti con diabete, ottenendo periodi prolungati di indipendenza dalla somministrazione di insulina esogena (fino a 5 anni), è stata effettuata nel 1990. Questa prima serie di trapianti di isole è stata realizzata al Thomas E. Starzl Transplant Institute dell’università di Pittsburgh, da una équipe internazionale (proveniente da Milano, Miami e Pittsburgh), in pazienti con gravi forme di diabete indotte da pancreatectomia totale, per il trattamento di estese forme tumorali maligne. Questa forma di terapia cellulare è evoluta lentamente nei 15 anni successivi, anche a causa della complessità di una strategia multidisciplinare che richiede un intervento sequenziale e integrato tra specialisti che affrontano problematiche diverse: dall’estrazione di cellule metabolicamente attive (le cellule insulino-secernenti che rappresentano l’1-2% della massa pancreatica) dal pancreas umano, alla ricostituzione di una funzione biologica complessa in un sito di trapianto ectopico (come il fegato), al controllo della reazione immune post-trapianto mediante combinazioni appropriate di farmaci immunosoppressori e immunomodulatori, che permettano di bloccare le reazioni di rigetto immune o la ricorrenza di autoimmunità diretta contro le cellule beta trapiantate. Prima dell’introduzione del protocollo immunosoppressivo, soltanto in un terzo dei casi di trapianto di isole pancreatiche la funzione delle isole trapiantate persisteva oltre un anno dopo l’intervento. Nonostante i risultati clinici siano progressivamente migliorati, il trapianto di isole rimane indicato soltanto a livello sperimentale per il trattamento dei casi più severi di diabete di tipo I, in cui esista una probabilità di episodi di ipoglicemia grave tale da giustificare i rischi associati alla necessità di somministrazione cronica di farmaci immunosoppressori, necessari per prevenire il rigetto immune delle cellule trapiantate o la loro distruzione da parte del processo autoimmune che aveva eliminato selettivamente le cellule beta del pancreas nativo, all’esordio del diabete di tipo I.
Altri trapianti cellulari
Oltre alle strategie di terapia cellulare sostitutiva della funzione pancreatica endocrina compromessa, altre forme di trapianti sperimentali di cellule sono correntemente in via di valutazione e includono i trapianti di cellule progenitrici ematopoietiche (CD34+) o l’infusione di linfociti T regolatori, con l’obiettivo di indurre tolleranza specifica verso le cellule insulino-secernenti trapiantate o per trattare la condizione autoimmune che porta all’attacco immunitario delle cellule insulino-secernenti. Inoltre, trial recenti di terapia cellulare nel diabete di tipo II hanno utilizzato tecniche di autotrapianto di cellule prelevate dal midollo osseo dei pazienti stessi e reinfuse nel pancreas tramite arteriografia selettiva arteriosa, unitamente a un trattamento peritrapianto con ossigenoterapia iperbarica. I risultati iniziali di questi trial suggeriscono un possibile ruolo delle terapie cellulari anche nel campo della medicina rigenerativa del diabete, per stimolare in maniera diretta, o indiretta, la rigenerazione delle cellule insulino-secernenti contenute nelle isole pancreatiche, a partire da precursori o elementi immaturi pancreatici. Le terapie cellulari per il trattamento del diabete sono evolute nelle ultime due decadi del 20° secolo, con un miglioramento progressivo dei risultati clinici a breve e a lungo termine. Diversi gruppi negli Stati Uniti e in Europa sono correntemente impegnati in trial randomizzati per definire efficacia, indicazioni e prospettive delle terapie cellulari nel trattamento del diabete.