CUORE
Cuore
«If I can stop one heart from breaking,I shall not live in vain» (Emily Dickinson)
Lo stato dell’arte della cardiologia
di Pietro Francia
13 febbraio
Il presidente della Repubblica Giorgio Napolitano consegna un riconoscimento al GISSI (Gruppo italiano per lo studio della sopravvivenza nell’infarto), nato 25 anni fa dalla collaborazione tra l’Istituto di ricerche farmacologiche Mario Negri e l’Associazione nazionale medici cardiologi ospedalieri. Le sue ricerche hanno consentito importanti avanzamenti nella prevenzione e nella terapia delle malattie cardiovascolari, patologie che a livello mondiale sono responsabili del 30-40% dei decessi e rappresentano la prima causa di morte sia nei paesi sviluppati sia in quelli in via di sviluppo.
L’infarto del miocardio
Più di qualunque altra epoca storica, il 20° secolo ha fatto registrare un incremento dell’aspettativa di vita e, parallelamente, il modificarsi delle cause di morte. Nei secoli precedenti, le infezioni e la malnutrizione erano responsabili della maggior parte dei decessi nel mondo, mentre alle malattie cardiovascolari si addebitava complessivamente meno del 10% delle morti. Oggi tale percentuale è salita al 30-40 e le malattie cardiovascolari sono divenute la prima causa di morte. In particolare, l’infarto del miocardio è tra le prime cause di morbilità e di mortalità a livello mondiale, con circa 7 milioni di nuovi casi ogni anno. Da patologia propria dei paesi sviluppati, sta diventando sempre più una malattia dei paesi in via di sviluppo, nei quali i processi di rapida urbanizzazione sono accompagnati da un preoccupante incremento della prevalenza di fattori di rischio cardiovascolare quali l’obesità, il diabete mellito, lo stile di vita sedentario, il fumo di sigaretta. Inoltre la crescente epidemia di malattia coronarica in questi paesi non si accompagna a un altrettanto consistente sviluppo dei sistemi sanitari e alla disponibilità di tecnologie biomediche avanzate.
Definizione
L’infarto del miocardio rappresenta la necrosi del tessuto muscolare del cuore a seguito di una prolungata e significativa ipossigenazione delle cellule cardiache, nella quasi totalità dei casi imputabile a una interruzione del flusso ematico coronarico. È definito dalla presenza di un innalzamento dei valori ematici di un particolare indicatore di necrosi cellulare, la troponina, che si presenti in associazione a sintomi tipici (dolore precordiale costrittivo, spesso descritto come un ‘peso’ o una ‘morsa’, localizzato al centro del petto ed eventualmente irradiato al lato ulnare del braccio sinistro, al collo, alla mandibola, o tra le scapole) e a sintomi accessori (intensa debolezza, affanno, cardiopalmo; nausea e vomito possono manifestarsi nel caso in cui l’infarto interessi la parete inferiore del cuore), specifiche modificazioni dell’elettrocardiogramma, o presenza di anomalie della contrattilità del cuore individuate da un esame di imaging cardiaco (per esempio, l’ecocardiogramma). Non infrequentemente l’infarto del miocardio può presentarsi con il quadro clinico della morte improvvisa, soprattutto quando questa sia preceduta da sintomi tipici o modificazioni elettrocardiografiche specifiche, o quando l’esame autoptico riveli la presenza di una trombosi coronarica recente.
La definizione puntuale della storia naturale dell’infarto miocardico comporta inesattezze e approssimazioni, legate all’occorrenza di eventi acuti asintomatici (per esempio, nei soggetti diabetici) e al fatto che una quota considerevole dei soggetti colpiti da infarto muore improvvisamente, senza dunque una diagnosi certa di malattia. Stime conservative indicano che la mortalità per infarto del miocardio nelle prime 4 settimane è del 50% circa e che la metà di questi decessi avviene nelle prime 2 ore dall’evento.
Cause
Studi epidemiologici di ampie proporzioni hanno documentato come nel 90% circa dei casi il rischio di infarto del miocardio sia legato a fattori modificabili, rappresentati principalmente dal fumo di sigaretta, dalle dislipidemie, dall’ipertensione arteriosa, dall’obesità addominale e dal diabete mellito. Il trattamento farmacologico dell’ipertensione arteriosa, dell’ipercolesterolemia, del diabete mellito e l’adozione di programmi di attività fisica volti a combattere l’obesità hanno infatti dimostrato di poter ridurre drasticamente il rischio di malattia coronarica. La presenza di fattori di rischio non modificabili, principalmente rappresentati da componenti genetiche che svolgono un ruolo nello sviluppo delle lesioni aterosclerotiche coronariche, suggerisce l’opportunità per alcuni soggetti di un controllo ancora più attento dei fattori di rischio modificabili. Sotto il profilo fisiopatologico, la causa principale di infarto del miocardio (circa il 70% dei casi) è rappresentata dalla rottura di una placca aterosclerotica nel lume di un’arteria coronaria. Le placche aterosclerotiche coronariche, lesioni ricche di colesterolo che protrudono nel lume delle arterie coronarie, sono particolarmente vulnerabili e suscettibili di rottura quando interessate da processi infiammatori. La propensione alla rottura è inoltre maggiore quando la placca è anatomicamente costituita da un nucleo centrale (core) particolarmente ricco di lipidi e delimitato da un cappuccio fibroso sottile. La rottura della placca espone al torrente ematico il core lipidico, che è altamente trombogeno e contiene elevate concentrazioni di fattore tissutale (tissue factor), una molecola grandemente procoagulante. Si innesca conseguentemente un processo trombotico in grado di occludere il lume del vaso e di embolizzare nel territorio più distale, il microcircolo, impedendo così l’afflusso di sangue al muscolo cardiaco e determinandone l’ischemia dapprima, e la necrosi successivamente. Una minoranza dei casi di infarto è invece imputabile a spasmi e dissezioni delle arterie coronarie, o a eventi embolici.
Diagnostica
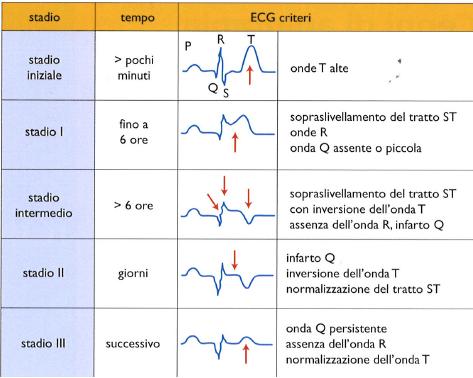
Lo strumento principe nella diagnosi di infarto del miocardio è l’elettrocardiogramma (ECG), che nelle fasi successive all’instaurarsi dell’occlusione di un’arteria coronaria mostra alterazioni dell’attività elettrica del cuore in costante evoluzione. Ai fini dell’inquadramento prognostico e della terapia, assume fondamentale importanza l’alterazione del ‘segmento ST’ dell’ECG (v. fig.), il quale esprime, da un punto di vista elettrico, l’inizio della fase in cui le cellule del cuore si ripolarizzano, cioè recuperano la loro eccitabilità. La presenza di un innalzamento del segmento ST al di sopra della linea isoelettrica dell’ECG (tecnicamente definito ‘sopraslivellamento del tratto ST’) qualifica l’infarto con sopraslivellamento ST o STEMI (ST Elevation Myocardial Infarction), mentre in assenza di tale alterazione si parla di NSTEMI (Non-ST Elevation Myocardial Infarction). I pazienti con STEMI presentano l’occlusione di uno o più rami coronarici epicardici, necessitano di una terapia che riporti rapidamente sangue al cuore (riperfusione) e hanno una elevata mortalità nell’immediato post-infarto. Al contrario, i pazienti con NSTEMI presentano generalmente una grave malattia aterosclerotica che interessa diffusamente le coronarie, pur in assenza di occlusioni acute di una di esse. Possono ricevere la terapia riperfusiva senza carattere di urgenza (generalmente comunque entro 48 ore), hanno una più bassa mortalità nell’immediato post-infarto, ma presentano una mortalità più elevata nel lungo periodo, quest’ultima legata alle comorbidità (ipertensione, dislipidemia, diabete ecc.) che hanno condizionato l’instaurarsi di una estesa malattia aterosclerotica.
Ogni infarto del miocardio comporta la perdita di integrità delle membrane delle cellule muscolari cardiache e il conseguente rilascio nel torrente circolatorio di alcune macromolecole che possono essere dosate nel sangue e utilizzate come ‘marcatori’ di danno cardiaco. I marcatori più utilizzati sono la creatinchinasi (e il suo isoenzima MB), la mioglobina e le troponine cardiospecifiche (troponina I e T). Alcuni di essi, come la mioglobina, presentano valori patologici già entro pochi minuti dall’inizio dei sintomi, ma mancano di specificità. Altri, come le troponine, presentano valori patologici entro 2-3 ore dall’inizio dei sintomi, ma sono estremamente specifici nell’identificare un danno cardiaco. L’aumento dei valori ematici delle troponine oltre una soglia prestabilita è un requisito indispensabile per porre diagnosi di infarto miocardico.
Aree di alterazione della cinesi delle pareti del cuore possono essere osservate quasi invariabilmente nei soggetti con infarto miocardico in corso. L’ecocardiogramma, grazie alla sua facile reperibilità e relativa semplicità di esecuzione, è l’esame di imaging più frequentemente utilizzato per supportare la diagnosi di infarto del miocardio, soprattutto in presenza di alterazioni elettrocardiografiche sfumate o comunque non conclusive. Altre metodiche di imaging come la tomografia computerizzata, la risonanza magnetica nucleare e la scintigrafia miocardica sono utili sia nella diagnosi sia nella stadiazione prognostica della malattia ma, considerata la complessità di esecuzione e la necessità di trasferire il paziente in laboratori dedicati, trovano più frequentemente utilizzo nelle fasi subacute o croniche della malattia.
La coronarografia consiste in un cateterismo cardiaco nel corso del quale viene iniettato un mezzo di contrasto radiopaco nelle arterie coronarie epicardiche al fine di visualizzare il profilo del lume del vaso ed evidenziarne le irregolarità (per esempio, presenza di stenosi, cioè di restringimenti). Le stenosi possono essere di entità variabile, da lieve a severa, sino a configurare un quadro di occlusione dell’arteria coronaria associata alla presenza di materiale trombotico nel lume del vaso (come avviene nell’infarto STEMI). La coronarografia è l’esame diagnostico che indirizza, a seconda del numero delle arterie coronarie malate, dell’entità e della sede delle stenosi, verso la scelta della più idonea terapia di riperfusione miocardica (angioplastica o by-pass coronarico).
Terapia
La terapia dell’infarto miocardico STEMI consiste nella riperfusione precoce. Vale il criterio per cui ‘il tempo è muscolo’, indicativo di come una tempestiva riapertura dell’arteria coronaria occlusa consenta di riportare sangue al muscolo cardiaco prima che questo sviluppi ampie aree di necrosi responsabili di una riduzione, talvolta grave, della performance generale del cuore. Il cardine di una moderna strategia di riperfusione miocardica precoce è l’angioplastica primaria (PCI, Percutaneous Coronary Intervention), una procedura terapeutica eseguita mediante un catetere munito di un ‘palloncino’ su cui è montata una protesi metallica espandibile a maglie (lo stent). Una volta introdotto nel vaso, il palloncino viene fatto progredire sotto controllo radioscopico sino al tratto occluso. Il gonfiaggio del palloncino, situato sulla punta del catetere e comandato dall’operatore, dilata il lume coronarico ed espande lo stent che, aderendo alla parete interna del vaso, ne mantiene pervio nel tempo il lume. In casi selezionati è possibile ricorrere all’utilizzo di stent medicati (DES, Drug Eluting Stent), in grado di rilasciare in loco molecole ad attività antiproliferativa, le quali riducono il rischio che il segmento di arteria coronaria sede dell’angioplastica sviluppi una restenosi. La necessità di eseguire una riapertura tempestiva del vaso occluso ha stimolato l’organizzazione di ‘reti’ sanitarie in grado di massimizzare l’efficienza della gestione dell’infarto STEMI e di ridurre i tempi necessari per la diagnosi e il trasporto presso strutture sanitarie dove poter eseguire l’angioplastica primaria, anche attraverso l’utilizzo della telemedicina.
Nei pazienti con infarto miocardico STEMI, l’alternativa all’angioplastica primaria è rappresentata dalla terapia con farmaci fibrinolitici (alteplase, reteplase, tenecteplase, streptochinasi), che agiscono trasformando il plasminogeno in plasmina, la quale degrada la fibrina sciogliendo quindi i trombi. Il trattamento con fibrinolitici ha costituito il cardine della terapia di riperfusione coronarica dalla metà degli anni 1980, quando uno studio italiano del GISSI (Gruppo italiano per lo studio della sopravvivenza nell’infarto) ha dimostrato in oltre 11.000 pazienti che la streptochinasi era in grado di ridurre la mortalità per infarto del miocardio se somministrata entro 6 ore dall’inizio dei sintomi. Il dibattito scientifico sulla miglior strategia di riperfusione coronarica (fibrinolisi o angioplastica primaria) è continuamente alimentato da evidenze scientifiche emergenti. Tuttavia, l’attuale consenso generale è che la terapia fibrinolitica rappresenti un’opzione terapeutica valida solo quando praticata entro le primissime ore dall’insorgenza dei sintomi o quando l’esecuzione dell’angioplastica primaria comporti un ritardo significativo del tempo atteso per la riperfusione coronarica.
La fase acuta di un infarto del miocardio viene gestita in strutture ospedaliere ad hoc denominate UTIC
(Unità di terapia intensiva coronarica), nelle quali vengono eseguiti trattamenti complementari all’angioplastica o alla fibrinolisi e che agiscono sinergicamente per ridurre il carico di lavoro del cuore (nitrati), incrementare le probabilità di riapertura dell’arteria coronaria colpita e impedire il riformarsi di trombi nella sede della lesione già trattata (farmaci antitrombotici), preservare la funzionalità del muscolo cardiaco (per esempio, ACE-inibitori), proteggere i pazienti dal rischio di aritmie cardiache potenzialmente fatali (per esempio, β-bloccanti). Farmaci chiave nella gestione di ogni paziente colpito da infarto miocardico sono i cosiddetti antiaggreganti piastrinici. Questi ultimi sono rappresentati dall’acido acetilsalicilico e dal clopidogrel, dagli inibitori delle glicoproteine IIb/IIIa (abciximab, tirofiban ed eptifibatide) e dall’eparina, che ha attività anticoagulante. La terapia antitrombotica dell’infarto miocardico si è inoltre arricchita con la disponibilità degli inibitori diretti della trombina (bivalirudina) e degli inibitori del fattore X attivato della coagulazione (fondaparinux), nonché di molecole antiaggreganti a oggi utilizzate ancora in via sperimentale come il plasugrel e il ticagrelor.
L’impossibilità di eseguire una rivascolarizzazione miocardica clinicamente efficace e sicura mediante l’angioplastica indirizza verso la scelta della rivascolarizzazione chirurgica (by-pass coronarico). L’intervento consiste nel confezionamento di ‘ponti’ vascolari in grado di far affluire il sangue a valle delle stenosi coronariche. A tal fine possono essere utilizzate sia arterie (per esempio, l’arteria mammaria interna) sia vene (segmenti di vena safena). L’opzione cardiochirurgica trova attualmente indicazione soprattutto nella malattia coronarica multivasale e particolarmente nei pazienti diabetici, i quali tendono a sviluppare frequentemente restenosi quando le lesioni coronariche vengono trattate con l’angioplastica. Tuttavia, la crescente disponibilità di nuovi materiali e soluzioni tecnologiche avanzate rende l’angioplastica coronarica sempre più efficace e sicura, sicché ne possono beneficiare anche pazienti con malattia coronarica complessa, in passato invariabilmente candidati all’intervento chirurgico.
L’insufficienza cardiaca
L’evoluzione del concetto di insufficienza cardiaca ha comportato, nel corso dell’ultimo decennio, una continua riformulazione della sua stessa definizione. Spesso descritta come la condizione per cui il cuore non è in grado di pompare sangue in quantità adeguate a soddisfare le esigenze metaboliche dell’organismo, l’insufficienza cardiaca trova invece nella formulazione delle più recenti linee guida internazionali una definizione operativa. Viene infatti descritta come la sindrome per cui sono presenti sintomi da insufficienza cardiaca (dispnea da sforzo o a riposo, facile affaticabilità), segni di insufficienza cardiaca (congestione polmonare, edemi periferici, tachicardia, tachipnea, epatomegalia) ed evidenza obiettiva di un’alterazione della struttura o della funzione del cuore a riposo (per esempio, dilatazione del cuore, riduzione della funzione sistolica e/o diastolica). Configurandosi quale potenziale esito di quasi tutte le cardiopatie, l’insufficienza cardiaca ha assunto un impatto drammatico sulla salute pubblica e sulle risorse economiche limitate dei sistemi sanitari. Il progressivo invecchiamento della popolazione e le innovazioni nel trattamento delle malattie cardiovascolari (in particolar modo dell’infarto miocardico acuto), un tempo frequentemente fatali e oggi sempre più curabili, hanno determinato un aumento della sua prevalenza. Ne consegue la necessità di nuovi approcci tesi a riconoscere la malattia nelle sue fasi più precoci, seguirne l’evoluzione stimando con accuratezza la probabilità di eventi avversi, migliorare la sopravvivenza e la qualità della vita dei pazienti.
Circa 15 milioni di persone in Europa sono affette da insufficienza cardiaca, con una prevalenza che raggiunge il 10-20% nella popolazione tra i 70 e gli 80 anni. Nei paesi della Unione Europea, l’insufficienza cardiaca è direttamente responsabile di circa 60.000 decessi ogni anno, mentre ne rappresenta una concausa in poco meno di 300.000. È una sindrome che condiziona negativamente la qualità di vita e presenta una mortalità del 50% a 4 anni dalla diagnosi, che raggiunge il 75% a un anno nei pazienti più gravi. È inoltre una delle patologie più comunemente motivo di ricovero ospedaliero. Le cause sono attribuibili per lo più a frequenti episodi di scompenso cardiaco acuto. Si stima che il 45% dei soggetti ricoverati per scompenso cardiaco venga nuovamente ospedalizzato almeno una volta entro un anno (il 15% due volte). Ne consegue un tale impatto economico che la gestione della malattia arriva a coprire il 2% circa della spesa sanitaria complessiva nei paesi occidentali. In generale, i soggetti più a rischio di sviluppare un’insufficienza cardiaca sono gli anziani. Più a rischio delle donne sono gli uomini, sebbene questa differenza vada riducendosi con l’età. Gli studi epidemiologici indicano inoltre che alcune malattie, fattori di rischio cardiovascolare e comportamenti espongono a un aumento del rischio di sviluppare un’insufficienza cardiaca nel corso della vita. Tra questi l’ipertensione arteriosa, il diabete mellito, l’uso di sostanze cardiotossiche (per esempio, alcol, cocaina, chemioterapici come le antracicline), l’ipercolesterolemia, l’ipo- e l’ipertiroidismo, la malattia aterosclerotica delle coronarie. Inoltre, sono stati indicati come fattori di rischio per insufficienza cardiaca anche l’inattività fisica, l’obesità e il basso livello di istruzione.
Cause e forme
Nei paesi industrializzati, la causa più comune di insufficienza cardiaca (70% dei casi) è la cardiopatia ischemica. I soggetti colpiti da un infarto del miocardio, soprattutto quando non trattato tempestivamente, sviluppano ampie aree di necrosi muscolare. Tali aree subiscono un’evoluzione in senso cicatriziale, trasformandosi in un tessuto privo di proprietà contrattili e quindi non più in grado di partecipare attivamente alla sistole e alla diastole cardiaca. Nel lungo periodo la ridistribuzione del carico di lavoro e delle pressioni a svantaggio delle aree muscolari ancora completamente o parzialmente attive comporta un complesso processo di riespressione genica e attivazione di sistemi neurormonali (primo tra tutti il sistema renina-angiotensina-aldosterone, RAAS) che condizionano lo sviluppo di ipertrofia dei cardiomiociti e dilatazione delle camere cardiache, principalmente del ventricolo sinistro. Altre cause di insufficienza cardiaca di primaria importanza sono le malattie valvolari (soprattutto la stenosi e l’insufficienza delle valvole aortica e mitrale), l’ipertensione arteriosa e le cardiomiopatie (soprattutto la cardiomiopatia dilatativa primitiva), che rappresentano un complesso di malattie caratterizzate da alterazioni patologiche della struttura e della funzione del cuore in assenza di malattia coronarica, ipertensione arteriosa, malattie valvolari o congenite.
Tutte queste forme di insufficienza cardiaca si esprimono solitamente con un deficit della capacità di espellere un volume adeguato di sangue durante la contrazione del ventricolo (disfunzione sistolica). Tuttavia anche la disfunzione diastolica, cioè un deficit di riempimento del ventricolo sinistro, può dar luogo ai tipici segni e sintomi dell’insufficienza cardiaca, configurandosi come un rilasciamento ventricolare rallentato o incompleto che può essere transitorio, come nell’ischemia acuta, o prolungato, come nell’ipertrofia concentrica secondaria a lunghi periodi di sovraccarico pressorio (per esempio, nell’ipertensione arteriosa non controllata di lungo corso, oppure nella stenosi della valvola aortica) o in alcune cardiopatie secondarie a malattie infiltrative, come l’amiloidosi. Nonostante esistano forme di insufficienza cardiaca pura sistolica o diastolica, nella maggior parte dei casi le due varianti coesistono.
Fisiopatologia
Nei pazienti affetti da insufficienza cardiaca, l’ipoperfusione periferica e la congestione venosa sono alla base di una serie complessa di modificazioni a livello del sistema nervoso autonomo e di alcuni sistemi ormonali. L’attivazione del sistema nervoso simpatico comporta la liberazione di noradrenalina, la quale contribuisce ad aumentare la pressione arteriosa e quindi a mantenere una adeguata perfusione dei tessuti attraverso tre diversi meccanismi: costrizione di quasi tutte le arteriole del corpo, con conseguente aumento delle resistenze periferiche; vasocostrizione delle vene e degli altri grossi vasi, che contribuisce a spostare consistenti volumi di sangue verso il cuore, migliorandone in tal modo il riempimento; incremento diretto della contrattilità delle fibrocellule muscolari e della frequenza cardiaca, con un conseguente aumento della gittata. A beneficiare di questi meccanismi omeostatici sono soprattutto il cervello e il cuore, mentre il rene viene scarsamente protetto dall’ipoperfusione. La risposta del rene alla condizione di ipoperfusione consiste nella liberazione di renina e nella conseguente attivazione del sistema RAAS, che aumenta il riassorbimento di acqua e sodio a livello renale sia in modo diretto, sia stimolando la secrezione dalla ghiandola surrenale dell’aldosterone, il quale a sua volta promuove il riassorbimento di acqua e cloruro di sodio da parte del rene. L’attivazione del RAAS è in grado inoltre di indurre un complesso rimaneggiamento della citoarchitettuta del muscolo cardiaco, caratterizzato da ipertrofia dei cardiomiociti e formazione locale di tessuto fibroso. Esiste una chiara integrazione tra i due sistemi descritti, essendo la stimolazione dei recettori β1-adrenergici nell’apparato iuxtaglomerulare del rene a opera del sistema nervoso simpatico uno dei principali stimoli al rilascio di renina. L’iperattivazione del sistema adrenergico e del RAAS viene parzialmente bilanciata dal sistema dei peptidi natriuretici, principalmente dall’ANP (Atrial Natriuretic Peptide) e dal BNP (B-type Natriuretic Peptide). Questo ulteriore network ormonale partecipa alla regolazione del volume plasmatico provocando vasodilatazione e aumento della diuresi e inibendo la secrezione, produzione e/o azione di numerosi ulteriori fattori neurormonali. Agisce attraverso un’azione mirata su tutti gli organi e i tessuti coinvolti nell’omeostasi del sodio e nel controllo della pressione arteriosa. In presenza di una disfunzione del ventricolo sinistro, l’attivazione dei sistemi neurormonali descritti consente il mantenimento della pressione di perfusione di tutti gli organi. Tuttavia, tali meccanismi di compenso producono nel tempo una crescente ritenzione di liquidi e un rimodellamento sfavorevole della geometria cardiaca, con conseguente aumento delle pressioni di riempimento del cuore, riduzione dell’efficienza della sua funzione di pompa e comparsa di sintomi.
Manifestazioni cliniche
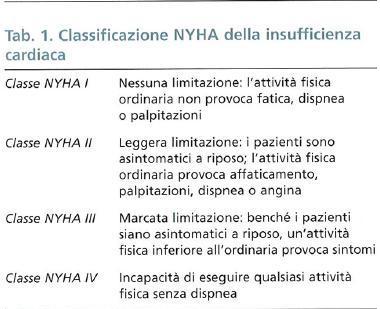
Il quadro clinico varia considerevolmente sulla base di diversi fattori, che comprendono l’età del paziente, la severità e la velocità con cui la funzione cardiaca si riduce. I sintomi e i segni principali interessano il respiro, l’attività muscolare e la diuresi. La dispnea è il sintomo base: consiste in una sensazione di fatica respiratoria più o meno associata a ‘fame d’aria’. È la conseguenza della congestione polmonare, che provoca edema interstiziale e riduce la distensibilità dei polmoni. Proprio sulla base di questo sintomo-guida, la NYHA (New York Heart Association) ha formulato una sistema di inquadramento prognostico dei pazienti con insufficienza cardiaca fondato sul rapporto tra i sintomi clinici e la quantità di sforzo necessaria per provocarli (v. tab. 1). Il grado di dispnea più severo viene raggiunto durante l’edema polmonare acuto, una condizione di congestione polmonare tale da provocare, oltre all’edema interstiziale, anche edema alveolare, con conseguente grave compromissione degli scambi gassosi a livello del polmone. La continua ritenzione di sodio e acqua è inoltre responsabile della comparsa di edemi periferici, generalmente più marcati a livello degli arti inferiori, ma che possono interessare anche altri distretti corporei in caso di grave insufficienza ventricolare sinistra.
I sintomi relativi all’attività muscolare consistono in debolezza e facile affaticabilità, spesso accompagnate da senso di pesantezza agli arti. Sono in genere correlati alla scarsa perfusione dei muscoli scheletrici a causa della ridotta portata cardiaca.
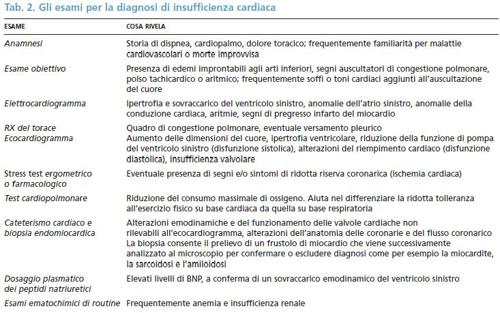
Le alterazioni della diuresi consistono prevalentemente nella nicturia e nell’oliguria. La nicturia, un aumento della diuresi durante le ore della notte, può verificarsi precocemente nel corso dell’insufficienza cardiaca. Durante le ore diurne, il filtrato glomerulare, cioè la quantità di sangue filtrata dalle unità funzionali del rene (glomeruli), è ridotto a causa della maggiore attività del sistema nervoso autonomo simpatico e del sistema RAAS, nonché dell’attività muscolare, la quale comporta una redistribuzione del flusso ematico verso i muscoli scheletrici, lontano dai reni. Di conseguenza, la diuresi è scarsa. Quando durante le ore della notte il paziente rimane in posizione supina, si verifica un insieme di condizioni (riduzione dell’attività muscolare e della richiesta metabolica di ossigeno; riassorbimento di acqua dall’interstizio dei tessuti con conseguente aumento del volume circolante e soppressione dell’ormone antidiuretico) che sinergicamente incrementano il flusso di sangue diretto ai reni. L’oliguria, cioè la contrazione della diuresi, generalmente <500 ml al giorno, è un segno di insufficienza cardiaca avanzata che dipende prevalentemente dalla riduzione della portata cardiaca e conseguentemente del flusso ematico renale (v. tab. 2).
Terapia
I cardini della terapia farmacologica dell’insufficienza cardiaca sono rappresentati dai farmaci diuretici, dai β-bloccanti e dagli antagonisti del sistema RAAS (ACE-inibitori, antagonisti recettoriali dell’angiotensina e antialdosteronici). Gli ACE-inibitori (inibitori dell’enzima di conversione) bloccano l’enzima che catalizza la trasformazione dell’angiotensina I in angiotensina II, l’effettore terminale dell’attivazione del sistema RAAS. I β-bloccanti sono molecole in grado di inibire in modo più o meno selettivo i recettori β-adrenergici, i quali mediano la risposta finale dell’attivazione del sistema nervoso autonomo simpatico. I diuretici sono farmaci utilizzati quasi invariabilmente nel trattamento dell’insufficienza cardiaca. I più diffusi sono quelli dell’ansa (per esempio, furosemide), i quali inibiscono il riassorbimento di acqua e sodio a livello renale. Un’altra classe di farmaci di sempre più largo impiego è rappresentata dagli antialdosteronici, in grado di inibire gli effetti dell’aldosterone (ritenzione di liquidi e rimaneggiamento in senso fibrotico dell’architettura cellulare del muscolo cardiaco). La terapia non farmacologica si basa preliminarmente sulla dieta e sull’esercizio fisico. È documentato infatti che nei soggetti con insufficienza cardiaca la riduzione dell’introito giornaliero di sale e di liquidi migliora i sintomi e riduce il ricorso al ricovero ospedaliero per scompenso cardiaco; i soggetti con insufficienza cardiaca avanzata dovrebbero quindi limitare l’introito di cloruro di sodio a circa 2 g al giorno. I soggetti con insufficienza cardiaca sintomatica caratterizzata da una grave compromissione della funzione del ventricolo sinistro presentano un rischio relativamente elevato di morte improvvisa imputabile a gravi aritmie cardiache (tachicardie ventricolari e fibrillazione ventricolare). In soggetti selezionati affetti da forme severe di disfunzione del ventricolo sinistro è raccomandabile la terapia con il defibrillatore impiantabile, un dispositivo in grado di monitorizzare costantemente l’attività elettrica del cuore e di erogare una terapia (generalmente uno shock elettrico) in presenza di aritmie cardiache pericolose per la vita. Alcuni soggetti affetti da insufficienza cardiaca presentano inoltre un particolare disturbo della conduzione elettrica del cuore noto come blocco di branca sinistra, in presenza del quale la contrazione delle diverse pareti del cuore risulta non coordinata, peggiorando la funzione del ventricolo sinistro. Qualora il blocco della branca sinistra si associ a una severa disfunzione ventricolare sintomatica, i pazienti affetti traggono beneficio dalla cosiddetta ‘terapia di resincronizzazione cardiaca’, eseguita mediante l’impianto di un particolare dispositivo in grado di stimolare contemporaneamente i ventricoli destro e sinistro del cuore. Tali dispositivi dispongono inoltre di una funzione di defibrillazione.
Nell’insufficienza cardiaca terminale intrattabile, soprattutto quando è altrimenti elevata la probabilità di morte entro breve tempo, trova indicazione il trapianto cardiaco. Criteri di esclusione, per cui non è indicata la candidatura a trapianto cardiaco, sono un’età troppo avanzata (generalmente >65 anni), una malattia cerebrovascolare diffusa, la disfunzione irreversibile di altri organi (come per esempio il rene o il fegato), una storia di malattia neoplastica con elevate probabilità di recidiva. I dati più recenti indicano che i pazienti trapiantati hanno una sopravvivenza stimata del 70% a 5 anni dall’intervento e del 50% circa a 10 anni.
Cellule staminali e rigenerazione miocardica
Studi recenti hanno dimostrato che le cellule staminali sono in grado di differenziarsi in cardiomiociti, capovolgendo l’assioma consolidato secondo cui il cuore è un organo incapace di rigenerazione. Queste prospettive hanno stimolato la ricerca di base e clinica nell’ipotesi che le cellule staminali, differenziandosi in cardiomiociti, possano sostituire il tessuto infartuale, integrandosi funzionalmente con le cellule cardiache residenti.
Le cellule staminali embrionali rappresentano la popolazione cellulare con le più ampie potenzialità di differenziazione, essendo in grado di trasformarsi in nuove linee cellulari dotate di proprietà funzionali caratteristiche di diversi tessuti. A livello sperimentale, le cellule staminali embrionali sono in grado di differenziarsi in cardiomiociti e di contrarsi ritmicamente con le altre cellule miocardiche quando impiantate nelle aree infartuali di modelli animali. Tuttavia, l’utilizzo di queste linee cellulari comporta problematiche metodologiche ed etiche non trascurabili. Inoltre, essendo tali cellule pluripotenti e ‘immortalizzate’, esistono incertezze circa il loro potenziale tumorale. Le cellule staminali di origine midollare sono cellule pluripotenti derivate dal midollo osseo dell’adulto. Alcuni studi sperimentali indicano che, una volta trapiantate in modelli animali di infarto miocardico, queste cellule sono in grado di promuovere la rigenerazione miocardica attraverso la formazione di nuovi cardiomiociti, fibroblasti e cellule muscolari lisce. La scoperta dell’esistenza di cellule staminali cardiache, ovvero cellule staminali residenti proprie del cuore, ha promosso il tentativo di stimolarne la differenziazione in cardiomiociti e la crescita. Studi in modelli animali hanno dimostrato come l’iniezione di tali cellule a livello del muscolo cardiaco danneggiato sia in grado di stimolare la rigenerazione del miocardio, migliorando globalmente la contrattilità cardiaca. Tentativi di rigenerazione miocardica sono stati inoltre eseguiti adoperando mioblasti di muscolo scheletrico, cellule primitive del tessuto muscolare che possono essere iniettate a livello del ventricolo disfunzionante dopo essere state prelevate dallo stesso paziente ricevente. Tuttavia, pur integrandosi nel tessuto miocardico del ricevente, i mioblasti scheletrici non sono in grado né di differenziarsi in cardiomiociti, né di formare con essi giunzioni cellulari. È stato osservato che proprio l’assenza di connessioni cellula-cellula è alla base di un rischio tutt’altro che trascurabile di aritmie cardiache fatali. Esistono dunque evidenze divergenti circa la possibilità che il processo di sostituzione del tessuto infartuale con cellule staminali possa realizzarsi in modo funzionalmente efficace e clinicamente utile. Per esempio, mentre è stato osservato come un infarto del miocardio comporta la perdita di miliardi di cardiomiociti, non esistono prove che una simile ‘ripopolazione’ cellulare possa essere ottenuta attraverso l’impianto di cellule staminali. Pur essendo il numero di cellule trapiantate e realmente integrate nelle aree cardiache danneggiate relativamente basso, esistono evidenze di come l’impianto di cellule staminali embrionali consenta un più favorevole rimodellamento cardiaco post-infartuale, con ridotto assottigliamento delle aree di fibrosi post-necrotica e contenimento della dilatazione del ventricolo sinistro. Questi risultati fanno ritenere che l’evoluzione favorevole del rimodellamento della geometria cardiaca dopo l’impianto di cellule staminali possa essere imputabile all’azione che alcune molecole (citochine), prodotte dalle stesse cellule staminali, esercitano sulla composizione della matrice extracellulare cardiaca, un network costituito principalmente da collageno, che regola la composizione del tessuto fibroso e
l’architettura della parete miocardica. L’entusiasmo legato ai risultati sperimentali sulla rigenerazione miocardica si è tradotto precocemente in un numero consistente di sperimentazioni di piccole dimensioni nell’uomo, le quali hanno prodotto risultati globalmente positivi. Tuttavia, il banco di prova dei trial randomizzati (studi in cui un gruppo di pazienti è stato casualmente assegnato a terapia medica ottimale e trattamento con cellule staminali, mentre l’altro alla sola terapia medica ottimale) ha fornito risultati contrastanti. Gli studi a oggi disponibili hanno documentato complessivamente un beneficio transitorio, legato in massima parte a una iniziale riduzione delle dimensioni dell’area infartuale e a un miglioramento della funzione del ventricolo sinistro che tendono a svanire dopo 6-12 mesi dalla terapia. Le discrepanze tra evidenze acquisite in laboratorio e reale efficacia clinica della terapia di rigenerazione miocardica mediante cellule staminali possono essere imputabili a diversi fattori, soprattutto di ordine metodologico nella conduzione degli studi clinici. È tuttavia opinione scientificamente condivisa che in questa fase sia necessario concentrare nuovamente gli sforzi sulla ricerca di base per comprendere le proprietà rigenerative delle diverse cellule staminali in vista di un possibile impiego clinico.
Cenni di anatomia e fisiologia
Il cuore, organo muscolare cavo, è il centro del sistema circolatorio, del quale costituisce il motore. La sua funzione è quella di porre in movimento il sangue nel sistema vascolare e di mantenerlo in permanente circolazione, assicurandone così la distribuzione a tutti i tessuti dell’organismo. Nell’esecuzione di tale compito, il cuore svolge un’enorme mole di lavoro che esegue incessantemente durante l’intero arco della vita dell’individuo. L’azione cardiaca consiste nella contrazione ritmica e coordinata delle pareti muscolari delle cavità atriali e ventricolari. Durante la contrazione, il sangue contenuto in queste cavità viene sospinto in modo tale che la sua progressione, condizionata da dispositivi valvolari, avvenga sempre dall’estremo arterioso a quello venoso del sistema circolatorio. Nell’individuo adulto, il cuore è costituito da quattro cavità, due atri e due ventricoli, divisi tra loro rispettivamente dal setto interatriale e dal setto interventricolare. Ogni atrio comunica con il rispettivo ventricolo mediante un orifizio atrioventricolare, fornito di un apparato valvolare (la valvola mitrale, o bicuspide, a sinistra; la valvola tricuspide a destra) disposto in modo tale da permettere il passaggio del sangue dall’atrio al ventricolo, e non viceversa. Tali valvole sono formate rispettivamente da due e tre lembi (cuspidi) che presentano, nel punto centrale del loro margine libero, un ispessimento, detto nodulo di Albini. In ciascun atrio la cavità è prolungata da un diverticolo, detto auricola. Nell’atrio destro si notano: gli orifizi di sbocco delle due vene cave (che trasportano il sangue dal distretto venoso), uno dei quali, quello della cava inferiore, è munito di una valvola insufficiente (valvola di Eustachio); lo sbocco del seno coronario (la dilatazione terminale della grande vena coronaria), con la valvola di Tebesio; alcuni rilievi a disposizione parallela, detti muscoli pettinati; una depressione (fossa ovale) sul setto interatriale. Nell’atrio sinistro si notano: i quattro sbocchi delle vene polmonari (che trasportano il sangue dal distretto polmonare) e la plica semilunare, residuo del forame di Botallo embrionale. Ogni cavità ventricolare, oltre l’orifizio atrioventricolare, presenta anche un orifizio arterioso, per la comunicazione a sinistra con l’aorta (orifizio aortico) e a destra con l’arteria polmonare, fornito di tre cuspidi (valvole semilunari) che presentano i bordi liberi divisi in due lunule da un nodulo e che delimitano, con la parete interna delle rispettive arterie, degli spazi, detti seni arteriosi di Valsalva. In ogni ventricolo si notano anche delle formazioni muscolari, le colonne carnose, dette di 1°, 2° e 3° ordine a seconda che siano attaccate alle pareti ventricolari con una sola estremità, con entrambe o in tutta la loro lunghezza. Quelle di 1° ordine, o muscoli papillari, si inseriscono alle cuspidi valvolari tramite le corde tendinee. La parete cardiaca è costituita fondamentalmente da una robusta tunica muscolare, il miocardio, i cui fasci si inseriscono sullo ‘scheletro’ del cuore, rappresentato da quattro anelli fibrosi che circondano i quattro grandi orifizi e dai due trigoni fibrosi, ispessimenti dei detti anelli. Il miocardio è avvolto dall’epicardio (foglietto viscerale del pericardio sieroso) e rivestito internamente dall’endocardio, tunica endoteliale e connettivale che si continua nella tunica intima dei vasi che fanno capo al cuore. Le fibre muscolari cardiache (miocardiociti) sono striate, similmente ai muscoli volontari scheletrici, ma si caratterizzano per la loro disposizione a rete sinciziale e per la presenza di dischi rifrangenti posti trasversalmente a intervalli irregolari (strie intercalari o scalariformi). Delle fibre miocardiche alcune (fibre comuni) passano dall’uno all’altro atrio o ventricolo, altre (fibre proprie) appartengono a un solo atrio o a un solo ventricolo. Il cuore è provvisto di un sistema per la generazione e la conduzione degli impulsi elettrici. Gli stimoli che determinano la contrazione degli atri originano a livello del nodo senoatriale (o nodo di Keith e Flack), sito a livello della giunzione tra vena cava superiore e atrio destro. Al nodo di Keith e Flack giungono dal plesso cardiaco rami simpatici, che esercitano un’azione acceleratrice sul ritmo del cuore, e rami parasimpatici (vagali), ad azione rallentatrice. La connessione elettrica tra atri e ventricoli avviene per mezzo del sistema specifico di conduzione atrioventricolare, costituito da formazioni di tessuto miocardico particolarmente differenziato (nodo atrioventricolare, o di Tawara, e fascio di His). Da qui gli impulsi elettrici si propagano uniformemente ai due ventricoli attraverso le branche destra e sinistra del sistema specifico di conduzione.
All’irrorazione del cuore provvedono le arterie e le vene coronarie. Le due arterie coronarie prendono origine dall’aorta in corrispondenza dei seni del Valsalva e percorrono, con i loro rami, i solchi interventricolari e il solco atrioventricolare sulla superficie esterna del cuore. Le vene coronarie raccolgono il sangue refluo dal cuore stesso e lo convogliano nel sistema venoso del seno coronarico, che sbocca a livello dell’atrio destro.
Dal punto di vista fisiologico, il cuore svolge la sua attività come una pompa, a cicli, ciascuno dei quali comprende un periodo di riempimento (diastole) seguito da un periodo di espulsione (sistole). Durante ciascun ciclo un gran numero di miocardiociti deve svolgere un’attività coordinata: generazione spontanea dell’impulso, che ha luogo normalmente solo nel nodo del seno (pacemaker naturale del cuore); propagazione coordinata dell’impulso di contrazione da una cellula all’altra attraverso le vie di conduzione; sviluppo di un potenziale d’azione di lunga durata durante il quale il muscolo non può essere rieccitato. La membrana del miocardiocito, costituita da una complessa stratificazione di protidi e lipidi, è diversamente permeabile agli ioni K+ e Na+, e ciò in ragione di condizioni chimico-fisiche e di processi metabolici attivi (meccanismi di ‘pompa’). In rapporto alla situazione elettrochimica derivante dalla distribuzione di questi e di altri ioni, fra i due lati della membrana della cellula in riposo esiste una differenza di potenziale, dovuta al fatto che il mezzo intracellulare è negativo (o meno positivo) rispetto a quello extracellulare. Quando la cellula viene stimolata, la resistenza della membrana diminuisce, ossia aumenta la sua permeabilità ai vari ioni, che possono quindi attraversarla con libertà molto maggiore. In questa fase, il flusso di Na+ verso l’interno prevale nettamente su quello di Cl- nella stessa direzione e di K+ verso l’esterno, per cui la carica elettrica del mezzo intracellulare e la polarità della membrana si annullano e addirittura si invertono (depolarizzazione della membrana). Fra l’area depolarizzata e il resto della cellula (o l’esterno) esiste logicamente una differenza di potenziale, che prende il nome di potenziale di azione. Le variazioni di potenziale che si accompagnano alla propagazione del fronte di depolarizzazione possono essere registrate dall’elettrodo di un elettrocardiografo. L’azione ritmica del cuore si svolge attraverso tre fasi essenziali, componenti la cosiddetta ‘rivoluzione cardiaca’ o ‘ciclo cardiaco’: nella prima fase, la contrazione ventricolare, la pressione all’interno dei ventricoli aumenta sino a comportare la chiusura delle valvole atrioventricolari e l’apertura delle valvole semilunari e, conseguentemente, l’eiezione del sangue nell’aorta (dal ventricolo sinistro) e nell’arteria polmonare (dal ventricolo destro). Nella seconda fase, i ventricoli si rilasciano e la pressione al loro interno si riduce progressivamente sino a risultare inferiore a quella aortica (per il ventricolo sinistro) e polmonare (per il ventricolo destro). Essendo in questa fase le valvole atrioventricolari ancora chiuse, il rilasciamento dei ventricoli non comporta variazioni del loro volume interno (rilasciamento isovolumetrico). Nella terza fase, la pressione all’interno dei ventricoli scende al di sotto di quella degli atri, e con la contemporanea apertura delle valvole atrioventricolari inizia la fase di riempimento ventricolare precoce. Questa virtualmente si interrompe quando la pressione all’interno dei ventricoli eguaglia quella degli atri. A questo punto, il completamento del riempimento ventricolare richiede la contrazione degli atri, che spingono il sangue attraverso le valvole atrioventricolari verso i ventricoli. La fase che inizia con la contrazione dei ventricoli e termina con il raggiungimento della massima eiezione di sangue in aorta ed in arteria polmonare prende il nome di sistole, mentre la fase successiva, essenzialmente rappresentata dal rilasciamento dei ventricoli, prende il nome di diastole. Tutta la rivoluzione cardiaca si svolge in meno di un secondo. Quando esiste una maggiore richiesta di ossigeno da parte dell’organismo (lavoro muscolare, stati febbrili, ipertiroidismo ecc.) il cuore aumenta la propria gittata per minuto, accelerando il ritmo (tachicardia) e immettendo in circolo a ogni sistole una maggiore quantità di sangue.
Fattori di rischio delle malattie cardiovascolari
In Europa, le malattie cardiovascolari, incluse la malattia aterosclerotica coronarica e l’ictus, sono la principale causa di morte nella popolazione adulta, provocando il 50% circa di tutti i decessi. Nonostante negli ultimi decenni i tassi di mortalità siano in progressiva riduzione, la prevalenza delle malattie cardiovascolari è in aumento, principalmente a causa dell’invecchiamento della popolazione. D’altro canto, l’attuale tendenza a un incremento della prevalenza dell’obesità nei bambini e negli adolescenti potrebbe comportare nel prossimo futuro un livellamento verso il basso dell’età media di insorgenza.
Le malattie cardiovascolari sono strettamente legate alle abitudini di vita e a specifici fattori di rischio. Da un punto di vista epidemiologico per fattore di rischio si intende una caratteristica di un individuo o di una popolazione che si associa a un aumento del rischio di sviluppare in futuro una malattia. Per essere di una qualche utilità clinica, i fattori di rischio devono poter essere agevolmente e precocemente identificabili, al fine di consentire strategie di prevenzione. La correzione dei fattori di rischio, quando non esista ancora evidenza di malattia conclamata, viene definita ‘prevenzione primaria’. In ambito cardiologico, il principale obiettivo della prevenzione primaria è la riduzione dell’incidenza dell’infarto del miocardio e dell’insufficienza cardiaca attraverso la correzione di fattori di rischio quali l’ipertensione arteriosa, l’ipercolesterolemia, il fumo, il diabete mellito e l’obesità. Studi europei di ampie dimensioni hanno infatti dimostrato come il 70% circa di tutti i nuovi casi di infarto sia attribuibile a errate abitudini di vita (tra cui il fumo, l’alcol, il basso consumo di frutta e vegetali, la sedentarietà) e come fino al 90% sia legato a pochi fattori di rischio facilmente identificabili.
Tradizionalmente, la prevenzione cardiovascolare è stata concepita come l’adozione di misure preventive e trattamenti tesi a combattere singoli fattori di rischio. Tuttavia, le evidenze scientifiche emergenti sono concordi nell’indicare che le malattie cardiovascolari hanno un’eziologia multifattoriale e che i singoli fattori di rischio possono agire sinergicamente con un effetto moltiplicativo sul rischio cardiovascolare. L’ipertensione arteriosa, definita come una pressione arteriosa sistolica Ž140 mmHg e/o diastolica Ž90 mmHg, è una delle principali cause di morte prematura nel mondo. Il rischio di andare incontro a un evento cardiovascolare (per es., infarto del miocardio o ictus) raddoppia ogni 10 mmHg di aumento della pressione diastolica o ogni 20 mmHg di aumento della pressione sistolica. Il controllo dei valori di pressione arteriosa può essere perseguito sia attraverso interventi mirati sullo stile di vita sia con la terapia farmacologica. I primi, utilizzati come primo approccio nelle forme di ipertensione lieve, consistono principalmente nella riduzione dell’eccesso ponderale e del contenuto di sale nella dieta, nonché nella pratica regolare di attività fisica. La terapia farmacologica, che deve essere iniziata anche in caso di ipertensione lieve quando la correzione dello stile di vita non risulti efficace, prevede l’utilizzo di molecole quali gli antagonisti del sistema renina-angiotensina-aldosterone (ACE-inibitori, bloccanti recettoriali dell’angiotensina II, recentemente gli inibitori diretti della renina), i calcio-antagonisti, i diuretici e i β-bloccanti. Il fumo di sigaretta è il fattore di rischio dominante per morte cardiaca. Gli effetti cardiovascolari sono principalmente legati alla promozione della disfunzione vascolare, della formazione di placche aterosclerotiche nelle arterie e della aggregazione piastrinica. Nonostante l’astensione dal fumo migliori in modo marcato la prognosi dei pazienti con malattie cardiovascolari, è stato stimato come i fumatori che non hanno mai avuto eventi cardiovascolari e che smettono di fumare impieghino fino a 10 anni per raggiungere il rischio cardiovascolare di coloro i quali non hanno mai fumato.
L’ipercolesterolemia non produce sintomi, rappresentando solo un fattore di rischio. La probabilità di sviluppare una malattia aterosclerotica delle coronarie dipende in modo sensibile dagli altri fattori di rischio cui l’ipercolesterolemia si associa. Il rischio cardiovascolare può essere basso in presenza di ipercolesterolemia lieve e isolata, ma aumenta drasticamente qualora questa si associ a fattori quali il fumo di sigaretta o, ancora più significativamente, il diabete mellito. Il colesterolo è veicolato nel sangue da lipoproteine a densità variabile, principalmente LDL (Low Density Lipoproteins) e HDL (High Density Lipoproteins). Particolare attenzione è posta sul colesterolo LDL, implicato nel rischio di aterosclerosi. Al contrario, valori elevati di colesterolo HDL rappresentano un fattore protettivo. Secondo le attuali linee guida europee, la decisione di impostare una terapia ipocolesterolemizzante si basa sulla stima del rischio cardiovascolare a 10 anni in funzione della presenza di altri fattori di rischio. Un rischio globale <5% a 10 anni suggerisce l’impiego di modificazioni dello stile di vita (dieta a basso contenuto di grassi, attività fisica, astensione dal fumo) tese a ridurre il colesterolo totale al di sotto di 190 mg/dl e la frazione LDL al di sotto di 115 mg/dl. Un rischio persistentemente elevato e il mancato raggiungimento di un profilo lipidico adeguato nonostante appropriate modificazioni dello stile di vita indirizzano verso una terapia farmacologica. I soggetti con malattia ateroslerotica nota o fattori di rischio come il diabete mellito hanno necessità di un controllo più intensivo della colesterolemia, con valori target di LDL inferiori a 80-100 mg/dl.
Circa 250 milioni di persone nel mondo sono affette da diabete mellito, numero destinato a raggiungere, secondo l’OMS, i 380 milioni entro il 2025. La prevalenza della malattia supererà il 6% della popolazione generale adulta nell’arco dei prossimi 15 anni. Il diabete è una malattia complessa caratterizzata da iperglicemia e frequentemente associata a ipertensione arteriosa, ipercolesterolemia, obesità e modificazioni aterogene e protrombotiche della parete delle arterie. Questi fattori interagiscono sinergicamente aumentando in modo sensibile il rischio cardiovascolare globale. La mortalità per malattie cardiovascolari nei soggetti diabetici è infatti da 2 a 8 volte maggiore rispetto ai soggetti con glicemia normale, e la malattia aterosclerotica delle coronarie è responsabile del 75% di tutti i decessi. L’elevato rischio cardiovascolare legato al diabete suggerisce la necessità di strategie farmacologiche e comportamentali volte non solo al controllo della glicemia, ma soprattutto a contenere tutti fattori di rischio associati.
La morte cardiaca improvvisa
Sebbene la mortalità associata a eventi cardiovascolari sia diminuita negli ultimi decenni, la morte improvvisa, tecnicamente definita come un decesso che occorre in modo inatteso entro un’ora dalla presentazione di sintomi, rimane la più frequente causa di morte sia negli Stati Uniti sia in Europa, con un’incidenza globale compresa tra lo 0,1 e lo 0,2% per anno. Per il carattere di imprevedibilità e di drammaticità che la caratterizza, la morte improvvisa ha un impatto umano, medico e sociale pressoché unico. In un’ampia maggioranza dei casi è imputabile a gravi e improvvise aritmie cardiache, quali la tachicardia ventricolare, la torsione di punte, la fibrillazione ventricolare. Queste possono far parte del quadro clinico di una cardiopatia strutturale (per esempio in soggetti con pregresso infarto del miocardio); in altri casi i soggetti, pur avendo un cuore strutturalmente normale, presentano un’alterazione di particolari strutture cellulari che presiedono alla regolazione degli scambi di ioni tra l’interno e l’esterno della cellula o tra i diversi comparti cellulari (per esempio la sindrome del QT lungo). A livello epidemiologico, la morte cardiaca improvvisa aritmica ha un’incidenza particolarmente elevata nei soggetti affetti da insufficienza cardiaca (è responsabile all’incirca del 50% dei decessi) e molto bassa nella popolazione generale. Tuttavia, il numero assoluto di eventi è centinaia di volte maggiore nella popolazione generale di soggetti asintomatici che non in quella di pazienti affetti da una cardiopatia strutturale, a indicare come siano ancora imperfetti gli strumenti per identificare i soggetti più a rischio di sviluppare tachiaritmie ventricolari potenzialmente fatali, malgrado gli sforzi compiuti negli ultimi anni dalla comunità scientifica.
Nonostante decenni di ricerca scientifica e di imponenti investimenti, la terapia farmacologica si è dimostrata inefficace nel prevenire la morte improvvisa aritmica in una ampia maggioranza di pazienti. Ciò ha promosso lo sviluppo di una tecnologia volta a miniaturizzare strumenti come il defibrillatore, trasformandolo da un apparecchio esterno utilizzabile solo da personale qualificato, in un dispositivo impiantabile (ICD, Implantable Cardioverter-Defibrillator), in grado di riconoscere autonomamente la presenza di aritmie cardiache potenzialmente fatali e di trattarle con l’erogazione di una terapia elettrica. I defibrillatori impiantabili, introdotti per la prima volta all’inizio degli anni 1980 da Michel Mirowski che li definì come «un trattamento non definitivo delle aritmie maligne ricorrenti che non va a sostituire la terapia farmacologica convenzionale», hanno tre funzioni principali: rilevazione dell’aritmia, erogazione di terapie elettriche appropriate, e memorizzazione di informazioni diagnostiche, inclusi i tracciati e i dettagli degli episodi aritmici trattati. L’apparecchio consta di due componenti: un generatore di impulsi e un sistema di elettrocateteri. Il primo è inserito in una tasca sottocutanea o sottomuscolare, generalmente in regione prepettorale sinistra, mentre l’elettrocatetere di defibrillazione viene introdotto attraverso la vena succlavia, ascellare o cefalica e posizionato nel ventricolo destro. Le terapie antitachicardiche erogabili dal defibrillatore impiantabile sono la stimolazione antitachicardica (ATP, Anti-Tachycardia Pacing), che interrompe le tachicardie ventricolari stimolando temporaneamente il cuore a una frequenza superiore a quella dell’aritmia, e lo shock elettrico, il quale consta di un circuito di defibrillazione interna, generalmente tra l’elettrocatetere ventricolare e la cassa del dispositivo.
La disfunzione ventricolare sinistra conseguente a un infarto del miocardio è la causa più frequente di morte cardiaca improvvisa. Il rimodellamento fibrotico cui il muscolo cardiaco va incontro dopo un infarto genera infatti il milieu ideale per la genesi di gravi aritmie cardiache. Nei pazienti con disfunzione ventricolare sinistra, la quasi totalità delle morti improvvise è imputabile a tachiaritmie ventricolari (tachicardia ventricolare o fibrillazione ventricolare). Sono particolarmente esposti al rischio i soggetti con una severa depressione della funzione sistolica del ventricolo sinistro e sintomi da insufficienza cardiaca da lievi a moderati (classe NYHA II e III). Il basso tasso di sopravvivenza dopo un arresto cardiaco ha promosso la necessità di identificare i pazienti ad alto rischio che potrebbero beneficiare del defibrillatore impiantabile. Ampi studi hanno quasi univocamente decretato come tali dispositivi riducano la mortalità nei pazienti con storia di aritmie ventricolari protratte e sintomatiche o arresto cardiaco (prevenzione secondaria della morte improvvisa) e nei soggetti che, pur non avendo una storia di aritmie ventricolari minacciose e sintomatiche, siano affetti da disfunzione ventricolare sinistra grave e sintomi da insufficienza cardiaca (prevenzione primaria della morte improvvisa).
La morte cardiaca improvvisa è inoltre un tratto caratteristico di alcune cardiomiopatie. La cardiomiopatia dilatativa idiopatica, malattia a genesi in larga parte ancora ignota in cui il cuore presenta una progressiva dilatazione e disfunzione ventricolare in assenza di malattia coronarica, rappresenta la seconda causa più frequente di morte improvvisa. La dilatazione del cuore e l’ipocinesia del ventricolo sinistro si associano a un profondo rimaneggiamento del tessuto muscolare, anche in conseguenza dell’attivazione di sistemi neurormonali come il sistema renina-angiotensina-aldosterone. Come nei soggetti con pregresso infarto del miocardio, il rischio di morte improvvisa è più elevato in caso di severa disfunzione del ventricolo sinistro e in presenza di sintomi da insufficienza cardiaca. In questo particolare sottogruppo di pazienti, la prevenzione della morte improvvisa richiede l’impianto di un defibrillatore. La cardiomiopatia ipertrofica è caratterizzata da un aumento degli spessori delle pareti del cuore in assenza di condizioni emodinamiche o circolatorie (per es., ipertensione arteriosa, malattie valvolari) che possano giustificarlo. L’aumento degli spessori parietali è generalmente asimmetrico (spesso a presentare l’ipertrofia più marcata è il setto interventricolare) e l’esame istologico del cuore rivela un grado elevato di ‘disorganizzazione’ dei miocardiociti (myocardial disarray). La malattia ha una incidenza di circa 1:500 nella popolazione generale e presenta frequentemente carattere familiare e trasmissione ereditaria, essendone responsabili mutazioni di geni che codificano le proteine del sarcomero (l’unità funzionale contrattile di ogni cellula muscolare). Il rischio di morte improvvisa è variabile dall’1% al 6-7% annuo, a seconda della gravità del quadro clinico. Fattori di rischio per l’insorgenza di aritmie ventricolari fatali sono un aumento marcato degli spessori delle pareti cardiache, la presenza in anamnesi di episodi di perdita di conoscenza associati a risoluzione del tono posturale (sincopi), la familiarità per morte improvvisa, l’evidenza di aritmie ventricolari di breve durata (le cosiddette tachicardie ventricolari non sostenute), un non soddisfacente incremento della pressione arteriosa durante l’esercizio fisico. In casi selezionati, e in presenza di più fattori di rischio aritmico, è raccomandato l’impianto del defibrillatore. La cardiopatia aritmogena del ventricolo destro è caratterizzata dalla presenza di una progressiva sostituzione del miocardio del ventricolo destro (nelle forme più gravi il fenomeno si estende anche al ventricolo sinistro) con tessuto adiposo e fibroso. La malattia è imputabile a mutazioni dei geni che codificano le proteine dei desmosomi (le giunzioni proteiche che uniscono cellule adiacenti). Nonostante sia una malattia rara (la prevalenza è di circa 1:5000), costituisce una causa tutt’altro che infrequente di morte improvvisa nei soggetti di giovane età, nei quali può rappresentare la prima manifestazione clinica di malattia. Criteri di elevato rischio aritmico, che suggeriscono l’opportunità dell’impianto del defibrillatore, sono rappresentati dalla storia di aritmie ventricolari maligne, familiarità per morte improvvisa, storia di episodi sincopali e presenza di una estesa sostituzione fibroadiposa che coinvolga anche il ventricolo sinistro.
Oltre a interessare soggetti affetti da una cardiopatia strutturale, la morte improvvisa aritmica rappresenta un elemento clinico centrale di alcune malattie ereditarie caratterizzate da alterazioni dei sistemi preposti all’omeostasi elettrica delle cellule cardiache, come per es. i sistemi di regolazione del calcio, del sodio e del potassio. L’impatto umano, clinico e mediatico della morte improvvisa in questi soggetti è notevole, trattandosi spesso di giovani peraltro perfettamente sani. I soggetti affetti presentano un cuore strutturalmente normale, nonostante l’elettrocardiogramma riveli frequentemente tipiche anomalie. Per tale ragione, molti giovani ricevono una diagnosi solo dopo un evento aritmico maggiore (generalmente un arresto cardiocircolatorio trattato con successo), o post mortem, mediante le indagini genetiche eseguite sui familiari. La sindrome del QT lungo è una malattia ereditaria caratterizzata da anomalie della regolazione cellulare degli ioni potassio e sodio che si manifestano all’elettrocardiogramma con un caratteristico e abnorme prolungamento del cosiddetto ‘intervallo QT’. Questo rappresenta in massima parte la durata della ripolarizzazione ventricolare, cioè il tempo che le cellule miocardiche dei ventricoli impiegano per passare dalla fase di depolarizzazione (che corrisponde alla contrazione cardiaca) a quella di ripolarizzazione (cioè la fase di quiescenza elettrica, che corrisponde alla diastole). La malattia è causata da mutazioni (ne sono state identificate oltre 300) in geni (ne sono noti 8) che codificano proteine dei canali regolatori dei flussi cellulari del potassio e del sodio. Il cuore è strutturalmente normale. La prevalenza della malattia è bassa (circa 1:5000), ma la diagnosi precoce è essenziale perché la morte improvvisa può rappresentare la prima manifestazione di malattia. La storia naturale della sindrome del QT lungo è caratterizzata dalla presenza di episodi sincopali, nella maggior parte dei casi associati a esercizio fisico o a stress emotivo. L’aritmia cardiaca dominante è la ‘torsione di punte’, una forma di tachicardia ventricolare polimorfa. Il rischio di aritmie maligne e quindi di morte improvvisa è legato a molteplici fattori, il più importante dei quali è la durata dell’intervallo QT all’elettrocardiogramma di superficie. Il trattamento farmacologico, peraltro non uniformemente efficace in tutti i soggetti, è costituito dalla terapia con β-bloccanti. I pazienti a rischio più elevato di morte improvvisa, soprattutto quando i farmaci β-bloccanti non siano efficaci, beneficiano dell’impianto del defibrillatore.
La sindrome di Brugada è una malattia ereditaria associata a un rischio relativamente elevato di morte improvvisa. È causata da mutazioni di un gene (SCN5A) codificante una subunità di un canale proteico che controlla i flussi dello ione sodio. Il cuore è strutturalmente normale. La diagnosi viene posta sulla base di una tipica anomalia elettrocardiografica (sopraslivellamento del tratto ST nelle derivazioni precordiali destre). I soggetti affetti possono presentare ripetuti episodi sincopali, imputabili ad aritmie cardiache maligne che si estinguono autonomamente. La morte improvvisa si manifesta con frequenza massima tra la terza e la quarta decade di vita ed è generalmente causata da una tachicardia ventricolare polimorfa o dalla fibrillazione ventricolare, che insorgono tipicamente a riposo o durante il sonno. Non esiste una terapia farmacologica di provata efficacia. I soggetti a rischio di morte improvvisa più elevato, soprattutto quando siano documentati pregressi episodi sincopali attribuibili ad aritmie ventricolari o un arresto cardiaco rianimato, necessitano dell’impianto del defibrillatore. La tachicardia polimorfa catecolaminergica è una malattia ereditaria che si manifesta con aritmie ventricolari e morte improvvisa durante l’esercizio fisico o in concomitanza di stress emotivi acuti. È causata da mutazioni a carico dei geni che codificano il recettore rianodinico cardiaco (RyR2) o la calsequestrina (CASQ2), i quali controllano i flussi intracellulari dello ione calcio. Si manifesta con episodi sincopali, generalmente durante l’adolescenza, nonostante la morte improvvisa possa costituire la prima manifestazione di malattia. L’aritmia dominante è una forma particolare di tachicardia nota come ‘tachicardia ventricolare bidirezionale’, nonostante possano verificarsi anche tachicardie ventricolari polimorfe o fibrillazione ventricolare. La terapia, peraltro non uniformemente efficace, prevede l’uso di farmaci β-bloccanti.