Correggere i geni prima della nascita
Correggere i geni prima della nascita
Il 1° febbraio 2016 le autorità britanniche hanno dato il via alla sperimentazione delle nuove tecniche di gene editing su embrioni umani. Una decisione che divide il mondo scientifico.
Il numero di malattie che affliggono la nostra esistenza e che trasmettiamo ai nostri figli e ai nostri nipoti per rattristare, abbreviare o mortificare la loro è in continua crescita e ammonta ormai a diverse migliaia, e ciò giustifica la grande attenzione e il notevole numero di studi che la medicina ha dedicato al problema. La strada della conoscenza è stata lastricata di errori e per molto tempo la medicina si è accontentata della eugenetica negativa (‘questo bambino è affetto da una malattia genetica e io non lo faccio nascere’).
La cosiddetta genetica positiva si è affacciata alla ricerca scientifica con molta prudenza e si è data 2 finalità: correggere le basi delle malattie genetiche con interventi sulle cellule somatiche e impedire la trasmissione delle malattie ereditarie intervenendo sulle cellule riproduttive o sugli embrioni agli stati iniziali di sviluppo. È stata una ricerca difficile, caratterizzata da molti fallimenti: l’inserimento di un gene normale che sostituisse il suo omologo non funzionante o comunque causa di un problema clinico veniva fatto con tecniche che davano scarse garanzie e modestissimi risultati e le varie metodiche sono state via via abbandonate. Oggi abbiamo a disposizione una metodica di correzione genetica (gene – o genoma – editing) nuova, semplice, efficace e poco costosa: la CRISPR-Cas9, molto vicina alla perfezione, che richiede però ancora di essere sperimentata alla ricerca di difetti che gli scienziati potrebbero aver sottovalutato.
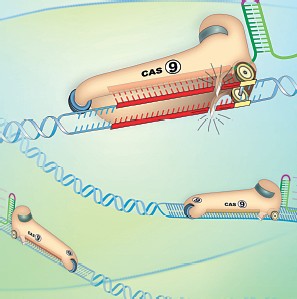
CRISPR-Cas9 è l’acronimo di Clustered regularly interspaced short palindromic repeats, una breve sequenza palindromatica (che cioè può essere letta nei 2 sensi) di DNA non codificante, presente in alcuni batteri, una sorta di memoria immunitaria che fa parte di un sistema di difesa antivirale. In 2 articoli che rappresentano un raro
esempio di chiarezza, razionalità e senso critico – consigliabili anche per capire meglio le dinamiche delle discussioni e delle critiche che hanno fatto seguito alla scoperta di questa tecnica e alle sue prime applicazioni –, Demetrio Neri descrive la tecnica come un GPS (Global positioning system) biologico e utilizza come esempio esplicativo quello di un correttore di bozze di un computer capace di intervenire automaticamente per correggere gli errori, segnalare l’esistenza di anomalie, intervenire (se richiesto) per correggerle cercando contemporaneamente nell’intero testo identici errori.
Il problema del gene editing ha sollevato perplessità ed è stato causa di animate discussioni che hanno riguardato soprattutto la sua applicazione alle cellule germinative e agli embrioni. In realtà, perplessità analoghe avrebbero dovuto nascere anche dall’analisi dei rischi di veder comparire nelle cellule germinali le stesse modificazioni indotte nelle cellule somatiche, cosa molto preoccupante perché eventuali anomalie causate dalle tecniche (definite in modo generico ‘effetti collaterali’) potrebbero diventare ereditarie. Questo problema è stato accantonato, ignorando dati della letteratura che riguardano non solo gli animali, ma anche le esperienze su esseri umani. Le critiche, soprattutto di derivazione religiosa, riguardano invece la sperimentazione su cellule della riproduzione e sugli embrioni che richiedono, oltre che un lungo passaggio sugli animali, anche una fase di ricerca su embrioni umani.
Molti bioeticisti, non solo cattolici, hanno richiesto una fase di moratoria, che a dire il vero sembra più una richiesta di sospensione definitiva (e che ricorda il vecchio paradosso che dà il titolo a Comma 22, il libro di J. Heller: la sperimentazione sull’uomo, infatti, non può aver inizio se non si completa una soddisfacente sperimentazione sugli embrioni, ma sperimentare sugli embrioni deve essere proibito perché eticamente inammissibile).
In realtà la ricerca scientifica è scarsamente sensibile alle regole morali e ai paradossi. È vero che la sperimentazione sugli embrioni è vietata in molti paesi e che nei luoghi nei quali è ammessa esistono regole molto rigide, la principale delle quali riguarda il fatto che in nessun caso gli embrioni che sono stati oggetto di manipolazione possono essere trasferiti in utero (anzi, dopo un periodo di tempo che non può in alcun caso superare i 14 giorni questi embrioni debbono essere distrutti), ma ciò non impedisce che la ricerca sia attiva e inevitabilmente destinata a influenzare i ricercatori di tutto il mondo. È dell’aprile 2015 la pubblicazione di uno studio di alcuni ricercatori cinesi dell’Università Sun Yat-sen di Guangzhoh, di cui molti europei erano a conoscenza (CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes), avvenuta su Protein Cell, una rivista assai poco conosciuta: l’articolo riporta i primi risultati di una sperimentazione di gene editing eseguita su embrioni umani portatori di un’anomalia genetica, la beta talassemia.
L’articolo era stato rifiutato dalle maggiori riviste scientifiche, Nature e Science, per «motivi etici», motivi che è assai difficile condividere trattandosi di esperimenti eseguiti su embrioni non trasferibili e destinati comunque a essere distrutti. In realtà si è trattato di motivi religiosi ed è peculiare che una rivista scientifica non sappia distinguere tra le due cose.
È comunque certo che la ricerca non aveva dato buoni risultati: su 86 embrioni sottoposti a gene editing solo 71 si erano sviluppati fino a 8 cellule, e dei 54 che erano stati presi in esame solo 28 non mostravano più il gene anomalo.
Ma il vero fallimento riguardava il fatto che solo pochissimi di questi embrioni possedevano un DNA normale, e che in molti casi erano comparse mutazioni impreviste.
Dopo la pubblicazione di questi dati sono intervenute in pratica tutte le istituzioni che a vario titolo si occupano dei rapporti tra la scienza e la morale: la critica più frequente considera queste ricerche come assolutamente illecite e ritiene che possano mettere a rischio la nostra comune dignità e la giustizia. Incuranti delle critiche, però, gli scienziati cinesi hanno ottenuto dal Comitato etico dell’Università del Sichuan e dal West China hospital il consenso di sperimentare il gene editing sull’uomo ed è possibile che la fretta che stanno dimostrando (il consenso è stato ottenuto nel giro di settimane) sia dovuta a una sorta di competizione che è cominciata tra la Cina e gli Stati Uniti, che progettano qualcosa di molto simile. La sperimentazione verrà eseguita su un malato terminale (un cancro ai polmoni metastatizzato in molte parti del corpo), che non deve temere effetti collaterali e complicazioni e avrà lo scopo di modificare il DNA dei linfociti T per indurre le cellule immunitarie del malato ad attaccare le cellule neoplastiche. È pensabile, tenendo conto del protocollo generale di sperimentazione presentato dai biologi, che questo studio abbia soprattutto lo scopo di ricercare le mutazioni indesiderate e di rendersi conto della sicurezza della tecnica.
È facile immaginare a quale pressione saranno sottoposti i ricercatori in caso di un successo, anche solo parziale, di questa ‘Rivoluzione DNA’.
L’Europa viaggia a velocità molto inferiore ma sta comunque facendo i primi passi. Il 1° febbraio del 2016 l’HFEA (UK Human fertilisation and embryology authority) ha autorizzato alcuni scienziati che ne avevano fatto richiesta a utilizzare le nuove tecniche di gene editing su embrioni umani. La richiesta portava la firma di una biologa del Francis Crick institute di Londra, Kathy Niakan, il cui gruppo è interessato a utilizzare la CRISPR/Cas9 nei primi giorni di sviluppo embrionale.
L’autorizzazione della HFEA obbliga gli sperimentatori a interrompere la ricerca quando l’embrione ha raggiunto il settimo giorno di sviluppo e consta di circa 250 cellule, e di distruggere subito dopo le blastocisti. Ufficialmente lo scopo della ricerca è quello di acquisire maggiori informazioni sulle fasi iniziali dello sviluppo embrionale, ma è evidente che l’interesse reale riguarda la possibilità di eseguire terapie geniche e di verificarne difficoltà, effetti collaterali e rischi.
La ricerca deve comunque essere definitivamente approvata dalla commissione etica locale e deve considerare comunque la proibizione vigente nel Regno Unito a qualsiasi modifica del genoma di un embrione destinato a essere impiantato: molti ricercatori britannici ritengono che questa norma potrebbe essere rivista e modificata se le sperimentazioni in atto dovessero dare risultati incoraggianti.
Ancora una volta è letteralmente esplosa la polemica, con toni addirittura più isterici di quanto non fosse occorso nelle occasioni precedenti e soprattutto con un eccesso di dichiarazioni improntate a un pessimismo effettivamente ingiustificato, considerate le limitazione imposte dall’HFEA ai ricercatori. Si tenga anche presente che i rischi di mutazioni accidentali (off target) evidenziati dalla ricerca dell’Università Sun Yat-sen diventano ogni giorno meno probabili vista la velocità con la quale queste tecniche vengono corrette e migliorate, e si consideri inoltre il fatto che i continui riferimenti all’esistenza di un pendio scivoloso è un retorico escamotage di chi non ha argomenti validi per assegnare credibilità razionale ai propri dubbi e si limita a nutrirli delle proprie emozioni viscerali. In realtà si ripropone la vecchia, ma mai superata, diatriba sullo statuto ontologico dell’embrione, palleggiata per anni tra filosofi e biologi: complessivamente, e con un buon contributo numerico delle religioni, la bioetica ha formulato almeno una decina di ipotesi che definiscono come inizio della vita personale un periodo che va dall’attivazione dell’oocita (i cattolici) all’acquisizione di un aspetto umano (gli ilomorfisti, ancora una volta cattolici), e che non si vuole accettare il fatto che tutte queste definizioni sono al contempo credibili e fallaci e vanno di conseguenza ignorate.
In realtà sappiamo tutti che la morale di senso comune, quella sulla cui base si costruiscono le regole etiche, si modifica a seguito dell’intuizione dei vantaggi che possono derivare dalle conoscenze possibili. Non può essere un caso che nel luglio 2016 si siano riuniti a Londra i ricercatori che si occupano della costruzione di un utero artificiale e a San Francisco i genetisti che ritengono giunto il momento di scrivere il nostro genoma. Si tratta evidentemente di un conflitto di paradigmi ed è consuetudine che in questi casi siano, prima o poi, le nuove proposte a prevalere. In ogni caso, per concludere, in alcune delle revisioni della letteratura sul gene editing emerge la sollecitazione ad affidare la responsabilità di una decisione ai genitori dei bambini che hanno ereditato gravi malattie genetiche, incompatibili con una accettabile qualità di vita, ed è una sollecitazione condivisibile.
Intorno alla tecnica CRISPR-Cas9 si scatena la guerra dei brevetti
Arriva in tribunale la disputa fra i ricercatori che per primi hanno dimostrato l’efficacia dell’innovativa metodica di editing genetico. Da una parte ci sono le genetiste Jennifer Doudna ed Emmanuelle Charpentier dell’Università della California di Berkeley, dall’altra Feng Zhang, bioingegnere che lavora al Broad Institute del MIT: si disputano la paternità della scoperta della CRISPR-Cas9 depositata presso l’ufficio brevetti statunitense. Le 2 scienziate nel giugno del 2012 pubblicano un fondamentale articolo su Science e 8 mesi dopo fanno richiesta di relativo brevetto, seguendo una procedura standard. A gennaio del 2013 una pubblicazione di Feng Zhang dimostra l’efficacia della tecnica applicata sia alle cellule di topo sia a quelle umane. A ottobre dello stesso anno, seppure in ritardo di 7 mesi rispetto alla richiesta del gruppo rivale, con una procedura a pagamento e dunque più spedita, Zhang riesce a ottenere l’attribuzione del brevetto provvisorio. A seguire, la decisione dell’ufficio brevetti statunitense viene impugnata dall’Università della California di Berkeley, che tutela le genetiste, richiedendo che una commissione dirima la questione. Potrebbe essere sancito un principio di non brevettabilità della scoperta, visto che la tecnica CRISPR-Cas9 è naturalmente impiegata dai batteri per difendersi dagli attacchi dei virus. Oppure la bilancia potrebbe pendere dalla parte delle ricercatrici se si dimostrasse che in realtà Zhang ha solo utilizzato le ricerche di Doudna e Charpentier. Oppure Zhang potrebbe risultare vincitore ove si ritenesse che le sue ricerche abbiano rappresentato un decisivo passo in avanti in questo settore. Inutile aggiungere che dietro la disputa ci sono interessi economici in diritti di licenza, visto che su questa tecnica di editing genetico si sono registrati investimenti milionari da parte di importanti case farmaceutiche.
Le parole
- Eugenetica
Controversa teoria che si propone di ottenere un miglioramento della specie umana, attraverso le generazioni, distinguendo i caratteri ereditari in favorevoli, o eugenici, e sfavorevoli, o disgenici, e cercando di favorire la diffusione dei primi (eugenetica positiva) e di impedire quella dei secondi (eugenetica negativa). La valorizzazione dell’eugenetica positiva dei regimi totalitari del Novecento portò alla teorizzazione del suo utilizzo per affermare la superiorità di tipi o di razze. Questi precedenti hanno posto limiti bioetici precisi alle pratiche di eugenetica positiva (come per le tecniche di clonazione umana oggi proibite dalla generalità dei paesi) che mirano a riprodurre individui con lo stesso patrimonio ereditario, quando esso risulti favorevole. Diversi sono invece gli studi attuali sull’eugenetica negativa che, grazie alle tecniche di ingegneria genetica, consentono di individuare e limitare la trasmissione di gravi malattie ereditarie al fine di ridurne la frequenza nelle generazioni successive.
- CRISPR-Cas9
CRISPR, ovvero un grappolo di corte sequenze ripetute aventi certe caratteristiche e distribuite uniformemente nel DNA. I primi a scoprire queste regolarità sono stati i giapponesi nel 1987 studiando un batterio, l’Escherichia coli: si tratta di sequenze ripetute di genomi di virus che quando infettano il batterio finiscono nel suo DNA. Queste sequenze ripetute servono in realtà ai batteri per riconoscere i virus e per difendersi da nuove infezioni. Sfruttando questa scoperta gli scienziati sono arrivati a costruire 2 aggregati molecolari con le funzioni tipiche l’uno di guida e l’altro di forbici: il primo indica al secondo dove tagliare il DNA difettoso. Le forbici sono in realtà una proteina che si chiama Cas9 e ‘addenta’ il DNA nel punto giusto con l’obiettivo di eliminare geni difettosi (il gene è un frammento di DNA) oppure di tagliarli e sostituirli con geni sani; la guida invece è un frammento di RNA che riconosce e localizza specifiche sequenze del DNA.
E in agricoltura si annuncia la nuova era post OGM
Le piante ottenute mediante la metodica CRISPR-Cas9 vanno classificate tra quelle OGM? In effetti queste nuove piante sono indistinguibili da quelle OGM: possiedono infatti un genoma modificato dall’uomo per ottenere uno specifico scopo, produttivo, economico o nutritivo. Se da un lato alcuni scienziati le ritengono innocue come gli OGM, secondo altri invece esse potrebbero essere nocive per chi se ne nutre o per l’ambiente, e dunque la loro diffusione va disciplinata. Della questione generale riguardante le ‘nuove trecniche di incrocio’ – in termini tecnici le New breeding techniques (NBT), fra le quali si annovera anche la CRISPR-Cas9 – se ne sta occupando la Commissione europea. Da mesi però a Bruxelles ci si ritrova in una situazione di stallo, non riuscendo a prendere una decisione in materia (peraltro non giuridicamente vincolante per gli Stati membri dell’UE). Da parte loro i singoli governi, fra cui quello italiano, aprono degli spiragli alla sperimentazione nel settore agricolo delle NBT prevedendo un’autorizzazione alle attività di ricerca in laboratorio, anche se non ancora in pieno campo. Negli Stati Uniti una decisione definitiva sulla questione è attesa per la fine del 2016, ma già si prevede che il verdetto della Commissione chiamata a pronunciarsi favorirà alla fine le NBT. Negli USA infatti si tende a valutare la sicurezza del prodotto finale e non il processo tecnologico con cui è stato ottenuto. Ovviamente in prospettiva della firma del trattato TTIP tra Stati Uniti e UE si registrano molte pressioni sulla Commissione europea perché la sua decisione non contrasti con quella in via di definizione negli USA in nome della semplificazione e dell’armonizzazione delle normative.
In Canada ha fatto discutere il caso di un fungo champignon, messo in commercio come naturale, a cui la tecnica di gene editing ha permesso di aumentare la durata della conservabilità. In questo scenario le multinazionali del seme si sono mosse per acquisire questa promettente tecnologia. Da un lato la DuPont-Pioneer ha annunciato che fra pochi anni metterà sul mercato delle nuove varietà di mais modificate e resistenti alla siccità ottenute con la tecnica di gene editing. Dall’altro la Monsanto, gigante mondiale del biotech, ha siglato un accordo con l’Istituto di ricerca dove lavora Feng Zhang, il Broad Institute del MIT. L’accordo prevede vincoli etici: non si potrà usare l’editing genetico per modificare piante di tabacco destinate al fumo, per produrre sementi sterili e per introdurre il meccanismo di gene drive, che potrebbe provocare la mutazione artificiale di un’intera specie.
Per saperne di più
- D. Neri, Embryo editing: la nuova frontiera della medicina preventiva, in Bioetica. Rivista interdisciplinare, 2015, 3-4, pp. 193- 218.
- D. Neri, Embryo editing: a proposito di una recente autorizzazione dell’HFEA, in BioLaw Journal, 2016, 1, pp. 261-269.