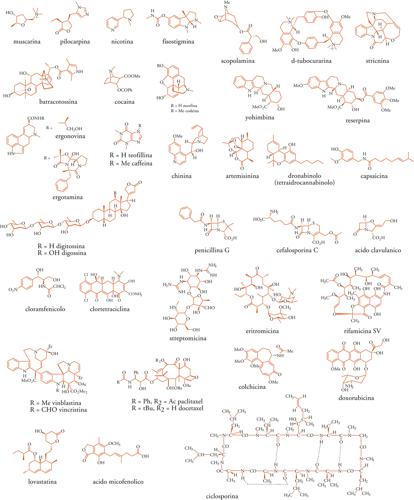
Composti chimici naturali
Composti chimici naturali
La chimica organica ha avuto un ruolo essenziale per lo sviluppo moderno della farmacologia e della terapeutica. Nei primi anni dell'Ottocento, infatti, i chimici furono in grado di isolare allo stato cristallino la morfina, la caffeina, la chinina e la stricnina, delle quali in seguito vennero determinate le formule brute, e, dall'inizio del Novecento, anche alcune formule di struttura. Dovettero però passare numerosi anni prima di risolvere i problemi della stereochimica di questi composti e arrivare così alle prime sintesi totali.
Nella prima metà del Novecento, la chimica delle sostanze naturali (insieme a quella delle vitamine) ha conosciuto una notevole fioritura di premi Nobel: da Paul Karrer e Walter N. Haworth nel 1937 a Robert W. Woodward nel 1965 per i suoi lavori di sintesi totale, in particolare per la monumentale sintesi della stricnina in 39 passaggi. Da quel periodo ‒ che coincide con la scoperta degli antibiotici e nel quale balzò in primo piano la ricerca di metaboliti dei microorganismi ‒ si può datare l'epoca più importante della chimica delle sostanze naturali, che successivamente ha accresciuto le sue potenzialità con una progressione di tipo geometrico.
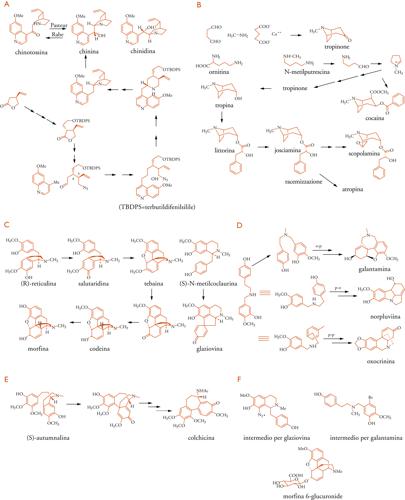
L'esempio della chinina, la prima arma efficace contro la malaria, è paradigmatico dell'evoluzione scientifica nello studio di queste sostanze. Essa fu isolata nel 1820 dalla corteccia della Cinchona rubra peruviana, il cui uso medico si era affermato in Europa già a partire dal XVII secolo. La sua struttura fu definita nel 1908 da Paul Rabe, ma senza alcun riferimento alla sua stereochimica, che fu chiarita da Vladimir Prelog soltanto nel 1944. La prima sintesi artificiale della chinina, attribuita a Woodward (1944), fu in realtà soltanto formale, perché il processo riconduceva alla chinotossina, un composto di isomerizzazione catalizzata da acidi e già ottenuto da Louis Pasteur, di cui Rabe aveva riferito la riconversione in chinina in un lavoro che non poté essere confermato. In seguito, la sfida della sintesi della chinina fu continuata con successo in diversi laboratori, senza obiettivi industriali a causa del costo modesto dell'alcaloide di origine estrattiva. Soltanto negli ultimi anni sono state conseguite sintesi pienamente stereocontrollate dai gruppi di ricerca di Gilbert Stork, di Karl Adler Jacobsen e di Shu Kobayashi.
Durante la Seconda guerra mondiale, l'introduzione del primo antimalarico sintetico ‒ la clorochina, modellata sulla struttura della chinina ‒ è il frutto di un primo esempio (l'altro furono i sulfamidici), di lavoro sistematico di sintesi e di studio delle relazioni tra struttura e attività biologica. Con le metodiche attuali, l'isolamento e la definizione strutturale di un composto di complessità paragonabile alla chinina potrebbe essere concluso in pochi giorni, e la sintesi combinatoriale con screening ad alta produttività potrebbe, nell'arco di mesi, generare analoghi attivi, in un ampio quadro di relazioni struttura-attività. D'altro canto, si può osservare che dagli insegnamenti tratti dalla chimica degli alcaloidi chinidinicisono derivati stimoli innovativi per la chimica organica.
La ricerca di farmaci efficaci contro forme resistenti di Plasmodium ha avuto un importante successo intorno al 1980 con la scoperta dell'artemisinina, ricavata dalla Artemisia annua, denominata Qingchao nell'antica medicina cinese. L'artemisinina è un esempio della varietà e della diversità delle strutture farmacologicamente attive derivabili da fonti naturali, e ha aperto nuovi indirizzi nella ricerca di analoghi sintetici e negli studi dei meccanismi d'azione dei farmaci antimalarici.
Indirizzi attuali nello studio delle sostanze naturali
La potenza delle nuove tecniche di analisi strutturale, come l'NMR (Nuclear magnetic resonance), la spettrometria di massa, la cristallografia, con esecuzioni automatizzate su quantità minime di campioni, e la disponibilità di metodi HPLC (High performance liquid chromatography), insieme alla spettrometria di massa per l'identificazione e la purificazione, hanno impresso nell'ultimo decennio un'accelerazione, insperabile nei periodi precedenti, alla ricerca chimica sulle sostanze naturali. Anche le tecniche di indagine biologica sono molto progredite, grazie alla biologia cellulare e ai modelli animali di patologie sperimentali e di ceppi modificati geneticamente. L'esecuzione seriale automatizzata dei saggi HTS (Hight throughput screening) consente l'esame rapido di grandi numeri (librerie, dall'ingl. library) di composti o anche di estratti non purificati.
Restano aperti i problemi della produzione delle quantità sperimentali per le ricerche avanzate e per lo sviluppo delle produzioni farmaceutiche, resi complessi dal progresso stesso delle metodiche di ricerca, che accedono a sostanze presenti in concentrazioni molto basse, o provenienti da organismi rari, spesso non coltivabili o allevabili. Progressi sono venuti, e sono attesi, dagli studi sulla biosintesi delle sostanze naturali e dalla biologia molecolare, con il trasferimento della biosintesi in microorganismi adatti alla produzione fermentativa, inserendo cluster di geni che esprimono l'intera sequenza enzimatica del processo biosintetico.
La chimica di sintesi ha riprodotto un grande numero di sostanze naturali mediante le sintesi totali, avendo acquisito la capacità di sormontare gradi elevati di complessità strutturale, ma non può prescindere dai problemi dei costi commerciali, se non in un numero minore di casi che riguardano sostanze non eccessivamente complesse: un importante esempio, nel grande momento dello sviluppo degli antibiotici, fu la sintesi industriale del cloramfenicolo (Tav. I). Tuttavia, la chimica organica, che ha derivato molte conoscenze e capacità dal lavoro sulle sostanze naturali, è in grado di intervenire per risolvere passaggi non superabili con i processi microbiologici, e per inserirvi precursori modificati, e, soprattutto, per migliorare con opportune modificazioni strutturali l'attività terapeutica delle sostanze naturali.
Mentre resta attiva la ricerca sulle piante terrestri, i maggiori interessi, per la grande varietà strutturale delle sostanze elaborate, sono rivolti ai microorganismi, fonti di sostanze con attività biologiche molto differenziate, e agli organismi marini, che spesso agiscono in simbiosi con i microrganismi. La ricchezza e la varietà delle sostanze che gli organismi marini offrono agli studiosi non può essere riassunta. Un'indicazione può essere tratta dall'edizione del 2005 del Natural product reports della Royal Society of Chemistry britannica, che elenca, per il solo anno 2003, 656 nuovi composti con struttura originale, isolati da microrganismi, fitoplancton, alghe, spugne, celenterati, briozoi, molluschi, tunicati ed echinodermi.
I processi biosintetici e le sintesi biomimetiche
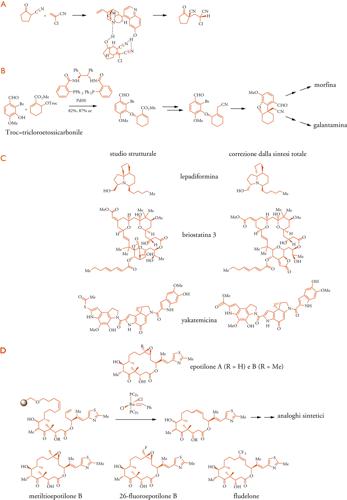
La ricerca del modo di formazione dei metaboliti secondari nelle diverse specie iniziò a partire dalla percezione di Robert Robinson, premio Nobel per la chimica nel 1947, che la loro varietà chimica avesse origine in processi biochimici diversificati, a partire da metaboliti primari comuni nella chimica della vita. Robinson aprì la via agli studi della biosintesi, e anche della riproduzione in laboratorio, già a partire dal 1917, con il suo lavoro sulla sintesi del tropinone, motivato da una carenza di atropina durante la Prima guerra mondiale. L'alcaloide fu ottenuto in unica reazione da dialdeide succinica, metilammina e acetondicarbossilato di calcio (Tav. II B).
In seguito, la biosintesi degli alcaloidi tropanici si è rivelata un campo affascinante. Gli studi di incorporazione isotopica e di singoli passaggi enzimatici hanno portato a un quadro complesso, con aspetti non ancora risolti, sommariamente esposto nella Tav. II B. L'origine e il meccanismo di incorporazione delle due unità acetato richieste indicano una probabile molteplicità di vie (e tra queste l'acetondicarbossilato di Robinson) sia nel percorso verso il gruppo della cocaina che verso quello dell'atropina. L'origine dell'acido tropico nella josciamina è stata chiarita con il ritrovamento in natura dell'intermedio di biosintesi, la littorina, che subisce una trasposizione radicalica enzimatica iniziata dall'estrazione del protone benzilico pro-(S). L'introduzione di un ossidrile che viene convertito a epossido nella scopolamina, e la racemizzazione dell'estere tropico per formare l'atropina sono passaggi terminali.
Il concetto di sintesi biomimetica, come studio di processi sintetici che seguano al meglio possibile i percorsi della biosintesi utilizzando reazioni proprie della chimica di sintesi, fu introdotto da Eugene E. van Tamelen nel 1961. Il lavoro di Robinson, per vari decenni, costituì un corpo organico di conoscenze che si arricchì sempre di più in precisione, ma subì anche correzioni col progresso delle metodologie.
Nel 2006 la morfina ha compiuto 200 anni. La sua struttura era stata chiarita ancora da Robinson nel 1925 e le sintesi totali, dopo la prima del 1952, sono tuttora un'utile palestra per i chimici. La speculazione sulla biosintesi, iniziata da Robinson, ha portato Derek H. R. Barton a dedurre e dimostrare i processi radicalici di accoppiamento fenolico, intramolecolare o intermolecolare, chiarendo l'origine di altri alcaloidi e di un grande numero di polifenoli. La capacità del meccanismo, orto- e paradiretto, di generare non solo sistemi difenolici, ma anche sistemi spirocicloesadienone-fenolo, esemplificato dalla salutaridina nella biosintesi dello scheletro della morfina (Tav. II C), è comune ad alcaloidi di diversa struttura (proapofine, alcaloidi delle Amarillidacee (Tav. IID), del Colchicum autumnale (Tav. II E). Su schemi biomimetici, sono stati sviluppati metodi di sintesi di interesse applicativo (Tav. II F): nel caso della glaziovina con metodo fotochimico dall'8-diazoderivato della N-metilcoclaurina, nel caso della galantamina indirizzando il coupling in orto con un intermedio parabromo protetto.
La ricerca della morfina endogena ha portato alla scoperta di sostanze peptidiche (endorfine, encefaline) che agiscono fisiologicamente sui recettori degli oppiacei. Più recentemente, la rivelazione della presenza della morfina stessa e di suoi precursori negli organi di mammiferi, e le indagini dei relativi percorsi biosintetici, destano curiosità per il possibile ruolo biologico di questa sostanza. È anche di notevole interesse che un metabolita umano della morfina, il 6-O-glucuronide (Tav. II F), sia oggetto di studi clinici avanzati come analgesico postoperatorio, meglio tollerato a causa di un minore effetto emetico. Questa osservazione ci ricorda che lo studio delle trasformazioni indotte sui farmaci, naturali o sintetici, da processi metabolici umani, che hanno generalmente una finalità difensiva (detossificazione ed escrezione), in diversi casi ha indicato la via per la realizzazione di molecole modificate con effetti terapeutici migliori.
Ulteriori progressi nella conoscenza dei meccanismi biosintetici sono derivati dagli studi su microorganismi, che possono essere indagati e pilotati con precise manipolazioni geniche. Attualmente, i prodotti del metabolismo secondario sono ordinati per categorie che fanno riferimento alle sostanze base dei processi biosintetici, quali alcaloidi (derivanti da amminoacidi), polifenoli, polichetidi, terpenoidi e steroidi, peptidi, peptidi non ribosomiali, oligo- e polisaccaridi. Spesso le derivazioni sono miste, come negli alcaloidi steroidici, in quelli isochinolino- o indoloterpenici, nei glicosidi politerpenici e steroidici.
I microorganismi producono una varietà di polichetidi (da unità acetato e propionato) e peptidi non ribosomiali (da amminoacidi, spesso di struttura o stereochimica diversa da quelli essenziali) avvalendosi di sistemi enzimatici PKS (Polyketide synthase), NRPS (Non-ribosomal peptide synthetase) che organizzano una pluralità di passaggi biosintetici. Si tratta spesso di sostanze di interesse terapeutico, come l'eritromicina (polichetide), la ciclosporina (peptide non ribosomiale) o gli epotiloni di biosintesi mista.
La risoluzione dei problemi di produzione di queste sostanze, che sono proibitivi per la chimica di sintesi a causa della loro complessità strutturale, e sono talvolta complicati dalla non adattabilità dei microrganismi ai processi di fermentazione industriale, può essere ricercata nel trasferimento eterologo dei geni biosintetici in microorganismi più adatti. Questo approccio potrà essere determinante per le sostanze degli invertebrati marini, la cui biosintesi si rivela spesso dipendente da meccanismi enzimatici presenti in simbionti batterici degli organismi studiati. Le aspettative di futuri metodi per la produzione su larga scala si indirizzano verso lo sfruttamento biotecnologico di questi processi naturali.
Le tecniche di trasferimento genico potranno anche contribuire alla diversità chimica (varietà) delle sostanze generate, perché spesso nel microorganismo ospite si possono esprimere anche processi biosintetici che restano silenti (criptici) in quello originale.
Farmaci antitumorali dalle piante
I primi antitumorali ricavati da piante superiori sono stati gli alcaloidi indolici vincristina e vinblastina (Tav. I). In questo campo, i maggiori progressi sono stati realizzati con il paclitaxel, il primo farmaco stabilizzatore della tubulina, che ha indotto importanti studi clinici, ma anche notevoli innovazioni negli aspetti chimici, per la sua produzione e per la ricerca di nuovi derivati (tassani). Il meccanismo d'azione è condiviso da nuovi farmaci in studio, come il discodermolide, gli epotiloni, le eleuterobine e le sarcodictiine.
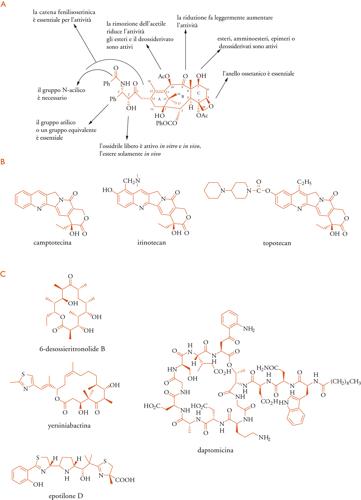
Lo sviluppo farmaceutico e clinico del paclitaxel ha richiesto uno sforzo trentennale. I problemi di reperimento della sostanza, ottenuta nel 1967 in piccole quantità dalla corteccia di una pianta d'alto fusto (il Taxus brevifolia), furono risolti con la scoperta di una fonte rinnovabile e relativamente abbondante di 10-deacetilbaccatina III, che poteva essere convertita semisinteticamente in paclitaxel, nelle foglie di diverse specie di Taxus. Progressi sono stati realizzati anche con culture cellulari di Taxus chinensis e di altre specie. Tra i tassani semisintetici il docetaxel (Tav. I) è già in uso clinico e gli studi vengono attivamente perseguiti (Tav. III A).
L'alcaloide camptotecina, attivo come inibitore della telomerasi I, si è rivelato inadatto alla somministrazione, ma le difficoltà sono state superate con i suoi derivati irinotecan e topotecan (Tav. III B).
Le sostanze naturalidai microorganismi
A partire dal 1940, la grande epoca degli antibiotici può essere ricondotta, nei suoi aspetti scientifici, terapeutici e tecnologici, alla storia degli antibiotici β-lattamici, che, a partire dalla scoperta della penicillina G da parte di Alexander Fleming (1928) e da quella della prima cefalosporina, ha visto gli sviluppi della ricerca, della selezione e della modificazione dei microganismi; dell'isolamento di nuovi termini; delle tecnologie di fermentazione su grande scala; dell'intervento della chimica organica nella creazione di numerosi derivati dell'acido 6-aminopenicillanico, di nuove cefalosporine, e di altri tipi strutturali, anche totalmente sintetici, come il β-lattame monociclico aztreonam. Nel contempo sono state scoperte altre classi di antibiotici (Tav. I), come streptomicina, clorotetraciclina, cloramfenicolo, il cui impiego medico si è molto ridotto, e altre, come eritromicina, gentamicina, rifamicina, a partire dalle quali le modificazioni semisintetiche hanno prodotto (e stanno producendo) strumenti terapeutici più avanzati.
Nuove proprietà e nuove applicazioni mediche dei metaboliti secondari dei microorganismi sono state scoperte ampliando le indagini dalle azioni sui patogeni infettivi alle azioni sulle cellule, normali o anomale, dell'organismo umano. Notevoli progressi terapeutici sono derivati da farmaci antitumorali (dalla mitomicina alle antracicline come la doxorubicina (Tav. I) e la epirubicina, alle bleomicine), e, soprattutto, dai farmaci immunosoppressori, come la ciclosporina, l'acido micofenolico (Tav. I) e il tacrolimus, indispensabili per la sopravvivenza nei trapianti d'organo e utili anche in alcune patologie autoimmunologiche. Nuovi progressi sono attesi dalla rapamicina (sirolimus), come immunosoppressore e anche come antitumorale, e dagli epotiloni, potenzialmente più efficaci dei tassani, che sono oggetto di intensi studi di sintesi. Alla lovastatina (Tav. I), inibitore della sintesi del colesterolo derivato dal Monascus ruber, si sono aggiunti numerosi potenti analoghi semisintetici e sintetici (statine), come, per esempio, l'atorvastatina.
Le produzioni biotecnologiche: i microorganismi come laboratori industriali
La coltura di cellule dell'organismo originatore di una sostanza naturale incontra spesso difficoltà insormontabili. Questo vale per molti microorganismi: per esempio per quelli marini non suscettibili di allevamento in coltura e, a maggior ragione, per gli organismi pluricellulari animali. Difficoltà si presentano anche nella coltura di specifiche cellule vegetali che tendono a degenerare in tessuti multicellulari. Le tecniche di produzione, perciò, si stanno orientando nel senso del trasferimento biotecnologico dei geni, e spesso di cluster di diversi geni, che governano la sintesi delle sostanze di interesse, in microorganismi ben governabili in colture sommerse di grandi volumi. Le potenzialità di questi approcci promettono di allargarsi alla produzione di sostanze modificate, per effetti metabolici intrinseci al microrganismo accettore o per la somministrazione di adatti precursori o, anche, per la possibilità di manipolare i geni da trasferire. Inoltre, si è rilevato che nel trasferimento genico possono diventare operanti meccanismi biosintetici che restavano silenti negli organismi originatori. Queste recenti osservazioni fanno prevedere una nuova diversificazione delle sostanze naturali ottenibili biotecnologicamente.
Le difficoltà sono tuttavia rilevanti e finora i microorganismi adatti a produzioni fermentative sono limitati ad alcuni streptomiceti, pseudomonadi e bacilli, oltre a Escherichia coli, tecnologicamente collaudato nella biosintesi di proteine. Una rassegna del 2005 discute le nuove possibilità alla luce dei risultati sinora ottenuti (Tav. III C). Le biosintesi del 6-desossieritronolide B, aglicone della eritromicina presente nella Saccharopolyspora erythrea e di yersianibactina, un sideroforo che è fattore di virulenza della Yersinia pestis e di altri patogeni, sono state attuate nell'Escherichia coli. I complessi processi biosintetici di questi composti polichetidici, che sono codificati in cluster genici di notevoli dimensioni (dell'ordine di 30 kb), hanno richiesto la coespressione di diversi plasmidi, ciascuno portatore di un gruppo di geni, per il trasferimento in un batterio non correlato.
La produzione dell'antitumorale epotilone D, isolato da Sorangium cellulosum, che ha un ciclo replicativo molto lento, ha potuto essere migliorata mediante il trasferimento del cluster genico in un altro mixobatterio, Myxococcus xanthus, adattabile alla produzione fermentativa.
La daptomicina, un antibiotico lipopeptidico dotato di una strutttura complessa e di un elevato peso molecolare (recentemente introdotto come terapia di seconda istanza nelle infezioni cutanee) è originato dallo Streptomyces roseosporum. La sua produzione eterologa nello Streptomyces lividans rappresenta finora l'esempio di trasferimento di cluster genico di maggiori dimensioni (128 kb).
Antitumorali da organismi marini
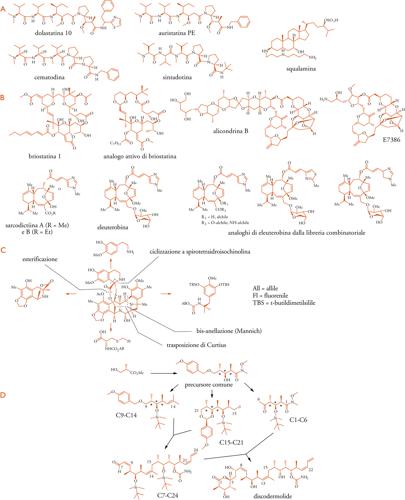
Negli ultimi anni il maggior numero di potenziali antitumorali è stato scoperto in organismi marini. Nella maggior parte dei casi i composti sono emersi dallo screening in 60 diversi saggi che il National Cancer Institute statunitense offre di eseguire sulle nuove sostanze isolate. Tuttavia, ancora nessun farmaco ha raggiunto l'approvazione per l'uso terapeutico. Ci sono obiettive difficoltà nel valutare mediante studi clinici i vantaggi di ogni nuovo antitumorale rispetto ai farmaci in uso, e si ritiene che, in futuro, ci si possano attendere terapie più innovative dalle indagini mirate allo studio dei meccanismi biomolecolari di tumori specifici. Per le sostanze di origine marina, il quadro è complicato dalle difficoltà degli sviluppi produttivi, che si conta di superare con nuovi approcci biotecnologici. La novità e la varietà strutturale offerta dagli organismi marini è ben evidente nel gruppo di sostanze che sono oggetto di studi avanzati (Tav. IV A, B). Gli studi clinici sulla dolastatina-10 sono stati abbandonati, ma sono in corso studi clinici preliminari di derivati modificati (auristatina PE, cematodina, sintadotina). Studi clinici di fase III sono in corso per la ecteinascidina 743, riprodotta per sintesi da Elias J. Corey (premio Nobel 1990 per la chimica) (Tav. IV C), e sono iniziati gli studi sul discodermolide, anch'esso riprodotto per sintesi (Tav. IV D). L'interesse per i risultati clinici della briostatina-1, e per il suo peculiare meccanismo d'azione sulla proteinchinasi PKC-α, ha incentivato gli studi sulla sintesi di analoghi semplificati (Tav. IV B); anche per altre sostanze (alicondrina B, eleuterobina, sarcodictiina) la ricerca di analoghi sintetici è molto attiva. Tutte queste sostanze provengono da invertebrati, o da microorganismi loro associati, con l'interessante eccezione della squalamina, isolata dallo Squalus achantias.
Chimica di sintesi e sostanze naturali: contributi reciproci
Lo studio delle sostanze naturali ha stimolato importanti sviluppi nel campo della chimica organica grazie agli insegnamenti tratti dai processi di biosintesi; ai nuovi suggerimenti per l'esplorazione di reattività insolite osservate nelle sostanze naturali; agli stimoli per la ricerca di nuovi reagenti selettivi e di nuovi gruppi protettivi indotti dagli studi di sintesi totale. Inoltre, la disponibilità di sostanze naturali per la soluzione di problemi di stereochimica ‒ risoluzione di racemi, induzione di nuovi centri chirali come sintoni o come catalizzatori ‒ ha offerto fonti facilmente accessibili, come gli amminoacidi, gli zuccheri e loro derivati, ma anche sostanze complesse non eccessivamente costose e recuperabili, come gli alcaloidi chinidinici.
Le difficoltà che la sintesi totale deve affrontare dipendono dalla struttura della molecola obiettivo e, attualmente, a fronte dei successi già registrati in molti tipi strutturali, dalla sua novità. I problemi originano dalle dimensioni della molecola, dall'instabilità della struttura (intrinseca (termodinamica) o nei confronti di reagenti organici), dal numero delle funzioni (specialmente se comportano reattività diversificate), dal numero dei sistemi ciclici e, in maniera notevole, dal numero di stereocentri.
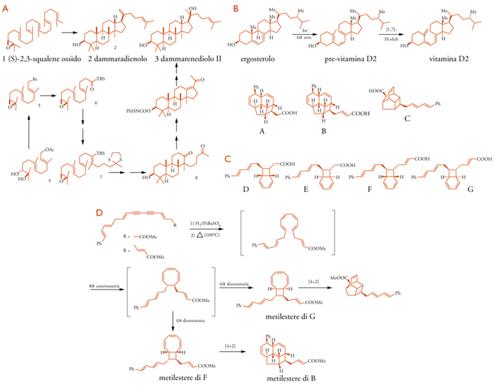
In particolare, i problemi stereochimici da risolvere sono maggiori nel caso degli stereocentri di carbonio quaternario, che comportano una limitata disponibilità di reazioni per generarli e una congestione sterica di 4 sostituenti, specialmente quando 2 di tali stereocentri sono adiacenti. Interessanti processi biosintetici che assemblano stereocentri quaternari sono stati individuati nelle sintesi dei terpeni e degli steroidi, come, per esempio, il processo enzimatico di policiclizzazione dell'(S)-2,3-squalene ossido 1 a dammaradienolo 2 in alcune piante (Tav. V A), che induce 3 stereocentri quaternari con la corretta stereochimica.
Nel 1996 Corey e Linus S. Lin hanno impostato su linee biomimetiche la loro sintesi del dammarenediolo II 3, partendo dal diolo 4. È interessante notare che il diolo 4 è stato ottenuto con alta purezza enantiomerica dall'acetato di (E,E)-farnesile con la reazione di diossidrilazione di Sharpless, catalizzata da diidroderivati di chinina o chinidina. Attraverso il bromuro allilico/epossido 6 e l'acilsilano 8 è stato ottenuto il precursore aciclico 9, con un solo centro chirale; la tripla ciclizzazione cationica a −95 °C ha prodotto un precursore aciclico 10 con la corretta introduzione di 3 stereocentri; le successive elaborazioni hanno condotto al dammarenediolo II 3.
Questo risultato illustra l'efficacia delle strategie biomimetiche per la costruzione di strutture stereochimicamente complesse. D'altro canto, la risoluzione dell'ossidosqualene sintasi umana cocristallizzata con lanosterolo, e gli studi di struttura e di mutagenesi di altri enzimi della famiglia lasciano prevedere l'impiego di enzimi bioingegnerizzati per finalità di sintesi.
In anni recenti, è stata messa in luce una notevole ricchezza di processi biosintetici che utilizzano reazioni pericicliche (cicloaddizioni, trasposizioni sigmatotropiche, elettrociclizzazioni), a lungo apparse prive di ruolo in natura, con qualche eccezione: per esempio la trasformazione nei vegetali dell'ergosterolo nella vitamina D2 mediante l'apertura fotochimica dell'anello cicloesadienico, seguita dallo [1-7]-shift di un atomo di idrogeno (Tav.V B).
Il ruolo delle reazioni di elettrociclizzazione, o di più elettrociclizzazioni in cascata, nei processi biosintetici, anche se talvolta ancora speculativo, ha ispirato molti studi di sintesi biomimetica. Interessanti esempi dello sviluppo parallelo di nuove reazioni organiche, del riconoscimento del loro ruolo biosintetico e dello sviluppo di sintesi biomimetiche, s'incontrano nel gruppo di sostanze con scheletro biciclo[4.2.0] ottadienico, o altro da esso derivato, che si è arricchito dopo la scoperta negli anni Ottanta degli acidi endriandici (Tav. V C) nella lauracea australiana Endrianda introrsa, dei quali D-G hanno forma racemica, e anche di sostanze correlate in microorganismi e in molluschi, talvolta in forme otticamente attive.
La constatazione della forma racemica degli acidi D-G aveva suggerito una formazione non enzimatica da precursori achirali mediante una cascata 8π-6π, seguita da reazioni di Diels-Alder nella trasformazione nei tipi più complessi (A, B, C). La fattibilità del processo biomimetico è stata dimostrata da Kyriacos C. Nicolaou in diversi studi (Tav. V D, R=CH=CH−COO− Me); gli acidi D, E e A sono stati ottenuti in modo analogo dall'intermedio poliene-diinico a catena più corta (R=COOMe).
I lavori dei gruppi di ricerca di Corey e del suo allievo Nicolaou rappresentano la continuità ai nostri giorni dei grandi studi di sintesi totale inaugurati dalla scuola di Woodward. Esempi notevoli del lavoro di Corey, e del suo metodo di analisi retrosintetica, si ritrovano nella sintesi dell'eritronolide B del 1978 (quasi contemporanea della sintesi dell'eritromicina A da parte di Woodward nel 1981) e in quella della ecteinascidina 743 richiamata nella Tav. IV C.
Dal gruppo di Nicolaou, molto attivo, a partire dal 1990 sono stati risolti i problemi delle sintesi della rapamicina (1993), del paclitaxel (1994), degli epotiloni (1997-2002), dell'eleuterobina e delle sarcodictiine (1997) e, al contempo, è stata elaborata la strategia di integrare negli studi sintetici la ricerca di nuovi analoghi attivi, con l'ausilio di tecniche di sintesi combinatoriale, di progettazione molecolare computerizzata e di screening biologico ad alta efficienza.
Si è accennato ai limiti che la complessità delle sostanze naturali impone agli sviluppi di metodi sintetici per la loro produzione industriale. L'acquisizione di sostanze rare nelle quantità necessarie per studi approfonditi può peraltro presentare difficoltà e richiedere notevoli risorse, sia nelle fonti naturali che nella sintesi. Una prova che la sintesi totale può essere affrontata con risultati applicativi proviene dalla descrizione, da parte di un nutrito gruppo di 43 ricercatori dei laboratori Novartis e della Università di Cambridge, della preparazione dell'antitumorale polichetidico discodermolide in quantità di 60 g, necessaria per gli studi clinici iniziali. La sintesi, denominata Novartis-Smith-Paterson per dare atto della derivazione da approcci precedenti dei due studiosi, ha richiesto 39 passaggi, 26 dei quali in sequenza lineare, e un buon numero di purificazioni cromatografiche. Lo schema è fondato (Tav. IV D) sulla sintesi di tre sezioni, C1-C6, C9-C14 e C15-C21, derivate da un unico precursore che determina 3 centri di asimmetria, e che sono assemblate completando con i frammenti C7-C8 e C22-C24. Il discodermolide naturale è disponibile soltanto dalla raccolta con sommozzatori della spugna Discodermia dissoluta. L'accesso alle quantità industriali per le sperate applicazioni terapeutiche è atteso da produzioni biotecnologiche, non ancora realizzate, con microorganismi che possano recepire il cluster genico del simbionte della spugna.
Gli sviluppi sopra descritti delle sintesi di sostanze naturali sono stati sostenuti da progressi nelle conoscenze chimiche fondamentali, come l'analisi conformazionale, le regole di Woodward e Hoffman, i reagenti e i catalizzatori organometallici, la chimica di coordinazione, le reazioni in cascata, l'uso dei gruppi protettivi, l'analisi retrosintetica di Corey e la catalisi asimmetrica, che nel 2002 è valsa il premio Nobel per la chimica a K. Barry Sharpless e Ryoji Noyori. Non vi è dubbio che molti di questi progressi sono arrivati a maturazione proprio nel cimento delle sintesi totali. Con due recenti lavori dei gruppi di Li Deng e di Barry M. Trost si possono esemplificare i proficui contributi reciproci tra lo studio delle sostanze naturali e la chimica sintetica. Da un lato, lo studio di Deng affronta il problema concettualmente complesso di generare in un solo passaggio due stereocentri non adiacenti mediante catalizzatori chirali, anche in questo caso derivati dagli alcaloidi di Cinchona (6-O-dimetil-chinina e -chinidina), e consegue una simultanea addizione-protonazione di α-cloroacrilonitrile su diversi β-ciano- e -cheto-esteri; su diversi substrati la reazione è stata realizzata con quantità molari di catalizzatore del 10% e concentrazioni 0,1 M, con buoni risultati di resa, di enantioselettività e diasteoreoselettività (Tav. VI A).
Dall'altro lato, il lavoro di Trost illustra la grande rilevanza acquisita dai processi di catalisi asimmetrica nella sintesi di sostanze naturali da composti achirali. Gli studi delle sostituzioni alliliche enantioselettive con catalizzatori chirali di palladio hanno condotto a sintesi stereoselettive della morfina e della galantamina attraverso un intermedio chiave (Tav. VI B), ottenuto da precursori racemici con un versatile catalizzatore difosfano bisammidico, con una resa dell'82% e con un eccesso enantiomerico fino all'87%.
La sintesi di sostanze naturali, d'altra parte, ha mostrato la sua utilità anche nel correggere errori nelle assegnazioni di strutture. Casi recenti (Tav. VI C), e anche piuttosto sorprendenti se si considera l'efficacia dei metodi attuali di indagine strutturale, sono quelli dell'alcaloide cardioattivo lepadiformina della ascidia Clevelina lepidoformis, della briostatina 3, un rappresentante del gruppo delle briostatine delle quali la briostatina 1 è oggetto di studi clinici, e dell'antibiotico antifungino yakatemicina.
Biodiversità e diversità chimica
Negli anni Novanta si è affermata la ricerca di nuove molecole bioattive non soltanto nei repertori di composti chimici esistenti, ma soprattutto in grandi librerie di composti sintetizzati con varie tecniche di sintesi combinatoriale, che in combinazione con saggi di screening biologico automatizzati (HTS) hanno consentito di esaminare un grandissimo numero di nuovi composti. Negli ultimi anni, un esame critico dei risultati ottenuti rispetto alle risorse impegnate ha ridimensionato l'iniziale entusiasmo per questo approccio, mettendo in luce, come elemento sfavorevole, un'intrinseca tendenza alla ripetitività delle strutture progettate. Da diversi studiosi è stata sottolineata la qualità innovativa dei risultati conseguiti nello stesso periodo, pur con minori risorse, dalla ricerca di sostanze bioattive di origine naturale, sia per quanto riguarda le caratteristiche strutturali sia i tipi dell'attività biologica di queste. Questi rilievi sono stati di stimolo alla ricerca in natura di nuove sostanze, anche avvalendosi dei vantaggi che la bioingegneria molecolare può offrire sia nella ricerca sia nella produzione. Sul versante della chimica di sintesi è stato proposto di ispirarsi alla diversità molecolare offerta dalla biodiversità naturale per progettare librerie combinatoriali in grado di coprire uno spazio chimico più vario, e nel contempo più affine alla chimica della vita, rispetto alle modalità già affermate nella chimica combinatoriale. La considerazione che i metaboliti secondari si sono differenziati per via evolutiva nelle specie viventi per la loro potenzialità di interazione con obiettivi biomolecolari di altre specie è di sostegno all'idea di avvalersi della biodiversità usando le sostanze naturali, o loro elementi strutturali, come substrato o come modello nella sintesi di nuove librerie combinatoriali. In modo analogo, si è sviluppata l'idea di utilizzare tipi di reazioni correlati ai processi biosintetici per aumentare la diversità e l'affinità biologica delle librerie.
Abbiamo già osservato che molti farmaci sono stati ottenuti da modifiche semisintetiche di capostipiti naturali. Le possibilità di avvalersi dei progressi metodologici recenti per creare nuovi composti attivi che riflettano la diversità naturale sono concretamente fondate sui progressi delle sintesi e delle produzioni biotecnologiche, che mettono a disposizione le sostanze stesse, o loro sottostrutture (scaffolds), per l'elaborazione di serie o di librerie.
Gli esempi più interessanti provengono dal lavoro sulle sostanze antitumorali, come quelli già citati sui tassani e sulla camptotecina, e, soprattutto, su quelle di origine marina (Tav. IV B).
Una notevole semplificazione strutturale della briostatina è stata conseguita dal gruppo di Paul A. Wender, ottenendo analoghi molto potenti, con affinità picomolare per la PKC-α. Il lavoro congiunto del gruppo di Yoshito Kishi (Harvard) con quello giapponese della casa farmaceutica Eisai sulla sintesi dell'alicondrina B ha aperto la via per nuovi analoghi, tra cui E7389, anch'esso con struttura più semplice, candidato per lo sviluppo clinico.
Con un approccio combinatoriale è stata costituita una libreria di oltre 60 analoghi delle sarcodiictine e dell'eleuterobina (Tav. IV B). I composti più attivi hanno mostrato un rapporto tra citotossicità su cellule tumorali ed effetti nella polimerizzazione della tubulina diverso da quello dei composti naturali, suggerendo l'ipotesi di un duplice meccanismo d'azione.
Lo stesso gruppo ha ottenuto per sintesi totale gli epotiloni A e B, e ha ulteriormente elaborato i metodi per sintetizzare numerosi analoghi con tecniche combinatoriali in fase solida (Tav. IV D). Due di questi composti, metiltio- e 26-fluoro-epotilone, sono oggetto di studi clinici preliminari. Candidato per studi clinici è anche il fludelone, sintetizzato dal gruppo di Samuel J. Danishefsky.
Altri studiosi hanno discusso ampiamente gli attuali risultati e le prospettive della sintesi combinatoriale ispirata alle sostanze naturali. I processi evolutivi che hanno generato la varietà strutturale dei metaboliti secondari in funzione della loro spiccata capacità di interagire con le biomolecole ‒ in particolare con le proteine ‒ rendono le sostanze naturali e i loro analoghi modificati strumenti particolarmente idonei nelle indagini di meccanismi biologici con i principi della genetica chimica. La possibilità di individuare espressioni fenotipiche indotte da una sostanza nuova, di tipologia strutturale non ancora saggiata su cellule umane, e di risalire da queste espressioni alla proteina regolatrice, apre interessanti prospettive parallele e potenzialmente sinergiche con quelle del reverse genetic approach biologico, per la scoperta di nuovi obiettivi medici e terapeutici.
Bibliografia
Beaudry 2005: Beaudry, Christopher M. - Malerich, Jeremiah - Trauner, Dirk, Biosynthetic and biomimetic electrocyclizations, "Chemical reviews", 105, 2005, pp. 4757-4778.
Bode, Müller 2005: Bode, Helge B. - Müller, Rolf, The impact of bacterial genomics on natural product research, "Angewandte Chemie. International edition", 44, 2005, pp. 6828-6846.
Blunt 2005: Blunt, John W. e altri, Marine natural products, "Natural product reports", 22, 2005, pp. 15-61.
Butler 2005: Butler, Mark S., Natural products to drugs: natural product derived compounds in clinical trials, "Natural product reports", 22, 2005, pp. 162-195.
Casagrande, Canonica 1975: Casagrande, Cesare - Canonica, L., Studies on proaporphine and aporphine alkaloids. Part V: Synthesis of glaziovine by 8,1'-ring closure of 1-benzylisoquinoline derivatives, "Journal of the Chemical Society - Perkin transactions I", 1975, pp. 1647-1651.
Corey 1996: Corey, Elias J. - Gin David Y. - Kania, Robert S., Enantioselective total synthesis of ecteinascidin 743, "Journal of the American Chemical Society", 118, 1996, pp. 9202-9203.
Corey, Lin 1996: Corey, Elias J. - Lin, Linus S., A short enantioselective total synthesis of dammarenediol II, "Journal of the American Chemical Society", 118, 1996, pp. 8765-8766.
Goodman, Gilman 2006: Goodman, Louis S. - Gilman, Alfred, Goodman & Gilman's The pharmacological basis of therapeutics, 11. ed., edited by Laurence L. Brunton, New York, McGraw-Hill, 2006.
Harborne 2001: Harborne, Jeffrey B., Twenty-five years of chemical ecology, "Natural product reports", 18, 2001, pp. 361-379.
Herbert 1997-2003: Herbert, Richard B., The biosynthesis of plant alkaloids and nitrogenous microbial metabolites, "Natural product reports", 14, 1997, pp. 359-372; 18, 2001, pp. 50-65; 20, 2003, pp. 494-508.
Kaufman, Ruveda 2005: Kaufman, Teodoro S. - Ruveda, Edmundo A., The quest for quinine: those who won the battles and those who won the war, "Angewandte Chemie. International edition", 44, 2005, pp. 854-885.
Kuenburg 1999: Kuenburg, Bernhard e altri, Development of a pilot scale process for the anti-Alzheimer drug (-)-galanthamine using large-scale phenolic oxidative coupling and crystallisation-induced chiral conversion, "Organic process research and development", 3, 1999, pp. 425-431.
Kumar, Surapaneni 2001: Kumar, Gondi N. - Surapaneni, Sekhar, Role of drug metabolism in drug discovery and development, "Medicinal research review", 21, 2001, pp. 397- 411.
Mickel 2004: Mickel, Stuart J. e altri, Large-scale synthesis of the anti-cancer marine natural product (+)-discodermolide. Part 5: Linkage of fragments C1-6 and C7-24 and finale, "Organic process research and development", 8, 2004, pp. 122-130.
Newman, Cragg 2004: Newman, David J. - Cragg, Gordon M., Marine natural products and related compounds in clinical and advanced preclinical trials, "Journal of natural products", 67, 2004, pp. 1216-1238.
Nicolaou 2005: Nicolaou, Kyriacos C., Joys of molecules. 1. Campaigns in total synthesis, "Journal of organic chemistry", 70, 2005, pp. 7007-7027.
Nicolaou 2005: Nicolaou, Kyriacos C., Joys of molecules. 2. Endeavors in chemical biology and medicinal chemistry, "Journal of medical chemistry", 48, 2005, pp. 5613-5638.
Nicolaou, Snyder 2005: Nicolaou, Kyriacos C. - Snyder, Scott A., Chasing molecules that were never there: misassigned natural products and the role of chemical synthesis in modern structure elucidation, "Angewandte Chemie. International edition", 44, 2005, pp. 1012-1044.
Ortholand, Ganesan 2004: Ortholand, Jean-Yves - Ganesan, Arasu, Natural products and combinatorial chemistry: back to the future, "Current opinion in chemical biology", 8, 2004, pp. 271-280.
Peterson, Overman 2004: Peterson, Emily A. - Overman, Larry E., Contiguous stereogenic quaternary carbons: a daunting challenge in natural products synthesis, "Proceedings of the National Academy of Sciences USA", 101, 2004, pp. 11943-11948.
Rivkin 2005: Rivkin, Alexey - Chou, Ting-Chao - Danishefsky, Samuel J., On the remarkable antitumor properties of fludelone: how we got there, "Angewandte Chemie. International edition", 44, 2005, pp. 2838-2850.
Schreiber 2000: Schreiber, Stuart L., Target-oriented and diversity-oriented organic synthesis in drug discovery, "Science", 287, 2000, pp. 1964-1969.
Spring 2005: Spring, David R., Chemical genetics to chemical genomics: small molecules offer big insights, "Chemical Society review", 34, 2005, pp. 472-482.
Srivastava 2005: Srivastava, Vandana e altri, Plant-based anticancer molecules: a chemical and biological profile of some important leads, "Bioorganic & medicinal chemistry", 13, 2005, pp. 5892-5908.
Stocking, Williams 2003: Stocking, Emily M. - Williams, Robert M., Chemistry and biology of biosynthetic Diels-Alder reactions, "Angewandte Chemie. International edition", 42, 2003, pp. 3078-3115.
Thomas 2004: Thomas, Robert, Biogenetic speculation and biosynthetic advances, "Natural product reports", 21, 2004, pp. 224-248.
Trost, Tang 2002: Trost, Barry M. - Tang, Weiping, Enantioselective synthesis of (-)-codeine and (-)-morphine, "Journal of the American Chemical Society", 124, 2002, pp. 14542-12543.
Trost, Tang 2002: Trost, Barry M. - Tang, Weiping, An efficient enantioselective synthesis of (-)-galanthamine, "Angewandte Chemie. International edition", 41, 2002, pp. 2795-2797.
Wang 2006: Wang, Ying - Liu, Ximeng - Deng, Lianfu, Dual-function Cinchona alkaloid catalysis: catalytic asymmetric tandem conjugate addition-protonation for the direct creation of nonadjacent stereocenters, "Journal of the American Chemical Society", 12, 2006, pp. 3928-3930.
Wenzel, Müller 2005: Wenzel, Silke C. - Müller, Rolf, Recent developments towards the heterologous expression of complex bacterial natural product biosynthetic pathways, "Current opinion in biotechnology", 16, 2005, pp. 594-606.
Yoder, Johnston 2005: Yoder, Ryan A. - Johnston, Jeffrey N., A case study in biomimetic total synthesis: polyolefin carbocyclizations to terpenes and steroids, "Chemical reviews", 105, 2005, pp. 4730-4756.