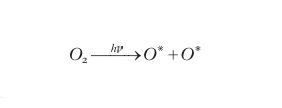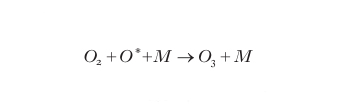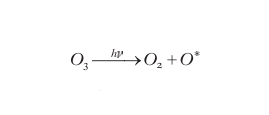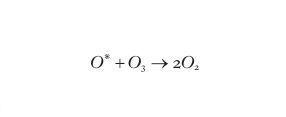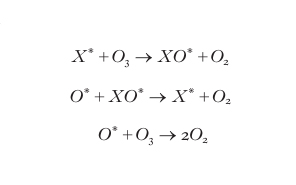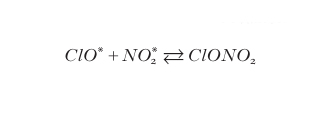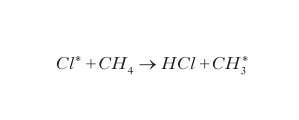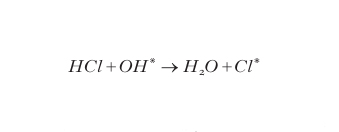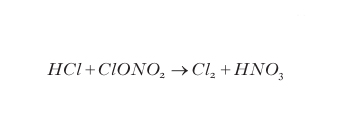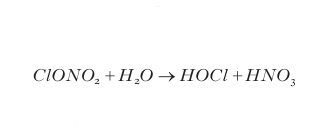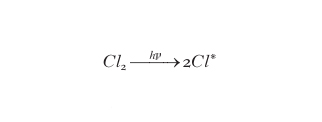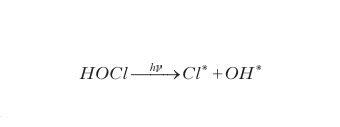Chimica atmosferica
Chimica atmosferica
di Massimo Carlotti
L'atmosfera viene comunemente immaginata come una miscela di gas. In realtà, fanno parte dell'atmosfera anche specie chimiche presenti nello stato di aggregazione liquido e solido. La fase gassosa è, però, di gran lunga dominante e la chimica dell'atmosfera è prevalentemente una chimica dello stato gassoso; tuttavia, anche gli altri stati di aggregazione della materia (liquidi in gocce, cristalli di ghiaccio, polveri) sono coinvolti in alcuni processi chimici importanti che avvengono in fase eterogenea. In laboratorio, una miscela dei gas che compongono l'atmosfera raggiunge uno stato di equilibrio chimico per cui, dopo un tempo sufficientemente lungo, la concentrazione delle specie molecolari rimane costante e uniformemente distribuita nel volume di ambiente in cui la miscela è confinata. Per contro, nell'atmosfera la chimica fra i gas è in continua evoluzione. Questo deriva dal fatto che l'atmosfera viene costantemente perturbata da due fattori esterni: 1) la radiazione elettromagnetica proveniente dallo spazio (essenzialmente radiazione solare); 2) l'interazione con la superficie del pianeta (per es., attività vulcaniche nonché processi nella biosfera di cui sono parte le attività umane). Inoltre, le differenti condizioni fisiche che si instaurano in zone diverse dell'atmosfera provocano spostamenti delle masse d'aria, ciò che contribuisce a fare di essa un sistema chimico e dinamico non omogeneo.
Struttura dell'atmosfera
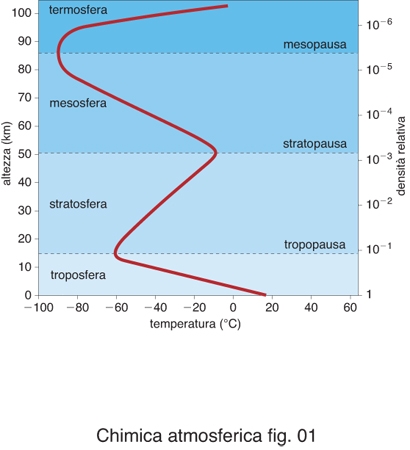
È noto che la pressione diminuisce esponenzialmente allontanandosi dalla superficie terrestre, seguendo una legge che porta a dimezzare il suo valore ogni circa 5000 m di quota. Questo comportamento è determinato dall'equilibrio idrostatico che si instaura, in assenza di perturbazioni, fra il gradiente di pressione e la densità della miscela atmosferica in presenza della gravità (la densità varia con la quota in modo analogo alla pressione). L'andamento della temperatura con la quota è normalmente rappresentato da una curva del tipo riportato in fig. 1, che reca in ordinata, parallelamente all'altezza, anche l'andamento della densità, espresso in frazioni della densità al suolo posta uguale a uno. L'andamento della temperatura determina la suddivisione convenzionale dell'atmosfera in gusci concentrici. Il guscio più basso prende il nome di troposfera ed è delimitato dalla superficie ideale, detta tropopausa, identificata dal primo minimo che raggiunge la temperatura partendo dal basso. Segue la stratosfera, delimitata al primo massimo della temperatura dalla stratopausa; segue ancora la mesosfera, delimitata al secondo minimo della temperatura dalla mesopausa. Alle quote superiori, termosfera e altre denominazioni corrispondono a regioni atmosferiche con densità decrescenti che risultano inferiori a un milionesimo della densità al suolo e con proprietà chimico-fisiche molto diverse da quelle della regione al di sotto della mesopausa. La quota delle superfici che delimitano i gusci atmosferici non è costante, ma varia con la latitudine e con la stagione.
La composizione dell'atmosfera non è descrivibile in modo semplice a causa del numero molto alto di molecole e di radicali che vi si trovano sia in modo permanente sia in modo transitorio: qui basti ricordare che l'azoto costituisce circa il 78% dell'atmosfera, l'ossigeno il 21% e l'argon l'1%. Molte altre specie (incluse l'acqua, l'anidride carbonica, il metano, l'ozono) sono presenti in tracce con concentrazioni e vicende differenti fra troposfera e stratosfera.
Interazione fra la chimica e la fisica dell'atmosfera
I processi chimici che avvengono in atmosfera sono fortemente correlati alle condizioni fisiche delle masse d'aria interessate. Inversamente, le condizioni fisiche, specialmente in relazione alla quota, dipendono anche dai processi chimici che hanno luogo nell'atmosfera. Questa interconnessione si evidenzia esaminando l'andamento della temperatura (fig. 1). È infatti noto che, in presenza della gravità, un fluido portato a una temperatura maggiore del fluido che lo sovrasta subisce, per effetto della diminuzione di densità conseguente al riscaldamento, una spinta idrostatica verso l'alto. Questo meccanismo innesca lo spostamento verticale di masse d'aria (moti convettivi) nella troposfera, che pertanto è caratterizzata da scambi di materia proveniente da quote diverse. Processi analoghi non sono possibili in stratosfera dove le masse d'aria hanno una collocazione in quota coerente con la loro temperatura (più fredde e dense in basso, più calde e rarefatte in alto); in questa situazione i possibili spostamenti avvengono essenzialmente in direzione orizzontale e l'atmosfera si trova a essere stratificata (da cui il nome). Tali condizioni corrispondono a una configurazione in cui la tropopausa costituisce una vera e propria barriera che impedisce il mescolamento convettivo di masse d'aria fra troposfera e stratosfera. I fenomeni di sfondamento della tropopausa sono piuttosto rari (i cumulonembi equatoriali, le forti eruzioni vulcaniche ne sono alcuni esempi). Nella troposfera la diminuzione di temperatura che si osserva sollevandosi dalla superficie terrestre è spiegata con l'allontanamento dalla principale sorgente di calore che, a queste quote, è la superficie terrestre stessa. Per spiegare l'innalzamento di temperatura che caratterizza la stratosfera bisogna invece ricorrere alla chimica dei fenomeni che si realizzano in questa regione. Come sopra ricordato, la radiazione elettromagnetica proveniente dal Sole interagisce con i gas che compongono l'atmosfera. Nella stratosfera, i fotoni che corrispondono alla radiazione ultravioletta (UV, con lunghezza d'onda superiore a 50 nm) sono in grado di rompere i legami chimici delle molecole atmosferiche; in particolare un fotone con λ≤241 nm può rompere il legame della molecola di ossigeno liberando gli atomi corrispondenti:
formula [
1]
L'ossigeno atomico dispone di un elettrone spaiato (indicato dal simbolo * nella reazione) che lo rende fortemente reattivo. In presenza di ossigeno molecolare, l'ossigeno atomico può formare ozono:
formula [
2]
Nella reazione [2] l'ozono si forma in uno stato elettronicamente eccitato che, essendo instabile, si dissocia formando nuovamente ossigeno atomico e molecolare. La dissociazione non avviene se, dopo la sua formazione, la molecola di ozono riesce a cedere energia a una generica molecola presente nell'ambiente di reazione (indicata con M nella reazione [2]) decadendo così in uno stato stabile. Poiché questo trasferimento di energia avviene per urto, la formazione di ozono stabile è accompagnata da un aumento di energia cinetica della particella M. In termini di teoria cinetica dei gas questo significa che il processo di formazione dell'ozono nell'atmosfera è accompagnato da un aumento di temperatura dell'ambiente in cui esso avviene. Pertanto la formazione dell'ozono, e la sua decomposizione secondo la reazione [3] (discussa in seguito e anch'essa esotermica), sono responsabili dell'aumento di temperatura che si osserva sopra la tropopausa e che determina l'esistenza della stratosfera stessa. La reazione [1] avviene evidentemente solo di giorno negli strati atmosferici in cui la radiazione UV riesce ancora a penetrare efficacemente e dove la densità è ancora abbastanza alta. Alle alte quote, e cioè dalla mesosfera alla termosfera e oltre, con densità che diventano inferiori a un milionesimo di quella al suolo, il flusso di radiazione è tale da far sì che tutto l'ossigeno si trovi praticamente in forma atomica. Scendendo in quota, l'azoto, l'ossigeno molecolare e lo stesso ozono assorbono sufficiente radiazione UV da rendere possibile la coesistenza di ossigeno atomico e molecolare; questo avviene appunto all'altezza della stratopausa dove, essendo presenti entrambi i reagenti della reazione [2], inizia a formarsi l'ozono. L'azione filtrante dell'atmosfera sulla radiazione UV fa in modo che, scendendo al di sotto della stratopausa, la presenza di ossigeno atomico diminuisca a vantaggio dell'ossigeno molecolare; il rapporto stechiometrico di 1:1 fra i reagenti della reazione [2] si verifica in genere attorno a 25 ÷ 30 km di quota dove, pertanto, si trova il massimo di concentrazione di ozono in presenza di una densità residua di qualche centesimo di quella al suolo. Scendendo ancora, la quantità di ossigeno atomico decresce finché, all'altezza della tropopausa, cessa la formazione dell'ozono per mancanza di questo reagente.
Chimica della troposfera
La troposfera è la regione più direttamente influenzata dall'interazione con la superficie del pianeta. Una grande varietà di sostanze (anche antropogeniche) vengono rilasciate in troposfera dove possono indurre processi chimici molto complessi ma di portata spesso limitata a problematiche locali. È questo il caso dello smog fotochimico che si forma nei centri cittadini quando idrocarburi (o solventi organici) incombusti vengono rilasciati insieme agli ossidi di azoto (generalmente prodotti dai motori a combustione interna). In assenza di ventilazione queste sostanze si concentrano creando una miscela sulla quale la radiazione solare riesce a innescare processi chimici che conducono alla formazione di ozono (detto smog fotochimico in queste circostanze).
Alcune sostanze che vengono rilasciate nella troposfera agiscono su più vasta scala; è il caso del diossido di zolfo (SO2), o anidride solforosa nella nomenclatura tradizionale, che si genera nella combustione di molecole solforate presenti nei combustibili fossili. L'ambiente ossidante dell'atmosfera e la presenza di acqua trasformano la SO2 in acido solforico (H2SO4), che, essendo fortemente idrofilo, può entrare nelle nubi e quindi ricadere con la pioggia in zone anche molto lontane da quella in cui è stata introdotta la SO2. È questo uno dei meccanismi che generano il fenomeno delle piogge acide riscontrato tipicamente in Scandinavia, dove il pH dei laghi si abbassa (con gravi conseguenze sulla vita degli organismi acquatici) e le foreste muoiono a causa degli acidi solforico e nitrico (generato con meccanismo analogo dal diossido di azoto, NO2) provenienti dalle emissioni industriali prodotte in Gran Bretagna.
Altre sostanze rilasciate in troposfera intervengono in processi che hanno un impatto di portata planetaria; è il caso della CO2, diossido di carbonio nella nomenclatura IUPAC (International Union of Pure and Applied Chemistry), che contribuisce al processo fisico dell'effetto serra, e dei clorofluorocarburi (CFC) che, come vedremo in seguito, alterano la chimica dell'ozono nella stratosfera.
Chimica della stratosfera
A causa della loro rilevanza globale, i processi chimici che maggiormente hanno impegnato la ricerca negli anni più recenti sono quelli che avvengono nella stratosfera. Come per la formazione dell'ozono, la radiazione elettromagnetica proveniente dal Sole è responsabile della maggior parte dei processi chimici presenti nella stratosfera. Pertanto è appropriato parlare di fotochimica quando si fa riferimento a questi processi. È noto il ruolo che l'ozono svolge come agente filtrante di quella parte della radiazione UV che non viene trattenuta dall'azoto e dall'ossigeno atmosferici. Per questo motivo, nell'ultima parte del 20° sec. e negli anni successivi, sono stati studiati a fondo i meccanismi che portano all'impoverimento dello strato di ozono che è stato riscontrato nella seconda metà del secolo scorso. L'ozono viene distrutto per via fotochimica diretta tramite le reazioni:
formula [
3]
formula [
4]
In questo processo l'energia del fotone (con frequenza UV) viene convertita in energia cinetica (attraverso il decadimento degli stati eccitati in cui si formano i prodotti) con conseguente innalzamento della temperatura. Oltre a questo processo sono stati identificati cicli di distruzione catalitica dell'ozono che sono rappresentabili, in forma semplificata, dallo schema seguente:
formula [
5]
La reazione risultante di questo schema è identica alla [4], tuttavia il processo [5] è innescato da una specie radicalica (genericamente indicata con X* nelle reazioni) che non compare nella reazione risultante e, pertanto, risponde alla definizione chimica di catalizzatore. La proprietà di uscire inalterato dalle reazioni che ha innescato, consente al catalizzatore, una molecola o un atomo, di distruggere un numero elevato di molecole di ozono (dell'ordine di decine di migliaia) prima di essere bloccato da una reazione chimica che lo disattivi. Sono state riconosciute tre famiglie principali di catalizzatori denotate convenzionalmente con le sigle HOx, NOx e ClOx in cui x identifica le diverse molecole che appartengono alla famiglia. I processi di distruzione catalitica, così come il processo fotochimico, sono parte dell'equilibrio naturale che ha mantenuto l'ozono stratosferico alle concentrazioni che hanno permesso lo sviluppo dell'ecosistema biologico sulla superficie del pianeta. Questo equilibrio naturale può essere alterato dalle attività umane attraverso l'immissione in atmosfera di sostanze che sono in grado di raggiungere la stratosfera e qui generare le molecole che sono catalizzatori nello schema [5].
La famiglia di catalizzatori dei ClOx è stata, storicamente, quella maggiormente influenzata dalle attività umane attraverso la dispersione massiccia in atmosfera dei clorofluorocarburi (CFC), composti chimicamente inattaccabili e insolubili in acqua. Queste caratteristiche (unite alla loro temperatura di ebollizione che è prossima a quella ambiente) rendono i CFC ideali per numerose applicazioni industriali, ma conferiscono alle loro molecole (che non possono essere ossidate né abbattute dalla pioggia) tempi di permanenza in atmosfera dell'ordine di decine di anni, abbastanza lunghi cioè da consentire alle molecole di diffondersi oltre la tropopausa sino a raggiungere la stratosfera. La radiazione UV presente nella stratosfera può rompere i legami che uniscono il carbonio agli altri atomi dei CFC e, in particolare, il legame più debole che è quello con il cloro. Il risultato di questo processo è che i CFC sono in grado di immettere in stratosfera atomi di cloro, che è uno dei catalizzatori nello schema [5].
È importante notare che i CFC non sono molecole naturali, ossia che non esistevano in natura prima della cosiddetta era industriale; pertanto tutti i CFC che vengono misurati in atmosfera (con un andamento in crescita fino all'ultimo decennio del 20° sec.) sono stati sintetizzati in processi industriali.
Come sopra ricordato, una molecola di catalizzatore può essere disattivata da reazioni che, combinandola in vari modi, conducono a una molecola inattiva sul ciclo di distruzione dell'ozono. La molecola inattiva può sottrarre il catalizzatore dall'ambiente di reazione definitivamente oppure soltanto temporaneamente se è in grado di rigenerarlo in condizioni opportune; in questo caso la molecola inattiva viene chiamata molecola riserva. Nel ciclo dei ClOx le principali molecole riserva sono ClONO2 e HCl che si formano con reazioni del tipo:
formula [
6]
formula [
7]
Il ClONO2 può rilasciare il catalizzatore tramite l'equilibrio stesso della reazione [6] mentre HCl può rigenerare cloro atomico con reazioni del tipo:
formula [
8]
Le molecole riserva svolgono comunque un ruolo importante nell'equilibrio naturale della stratosfera perché contribuiscono ad abbassare la concentrazione dei catalizzatori.
L'alterazione che le attività umane inducono sui cicli catalitici porta a un impoverimento generalizzato dello strato di ozono nella stratosfera, con conseguente attenuazione dell'azione filtrante che questa molecola esercita sulle radiazioni UV con λ compresa fra 220 e 320 nanometri.
Il buco dell'ozono
Questa denominazione è attribuita a un fenomeno che si verifica nei mesi di ottobre e di novembre nella stratosfera sovrastante il continente antartico dove, in questo periodo, avviene una drastica diminuzione (di oltre il 50%) della quantità di ozono. Il fenomeno è stato osservato a partire dalla seconda metà degli anni Cinquanta del 20° sec. e, da allora, si è progressivamente accentuato. Il meccanismo che provoca il cosiddetto buco dell'ozono viene innescato dal drastico abbassamento di temperatura che si verifica sopra l'Antartide in coincidenza dell'inverno polare. L'assenza prolungata (dell'ordine di mesi) di radiazione solare che si verifica durante l'inverno antartico, a sud del circolo polare, è responsabile del raffreddamento perché elimina, oltre al riscaldamento diretto, anche la sorgente di calore dovuta alla formazione e alla dissociazione dell'ozono. In queste condizioni la temperatura della stratosfera scende a valori (anche inferiori a −90 °C) ai quali l'acido nitrico e l'acido solforico presenti in stratosfera solidificano in forma idrata formando microcristalli del tipo HNO3−nH2O (con n prevalentemente 3 e 5) che si aggregano per formare vere e proprie nuvole dette nuvole stratosferiche polari (PSC, Polar Stratospheric Clouds). La natura fortemente polare delle molecole della superficie dei microcristalli conferisce loro un forte potere adsorbente su altre specie polari e in particolare sulle molecole riserva HCl e ClONO2 che vi si concentrano sopra. Sulla superficie delle PSC avvengono quindi reazioni del tipo:
formula [
9]
formula [
10]
che sono completamente spostate verso destra perché, in entrambi i casi, il prodotto di reazione HNO3 solidifica, entrando a far parte della PSC, e viene quindi sottratto all'ambiente di reazione. Questi processi fanno sì che, durante l'inverno antartico, tutto il Cloro venga trasformato in HOCl e, prevalentemente, in Cl2.
Un secondo processo, di natura soltanto fisica, si verifica nella stratosfera durante l'inverno antartico; questo processo deriva dal forte abbassamento di pressione associato all'abbassamento di temperatura (una massa gassosa raffreddata aumenta in densità e tende a occupare un minor volume generando così una depressione). La bassa pressione che si forma sulla regione antartica richiama le masse d'aria circostanti che, muovendosi su un sistema in rotazione (la Terra) sono soggette alla forza di Coriolis. Questa forza agisce in direzione perpendicolare al moto delle masse d'aria che si spostano verso Sud, innescando un vortice detto vortice polare. I vortici in atmosfera si formano ogni volta che si genera un centro di bassa pressione; tuttavia, nel caso dell'inverno antartico, il vortice polare è di grandi dimensioni (può abbracciare tutto il continente) e l'aria che si muove sul suo bordo può raggiungere e superare velocità di 300 km/h. In queste condizioni il bordo del vortice polare costituisce una sorta di barriera che impedisce lo scambio di masse d'aria. Pertanto, durante l'inverno, la stratosfera antartica diviene un sistema isolato con composizione chimica anomala che non può essere compensata da scambi di materia con l'ambiente esterno al vortice. È da notare, tuttavia, che questa anomalia non comporta alterazioni significative sulla quantità di ozono se non quella dovuta a una sua naturale decomposizione non compensata da una contemporanea formazione (che avviene solo in presenza di radiazione solare).
La situazione sopra descritta persiste durante l'inverno polare ma viene modificata dalla ricomparsa della radiazione solare che, nell'ultima decade di settembre, segue l'equinozio di primavera antartica. I raggi UV che ricompaiono nell'ambiente sono in grado di rigenerare atomi di cloro dalle molecole di Cl2 e HOCl accumulatesi durante l'inverno con reazioni del tipo:
formula[
11]
formula [
12]
Nelle condizioni fisiche tipiche del periodo successivo all'equinozio di primavera le molecole riserva non possono svolgere il loro ruolo di contenimento del catalizzatore perché, pur formandosi attraverso le reazioni [6] e [7], vengono immediatamente rimosse dalle reazioni [9] e [10] che rimangono attive finché le PSC sono presenti in stratosfera. In queste condizioni tutto il cloro viene a trovarsi nella forma atomica che agisce da catalizzatore nel ciclo di distruzione [5]. È questa alta concentrazione di cloro atomico che, confinato all'interno del vortice polare, provoca la massiccia distruzione dell'ozono stratosferico e la conseguente formazione del cosiddetto buco. La situazione che si determina dopo l'equinozio di primavera si protrae finché in stratosfera permangono le PSC, ossia finché la temperatura risale su valori che riportano l'acido nitrico allo stato gassoso. Tipicamente questo passaggio di fase avviene 40÷50 giorni dopo l'equinozio ed è per questo che il massimo del buco dell'ozono si verifica nel mese di ottobre. In concomitanza con la temperatura risale anche la pressione e il vortice polare si dissolve gradualmente permettendo un rimescolamento delle masse d'aria che, se da un lato vanno a colmare il buco, dall'altro impoveriscono di ozono la stratosfera alle latitudini limitrofe.
Il processo che porta alla formazione del buco dell'ozono avviene, seppure in forma meno marcata, anche sulla regione artica. Nell'emisfero boreale la minore intensità del fenomeno è dovuta alla temperatura che, in quella regione, non scende ai valori estremi che caratterizzano l'inverno antartico.
Stato della ricerca e prospettive
Il grado di conoscenza sulla composizione dell'atmosfera, obiettivo ultimo della ricerca sulla c. a., è determinato dall'accuratezza dei valori di concentrazione delle specie molecolari e dalla loro risoluzione spaziale.
È d'altro canto importante saper prevedere l'evoluzione della composizione dell'atmosfera. La spettroscopia è la tecnica più utilizzata per misurarne la composizione; misure spettroscopiche hanno permesso di identificare numerose specie molecolari e di determinare la loro distribuzione in quota. L'avvento dei modelli chimici dell'atmosfera ha permesso di prevedere la presenza di molecole non ancora identificate dalle misure; tuttavia i modelli hanno bisogno di essere sostenuti da osservazioni, sia per fornire lo stato iniziale delle simulazioni sia per validare la correttezza delle loro previsioni. Numerose misure volte a determinare la composizione dell'atmosfera sono state effettuate da terra, da aereo o da pallone stratosferico, ma neppure l'uso congiunto di queste tecniche è ancora in grado di fornire una copertura geografica e temporale completa. La miglior copertura viene offerta da osservazioni spettroscopiche che sono effettuate da un satellite artificiale posto su orbita polare. In questo caso il piano su cui giace l'orbita (piano di osservazione) contiene i poli e il centro della Terra, mentre tutti gli altri punti della superficie terrestre attraversano il piano di osservazione per effetto della rotazione del pianeta; lo strumento osservatore si trova quindi a sondare con continuità porzioni successive dell'atmosfera.
La tendenza attuale della ricerca va verso una unificazione dei modelli chimici e di quelli fisici dell'atmosfera. I modelli chimici richiedono misure di pressione e temperatura; i modelli fisici richiedono una conoscenza puntuale delle stesse grandezze e del contenuto di acqua per il loro scopo di previsione dell'evoluzione meteorologica. Considerando la loro complessità, i due tipi di modello vengono tuttora usati separatamente per descrivere il comportamento chimico e fisico dell'atmosfera; è evidente però che il sistema atmosfera può essere descritto rigorosamente nel suo insieme solo modellizzando allo stesso tempo le sue proprietà fisiche e chimiche. In questa direzione, grazie alle crescenti potenze di calcolo disponibili, si stanno sviluppando i modelli meteorologici più avanzati che tendono a includere, oltre all'acqua, le specie chimiche che maggiormente influenzano la meteorologia. L'ozono viene attualmente incluso in alcuni modelli meteorologici.
Per le loro applicazioni, i modelli chimici e fisici dell'atmosfera richiedono la conoscenza delle condizioni iniziali del sistema con un livello di dettaglio che, in molti casi, non è disponibile nemmeno attraverso la copertura satellitare delle osservazioni.
Uno strumento di indagine, di recente sviluppo, che permette di stimare le condizioni dell'atmosfera in ogni suo punto è fornito dalle tecniche di assimilazione dei dati (data assimilation). Questa è la denominazione attribuita a un processo matematico che, partendo da un modello dell'atmosfera e da una serie di osservazioni, determina l'implementazione del modello per una rappresentazione che è in migliore accordo con le osservazioni. In un processo di assimilazione, la mancanza di informazione dovuta alla carenza di osservazioni è compensata dalla conoscenza del comportamento dell'atmosfera e dalla sua struttura probabile. In particolare, la conoscenza dell'evoluzione del sistema nel tempo (fornita dal modello) consente di fare previsioni che possono essere confrontate con osservazioni effettuate in tempi diversi. Il grande vantaggio delle tecniche di assimilazione è l'affinamento reciproco delle misure e dei modelli. Il confronto dell'evoluzione prevista con quella osservata consente un'analisi critica delle prestazioni delle misure e dei modelli, e con ciò un'ottimizzazione dei risultati e delle previsioni.
Bibliografia
R. Atkinson, Gas-phase tropospheric chemistry of organic compounds: a review, in Atmos. environ., 1990, 24A, pp. 1-41.
S. Solomon, Progress toward a quantitative understanding of antarctic ozone depletion, in Nature, 1990, 347, pp. 347-54.
J.S. Taylor, DNA, sunlight, and skin cancer, in Journal of chemical education, 1990, 67, pp. 835-41.
O.B. Toon, R.P. Turco, Polar stratospheric clouds and ozon depletion, in Scientific american, 1991, 6, pp. 68-74.
J.B. Kerr, C.T. McElroy, Evidence for large upward trends of ultraviolet-B radiation linked to ozone depletion, in Science, 1993, 262, pp. 1032-34.
D.W. Fahey, E.R. Keim, K.A. Boering et al., Emission measurements of the Concorde supersonic aircraft in the lower stratosphere, in Science, 1995, 270, pp. 70-74.
S.R. Weart, The discovery of the risk of global warming, in Physics today, 1997, 1, pp. 30-40; J.H. Seinfeld, Atmospheric chemistry and physics, New York 1998; B.J. Finlayson-Pitts, J.N. Pitts, Chemistry of the upper and lower atmosphere, San Diego 2000.