Bioluminescenza
Bioluminescenza
di Franco Magni
Bioluminescenza
sommario: 1. Introduzione. 2. Distribuzione della bioluminescenza nel mondo vivente e struttura degli organi luminosi: a) Batteri e Funghi; b) Protozoi; c) Metazoi. 3. Biochimica della bioluminescenza: a) generalità; b) sistemi enzimatici; c) sistemi non enzimatici. 4. Fisiologia della bioluminescenza: a) meccanismi di eccitazione; b) meccanismi di modulazione. 5. Significato biologico della bioluminescenza: a) generalità; b) difesa contro i predatori; c) attrazione della preda; d) riconoscimento inter- e intraspecifico e attrazione tra i sessi; e) illuminazione. □ Bibliografia.
1. Introduzione
Il termine ‛bioluminescenza' viene generalmente usato per definire ogni tipo di chemiluminescenza prodotta da una reazione biochimica specifica in un organismo vivente.
Il fenomeno dell'emissione di luce da parte di organismi viventi è noto da secoli (v. Harvey, 1952 e 1957); tuttavia, se si eccettua la scoperta di Boyle nel 1667 della dipendenza della luminescenza batterica dall'ossigeno, l'approccio sistematico alla comprensione del fenomeno in tutti i suoi aspetti (morfologico, chimico e fisiologico) è iniziato solo nella seconda metà del XIX secolo con le ricerche di Pflüger sui Batteri luminosi. Da allora, l'interesse dei ricercatori per la bioluminescenza è andato continuamente aumentando per tutto il XX secolo; il risultato di questo sforzo è stato l'accumularsi di un considerevole corpo di conoscenze su quasi tutti gli aspetti del fenomeno.
Da questo corpo di conoscenze si possono enucleare quattro principali indirizzi di studio, concernenti: 1) la distribuzione della bioluminescenza tra gli organismi viventi e la struttura degli organi luminosi, nel tentativo di tracciarne le linee dell'evoluzione filogenetica; 2) la biochimica della reazione luminosa (purificazione e identificazione dei reagenti, cinetica della reazione, richiesta e resa energetica, localizzazione dei reagenti nei sistemi viventi e meccanismi della loro interazione); 3) i meccanismi fisiologici di controllo dell'emissione luminosa nei diversi organismi; 4) il significato biologico dell'emissione luminosa in rapporto al comportamento dell'animale.
Nel tentativo di conciliare la chiarezza di esposizione con la limitazione di spazio, nelle pagine che seguono lo sviluppo delle ricerche lungo ciascuna di queste quattro direzioni principali verrà trattato in capitoli separati, e verranno messi in evidenza i numerosi problemi ancora aperti.
2. Distribuzione della bioluminescenza nel mondo vivente e struttura degli organi luminosi
Osservazioni di organismi luminosi si trovano sparse attraverso i secoli. L'importanza delle osservazioni è varia, dal livello di una semplice menzione a quello di un'accurata descrizione, classificazione tassonomica, osservazione del comportamento e, almeno in alcuni casi, ricerca fisiologica e biochimica. Le monumentali monografie di E.N. Harvey (v., 1952 e 1957) formano un compendio di tutte le conoscenze che si avevano sull'argomento fino al tempo della loro pubblicazione.
La distribuzione degli organismi luminosi nei phyla e nelle classi del regno animale è compendiata nella tab. I (v. Harvey, 1952).
Se si considerano i Dinoflagellati come appartenenti al regno animale, gli organismi luminescenti vegetali sono distribuiti nei gruppi seguenti:
La distribuzione della luminescenza nel mondo vivente
è estremamente variabile, essendo presente in una specie e assente in un'altra strettamente vicina. L'evoluzione filogenetica della bioluminescenza si presenta perciò come un problema enigmatico, ancora lontano da una soluzione.
a) Batteri e Funghi
Batteri luminescenti sono responsabili del ben noto fenomeno della luce emessa dalla carne e dal pesce in via di decomposizione (per una bibliografia sull'argomento, v. Harvey, 1952). La vecchia ipotesi (v. Harvey, 1952) che tutte le forme di luminescenza fossero dovute alla presenza di batteri simbionti può essere oggi abbandonata, o è assai dubbia, per la maggioranza degli organismi luminescenti (v. Johnson e Haneda, 1966; v. Johnson e Shimomura, 1972). Solo in alcuni Cefalopodi e Pesci è stato possibile isolare e coltivare batteri luminosi dagli organi luminescenti (v., per es., Haneda, 1938, 1940 e 1966).
Per quanto non vi siano dubbi sulla sede intracellulare del fenomeno, non è stato possibile identificare alcun substrato morfologico per la luminescenza batterica.
Anche per ciò che riguarda i funghi luminosi, niente è noto intorno alle caratteristiche strutturali delle cellule luminescenti. Uno dei reagenti della reazione luminosa sembra essere associato con una struttura particolata di natura ignota (v. Airth e altri, 1966).
b) Protozoi
Per quanto riguarda i Dinoflagellati, cui è dovuto il noto fenomeno della ‛fosforescenza del mare', in Noctiluca la luminescenza è chiaramente associata a corpuscoli citoplasmatici ( v. Eckert, 1966), mentre in Gonyaulax la natura particolata del sistema luminescente non è ancora definitivamente stabilita (v. De Sa e altri, 1963; v. Sweeney e Bouck, 1966; v. De Sa e Hastings, 1968; v. Johnson e Shimomura, 1972).
c) Metazoi
Nei metazoi luminosi, la luminescenza è prodotta da cellule specializzate, sia sotto forma di secrezione (luminescenza extracellulare), sia come fenomeno intracellulare.
La produzione di un secreto luminoso è stata riscontrata fino a oggi prevalentemente in animali marini. In questi casi, la reazione luminosa avviene dopo che i reagenti, secreti da cellule ghiandolari specializzate, si sono mescolati nell'acqua di mare o nel muco che riveste la superficie del corpo. Le cellule ghiandolari specializzate, che sono caratterizzate dalla presenza di granuli nel loro citoplasma, possono trovarsi sia frammiste a cellule mucipare e a cellule epiteliali ordinarie su tutta o parte della superficie corporea, sia raggruppate in parti ben definite della superficie del corpo. In altre forme, esse sono riunite in complesse strutture ghiandolari, spesso fornite di una cavità comune e di un apparato neuromuscolare per l'espulsione del materiale luminoso (v. Harvey, 1952; v. Nicol, 1962 e 1967).
La luminescenza intracellulare si osserva in molte forme animali, marine e terrestri, ed è di solito associata allo sviluppo di organi luminosi e di apparati accessori di varia complessità. Questo tipo di bioluminescenza è stato di gran lunga il meglio studiato sia dal punto di vista anatomico, sia dal punto di vista fisiologico, nel tentativo di far luce sui molti problemi relativi al controllo dell'emissione di luce.
La mancanza di spazio rende impossibile una descrizione dettagliata di tutti gli organi luminosi appartenenti a questo tipo. Si rinvia perciò il lettore alle monografie di Harvey (v., 1952) e di Nicol (v., 1962). Qui ci limitiamo a prendere in considerazione l'organo luminoso delle lucciole, sul quale è stata condotta una gran quantità di ricerche fisiologiche e biochimiche.
La luminescenza intracellulare è rappresentata negli organismi terrestri per lo più tra gli Insetti. Ad eccezione dei coleotteri luminosi (lucciole), le informazioni intorno all'anatomia degli organi luminosi degli Insetti sono molto scarse, e sono riportate nella monografia di Harvey (v., 1952). Meritano di essere ricordati gli organi luminosi delle larve di Bolitophila e Arachnocampa (Diptera), poiché le cellule fotogene sono situate all'apice di quattro tubuli malpighiani modificati (v. Wheeler e Williams, 1915).
Gli organi luminosi dei Coleotteri sono situati vicino alla superlicie corporea e sono coperti da uno strato di cuticola trasparente. La localizzazione, la forma e la grandezza degli organi luminosi, come pure il colore della luce emessa, sono molto diversi nei diversi generi e specie e anche fra i due sessi della stessa specie.
In Photinus, Photuris e Luciola gli organi sono localizzati negli sterniti 6 e 7 e sono presenti nei due sessi. In Lampyris, la femmina, che è priva di ali, emette una luce viva da organi fotogeni localizzati negli sterniti 5, 6, 7, 8, mentre il maschio emette una luce molto debole. In entrambi i sessi di Pyrophorus gli organi luminosi sono rappresentati da due piccoli organi fotogeni di forma circolare situati agli angoli del pronoto, che emettono una luce verde, e da un organo più grande sulla superficie anteriore dell'addome, che emette luce arancione quando l'animale è in volo. Una serie di undici o dodici organi fotogeni segmentali che emettono luce verde si ritrovano nelle femmine di Phengodes e Phrixothrix, il quale ha inoltre sulla testa un organo luminoso che emette luce rossa.
Questa considerevole diversità di forma e di localizzazione va di pari passo con la diversità di architettura istologica. Buck (v., 1948), basandosi sui lavori di Dahlgren (v., 1917), ha proposto una classificazione degli organi luminosi in sei tipi, che si fonda sui rapporti tra cellule fotogene e trachee. Al tipo I appartiene l'organo luminoso di Phengodes, che è formato da cellule giganti luminose libere, che somigliano molto a enociti, apparentemente sprovviste di una tracheazione specifica. Gli organi luminosi di Phrixothrix (v. Buck, 1946), delle femmine di Lamprohiza splendidula (v. Bongardt, 1903) e di Phausis delarouzei (v. Bugnion, 1929) consistono in una massa di cellule fotogene contenenti granuli citoplasmatici, forniti di un'abbondante arborizzazione tracheale (tipo II).
Il tipo III è essenzialmente simile al tipo Il per quanto riguarda i rapporti trachee-fotociti, con la sola differenza che le cellule fotogene si appoggiano a uno strato di cellule non luminose (il cosiddetto ‛strato riflettore'), il cui aspetto e le cui proprietà tintoriali sono considerevolmente diversi da quelli dei fotociti. A questo tipo appartengono gli organi luminosi delle larve di Luciola cruciata, Pyrocoelia rufa (v. Okada, 1935; v. Hasama, Über die Biolumineszenz der Larvae..., 1942), P. analis (v. Hasama, Über die Biolumineszenz der Larvae..., 1942), P. fumosa (v. Hasama, 1944), Lampyris noctiluca (v. Bongardt, 1903) e Photuris pennsylvanica (v. Buck, 1948). A questo tipo appartengono anche gli organi luminosi degli adulti di Lampyris noctiluca (v. Bongardt, 1903) e di Pyrophorus (v. Geipel, 1915; v. Dahlgren, 1917).
Gli organi fotogeni dei tipi IV, V e VI sono caratterizzati dalla presenza di cellule tracheali terminali (v. Schultze, 1865): queste cellule sono localizzate nei punti in cui i rami tracheali si assottigliano ed emettono due o più sottili tracheole che scorrono tra i fotociti. Nel tipo IV (il più semplice tra gli organi luminosi forniti di cellule tracheali terminali) le trachee corrono in direzione ventrale attraverso lo strato riflettore, assumono un andamento tangenziale al confine fra strato riflettore e strato fotogeno, terminano in cellule tracheali terminali e mandano infine le tracheole nel sottostante tessuto fotogeno. Il tipo V è caratterizzato dal fatto che le trachee si ramificano entro lo strato fotogeno e terminano in cellule tracheali terminali da cui hanno origine le tracheole. Questa è l'architettura anatomica degli organi fotogeni degli adulti di Pyrocoelia rufa (v. Hasama, Über die Biolumineszenz bei Pyrocoelia rufa..., 1942), Luciola africana (v. Geipel, 1915), Luciola parva e Luciola vitticollis (v. Dahlgren, 1917). Gli organi luminosi di Photinus e di Photuris appartengono al VI tipo (v. Townsend, 1904; v. Dahlgren, 1917; v. McDermott e Crane, 1911; v. Lund, 1911; v. Williams, 1916; v. Hess, 1922; v. Buck, 1940 e 1942), e così pure gli organi di Luciola italica (v. Tozzetti, 1870; v. Emery, 1884). Questi organi sono costituiti da cellule sottili e allungate, orientate con il loro asse perpendicolarmente alla superficie del corpo e riunite intorno ai tubi tracheali, che hanno la medesima direzione. Dalle trachee si staccano ad angolo retto le branche tracheolari, che sono circondate da una cellula tracheale terminale. All'uscita dalla cellula tracheale terminale la tracheola si divide in due o tre rami sottili, le pareti dei quali sono circondate dalle espansioni citoplasmatiche allungate della cellula tracheolare (v. Smith, 1963). Le tracheole corrono tra i fotociti disposti radialmente e sono alloggiate in un solco sulla superficie di essi. Questa disposizione conferisce all'organo una tipica struttura ‛a rosetta' quando viene osservato in sezione tangenziale. Fin dalle prime osservazioni era stata dimostrata la presenza di innervazione dell'organo fotogeno: si era osservato che le fibre nervose avevano un decorso identico a quello delle trachee, tuttavia non era stato possibile definire con precisione il luogo e il modo di terminazione (per una bibliografia, sull'argomento, v. Buck, 1948). Uno studio dettagliato al microscopio elettronico (v. Smith, 1963) ha permesso di scoprire che le fibre nervose decorrono parallelamente alle branche tracheali e terminano con giunzioni sinaptiche tra le cellule tracheali terminali e le cellule tracheolari. Si può quindi concludere che in alcune specie (Photuris) non esiste innervazione diretta dei fotociti, mentre in altre specie è stato possibile dimostrare tale innervazione diretta (v. Peterson e Buck, 1968).
Sulla base di questa disposizione anatomica e del fatto che numerosi autori hanno descritto strutture specializzate (dilatazioni a forma di sfintere, fibre contrattili) nel citoplasma delle cellule tracheali terminali (v. Bongardt, 1903; v. Dahlgren, 1917), si è prospettata l'ipotesi che il complesso formato dalla cellula tracheale terminale, dalla cellula tracheolare e dalla terminazione nervosa (il cosiddetto ‛organo terminale') abbia una funzione di primaria importanza nell'accoppiamento neuroeffettore dell'organo luminoso (v. Dahlgren, 1917; v. Creighton, 1926; v. Snell, 1932; v. Alexander, 1943).
3. Biochimica della bioluminescenza
a) Generalità
La straordinaria diversità degli organi e apparati luminosi e la dispersione della distribuzione della bioluminescenza nei phyla del mondo vivente trovano riscontro nell'estrema varietà delle reazioni luminose scoperte dalla biochimica.
L'inizio delle indagini biochimiche sulla bioluminescenza può essere fatto risalire alla scoperta classica di Dubois (v., 1885 e 1887), il quale preparò estratti acquosi a freddo e a caldo degli organi luminosi di Pyrophorus e di Pholas: l'estratto a freddo (che ovviamente conteneva tutti i reagenti delle reazioni luminose) continuava a emettere luce per un certo tempo dopo la preparazione, finché l'emissione luminosa si estingueva per l'esaurimento di uno dei reagenti; l'estratto a caldo non emetteva luce, tuttavia aggiunto a un estratto a freddo che avesse cessato di emettere luce, produceva l'immediata ricomparsa della bioluminescenza.
Sulla base di questi esperimenti, si giunse alla conclusione che l'estratto a freddo contiene un enzima (chiamato più tardi luciferasi), che catalizza la reazione luminosa agendo su di un substrato che viene consumato nel corso della reazione; questo enzima viene inattivato dal calore e quindi non è presente nell'estratto a caldo, che contiene solo il substrato (luciferina), relativamente resistente al calore. Le due sostanze (luciferina e luciferasi) vengono di nuovo messe a contatto quando si mescolano gli estratti, con la conseguente emissione di luce.
La scoperta della reazione luciferina-luciferasi ha grandemente stimolato le ricerche biochimiche intorno ai meccanismi enzimatici che sono alla base della bioluminescenza. Gli studi successivi si sono sviluppati lungo due linee principali di ricerca, e precisamente: a) l'identificazione di un sistema luciferina-luciferasi nei vari organismi luminosi e la sua specificità; b) la natura chimica dei reagenti e la cinetica della reazione. Entrambe queste linee di ricerca hanno portato a considerevoli progressi nelle nostre conoscenze, e sono tuttora attivamente perseguite in molti laboratori, come è testimoniato da un'ampia letteratura, sintetizzata in numerose monografie e riviste (v. Harvey, 1952; v. Johnson, 1966 e 1967; v. Mc Elroy e Glass, 1961; v. Mc Elroy e Seliger, 1966; v. Chase, 1964; v. Cormier e Totter, 1964 e 1968; v. Seliger e Mc Elroy, 1965; v Johnson e Haneda, 1966; v. Hastings, 1968; v. Johnson e Shimomura, 1972; v. Seliger e Morton, 1968).
Lungo la prima linea di ricerca, Harvey ha dimostrato la presenza della reazione luciferina-luciferasi in parecchi organismi, in aggiunta a quelli che formano l'oggetto delle indagini di Dubois, e precisamente le lucciole americane Photinus e Photuris, la lucciola giapponese del genere Luciola, il crostaceo Cypridina, il gambero Systellaspis e il polichete Odontosyllis. Egli non riuscì a provare l'esistenza di reazione crociata eccetto che tra specie molto vicine, nel senso che non fu possibile ottenere una reazione luminosa mescolando un estratto contenente luciferina di un tipo di organismo con un estratto contenente luciferasi di un altro tipo. Nuovi esempi di sistemi luciferina-luciferasi in altri tipi di organismi sono stati scoperti dalle ricerche più recenti, ad es. nel gasteropode Latia, nei batteri luminosi, nel dinoflagellato Gonyaulax, nei pesci Parapriacantus e Apogon, nei funghi Armillaria e Collybia, nell'antozoo Renilla, nell'emicordato Balanoglossus, nei vermi Diplocardia e Octachaetus (v. Johnson e Shimomura, 1972).
La seconda linea di ricerca, dedicata all'identificazione della natura chimica dei reagenti, ha condotto alla purificazione completa, all'identificazione della struttura chimica e alla sintesi totale delle sostanze che partecipano, alle reazioni luminose di Renilla, Cypridina, Latia, delle lucciole, dei batteri e di alcuni funghi luminescenti. A queste ricerche biochimiche e ad alcuni sistemi luminescenti meno noti del tipo luciferina-luciferasi verrà dedicata brevemente la nostra attenzione.
Una scoperta completamente inattesa dovuta alle ricerche moderne nel campo della bioluminescenza è stata quella di sistemi luminescenti nei quali la luce è emessa non come conseguenza dell'ossidazione enzimatica di un substrato, ma da una proteina (fotoproteina), la quale, contrariamente a quanto ci si potrebbe attendere da un enzima, viene consumata durante la reazione; quest'ultima può essere scatenata in vari modi nei diversi sistemi. Alcuni di questi sistemi luminescenti non enzimatici sono stati analizzati completamente ed è stata identificata la struttura della fotoproteina, o almeno del suo gruppo attivo, come nella medusa Aequorea e nell'anellide Chaetopterus (v. Johnson e Shimomura, 1972). La biochimica dei sistemi non enzimatici verrà esposta nel È c di questo capitolo.
b) Sistemi enzimatici
Per ragioni di spazio, tratteremo in dettaglio solo la biochimica della luminescenza nelle lucciole. Gli altri sistemi enzimatici saranno succintamente esposti in una tabella (v. tab. II).
Sistema delle lucciole. - Il sistema delle lucciole costituisce una delle reazioni luminescenti meglio conosciute. Dalla classica scoperta di Dubois un'immensa letteratura si è accumulata sull'argomento; il risultato di tutte queste indagini, principalmente dovute a Mc Elroy e ai suoi collaboratori, è stata la conoscenza quantitativa della struttura e delle proprietà chimico-fisiche dei reagenti, come pure della cinetica della reazione luminosa.
La reazione luminosa delle lucciole consiste nell'ossidazione di un substrato (luciferina), catalizzata da un enzima specifico (luciferasi), e richiede come cofattori ATP, ossigeno molecolare e i cationi bivalenti Mg2+ o Mn2+. A causa delle necessità di ATP, il sistema delle lucciole è ampiamente usato in laboratorio come rivelatore sensibile di questa sostanza.
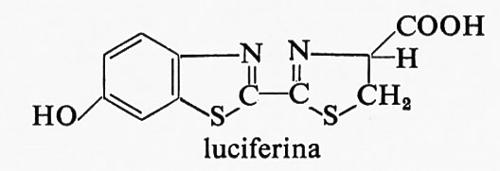
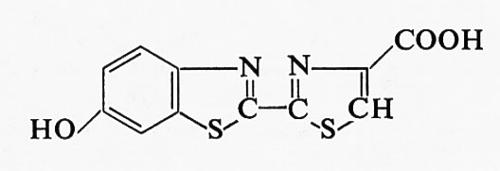
La struttura della luciferina è stata determinata da White e altri (v., 1961), i quali riuscirono anche a eseguirne la sintesi totale. La formula di struttura è la seguente:
Dei due stereoisomeri possibili, soltanto la D-luciferina produce luce in seguito all'ossidazione, mentre l'isomero L è completamente inattivo. La formula di struttura della ossiluciferina è:
La luciferasi è stata cristallizzata da Green e Mc Elroy (v., 1956); si tratta di una euglobulina il cui peso molecolare è stato stimato intorno a 100.000. Tuttavia determinazioni più recenti hanno dimostrato che il peso molecolare minimo della luciferasi è intorno a 50.000 (v. Johnson e Shimomura, 1972).
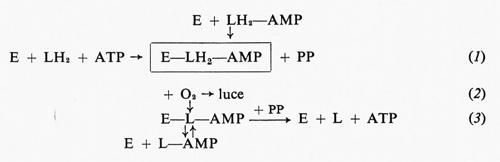
Gli eventi chimici che hanno luogo durante la reazione luminosa, secondo quanto si ricava dai lavori di Mc Elroy (v., 1964) e collaboratori, sono i seguenti:
Nella reazione (l) la luciferasi (E), la luciferina ridotta (LH2) e l'ATP formano un complesso enzima-luciferiladenilato, con liberazione di pirofosfato (PP). La reazione luminosa consiste nell'ossidazione del complesso attivo (E−LH2−AMP), che produce E−L−AMP (2). Poiché il complesso ossidato è stabile, l'enzima E viene progressivamente allontanato dalla miscela di reazione, il che rende conto della rapida e progressiva diminuzione di velocità della reazione luminosa (inibizione da prodotto, v. Mc Elroy e Strehler, 1949; v. Mc Elroy, 1951; v. Mc Elroy e Coulombre, 1952). L'inibizione da prodotto può essere rimossa, almeno parzialmente, dal pirofosfato che si accumula come conseguenza della reazione (1). Alte concentrazioni di pirofosfato spostano la reazione (3) verso destra, liberando in tal modo l'enzima dal complesso inattivo e rendendolo disponibile per partecipare di nuovo alla reazione (1). Un effetto simile è esercitato anche dal coenzima A (CoA), che libera l'enzima dalla ossiluciferina:
E−L−AMP+CoA→E+L−CoA+AMP.
Come dimostrato da Rhodes e Mc Elroy (v., 1958), se la reazione luminescente viene fatta svolgere in vitro aggiungendo LH2−AMP all'enzima, non si produce pirofosfato nella reazione (1) e quindi l'inibizione da prodotto non incontra opposizione.
Il pirofosfato viene idrolizzato in vivo dall'enzima pirofosfatasi inorganica, che è presente negli organi fotogeni delle lucciole in concentrazione dieci volte più alta che negli altri organi dell'animale (v. Mc Elroy e altri, 1951 e 1953).
Con questo meccanismo l'enzima e l'ATP rientrano in circolazione, mentre l'ossiluciferina, il cui preciso destino non è ben conosciuto, viene consumata; quindi luciferina ridotta deve essere continuamente prodotta ex novo a opera dei fotociti.
La resa quantica del sistema luminoso delle lucciole è stata calcolata dell'ordine di 0,88±0,25, ossia assai vicina all'unità (v. Seliger e Mc Elroy, 1960).
La natura della molecola emettitrice di luce è ancora avvolta da notevoli incertezze dovute al fatto che i complessi adenilati sono instabili, così che è impossibile analizzare il loro spettro di fluorescenza in condizioni fisiologiche. Un approccio più proficuo a questo problema è stato intrapreso partendo dall'osservazione che gli spettri di emissione delle diverse specie di lucciole in vivo sono diversi. Lo spettro di emissione di una miscela di reazione nella quale siano state poste luciferina da una specie di lucciole e luciferasi da un'altra speciè è sempre identico a quello della luce emessa dalla specie cui appartiene la luciferasi. Così, mescolando luciferasi di Photuris con luciferina di Photinus lo spettro della luce è identico a quello emesso da Photuris in vivo. Viceversa, la luciferasi di Photinus aggiunta alla luciferina di Photuris produce lo stesso spettro di emissione di Photinus. Non vi è dubbio quindi che gli spettri di emissione dipendano dalla specificità della luciferasi, ed è possibile che piccole variazioni strutturali di quest'ultima siano la causa delle differenze di emissione spettrale nelle varie specie. Sembra ragionevole pensare, pertanto, che la molecola emettitrice di luce sia il complesso attivo E−LH2−AMP (v. Seliger e Mc Elroy, 1964).
Il problema più importante che rimane tuttora insoluto, e che è comune a tutti gli animali luminosi, è quello dello scatenamento dell'emissione di luce in risposta a stimoli esterni o a impulsi nervosi. Per quanto riguarda le lucciole, le varie ipotesi proposte verranno discusse nel cap. 4, dedicato alla fisiologia della bioluminescenza.
Altri sistemi enzimatici. - Come abbiamo già osservato, un sistema luciferina-luciferasi è stato identificato in circa una dozzina di tipi di organismi (v. Johnson e Shimomura, 1972). In alcuni di essi, i reagenti sono stati isolati in forma pura ed è stata calcolata la resa quantica.
Gli aspetti essenziali delle reazioni luminose finora conosciute sono raccolti in forma schematica nella tab. II.
I sistemi luminosi dell'emicordato Balanoglossus e dell'oligochete Diplocardia sono esempi di una reazione luciferina-luciferasi che si discosta alquanto da quelli finora descritti: in essi, infatti, la luminescenza richiede la presenza di H2O2 invece di O2 e la luciferasi possiede tutte le proprietà di una perossidasi, da cui può essere sostituita nella reazione (v. Cormier, Kreiss e Prichard, 1966).
c) Sistemi non enzimatici
La partecipazione di una proteina specifica alla reazione luminosa è una caratteristica comune a tutti i sistemi luminescenti. I sistemi non enzimatici non costituiscono una eccezione alla regola, per quanto riguarda la partecipazione di una proteina specifica; essi tuttavia differiscono dai sistemi enzimatici per un aspetto importante, e cioè nel fatto che la proteina specifica non funziona come un enzima. Al contrario, la proteina fornisce energia per l'emissione luminosa (che può essere innescata da vari agenti) e viene distrutta nel processo.
I sistemi luminescenti delle meduse Aequorea, Halistaura e Pelagia, dell'anellide Chaetopterus e del gambero Meganyctiphanes sono esempi di meccanismi non enzimatici finora noti; altri verranno probabilmente scoperti in futuro.
I sistemi luminescenti di Aequorea e di Halistaura non richiedono la presenza di ossigeno, come è dimostrato dal fatto che si può ottenere emissione di luce in questi animali in condizioni strettamente anaerobiche (v. Harvey, 1952). La prova cruciale dell'indipendenza del sistema di Aequorea dall'ossigeno è stata ottenuta con gli esperimenti di Shimomura e altri (v., 1962) su preparazioni purificate. Questi autori estrassero e purificarono una proteina, che essi chiamarono ‛equorina', e dimostrarono che se la preparazione veniva eseguita in un mezzo privo di Ca2+, si poteva ottenere emissione di luce dalla proteina stessa con la sola aggiunta di Ca2+ o Sr2+.
Per spiegare le sorgenti energetiche della reazione luminosa è stato proposto che l'ossigeno o un perossido fossero legati alla proteina e potessero in questo modo fornire sufficiente energia per la radiazione visibile. Questa ipotesi, peraltro, non è sostenuta da prove conclusive ed il meccanismo intimo della reazione dell'equorina costituisce un problema ancora insoluto. Si può solo dire, al momento, che il complesso emettitore, designato con la sigla ‛BFP-3Ca', è il risultato del legame specifico di tre Ca2+ per molecola proteica. Entro questo complesso è stata identificata una porzione fluorescente strettamente legata alla proteina (AF-350), e si è prospettata l'ipotesi che essa sia il cromoforo funzionale. In questo, come negli altri esempi di sistemi non enzimatici che verranno esposti più avanti, non si è mai ottenuta alcuna prova che la proteina specifica abbia qualche caratteristica in comune con un enzima; al contrario, tutte le prove sperimentali indicano che la fotoproteina non rientra in circolo e viene distrutta durante l'emissione luminosa (v. Johnson e Shimomura, 1972).
Oltre all'importanza concettuale legata alla scoperta dei sistemi delle fotoproteine, l'equorina - come è stato suggerito originariamente da Shimomura e altri (v., Microdetermination..., 1963), e successivamente da Ashley (v., 1971) - costituisce un mezzo estremamente sensibile, specifico e rapido per la determinazione degli ioni Ca2+. Nei sistemi biologici l'equorina è stata usata per la prima volta da Ashley e Ridgway (v., 1968 e 1970), i quali poterono scoprire e misurare l'ingresso di Ca2+ dentro singole fibre muscolari di Balanus, precedentemente riempite di equorina, in risposta alla stimolazione elettrica. I vantaggi dell'equorina sono stati sfruttati anche da Baker e altri (v., 1970) per studiare il movimento di Ca2+ attraverso la membrana dell'assone gigante del calamaro.
Il sistema luminescente di Halistaura (v. Shimomura e altri, Extraction..., 1963) è essenzialmente simile nelle sue proprietà (specialmente per la sua indipendenza dall'ossigeno) a quello di Aequorea. Cofattori complessi, invece, sono richiesti dai sistemi luminescenti non enzimatici di Chaetopterus e Meganyctiphanes. Questi due sistemi richiedono ossigeno come cofattore, e quello di Chaetopterus ha bisogno inoltre di ferro ferroso (Fe2+), di un perossido e di due molecole non identificate (probabilmente una nucleoproteina e un lipide). La fotoproteina di Chaetopterus (peso molecolare 80.000) è stata isolata in forma cristallina (v. Johnson e Shimomura, 1972) e si è dimostrato che essa viene distrutta durante l'emissione di luce, ma il meccanismo dell'emissione luminosa non è stato ancora chiarito.
Nel gambero Meganyctiphanes è stata separata dalla fotoproteina una frazione responsabile dell'emissione di luce. Durante la reazione, la frazione fluorescente (F) che emette luce viene rimessa in circolo, mentre la proteina specifica (P), non diffusibile, viene distrutta per fornire energia alla frazione (F) per l'emissione luminosa (per una bibliografia sull'argomento, v. Johnson e Shimomura, 1972).
4. Fisiologia della bioluminescenza
a) Meccanismi di eccitazione
Generalità. - Non è stata fornita alcuna prova dell'esistenza di un meccanismo di controllo specifico della luminescenza in Batteri e Funghi. In queste forme la luminescenza ha il carattere di un'emissione continua ed è apparentemente il risultato inevitabile di una via metabolica parallela alla via principale del metabolismo ossidativo, che per manifestarsi richiede soltanto una sufficiente pressione parziale di ossigeno (v. Harvey, 1952; v. Mc Elroy e Seliger, 1962).
Un tipo di controllo fisiologico è stato dimostrato in tutte le altre forme di bioluminescenza finora investigate. Benché l'informazione che possediamo sulla fisiologia dell'emissione di luce sia ben lungi dall'essere completa, cercheremo di classificare i meccanismi di controllo in due gruppi principali, e precisamente meccanismi intrinseci e meccanismi estrinseci: ai primi appartengono tutti quei meccanismi che sono localizzati nelle stesse strutture che emettono luce, mentre alla seconda categoria appartengono tutti i meccanismi di controllo umorale o nervoso della luminescenza. I meccanismi estrinseci possono agire sia in maniera indiretta (cioè non eccitando l'emissione di luce dai fotociti, ma attraverso l'azione di apparati accessori), sia esercitando un'azione eccitatoria diretta sulle cellule fotogene. Deve essere peraltro sottolineato che questa suddivisione ha il difetto di essere eccessivamente semplificata ed è, almeno in certa misura, arbitraria, perché non esistono ragioni che permettono di escludere a priori la possibilità che meccanismi diretti e indiretti coesistano nello stesso organismo e perfino nello stesso organo luminoso; essa viene adottata qui solo per ragioni di chiarezza.
Controllo intrinseco. - Questo meccanismo di controllo è presente nei Protozoi ed è stato indagato a fondo nel dinoflagellato Noctiluca miliaris.
Noctiluca emette un lampo di luce che si origina da sorgenti puntiformi diffuse nel suo citoplasma, in risposta a uno stimolo meccanico (v. Eckert e Reynolds, 1967; per una bibliografia sull'argomento, v. Harvey, 1952).
Le indagini condotte con metodo intracellulare (v. Eckert, 1965 e 1966; v. Eckert e Sibaoka, 1968) dimostrano che l'emissione di luce viene scatenata da un potenziale d'azione propagato del tipo ‛tutto o nulla'. Questo potenziale d'azione si origina in risposta alla stimolazione meccanica o elettrica di qualsiasi punto della superficie cellulare, si propaga alla intera superficie con una velocità di 60 μm/s ed è seguito da un'onda di luminescenza.
Il problema dell'accoppiamento tra potenziale d'azione e luminescenza è tuttora aperto. Tuttavia, poiché è stato possibile ottenere sommazione temporale delle risposte (v. Eckert e Reynolds, 1967), si può ritenere che la quantità di substrato non costituisca il fattore limitante per la durata del lampo. Si potrebbe pensare, perciò, che il potenziale d'azione aumenti la permeabilità della membrana a qualche cofattore, il quale potrebbe a sua volta dare inizio alla reazione luminosa, per poi scomparire rapidamente durante il lampo. La latenza tra flusso locale di corrente e lampo (2-3 ms) è compatibile con il tempo di diffusione dell'ipotetico cofattore.
Il ritmo diurno della risposta luminosa del dinoflagellato Gonyaulax polyedra costituisce un altro esempio di meccanismo fisiologico intrinseco di controllo della luminescenza. In questi dinoflagellati fotosintetici l'emissione luminosa avviene durante la notte e si arresta durante il giorno. Questa ritmica alternanza dell'emissione di luce ha il carattere di un ritmo endogeno, poiché rimane invariata nelle colture esposte a una luce debole continua (sufficientemente intensa, tuttavia, per la fotosintesi) e può essere sfasata alterando artificialmente il ciclo luce-buio. Lo sfasamento non è peraltro un fenomeno permanente, poiché il ritmo normale si ristabilisce non appena le colture vengono riportate a luce debole continua (v. Hastings e Sweeney, 1958; v. Hastings e Bode, 1962; v. Hastings, 1964; v. Hastings e Keynan, 1965; v. Sweeney e Hastings, 1957).
Controllo estrinseco. - Il lavoro sperimentale su questo tipo di controllo è scarso; la presenza in un certo animale di un controllo indiretto della luminescenza viene in larga misura desunta dalla sua organizzazione anatomica.
1. Meccanismi indiretti. Un tipico esempio di controllo indiretto è rappresentato da quei meccanismi neuromuscolari che controllano l'emissione della secrezione luminosa delle ghiandole. Uno dei casi meglio conosciuti è quello del crostaceo Cypridina (v. Okada, 1926), nel quale la luminescenza viene prodotta quando un apparato neuromuscolare spreme da cellule ghiandolari separate granuli di luciferina e luciferasi nell'acqua di mare, dove ha luogo la reazione luminosa.
Meccanismi simili sono stati descritti nel pesce Malacocephalus, che emette una secrezione luminosa in seguito alla contrazione di muscoli che spremono la ghiandola luminosa (v. Hickling, 1925 e 1926), e nel calamaro Heteroteuthis, che spruzza materiale luminoso in maniera analoga all'eiezione dell'inchiostro che si verifica nelle forme non luminose (v. Harvey, 1952).
Una seconda categoria di meccanismi indiretti di controllo è costituita da quelle attività neuromuscolari che regolano l'intensità e/o la durata della luce emessa. Ciò si può ottenere: a) nascondendo gli organi luminosi dietro pieghe tegumentarie pigmentate, come nel teleosteo Photoblepharon (nel quale la luce prodotta dai batteri luminosi alloggiati nei suoi fotofori può essere schermata dal sollevamento di pieghe di pelle pigmentata) e in Anomalops e altri Teleostei, i quali possono esporre o nascondere la loro luce ruotando l'organo luminoso stesso (v. Harvey, 1923 e 1952; v. Nicol, 1967); b) per mezzo dell'espansione o contrazione di cromatofori, come in diversi calamari luminosi (per es., Leachia, Watasenia, Abraliopsis), nei quali i cromatofori si espandono o si contraggono per azione di fibre muscolari (v. Nicol, 1960, 1962 e 1967). Un meccanismo simile controlla l'intensità dell'emissione luminosa in certi Teleostei (Coelorhyncus, Hymenocephalus) per mezzo della concentrazione o dispersione di cromatofori, i quali nei Pesci sono sottoposti a controllo nervoso e umorale (v. Nicol, 1967).
2. Meccanismi diretti. Il meccanismo attraverso il quale la secrezione delle cellule ghiandolari luminose è controllata da impulsi nervosi è praticamente ignoto. Non vi sono ragioni per postulare l'esistenza di meccanismi fondamentalmente diversi da quelli che agiscono a livello di altre giunzioni neuroghiandolari; il problema di come le cellule luminose scarichino il loro contenuto in risposta agli impulsi nervosi è quindi comune a tutte le altre cellule ghiandolari.
Nei pochi casi di luminescenza extracellulare finora studiati si è potuto dimostrare che la secrezione del materiale luminoso è sotto il controllo di impulsi nervosi, come nell'anellide Chaetopterus (v. Nicol, 1960) e negli Emicordati (v. Baxter e Pickens, 1964).
Controllo nervoso diretto interviene in tutti i casi di luminescenza intracellulare nei Metazoi.
La luminescenza può essere ottenuta in risposta all'eccitazione diretta dei nervi o come risposta riflessa a stimoli naturali in Meduse (v. Davenport e Nicol, 1956), Pennatulacee (v. Davenport e Nicol, 1955), Ctenofori (v. Chang, 1954) e Vermi polinoidi (v. Bonhomme, 1942; v. Nicol, 1960 e 1967). Nonostante la considerevole diversità di organizzazione anatomica, le risposte luminose che si ottengono da questi differenti animali in seguito a stimolazione elettrica sono accomunate dalle caratteristiche generali di risposte di tipici sistemi neuroeffettori, e cioè dipendenza della risposta dall'intensità dello stimolo, sommazione di stimoli subliminali, facilitazione, ‛scala' e tetano (v., ad es., Chang, 1954). Anche le variazioni della risposta che si ottengono alterando la composizione ionica del mezzo esterno (aumento di eccitabilità con elevata concentrazione di Ca2+ e bassa di Mg2+; depressione con bassa concentrazione di Ca2+ e alta di Mg2+) sono in accordo con il carattere neuroeffettorio della risposta luminosa (v. Heymans e Moore, 1924).
Un controllo umorale diretto è stato suggerito da Kay (v., 1965) per i fotofori del gambero Meganyctiphanes norvegica, che è apparentemente legato alla liberazione di 5-idrossitriptammina. È probabile che un sistema adrenergico, nervoso e umorale, partecipi al controllo della luminescenza in alcuni pesci (v. Greene e Greene, 1924; v. Nicol, 1957).
3. Eccitazione della bioluminescenza nelle lucciole: un esempio di meccanismo diretto ed estrinseco. La luminescenza intracellulare delle lucciole è l'esempio di gran lunga meglio studiato di controllo nervoso della bioluminescenza. La stretta dipendenza del lampeggiamento dal sistema nervoso fu dimostrata per primo da Verworn (v., 1892); questo autore osservò che il lampeggiamento scompariva nell'animale decapitato, nel quale, peraltro, potevano ancora ottenersi dei lampi in seguito a stimolazione della corda nervosa. Da allora le osservazioni di Verworn sono state ripetutamente confermate (v. Lund, 1911; v. Case e Buck, 1963; v. Buonamici e Magni, 1967; v. Harvey, 1952), sicché oggi è chiaramente stabilito che il lampeggiamento spontaneo è possibile solo quando sono intatte le connessioni fra cervello e lanterna.
La registrazione dell'attività elettrica dalle lanterne di larve di lucciole orientali e dalle lanterne di adulti che emettono luce continua (v. i contributi di Hasama, 1942; v. Buck, 1948) dimostra che i segmenti luminosi sono negativi rispetto a quelli non luminosi. Recentemente le registrazioni con semi-microelettrodi dalla lanterna di lucciole lampeggianti adulte (v. Case e Buck, 1963; v. Buonamici e Magni, 1967) hanno dimostrato che ciascun lampo spontaneo è trascinato da una salve d'impulsi nervosi che si originano dal cervello (scariche fotogene). La scarica ritmica degli impulsi nervosi è il risultato dell'attività di alcuni neuroni del cervello, che si crede siano dotati di attività autoritmica (v. Blair, 1915; v. Richmond, 1930; v. Hanson e altri, 1971). Questo modo di vedere, tuttavia, costituisce un'eccessiva semplificazione; infatti, esperimenti recenti suggeriscono l'ipotesi che la ritmicità non sia una proprietà intrinseca dei neuroni fotomotori localizzati nel protocerebro, ma sia piuttosto il risultato della ritmica inibizione dell'attività spontanea di questi neuroni da parte di strutture nervose situate nei lobi ottici (v. Magni, 1972).
L'analisi dei rapporti tra scariche fotogene e intensità e durata del lampo mostra che la scarica fotogena funziona principalmente come un agente scatenante: forma, durata e intensità del lampo sono in larga misura indipendenti sia dalla durata della scarica, sia dal numero e dalla frequenza dei potenziali d'azione che la costituiscono (v. Case e Buck, 1963; v. Buonamici e Magni, 1967). Secondo Case e Buck soltanto un terzo della variabilità del lampo può essere attribuito alla variabilità delle scariche; i rimanenti due terzi furono attribuiti da questi autori a meccanismi di inibizione periferica. Questa ipotesi ha ricevuto ampia conferma sperimentale e verrà discussa dettagliatamente più avanti.
L'analogia tra il comportamento del sistema luminescente in seguito a stimolazione elettrica e quello di un organo neuroeffettore tipico (già ricordata a proposito di altri animali) è stata dimostrata anche per le lucciole (v. Buck e Case, 1961; v. Buonamici e Magni, 1967). La risposta alla stimolazione elettrica diretta è costituita da un lampo identico a un lampo spontaneo per latenza e per andamento temporale; l'ampiezza della risposta dipende sia dall'intensità sia dalla durata dello stimolo, i cui rapporti sono descritti da una tipica curva intensità-durata. Alla stimolazione ripetitiva la risposta mostra i fenomeni della ‛scala', sommazione, facilitazione degli stimoli subliminali e può andare incontro a fenomeni di ‛fatica'. Usando stimoli di diversa intensità è stato possibile ottenere dall'organo luminoso tre classi di risposta, definite dalla loro latenza, e precisamente un lampo ‛lento', un lampo ‛rapido' e un lampo ‛ultrarapido'. Il lampo lento ha la soglia più bassa e compare con una latenza che è caratteristica della specie: 86 ms in Photuris pennsylvanica (v. Buck e Case, 1961), 150 ms in Luciola lusitanica (v. Buonamici e Magni, 1967), 194 ms in Photinus (v. Buck e Case, 1961). La seconda classe di risposte (il lampo rapido) si ottiene con stimoli più intensi ed è caratterizzata da una latenza molto più breve (20 ms; v. Buck e altri, 1963). Poiché poche ore dopo la sezione dei nervi lanternali non si ottiene più il lampo lento in seguito a stimolazione dell'organo luminoso, mentre il lampo rapido può essere ancora ottenuto, si deve concludere che il lampo lento è il risultato dell'eccitazione delle fibre nervose, mentre il lampo rapido è dovuto all'eccitazione di strutture periferiche. Usando stimoli molto intensi (fino a 150 V), è possibile ottenere la risposta ultrarapida, che ha una latenza ancora più breve (1 ms; v. Buck e altri, 1963). Sulla base di questi risultati è stata proposta una linea di trasmissione dell'eccitamento dai nervi ai fotociti, la quale interessa, in successione temporale e in ordine crescente di soglia: a) i nervi lanternali e le loro terminazioni; b) gli organi terminali (cellule tracheali terminali e cellule tracheolari); c) i fotociti. Le indagini comparative di Buck (v., 1948) mostrano che nelle lucciole la capacità di emettere luce in forma di lampi separati da periodi di oscurità dipende dalla presenza di organi terminali (v. sopra, cap. 2, È c); tuttavia si è ancora ben lontani dalla comprensione dell'esatto ruolo dell'organo terminale. Infatti, se gli esperimenti di denervazione provano al di là di ogni dubbio la natura nervosa del lampo lento, non vi è chiara prova che il lampo rapido e ultrarapido siano dovuti, rispettivamente, all'attivazione degli organi terminali e dei fotociti. Per di più, il significato fisiologico del lampo ultrarapido è dubbio, in considerazione delle elevate intensità di stimolo che sono necessarie per ottenerlo; d'altra parte il comportamento del lampo rapido (il suo aumento di ampiezza accompagnato dalla diminuzione del lampo lento con l'aumentare dell'intensità dello stimolo) non è incompatibile con la sua possibile origine dall'eccitazione diretta dei fotociti. In ogni modo, la lunga latenza delle risposte pone di per se stessa un problema. Poiché in Photuris il tempo totale speso nella conduzione e nell'attivazione trans-sinaptica del sistema effettore è 50-60 ms (differenza tra la latenza del lampo lento, 70-80 ms, e quella del lampo rapido, 20 ms), e poiché la conduzione lungo i nervi (10-15 ms) occupa soltanto una piccola frazione della latenza totale, un tempo di 35-50 ms dovrebbe essere perduto nell'attivazione trans-sinaptica. Questo tempo è troppo lungo per una sinapsi chimica convenzionale. Anche la latenza del lampo rapido (20 ms) è troppo lunga per l'attivazione diretta di organi effettori elettricamente eccitabili (v. Magni, 1972). Chiaramente, latenze di quest'ordine di grandezza possono solo essere dovute a eventi chimici che comportano diffusione per lunghe distanze o attraverso barriere di permeabilità. L'assenza di innervazione diretta dei fotociti rende questa ipotesi degna di attenta considerazione. Sfortunatamente niente sappiamo finora intorno ai meccanismi neuroeffettori a livello dell'organo fotogeno, che potrebbero aiutarci a far luce sui problemi sollevati dalle ricerche qui esposte. Il solo progresso è stato la dimostrazione dell'invalidità della teoria del controllo da parte dell'ossigeno, originariamente proposta da Snell (v., 1932) e Alexander (v., 1943), e universalmente accettata fino al 1948.
Questa teoria si fondava su due osservazioni, consistenti la prima nel fatto che con la microscopia ottica si potevano osservare nelle cellule tracheali terminali delle strutture che avevano l'aspetto di fibre contrattili, la seconda nella ben nota dipendenza della luminescenza delle lucciole dall'ossigeno. Si pensava perciò che la cellula tracheale terminale funzionasse come una valvola, normalmente chiusa quando gli animali non lampeggiano o negli intervalli tra i lampi, ma in grado di aprirsi per azione degli impulsi nervosi, permettendo all'ossigeno di giungere ai fotociti e dando così inizio alla luminescenza. I postulati anatomici e fisiologici su cui la teoria si fondava non hanno ricevuto conferma sperimentale. Si è visto infatti che l'ossigeno non può essere considerato il fattore limitante per la bioluminescenza nelle lucciole, poiché si può avere emissione di luce anche a pressioni parziali di ossigeno molto basse. Secondo la teoria dell'ossigeno, i fotociti dovrebbero essere mantenuti in condizioni completamente anaerobiche, non soltanto negli intervalli tra i lampi, ma anche nei lunghi periodi durante i quali l'animale non lampeggia. Inoltre la cinetica della diffusione di ossigeno negli Insetti non presenta alcuna somiglianza con la cinetica del lampo (v. Buck, 1948). Infine, l'osservazione di Beams e Anderson (v., 1955) al microscopio elettronico che la ipotetica struttura valvolare è in effetti costituita da mitocondri ha portato all'abbandono della teoria.
Sono stati suggeriti altri meccanismi di accoppiamento neuroeffettorio. Buck (v., 1948 e 1955) postula che tutti i reagenti della reazione luminosa siano presenti entro il fotocita e che l'arrivo degli impulsi nervosi porti alla liberazione di uno di essi (la luciferasi) da un complesso inattivo: da questo momento in poi la reazione si sviluppa con la sua velocità caratteristica, che dipende sia dalla concentrazione dell'enzima, sia dall'inibizione da prodotto (v. Mc Elroy, 1951; v. Mc Elroy e Strehler, 1949; v. Mc Elroy e Coulombre, 1952). Gli esperimenti di Mc Elroy (1951) sono in accordo con questa ipotesi, in quanto dimostrano che lampi identici a quelli osservati in vivo possono essere riprodotti in vitro in seguito alla liberazione dell'enzima da un complesso inattivo.
È noto (v. Mc Elroy e altri, 1951 e 1953) che il pirofosfato inorganico che si produce durante la formazione del complesso attivo (v. sopra, cap. 3, § b) è capace di liberare la luciferasi dal complesso inattivo ed è rapidamente distrutto dalla pirofosfatasi inorganica che è presente nel tessuto fotogeno ad alte concentrazioni. Su questa base è stato elaborato un modello (v. Mc Elroy, 1951; v. Mc Elroy e Hastings, 1955 e 1957) il quale postula la liberazione di acetilcolina dalle terminazioni sinaptiche e la sua susseguente reazione con il CoA a formare acetil-CoA; questo prodotto a sua volta libererebbe pirofosfato dall'ATP, dando l'avvio alla reazione luminosa, che cesserebbe appena il pirofosfato è idrolizzato e tutta la luciferasi è di nuovo sequestrata nel complesso inattivo. Si deve tuttavia notare che non esiste alcuna prova, che l'acetilcolina sia il mediatore delle sinapsi lanternali; al contrario, è stato osservato che l'acetilcolina è assolutamente incapace di dare inizio alla luminescenza (v. Carlson, 1967 e 1969; v. Bagnoli e altri, 1972). Ulteriori sforzi sono necessari per risolvere questo problema.
Ricerche recenti (v. Buck, 1966; v. Hanson e altri, 1969) hanno dimostrato che l'organo fotogeno si comporta come un mosaico funzionale, costituito da unità fotogene discrete. L'uso delle tecniche di intensificazione di immagine ha consentito a Hanson e collaboratori (1969) di concludere che l'unità funzionale è la porzione centrale del citoplasma di due o tre fotociti adiacenti, che sono controllati dal medesimo organo terminale (v. Smith, 1963). Poiché la durata del lampo di ciascuna unità funzionale è più breve di quella dell'intero lampo e l'emissione di ciascuna microsorgente unitaria non è di tipo ‛tutto o nulla', ma completamente graduabile in intensità, il lampo emesso dall'intero organo deve essere considerato come l'integrale dell'attività coordinata di una popolazione di microsorgenti. Questo fa pensare che il sistema nervoso centrale possa modulare l'emissione luminosa variando sia il numero sia la sequenza temporale delle microsorgenti e/o variando l'intensità della luce emessa da ciascuna sorgente unitaria.
b) Meccanismi di modulazione
In molti animali un certo numero di stimoli naturali è capace di modulare la luminescenza (v. Harvey, 1952): tra questi il più importante è certamente la luce, che esercita sugli organi fotogeni sia azioni eccitatrici, sia azioni inibitrici. L'inibizione della luminescenza indotta dalla luce è stata osservata nella medusa Pelagia, nella quale l'eccitabilità riflessa degli organi luminosi sembra essere anche sotto il controllo di un ritmo diurno (v. Heymans e Moore, 1924). Nello ctenoforo Renilla l'effetto inibitorio della luce si esercita direttamente sui fotociti (v. Davenport e Nicol, 1955), mentre in Mnemiopsis l'inibizione indotta dalla luce si esercita attraverso una connessione diretta dei recettori con i fotociti (v. Moore, 1924, 1925 e 1926; v. Heymans e Moore, 1925; v. Harvey, 1925). Alcuni esperimenti indicano un'azione eccitatrice e inibitrice della luce sulla luminescenza del gambero Meganyctiphanes norvegica, ma il meccanismo di queste azioni non è stato precisato (v. Kay, 1965).
Il più notevole esempio di modulazione fotica è quello fornito dalle lucciole. In questi animali l'azione inibitrice della luce sul lampeggiamento è stata osservata da molti ricercatori (v. Harvey, 1952). La natura riflessa del fenomeno è stata per la prima volta dimostrata da Gerretsen (v., 1922), il quale osservò che l'inibizione del lampeggiamento in Luciola vittata può essere ottenuta soltanto con l'illuminazione degli occhi dell'animale. L'effetto della luce sul lampeggiamento dipende dall'intensità, in quanto luce di bassa intensità produce facilitazione e luce di alta intensità produce inibizione (v. Buck, Studies on the firefly. I. The effect..., 1937; v. Magni 1967). In Photuris l'inibizione del lampeggiamento si può ottenere sia con stimolazione elettrica sia con stimolazione fotica dell'occhio (v. Case e Buck, 1963; v. Case e Trinkle, 1968).
I meccanismi dell'inibizione fotica del lampeggiamento sono stati oggetto di numerose indagini in Luciola lusitanica. Un'azione inibitrice centrale della luce è dimostrata dal fatto che l'illuminazione degli occhi con luce intensa produce l'arresto sia del lampeggiamento, sia delle scariche fotogene (v. Magni, 1967). Tuttavia, con luce di intensità adatta è possibile ottenere la scomparsa dei soli lampi, mentre possono ancora essere registrate scariche fotogene di aspetto normale. Inoltre, l'illuminazione degli occhi deprime reversibilmente l'ampiezza dei ‛lampi lenti', che si ottengono in risposta ad uno stimolo di intensità costante applicato ai nervi lanternali (v. Magni, 1967) L'ipotesi che la dissociazione tra scariche e lampi e la depressione dei lampi periferici siano entrambe dovute alla soppressione di una influenza facilitante tonica di natura centrale (v. Case e Trinkle, 1968) può essere esclusa in seguito all'osservazione che la decapitazione o la resezione dei nervi lanternali non producono alcuna diminuzione dell'ampiezza del lampo periferico (v. Bagnoli e altri, 1970). I risultati sperimentali possono perciò essere spiegati soltanto con un meccanismo di inibizione periferica, la cui presenza era stata postulata da diversi ricercatori sulla base di prove indirette (v. Alexander, 1943; v. Buck e altri, 1963; v. Case e Buck, 1963; v. Carison, 1961).
La natura del meccanismo inibitorio periferico è stata oggetto di approfondite indagini. È stato dimostrato che nei maschi di Luciola lusitanica l'inibizione del lampeggiamento può essere trasferita, con un ritardo di circa 20 s, da una lucciola illuminata a una tenuta al buio, quando le cavità del corpo dei due animali sono connesse da un ponte di soluzione fisiologica (v. Brunelli e altri, Mechanisms..., 1968); il trasferimento dell'inibizione non avviene più dopo l'asportazione delle gonadi della lucciola ‛donatrice'. Questi esperimenti provano in maniera conclusiva che, in aggiunta al suo effetto inibitorio sul sistema nervoso, l'illuminazione degli occhi induce in via riflessa la secrezione dalle gonadi maschili di una sostanza che esercita un'azione inibitrice sul lampeggiamento. Ulteriori ricerche hanno dimostrato che la sostanza inibitrice liberata dalle gonadi agisce direttamente a livello dell'organo luminoso, e che la secrezione è probabilmente controllata dal sistema nervoso (v. Brunelli e altri, Effects of castration..., 1968; v. Bagnoli e altri, 1970).
La sostanza inibitrice viene sintetizzata e accumulata nei granuli citoplasmatici delle cellule che circondano i follicoli spermatici delle gonadi maschili (v. Brunelli e altri, 1970). Il numero dei granuli varia con un ritmo circadiano, che si mantiene anche in animali tenuti continuamente al buio (e pertanto è probabilmente di natura endogena), con un massimo nelle ore nelle quali l'animale lampeggia e un minimo nelle ore di inattività.
Bagnoli e altri (v., 1972) identificarono la sostanza inibitrice con la noradrenalina e dimostrarono che essa a) esercita una potente azione inibitrice a livello della lanterna; b) è contenuta nelle gonadi in una quantità dieci volte superiore alla dose soglia; c) è attivamente sintetizzata e immagazzinata nei granuli delle cellule corticali, legata a una molecola proteica; e infine d) viene liberata, in seguito a illuminazione degli occhi, insieme con la proteina.
Questi risultati sono in apparente discrepanza con quelli di studi precedenti, che avevano dimostrato la possibilità di ottenere l'eccitazione della luminescenza in seguito a somministrazione di catecolammine in lanterne di animali adulti (v. Kastle e Mc Dermott, 1910; v. Emerson e Emerson, 1941; v. Smalley, 1965; v. Borowitz e Kennedy, 1968) e di larve (v. i contributi di Carlson, 1968). È stato anche ipotizzato che l'adrenalina sia il mediatore eccitatorio a livello della lanterna (v. Smafley, 1965). Si deve notare, peraltro, che in questi esperimenti gli effetti eccitatori venivano ottenuti con dosi diecimila volte più alte di quelle che producono l'effetto inibitorio periferico (v. Bagnoli e altri, 1972), ed è pertanto possibile che l'eccitazione della luminescenza sia il risultato di un'azione puramente farmacologica. Non esiste inoltre alcuna prova della natura adrenergica dei nervi lanternali (v. Carlson, 1969).
Il problema del luogo e del meccanismo d'azione della noradrenalina a livello della lanterna è tuttora aperto; la risposta potrà venire soltanto da una migliore conoscenza dei meccanismi di accoppiamento neuroeffettorio.
Il significato biologico dell'inibizione periferica è stato chiarito da ricerche recenti. Si sapeva da lungo tempo che il lampeggiamento delle lucciole è un fenomeno dotato di periodicità circadiana, regolata da un ‛orologio' interno (v., per es.,. Allard, 1931; v. Buck, Studies on the firefly. I. The effect of light..., 1937). Durante il giorno gli animali stanno nascosti immobili tra l'erba senza lampeggiare; la stimolazione meccanica provoca alcuni movimenti e qualche volta alcuni deboli lampi, dopo di che gli animali tornano al loro stato di immobilità (v. Verworn, 1892; v. Case e Buck, 1963). Durante questo periodo l'eccitabilità dei nervi lanternali alla stimolazione elettrica è molto minore di quella posseduta dagli animali che lampeggiano attivamente (v. Case e Buck, 1963), fenomeno che ricorda le fluttuazioni di eccitabilità della risposta luminosa di Pelagia, riportate originariamente da Heymans e Moore (v., 1924). I meccanismi attraverso i quali opera l'orologio interno sono stati parzialmente chiariti: in lucciole tenute continuamente al buio si possono registrare durante il giorno scariche fotogene, paragonabili in ampiezza a quelle che trascinano il lampo nelle ore notturne: esse tuttavia non sono seguite dal lampo. La capacità di trascinare un lampo durante il giorno viene ristabilita in maniera permanente dalla castrazione (v. Bagnoli e altri, 1973), ed esperimenti di controllo dimostrano che questo effetto è specifico. È possibile pensare che anche altri aspetti del comportamento delle lucciole, per esempio l'immobilità che si osserva durante il giorno o la soppressione dell'emissione luminosa dopo l'accoppiamento (v. Papi, 1969), siano sotto il controllo della secrezione testicolare.
Riassumendo, le prove sperimentali dimostrano che due meccanismi intervengono nella modulazione del lampeggiamento nelle lucciole: un meccanismo centrale, di natura nervosa e di carattere fasico, devoluto alla modulazione a breve termine, richiesto per l'elaborazione di segnali visivi di breve durata caratteristici della comunicazione luminosa tra i sessi (v. sotto, cap. 5); un meccanismo di inibizione periferica, attivato da agenti esogeni (illuminazione degli occhi) ed endogeni (orologio interno), di natura umorale e di carattere tonico, devoluto alla modulazione a lungo termine dell'attività luminosa.
5. Significato biologico della bioluminescenza
a) Generalità
Benché in alcune forme animali sia possibile attribuire alla bioluminescenza un chiaro valore di sopravvivenza, in molti organismi il suo significato biologico rimane misterioso. Nei Batteri e nei Funghi la luminescenza è sprovvista di qualsiasi meccanismo di controllo fisiologico e non sembra avere nessun significato importante nella vita di questi organismi. In effetti, mutanti non luminosi mostrano respirazione e velocità di crescita identiche a quelle delle forme luminose. L'emissione di luce sembra essere la manifestazione inevitabile di un carattere genotipico, che richiede, per manifestarsi, solo una sufficiente quantità di ossigeno.
È stata prospettata l'ipotesi (v. Mc Elroy e Seliger, 1962) che la bioluminescenza abbia fatto la sua comparsa nelle prime ere biologiche in organismi anaerobici, probabilmente come difesa contro gli effetti tossici di un'atmosfera che si arricchiva sempre di più in ossigeno, in conseguenza dello sviluppo delle piante e della fotosintesi. Questa ipotesi postula inoltre che la capacità di produrre luce, una volta sviluppatasi, sia persistita attraverso l'evoluzione, anche se il suo primitivo valore adattativo era andato perduto. Sotto la pressione della selezione naturale i sistemi bioluminescenti rimasti si sarebbero evoluti lungo linee diverse andando incontro, almeno in alcune forme, ad altre funzioni adattative. Questa teoria, benché non universalmente accettata, ha il vantaggio di spiegare alcuni fatti: in primo luogo l'apparente inutilità dell'emissione di luce nei Batteri e nei Funghi; in secondo luogo, la distribuzione sparsa degli organismi luminescenti nel mondo vivente; e infine l'ampia differenza di valore per la sopravvivenza che la bioluminescenza ha nei diversi organismi. Essa non spiega tuttavia la diversità dei meccanismi biochimici e l'alta specificità delle sostanze che partecipano alla reazione luminosa.
Gli ‛usi' della bioluminescenza possono essere raggruppati sotto 4 voci principali, e cioè: a) difesa contro i predatori; b) attrazione della preda; c) riconoscimento inter e intraspecifico e attrazione tra i sessi; d) illuminazione. Bisogna precisare, tuttavia, che questa suddivisione schematica è molto probabilmente troppo semplicistica, e può essere soltanto giustificata come un tentativo di presentare in forma concisa un corpo di conoscenze che è ben lungi dall'essere completo.
b) Difesa contro i predatori
L'uso della bioluminescenza come mezzo passivo di difesa è stato suggerito, sulla base di prove indirette, per i Dinoflagellati e altri organismi planctonici. In questi organismi, che possiedono un elaborato meccanismo di controllo intrinseco (v. sopra, cap. 4, È a), la luminescenza può essere trascinata da stimoli meccanici naturali, come quelli causati dall'avvicinamento di un predatore. La risposta luminosa dei Protozoi potrebbe attrarre un secondo predatore, che si nutre del primo lungo la catena alimentare, e fornirebbe così un mezzo di difesa passiva sia per l'individuo, sia per la specie (v. Burkenroad, 1943). Un meccanismo indiretto di difesa è probabilmente costituito dalla luminescenza nel verme polinoide Acoloë: le singole elitre o l'intera parte posteriore dell'animale continuano a lampeggiare ritmicamente quando sono distaccate dal resto del corpo, e il distacco di queste parti nel caso di un attacco da parte di un predatore (per es., un granchio) può avere il significato di un'esca sacrificale per distrarre il predatore, mentre il resto dell'animale si nasconde nel buio.
Lo stesso uso della bioluminescenza è probabilmente presente negli Oligocheti, nei quali tuttavia la secrezione del materiale luminoso può essere ottenuta soltanto in seguito a stimoli molto intensi. Protezione passiva sembra essere esercitata dalla luminosità nei Miriapodi (v. Ridley, 1936) e in Bolitophyla luminosa, il verme luminoso della Nuova Zelanda (v. Hudson, 1926), per quanto manchi una prova diretta.
Un'ipotesi interessante è stata proposta da Clarke (v., 1963) per spiegare l'ampia distribuzione della luminescenza tra gli animali mesopelagici. Secondo questo autore, il fattore comune responsabile dello sviluppo della bioluminescenza in gruppi assai lontani dal punto di vista sistematico (Crostacei, Calamari e Pesci) potrebbe essere identificato nella necessità per gli animali mesopelagici di evitare di essere riconosciuti da predatori che abitano acque più profonde. Poiché la luce resta direzionale fino a una profondità di 1.000 metri circa, il riconoscimento dal di sotto potrebbe essere efficacemente evitato se l'animale fosse capace di emettere dalla superficie ventrale del corpo una luce di intensità e lunghezza d'onda tali da eguagliare la luce proveniente dalla superficie dell'acqua. È molto probabile che questa funzione di annullamento dei contrasti negli animali mesopelagici sia associata anche ad altre funzioni, quali il riconoscimento tra i sessi, l'allontanamento dei predatori, eccetera.
Fra i Molluschi la funzione di scacciare i predatori è stata suggerita per la secrezione luminosa di Pholas; questo è un esempio di meccanismo attivo di difesa. Un altro chiaro esempio è costituito dalla luminescenza extracellulare di alcuni calamari (Heteroteuthis), che espellono dal mantello una nuvola luminosa per abbagliare i predatori (lo stesso meccanismo della eiezione di inchiostro nei calamari non luminosi), mentre l'animale fugge. La funzione di scacciare i predatori è stata attribuita anche agli organi luminosi di alcuni gamberi e pesci (Systellaspis, Malacocephalus), ma di essa mancano prove dirette.
c) Attrazione della preda
Prove dirette in favore di questa funzione della bioluminescenza mancano completamente. Tuttavia, la disposizione peculiare degli organi luminosi all'estremità dei filamenti buccali e dei raggi anteriori della pinna dorsale dei pesci pescatori stomiatoidi e ceratoidi fa supporre che la loro funzione sia quella di un'esca. Anche l'illuminazione della cavità boccale in alcuni pesci (per es., Chauliodus) può servire ad attrarre la preda nella bocca.
Un uso simile della bioluminescenza è stato dimostrato da Lloyd (v., 1965) in alcuni insetti, associato alla sua azione principale, che è quella dell'attrazione tra i sessi (v. sotto). Le voraci femmine di Photuris rispondono in natura con la stessa latenza delle femmine di Photinus al segnale dei maschi di Photinus, e in tal modo li attraggono e li divorano. Anche la funzione di attrarre la preda, dunque, appare una ipotesi valida e suggestiva dell'uso della bioluminescenza.
d) Riconoscimento inter- e intraspecifico e attrazione tra i sessi
In molte specie luminescenti, appartenenti ai Calamari e ai Pesci, la distribuzione dei fotofori è altamente specifica, e differisce non soltanto nel numero e nella disposizione degli organi luminosi, ma anche (specialmente nei Calamari) nella lunghezza d'onda della luce emessa. Queste differenze possono essere usate come un segnale di riconoscimento interspecifico, che è di grandissima importanza negli animali che vivono in branchi.
In certe specie (per es. il calamaro Watasenia e i teleostei batipelagici della famiglia Melanostomiatidea) vi sono differenze nella distribuzione e nel colore degli organi luminosi tra i due sessi, differenze che possono essere importanti per il comportamento sessuale (v. Beebe e Crane, 1939; v. Marshall, 1954).
Il ruolo della bioluminescenza come segnale di accoppiamento è stato chiaramente dimostrato nel polichete Odontosyllis tra gli animali marini e nelle lucciole tra quelli terrestri.
L'attività sessuale di Odontosyllis enoplia è accompagnata da una caratteristica manifestazione luminosa che ha luogo tutti i mesi alcuni giorni dopo la luna piena e può essere osservata per un massimo di 11 giorni.
Le femmine, che emettono luce continua, appaiono alla superficie dell'acqua 45 minuti dopo il tramonto e prima del sorgere della luna: nuotano in circoli vivamente luminosi, circondati da un alone di luminosità più tenue, probabilmente costituito dalle uova avvolte da secrezione luminosa. Questa manifestazione di luminescenza costituisce il segnale di attrazione per i maschi, i quali emergono lampeggiando in modo intermittente dalla profondità dell'acqua e nuotano verso gli anelli luminosi delle femmine, diretti al centro. Dopo che si sono incontrati, femmine e maschi nuotano insieme, scaricando rispettivamente uova e spermi nell'acqua; dopo di ciò, la luminescenza ha termine in entrambi i sessi (v. Harvey, 1952).
Le lucciole costituiscono l'esempio meglio studiato della funzione sessuale della bioluminescenza. L'importanza del lampeggiamento come segnale di riconoscimento, per mezzo del quale i due sessi possono venire tra loro in contatto, è stata rilevata da molto tempo (per una bibliografia sull'argomento, v. Harvey, 1952); questa conclusione è in accordo con la differenza anatomica che gli organi luminosi presentano nei due sessi della maggioranza delle specie (v. Buck, 1948). Tuttavia, le carattenstiche specifiche dei segnali luminosi sono state oggetto di indagini dettagliate solo in tempi recenti. Uno dei più semplici sistemi di segnalazione è quello delle femmine aptere di Lampyris noctiluca (v. McDermott, 1917; v. Schwalb, 1961; v. Dreisig, 1971), che emergono dai loro nascondigli al tramonto e si fermano sui fili d'erba, emettendo luce continua dagli organi fotogeni; questa luce attrae i maschi, che dirigono il loro volo verso la sorgente di luce, atterrano in vicinanza delle femmine e infine le raggiungono. Dopo la copula, l'emissione di luce da parte delle femmine cessa e l'animale si nasconde di nuovo al suolo. Apparentemente l'attrazione tra i sessi non dipende da altri fattori che dal segnale luminoso, poiché i maschi possono essere attratti dalla luce di una femmina chiusa in un vaso di vetro (v. Dreisig, 1971) e perfino da una luce artificiale. Tuttavia, l'importanza relativa delle caratteristiche specifiche della luce (come intensità, lunghezza d'onda, dimensioni della sorgente) non è stata indagata a fondo.
Un meccanismo di segnalazione molto più elaborato interviene in quelle lucciole che emettono luce sotto forma di lampi. In questi casi il riconoscimento tra i sessi si basa sulla recezione di un segnale specifico da parte di uno dei partners, il quale a sua volta emette un segnale di ‛risposta' e modifica la propria attività motoria per raggiungere l'altro. Questo conduce allo stabilirsi di un dialogo luminoso tra individui di sesso diverso, le cui caratteristiche sono specie-specifiche (v. Lloyd, 1971).
Il problema centrale delle ricerche comportamentali sulla comunicazione luminosa è la determinazione dei parametri che conferiscono specificità al segnale luminoso. Nelle specie nelle quali la femmina risponde al segnale specifico emesso dal maschio si è potuto dimostrare che lunghezza d'onda, intensità, movimento e altezza dello stimolo non hanno importanza significativa nell'indurre la risposta della femmina (v. Mast, 1912; v. Buck, Studies on the firefly: II. The visual..., 1937; v. Lloyd, 1971); per contro, una importanza decisiva spetta ad altri parametri, quali numero e frequenza dei lampi (v. Carlson, 1969; v. Lloyd, 1971).
In diverse specie l'emissione del segnale specifico spetta alla femmina, che non lampeggia spontaneamente, ma è solo capace di emettere un lampo in risposta a uno stimolo luminoso. Quando gli occhi della femmina sono stimolati dal lampo di un maschio che vola nelle sue vicinanze, essa risponde con un lampo riflesso, la cui latenza è caratteristica della specie (v. Lloyd, 1971). Questa risposta specifica induce il maschio a dirigere il suo volo verso la femmina e a rispondere con un altro lampo, seguito da un'altra risposta della femmina (il ‛dialogo').
La specificità del segnale della femmina è stata studiata dettagliatamente in Photinus pyralis (v. Buck, Studies on the firefly. II. The visual..., 1937) e in Luciola lusitanica (v. Papi, 1969). In entrambi i casi è stato possibile dimostrare che la risposta del maschio non dipende dalle caratteristiche fisiche del segnale della femmina (come intensità, forma, lunghezza d'onda, dimensione, ecc.), ma solo dalla durata dell'intervallo di tempo che intercorre tra il lampo del maschio e la risposta riflessa della femmina. In Photinus pyralls questo ritardo è dell'ordine di 2 secondi, mentre quello di Luciola lusitanica è di 250-300 ms, secondo la temperatura. In entrambe le specie è possibile attrarre i maschi con una sorgente di luce artificiale, purché questa ultima venga accesa al termine dell'intervallo critico dopo il lampo del maschio. Papi (v., 1969) con un ingegnoso esperimento ha dimostrato che il ritardo specifico per l'attrazione dei maschi è compreso in limiti abbastanza ristretti per ogni data temperatura, poiché i maschi non vengono più attratti se il ritardo della risposta della femmina aumenta o diminuisce del 20-30%.
È ovvio che un comportamento complesso come quello della comunicazione luminosa richiede l'intervento di complicati circuiti nervosi; in particolare, lo stabilirsi di un dialogo luminoso implica l'esistenza di un sistema complesso di modulazione esercitato dal sistema visivo sui centri nervosi del lampeggiamento.
L'analisi fisiologica dei meccanismi neurali che stanno alla base di questo meccanismo complesso costituisce un arduo problema di neurofisiologia degli Insetti e si prospetta come un promettente campo di ricerca.
e) Illuminazione
Benché l'uso della bioluminescenza come mezzo di illuminazione ambientale sia stato più volte suggerito (v. Harvey, 1952), nessuna prova definitiva è stata finora presentata. Sembra tuttavia verosimile che gli animali mesopelagici e batipelagici, almeno quelli forniti di fotofori e occhi ben sviluppati, possano usare la luminescenza come mezzo di illuminazione per la visualizzazione della preda. Il valore che ha per la sopravvivenza tale ruolo funzionale della bioluminescenza appare evidente, in considerazione della bassa densità di popolazione delle acque batipelagiche. Da questo punto di vista è stato anche ipotizzato che il colore scuro della maggior parte dei pesci batipelagici (come pure il colore rosso di crostacei di mare profondo) possa essere il risultato di un processo adattativo, inteso a ridurre al minimo l'intensità della luce riflessa dalla loro superficie (v. Nicol, 1967).
Deve essere sottolineato, prima di chiudere questo articolo, che in molti organismi non è ancora possibile attribuire alcun ruolo alla bioluminescenza. Questo costituisce un importantissimo problema etologico le cui implicazioni evoluzionistiche appaiono di grande interesse (v. etologia).
bibliografia
Airth, R. L., Foerster, G. E., Behrens, P., The luminous Fungi, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 203-223.
Alexander, R. S., Factors controlling firefly luminescence, in ‟Journal of cellular and comparative physiology", 1943, XXII, pp. 51-71.
Allard, H. A., The photoperiodism of the firefly Photinus pyralis Linn. Its relation to the evening twilight and other conditions, in ‟Proceedings of the Entomological Society of Washington", 1931, XXXIII, pp. 49-58.
Anderson, R. S., Chemical studies on bioluminescence. III. The reversible reaction of Cypridina luciferin with oxidizing agents and its relation to the luminescent reaction, in ‟Journal of cellular and comparative physiology", 1936, VIII, pp. 261-275.
Anderson, R. S., Studies on bioluminescence. II. The partial purification of Cypridina luciferin, in ‟Journal of general physiology", 1936, XIX, pp. 301-305.
Ashley, C. C., Calcium and the skeletal muscle, in ‟Endeavour", 1971, XXX, pp. 18-25.
Ashley, C. C., Ridgway, E. B., Simultaneous recording of membrane potential, calcium transient and tension in single muscle fibres, in ‟Nature", 1968, CCXIX, pp. 1168-1169.
Ashley, C. C., Ridgway, E. B., On the relationships between membrane potential, calcium transient and tension in single barnacle muscle fibres, in ‟Journal of physiology", 1970, CCIX, pp. 105-130.
Bagnoli, P., Brunelli, M., D'Ajello, V., Magni, F., Further evidence for peripheral inhibition of flashing and for the role of the male gonads in Luciola lusitanica (Charp.), in ‟Archives italiennes de biologie", 1970, CVIII, pp. 181-206.
Bagnoli, P., Brunelli, M., Magni, F., Pellegrino, M., Central and peripheral mechanisms in the control of the diurnal rhythm of flashing in Luciola lusitanica (Charp.), in ‟Archives italiennes de biologie", 1973, CIX, pp. 170-186.
Bagnoli, P., Brunelli, M., Magni, F., Viola, M., The identification of a flash inhibiting substance from the male gonads of Luciola lusitanica (Charp.), in ‟Archives italiennes de biologie", 1972, CX, pp. 16-34.
Baker, P. F., Hodgkin, A. L., Ridgway, E. B., Two phases of calcium entry during the action potential in giant axons of Loligo, in ‟Journal of physiology", 1970, CCVIII, pp. 80-82 P.
Baxter, C. H., Pickens, P. E., Control of luminescence in hemichordates, in ‟Journal of experimental biology", 1964, XLI, pp. 1-14.
Beams, H. V., Anderson, E., Light and electron microscope studies on the light organ of the firefly (Photinus pyralis), in ‟Biological bulletin", 1955, CIX, pp. 375-393.
Beebe, W., Crane, T., Deep-sea fishes of the Bermuda oceanographic expeditions. Family Melanostomiatidae, in ‟Zoologica (U.S.)", 1939, XXIV, pp. 65-238.
Blair, K. G., Luminous insects, in ‟Nature", 1915, XCVI, pp. 411-415.
Bongardt, J., Beiträge zur Kenntnis der Leuchtorgane einheimischer Lampyriden, in ‟Zeitschrift für wissenschaftliche Zoologie", 1903, LXXV, pp. 1-44.
Bonhomme, C., Recherches sur l'histologie de l'appareil lumineux des Polynoïnés, in ‟Bulletin de l'Institut Océanographique, Monaco", 1942, DCCCIII, pp. 1-8.
Borowitz, J. L., Kennedy, J. R., Actions of sympathomimetic amines on the isolated light organ of the firefly Photinus pyralis, in ‟Archives internationales de pharmacodynamie et thérapie", 1968, CLXXI, pp. 81-92.
Brunelli, M., Buonamici, M., Magni, F., Mechanisms for photic inhibition of flashing in fireflies, in ‟Archives italiennes de biologie", 1968, CVI, pp. 85-99.
Brunelli, M., Buonamici, M., Magni, F., Effects of castration on the inhibition of flashing in fireflies, in ‟Archives italiennes de biologie", 1968, CVI, pp. 100-112.
Brunelli, M., Buonamici, M., Magni, F., Viola, M., The role of the male gonads in the peripheral inhibition of flashing in Luciola lusitanica, in ‟Archives italiennes de biologie", 1970, CVIII, pp. 1-20.
Buck, J. B., Studies on the firefly. I. The effect of light and other agents on flashing in Photinus pyralis, with special reference to periodicity and diurnal rhythm, in ‟Physiological zoology", 1937, X, pp. 45-58.
Buck, J. B., Studies on the firefly. II. The visual system and color vision in Photinus pyralis, in ‟Physiological zoology", 1937, X, pp. 412-419.
Buck, J. B., Comparative histology of colepteran photogenic organs, in ‟Anatomical records", 1940, suppl. 78, p. 176.
Buck, J. B., Problems in the distribution and light organ structure of Jamaican lampyrid fireflies, in ‟Yearbook of the American Philosophical Society", 1942, pp. 124-129.
Buck, J. B., Some aspects of the histology and physiology of luminescence in ‛rail-road worms', in ‟Biological bulletin", 1946, XCI, p. 226.
Buck, J. B., The anatomy and physiology of the light organ in fireflies, in ‟Annals of the New York Academy of Sciences", 1948, IL, pp. 397-482.
Buck, J. B., Some reflections on the control of bioluminescence, in The luminescence in biological systems (a cura di F. H. Johnson), Washington 1955, pp. 323-332.
Buck, J. B., Unit activity in the firefly lantern, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 459-474.
Buck, J. B., Case, J. F., Control of flashing in fireflies. I. The lantern as a neuroeffector organ, in ‟Biological bulletin", 1961, CXXI, pp. 234-256.
Buck, J. B., Case, J. F., Hanson, J. R., Control of flashing in fireflies. III. Peripheral excitation, in ‟Biological bulletin", 1963, CXXV, pp. 251-259.
Bugnion, E., Le ver-luisant provençal et la luciole niçoise, in ‟Mémoires de l'Association des Naturalistes de Nice et des Alpes Maritimes, Riviera scientifique", 1929, pp. 1-131.
Buonamici, M., Magni, F., Nervous control of flashing in the firefly Luciola italica L., in ‟Archives italiennes de biologie", 1967, CV, pp. 323-338.
Burkenroad, M. D., A possible function of bioluminescence, in ‟Journal of marine research", 1943, V, pp. 161-164.
Carlson, A. D., Effect of neural activation on the firefly pseudoflash, in ‟Biological bulletin", 1961, CXXI, pp. 256-276.
Carlson, A. D., Induction of scintillation in the firefly, in ‟Journal of insect physiology", 1967, XIII, pp. 1031-1038.
Carlson, A. D., Effect of adrenergic drugs on the lantern of the larval Photuris firefly, in ‟Journal of experimental biology", 1968, XLVIII, pp. 381-389.
Carlson, A. D., Effect of drugs on luminescence in larval fireflies, in ‟Journal of experimental biology", 1968, IL, pp. 195-199.
Carlson, A. D., Neural control of firefly luminescence, in ‟Advances in insect physiology", 19659, VI, pp. 51-96.
Case, J. F., Buck, J. B., Control of flashing in fireflies, II. Role of central nervous system, in ‟Biological bulletin", 1963, CXXV, pp. 234-250.
Case, J. F., Trinkle, M. S., Light-inhibition of flashing in the firefly Photuris missouriensis, in ‟Biological bulletin", 1968, CXXXV, pp. 476-485.
Chang, J. J., Analysis of the luminescent response of the ctenophore Mnemiopsis leidyi to stimulation, in ‟Journal of cellular and comparative physiology", 1954, XLIV, pp. 365-394.
Chase, A. M., Bioluminescence. Production of light by organisms, in Photophysiology (a cura di A. C. Giese), vol. II, New York 1964, pp. 389-421.
Clarke, W. D., Function of bioluminescence in mesopelagic organisms, in ‟Nature", 1963, CXCVIII, pp. 1244-1246.
Cormier, M. J., Hori, K., Kreiss, P., Studies on the bioluminescence system of the sea pansy, Renilla reniformis, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 349-362.
Cormier, M. J., Kreiss, P., Prichard, P. M., Bioluminescence systems of the peroxidase type, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 363-384.
Cormier, M. J., Totter, J. R., Bioluminescence, in ‟Annual review of biochemistry", 1964, XXXIII, pp. 431-458.
Cormier, M. J., Totter, J. R., Bioluminescence. Enzymic aspects, in Photophysiology (a cura di A. C. Giese), vol. IV, New York 1968, pp. 315-354.
Creighton, W. S., The effect of adrenalin on the luminescence of fireflies, in ‟Science", 1926, LXIII, pp. 600-601.
Dahlgren, U., The production of light by animals, in ‟Journal of the Franklin Institution", 1917, CLXXXIII, pp. 79-94, 211-220, 323-348, 593-624.
Davenport, D., Nicol, J. A. C., Observations on luminescence in sea pens, in ‟Proceedings of the Royal Society" (Series B), 1955, CXLIV pp. 480-496.
Davenport, D., Nicol, J. A. C., Luminescence in Hydromedusae, in ‟Proceedings of the Royal Society" (Series B), 1956, CXLV, pp. 399-411.
De Sa, R., Hastings, J. W., The characterization of scintillons, in ‟Journal of general physiology", 1968, LI, pp. 105-122.
De Sa, R., Hastings, J. W., Vatter, A. E., Luminescent ‛crystalline' particles: an organized subcellular bioluminescent system, in ‟Science", 1963, CXLI, pp. 1269-1270.
Dreisig, H., Control of the glowing of Lampyris noctiluca in the field (Coleoptera: Lampyridae), in ‟Journal of zoology", 1971, CLXV, pp. 229-244.
Dubois, R., Function photogénique des pyrophores, in ‟Comptes rendus de la Société de Biologie", 1885, XXXVII, pp. 559-562.
Dubois, R., Note sur la fonction photogénique chez les pholades, in ‟Comptes rendus de la Société de Biologie", 1887, XXXIX, pp. 564-566.
Eckert, R., Bioelectric control of bioluminescence in the dinoflagellate Noctiluca, in ‟Science", 1965, CXLVII, pp. 1140-1142.
Eckert, R., Asynchronous flash initiation by a propagated triggering potential, in ‟Science", 1965, CXLVII, pp. 1142-1145.
Eckert, R., Excitation and luminescence in Noctiluca miliaris, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 26-300.
Eckert, R., Reynolds, G. T., The subcellular origin of bioluminescence in Noctiluca miliaris, in ‟Journal of general physiology", 1967, L, pp. 1429-1458.
Eckert, R., Sibaoka, T., The flash triggering action potential of the luminescent dinoflagellate Noctiluca, in ‟Journal of general physiology", 1968, LII, pp. 258-282.
Emerson, G. A., Emerson, M. J., Mechanism of the effect of epinephrines on bioluminescence of the firefly, in ‟Proceedings of the Society of Experimental Biology and Medicine", 1941, XLVIII, pp. 700-703.
Emery, C., Untersuchungen über Luciola italica L., in ‟Zeitschrift für wissenschaftliche Zoologie", 1884, XL, pp. 338-355.
Geipel, E., Beiträge zur Anatomie der Leuchtorgane tropischen Käfer, in ‟Zeitschrift für wissenschaftliche Zoologie", 1915, CXII, pp. 239-290.
Gerretsen, F. C., Einige Notizen über den Leuchten des javanischen Leuchtkäfers (Luciola vittata Cast.), in ‟Biologisches Zentralblatt", 1922, XLII, pp. 1-9.
Green, A. A., Mc Elroy, W. D., Crystalline firefly luciferase, in ‟Biochimica et biophysica acta", 1956, XX, pp. 170-176.
Greene, C. W., Greene, H. H., Phosphorescence of Porichthys notatus, the Californian singing fish, in ‟American journal of physiology", 1924, LXX, pp. 500-506.
Haneda, Y., On the luminescence of the deep-sea fish Malacocephalus laevis (Lowe), in ‟Japanese journal of physiology", 1938, III, pp. 318-326.
Haneda, Y., On the luminescence of the fishes belonging to the family Leiognathidae of the tropical Pacific, in ‟Palao tropical biological station studies", 1940, II, pp. 29-39.
Haneda, Y., On a luminous organ of the Australian pine-cone fish, Cleidopus gloria-maris De Vis, in Bioluminescence in progress (a cura di F. H. Johnsone Y. Haneda), Princeton 1966, pp. 547-555.
Hanson, F. E., Case, J. F., Buck, E., Buck, J. B., Synchrony and flashentrainement in a New Guinea firefly, in ‟Science", 1971, CLXXIV, pp. 161-164.
Hanson, F. E., Miller, J., Reynolds, G. T., Subunit coordination in the firefly light organ, in ‟Biological bulletin", 1969, CXXXVII, pp. 447-464.
Harvey, E. N., The production of light by the fishes, Photoblepharon and Anomalops, in ‟Publications of the Carnegie Institution", 1923, CCCXII, pp. 43-60.
Harvey, E. N., Studies on bioluminescence. XVII. Fluorescence and inhibition of luminescence in ctenophores by ultraviolet light, in ‟Journal of general physiology", 1925, VII, pp. 331-339.
Harvey, E. N., Bioluminescence, New York 1952.
Harvey, E. N., A history of luminescence, Philadelphia 1957.
Hasama, B., Über die Biolumineszenz bei Pyrocoelia rufa im Aktionsstrombild sowie im histologischen Bild, in ‟Annotationes zoologicae japanenses", 1942, XXI, pp. 59-77.
Hasama, B., Über die Biolumineszenz der Luciola lateralis im zytologischen Bild sowie im Potentialbild ihres Leuchtorgans, in ‟Cytologia", 1942, XII, pp. 366-377.
Hasama, B., Über die Biolumineszenz der Larvae von Luciola cruciata sowie von Pyrocoelia rufa in Aktionsstrombild und im histologischen Bild ihres Leuchtorgans, in ‟Cytologia", 1942, XII, pp. 378-388.
Hasama, B., Histologische Untersuchungen des Leuchtorgans der Luciola parvula, in ‟Cytologia", 1944, XIII, pp. 179-185.
Hastings, J. W., The role of light in persistent daily rhythms, in Photophysiology (a cura di A. C. Giese), vol. I, New York 1964, pp. 333-361.
Hastings, J. W., Bioluminescence, in ‟Annual review of biochemistry", 1968, XXXVII, pp. 597-630.
Hastings, J. W., Bode, V. C., Biochemistry of rhythmic systems, in ‟Annals of the New York Academy of Sciences", 1962, XCVIII, pp. 876-889.
Hastings, J. W., Keynan, A., Molecular aspects of circadian systems, in Circadian clocks (a cura di J. Aschoff), Amsterdam 1965, pp. 167-182.
Hastings, J. W., Sweeney, B. M., A persistent diurnal rhythm of luminescence in Gonyaulax polyedra, in ‟Biological bulletin", 1958, CXV, pp. 440-458.
Hess, W. N., Origin and development of the light organs of Photuris pennsylvanica De Gur, in ‟Journal of morphology", 1922, XXXVI, pp. 245-277.
Heymans, C., Moore, A. R., Bioluminescence in Pelagia noctiluca, in ‟Journal of general physiology", 1924, VI, pp. 273-280.
Heymans, C., Moore, A. R., Note on the excitation and inhibition of luminescence in Beroë, in ‟Journal of general physiology", 1925, VII, pp. 345-348.
Hickling, G. F., A new type of luminescence in fishes. I., in ‟Journal of the Marine Biological Association of the United Kingdom", 1925, XIII, pp. 914-937.
Hickling, G. F., A new type of luminescence in fishes. II., in ‟Journal of the Marine Biological Association of the United Kingdom", 1926, XIV, pp. 495-507.
Hudson, G. V., The New-Zealand glow-worm Boletophila (Arachnocampa) luminosa: summary of observations, in ‟Annual magazine of natural history" (Series 99), 1926, XVII, pp. 228-235; XVIII, pp. 667-670.
Johnson, F. H. (a cura di), The luminescence of biological systems, Washington 1955.
Johnson, F. H., Introduction, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 3-21.
Johnson, F. H., Bioluminescence, in Comprehensive biochemistry (a cura di M. Florkin e E. H. Stotz), vol. XXVII, Amsterdam 1967, pp. 79-136.
Johnson, F. H., Haneda, Y. (a cura di), Bioluminescence in progress, Princeton 1966.
Johnson, F. H., Shimomura, O., Enzymatic and non enzymatic bioluminescence, in Photophysiology (a cura di A. C. Giese), vol. VII, New York 1972, pp. 275-334.
Kastle, J. M., McDermott, F. A., Some observations on the production of light by the firefly, in ‟American journal of physiology", 1910, XXVII, pp. 122-151.
Kay, R. M., Light-stimulated and light-inhibited luminescence of the euphasid Meganyctiphanes norvegica, in ‟Proceedings of the Royal Society" (Series B), 1965, CLXII, pp. 365-386.
Kishi, Y., Goto, T., Hirota, Y., Shimomura, O., Johnson, F. H., The structure of Cypridina luciferin, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 89-113.
Kuwabara, S., Wassink, E. C., Purification and properties of the active substance of fungal luminescence, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 89-113.
Kuwabara, S., Wassink, E. C., Purification and properties of the active substance of fungal luminescence, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 233-245.
Lloyd, J. E., Aggressive mimicry in Photuris. Firefly femmes fatales, in ‟Science", 1965, CIL, pp. 653-654.
Lloyd, J. E., Bioluminescent communications in Insects, in ‟Annual review of entomology", 1971, XVI, pp. 97-122.
Lund, E. J., On the structure, physiology and use of photogenic organs, with special reference to the Lampyridae, in ‟Journal of experimental zoology", 1911, XI, pp. 415-467.
McDermott, F. A., Observations on the light emission of American Lampyridae. The photogenic function as a mating adaptation, in ‟Canadian entomologist", 1917, IL, pp. 53-61.
McDermott, F. A., Crane, C. G., A comparative study of the structure of the photogenic organs of certain American Lampyridae, in ‟American naturalist", 1911, XLV, pp. 306-313.
Mc Elroy, W. D., Properties of the reaction utilizing adenosinetriphosphate for bioluminescence, in ‟Journal of biological chemistry", 1951, CXCI, pp. 547-577.
Mc Elroy, W. D., Insect bioluminescence, in Physiology of Insecta (a cura di M. Rockstein), vol. I, New York 1964, pp. 463-508.
Mc Elreoy, W. D., Coulombre, J., The immobilization of adenosinetriphosphate in the bioluminescent reaction, in ‟Journal of cellular and comparative physiology", 1952, XXXIX, pp. 475-485.
Mc Elroy, W. D., Coulombre, J., Hayes, R., Properties of firefly pyrophosphatase, in ‟Archives of biochemistry and biophysics", 1951, XXXII, pp. 207-215.
Mc Elroy, W. D., Glass, B. (a cura di), Light and life, Baltimore 1961.
Mc Elroy, W. D., Hastings, J. W., Biochemistry of firefly luminescence, in The luminescence of biological systems (a cura di F. H. Johnson), Washington 1955, pp. 161-198.
Mc Elroy, W. D., Hastings, J. W., Initiation and control of firefly luminescence, in Physiological triggers and discontinuous rate processes (a cura di T. H. Bullock), Washington 1957, pp. 80-84.
Mc Elroy, W. D., Hastings, J. W., Coulombre, J., Sonnefeld, V., The mechanism of action of pyrophosphate in firefly luminescence, in ‟Archives of biochemistry and biophysics", 1953, XLVI, pp. 399-416.
Mc Elroy, W. D., Seliger, H. H., Origin and evolution of bioluminescence, in Horizons in biochemistry (a cura di M. Kasha e B. Pullman), New York 1962, pp. 91-101.
Mc Elroy, W. D., Seliger, H. H., Firefly bioluminescence, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 427-458.
Mc Elroy, W. D., Strehler, B. L., Factors influencing the response of the bioluminescent reaction to adenosine triphosphate, in ‟Archives of biochemistry and biophysics", 1949, XXII, pp. 420-433.
Magni, F., Centraland peripheral mechanisms in the modulation of flashing in the firefly Luciola italica L., in ‟Archives italiennes de biologie", 1967, CV, pp. 339-360.
Magni, F., Meccanismi nervosi e umorali nella modulazione del lampeggiamento nelle lucciole, in Problemi attuali di scienze e di cultura, Accademia Nazionale dei Lincei, quaderno n. 176, Roma 1972, pp. 1-38.
Marshall, N. B., Aspects of deep-sea biology, London 1954.
Mast, S. O., Behavior of fireflies (Photinus pyrais) with special reference to the problem of orientation, in ‟Journal of animal behaviour", 1912, II, pp. 256-272.
Moore, A. R., Luminescence in Mnemiopsis, in ‟Journal of general physiology", 1924, VI, pp. 403-412.
Moore, A. R., The inhibition of luminescence by light, in ‟American journal of physiology", 1925, LXXII, pp. 214-215.
Moore, A. R., The inhibition of luminescence by light: dynamics of the reaction, in ‟Proceedings of the Society of Experimental Biology and Medicine", 1925, XXIII, pp. 6-7.
Moore, A. R., Inibizione della luminescenza nei Ctenofori, in ‟Archivio di scienze biologiche", 1926, VIII, pp. 112-121.
Nicol, J. A. C., Observations on photophores and luminescence in the teleost Porichthys, in ‟Quarterly journal of microscopical science", 1957, XCVIII, pp. 179-188.
Nicol, J. A. C., The regulation of light emission inanimals, in ‟Biological reviews", 1960, XXXV, pp. 1-42.
Nicol, J. A. C., Animal luminescence, in ‟Advances in comparative physiology and biochemistry", 1962, I, pp. 217-273.
Nicol, J. A. C., The biology of marine animals, London 1967.
Okada, Y. K., Luminescence et organe photogène des Ostracodes, in ‟Bulletin de la Société de Zoologie de France", 1926, LI, pp. 478-486.
Okada, Y. K., Origin and development of the photogenic organs of Lampyrids, withspecial reference to those of Luciola cruciata Motschulsky and Pyrocoelia rufa Ern Olivier, in ‟Memoirs of the College of Science, Kyoto Imperial University" (Series B), 1935, X, pp. 209-228.
Papi, F., Light emission, sex attraction and male flash dialogues in a firefly, Luciola lusitanica (Charp), in ‟Monitore zoologico italiano" (nuova serie), 1969, III, pp. 135-184.
Peterson, M. K., Buck, J. B., Light organ fine structure in certain Asiatic fireflies, in ‟Biological bulletin", 1968, CXXXV, pp. 335-348.
Rhodes, W. C., Mc Elroy, W. D., The synthesis and function of luciferyladenylate and oxyluciferyladenylate, in ‟Journal of biological chemistry", 1958, CCXXXIII, pp. 1528-1537.
Richmond, C. A., Firefly flashing in unison, in ‟Science", 1930, LXXI, pp. 537-538.
Ridley, H. N., The luminous secretions of the centipede Geophilus electricus (L.) as a defense against the attack of beetles, etc., in ‟Proceedings of the Royal Entomological Society" (Series A), 1936, XI, p. 48.
Schultze, M., Zur Kenntnis der Leuchtorgane von Lampyris splendidula, in ‟Archiv für mikroskopische Anatomie", 1865, I, pp. 124-137.
Schwalb, H. H., Beiträge zur Biologie der einheimischer Lampyriden Lampyris noctiluca und Phausis splendidula und experimentelle Analyse ihres Beutefang- und Sexualverhaltens, in ‟Zoologische Jahrbücher (Systematik)", 1961, LXXXVIII, pp. 399-550.
Seliger, H. H., Mc Elroy, W. D., Spectralemission and quantum yeld of firefly luminescence, in ‟Archives of biochemistry and biophysics", 1960, LXXXVIII, pp. 136-141.
Seliger, H. H., Mc Elroy, W. D., The colors of firefly bioluminescence: enzyme configuration and species specificity, in ‟Proceedings of the National Academy of Sciences", 1964, LII, pp. 75-81.
Seliger, H. H., Mc Elroy, W. D., Light: physicaland biological action, New York 1965.
Seliger, H. H., Morton, R. A., A physical approach to bioluminescence, in Photophysiology (a cura di A. C. Giese), vol. IV, New York 1968, pp. 253-314.
Shimomura, O., Johnson, F. H., Haneda, Y., Isolation of the luciferin of the New Zealand fresh-water limpet, Latianeritoides Gray, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 391-404.
Shimomura, O., Johnson, F. H., Saiga, Y., Purification and properties of Cypridina luciferase, in ‟Journal of cellular and comparative physiology", 1961, LVIII, pp. 113-123.
Shimomura, O., Johnson, F. H., Saiga, Y., Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan Aequorea, in ‟Journal of cellular and comparative physiology", 1962, LIX, pp. 223-240.
Shimomura, O., Johnson, F. H., Saiga, Y., Extraction and properties of halistaurin, a bioluminescent protein from the hydromedusan Halistaura, in ‟Journal of cellular and comparative physiology", 1963, LXII, pp. 9-16.
Shimomura, O., Johnson, F. H., Saiga, Y., Microdetermination of calcium byaequorin luminescence, in ‟Science", 1963, CXL, pp. 1339-1340.
Smalley, K., Adrenergic transmission in the light organ of the firefly, Photinus pyralis, in ‟Comparative biochemistry and physiology", 1965, XVI, pp. 467-477.
Smith, D. S., The organization and innervation of the luminescent organ in a firefly, Photuris pennsylvanica (Coleoptera), in ‟Journal of cell biology", 1963, XVI, pp. 323-359.
Snell, P. A., The control of luminescence in the male lampyrid firefly, Photuris pennsylanica, with special reference to the effect of oxygen tension on flashing, in ‟Journal of cellular and comparative physiology", 1932, I, pp. 37-51.
Sweeney, B. M., Bouck, G. B., Crystal-like particles in luminous and non-luminous dinoflagellates, in Bioluminescence in progress (a cura di F. H. Johnson e Y. Haneda), Princeton 1966, pp. 331-348.
Sweeney, B. M., Hastings, G. W., Characteristics of the diurnal rhythm of luminescence in Gonyaulax polyedra, in ‟Journal of cellular and comparative physiology", 1957, IL, pp. 115-128.
Townsend, A. B., The histology of the light organs of Photinus marginellus, in ‟American naturalist", 1904, XXXVIII, pp. 127-151.
Tozzetti, A. T., Sull'organo che fa lume nelle lucciole volanti d'Italia (Luciola italica), in ‟Bollettino della Società Entomologica Italiana", 1870, II, pp. 177-189.
Tsuji, F. I., Sowinski, R., Purification and molecular weight of Cypridina luciferase, in ‟Journal of cellular and comparative physiology", 1961, LVIII, pp. 125-129.
Verworn, M., Ein automatisches Zentrum für die Lichtproduktion bei Luciola italica L., in ‟Zentralblatt für Physiologie", 1892, VI, pp. 69-74.
Wheeler, W. M., Williams, F. X., The luminous organ of the New-Zealand glow-worm, in ‟Psyche (U.S.)", 1915, XXII, pp. 36-43.
White, E. H., Mc Capra, F., Field, G. F., Mc Elroy, W. D., The structure and synthesis of firefly luciferin, in ‟Journal of the American Chemical Society", 1961, LXXXIII, pp. 2402-2403.
Williams, F. X., Photogenic organs and embryology of lampyridas, in ‟Journal of morphology", 1916, XXVIII, pp. 145-207.