Biochimica
Biochimica
(App. IV, i, p. 279; V, i, p. 366; v. chimica biologica, X, p. 110; App. II, i, p. 578)
La b. ha una posizione centrale nelle scienze della vita per i contenuti tematici, per le strategie sperimentali e la produzione di avanzamenti scientifici. L'influsso determinante della b. e della biologia molecolare (in larga misura originatasi dalla b. stessa) sullo sviluppo delle singole discipline biologiche, da un lato è testimoniato dagli impressionanti risultati raggiunti negli ultimi tempi dalla genetica, dalla biologia cellulare, dalla biologia dello sviluppo, dalla farmacologia e dall'immunologia, dall'altro lato è sottolineato dalla virtuale abolizione dei confini tra queste discipline biologiche, in virtù di una strategia unificante impostata sulla centralità dei meccanismi. Tale situazione è attualmente riconosciuta dagli ordinamenti didattici di numerosi paesi nei quali sono state dedicate facoltà universitarie, o corsi di laurea, alla b. intesa non più come singola disciplina ma piuttosto come matrice scientifico-didattica comune a più indirizzi e di essi costante ispiratrice. È in effetti indiscutibile che, oltre al consolidamento di una disciplina tematicamente ancora definibile nelle sue generalità e identificabile con la classica b., gli anni Novanta hanno visto il sempre maggiore coinvolgimento della ricerca biochimica nei confronti di singoli sistemi biologici (strutture e organuli subcellulari, cellule, tessuti, organi) e di singoli organismi (procarioti, vegetali e animali), al fine di chiarire le basi molecolari delle loro attività funzionali (per es., rimanendo agli organismi animali, la proliferazione cellulare, la contrazione muscolare, la risposta immunitaria, la trasmissione nervosa). Inoltre la b. ha dimostrato di poter decifrare anche processi patologici, presentando quindi potenzialità risolutive e sollevando aspettative molto fondate per quanto riguarda la salvaguardia della salute umana e animale nei tre aspetti classici della diagnosi, prevenzione e terapia delle malattie.
Di conseguenza, la b. contribuisce all'approfondimento di numerosi aspetti conoscitivi, ma anche alla soluzione di problemi pratici che ovviamente non sono limitati alla salute, ma si estendono a settori applicativi quanto mai eterogenei. Il superamento del livello meramente fenomenologico d'indagine dei processi biologici e l'attenzione istituzionale nei confronti della struttura, della funzione e della regolazione di molecole biologiche anche complesse conferiscono alla b. il ruolo ampiamente riconosciuto di disciplina portante delle biotecnologie. Decifrare i meccanismi molecolari dei processi biologici è infatti la premessa alla possibilità di ricostruire in vitro tali processi, eventualmente modificandone e migliorandone le caratteristiche, al fine di generare beni e servizi, che è appunto l'obiettivo di fondo delle biotecnologie (v. biotecnologia, in questa Appendice).
La più puntuale dimostrazione di questo ruolo della b. è la recentissima identificazione della biologia strutturale come area di frontiera delle biotecnologie, nella quale confluiscono molti approcci sperimentali propri della b., peraltro completati e integrati con altre competenze scientifiche e tecnologiche (per es., sintesi chimica, caratterizzazione analitica di molecole, bioinformatica, espressione genica). In effetti, l'attuale sviluppo della biologia strutturale poggia sulla coordinazione di alcuni aspetti fondamentali di pertinenza diretta o indiretta della b., quali: 1) l'organizzazione strutturale di macromolecole biologicamente attive (proteine, acidi nucleici, polisaccaridi) e le relative correlazioni con attività funzionali di queste macromolecole; 2) l'avanzamento di tecnologie capaci di esplorare la dinamica molecolare e di metodologie appropriate per l'archiviazione dei dati sperimentali; 3) il miglioramento progettuale delle prestazioni funzionali delle macromolecole biologiche, fondato sia sul disegno razionale di biomolecole sia sull'evoluzione molecolare applicata (che imita al livello molecolare i processi selettivi dell'evoluzione).
In conclusione, la decifrazione dei sistemi e dei processi biologici nei loro dettagli molecolari permette alla ricerca biochimica di aumentare le conoscenze relative a singoli organismi e alle loro funzioni, da un lato orientando tali conoscenze a finalità applicative, dall'altro ponendosi l'obiettivo senza fine di svelare la complessità sempre più manifesta delle 'regole del gioco' che governano la vita. Entrambe le missioni della b., quella conoscitiva e quella applicativa, sono strettamente intrecciate. Uno degli esempi più illuminanti e attuali in tal senso è quello della proteina prionica (PrPC), normalmente presente nel cervello di molti Mammiferi, uomo incluso. Una forma modificata di questa proteina, definita PrPSc, forse derivante da un 'taglio' proteolitico limitato a carico di PrPC, sembra essere l'agente eziologico responsabile di una serie di malattie letali, definite malattie da prioni (v. prione, App. V) e comprendenti l'encefalopatia bovina spongiforme ('malattia della mucca pazza'), oltre che malattie umane, quali la sindrome di Creutzfeld-Jacob, la sindrome di Gerstmann-Sträussler-Scheinker, il kuru e l'insonnia familiare fatale. A parte l'eccezionalità del fatto che una proteina (e non un virus o un microrganismo) determini una serie di malattie infettive, le ricerche tuttora in atto tendono a chiarire una serie di interrogativi che, se risolti, potranno debellare definitivamente questo flagello del 20° secolo.
Questi interrogativi sono: 1) perché e attraverso quali meccanismi una struttura proteica modificata (e non la proteina nativa) induca l'attività infettante; 2) quali siano le vere cause della modificazione di una proteina cellulare normale in una dotata di attività infettante; 3) se esistano o meno (come purtroppo sembra) barriere tra specie animali e uomo per quanto riguarda la trasmissione di queste malattie; 4) se esistano ruoli differenziati tra cellule non nervose e cellule nervose (che subiscono gli effetti degenerativi letali) nella propagazione delle malattie da prioni. Tutti questi interrogativi, drammaticamente aperti, riguardano ricerche di b. e di biologia molecolare perché concernono la struttura e le modificazioni di una proteina specifica e perché, di conseguenza, comportano approcci e soluzioni tipiche di queste due discipline. È molto significativo, in proposito, che il premio Nobel 1997 per la medicina o la fisiologia sia stato attribuito al biochimico americano S.B. Prusiner, che ha dato un contributo determinante all'identificazione di questo enigma biologico dei prioni, tuttora irrisolto.
Contenuti della biochimica
Come sopra accennato, la polivalenza della b. e le sue positive ricadute su tutte le scienze e tecnologie della vita non precludono l'identificazione di contenuti tematici ben precisi, che in parte risalgono storicamente agli anni 1940-50, in parte riflettono i risultati a cui è recentemente pervenuta la ricerca avanzata. Per le argomentazioni espresse in precedenza, alcune di queste aree a forte innovatività sperimentale rappresentano zone di frontiera con altre discipline e pertanto, negli ordinamenti didattici e nei libri di testo, vengono considerate, almeno in parte, anche nell'ambito di queste discipline. Ciò vale, per es., per la b. informazionale (struttura, funzioni, maturazione e metabolismo di acidi nucleici, sintesi proteica) e per la strutturistica macromolecolare, che rappresentano ormai settori caratterizzanti di discipline quali la biologia molecolare, la biologia cellulare, la biofisica. Un altro esempio di questa interazione tra discipline riguarda l'enzimologia che, originata da studi prevalentemente biochimici i quali ne hanno precisato le regole generali (cinetiche e termodinamiche), ha successivamente trovato collocazione nella chimica delle fermentazioni per quanto riguarda importanti aspetti teorico-applicativi. Una situazione analoga si è verificata per la bioenergetica che, per la particolare complessità dei problemi sperimentali, si sta progressivamente specializzando in maniera multi- e interdisciplinare, pur mantenendo regole e strategie che in larga misura derivano dalla biochimica.
Per queste ragioni è sempre più difficile trovare omogeneità nei testi di b., per quanto completi e aggiornati essi possano essere. Va inoltre considerato che criteri di eterogeneità derivano inevitabilmente anche dalle diverse tipologie di lettori a cui questi libri sono indirizzati, sia che si tratti di studenti sia di ricercatori o cultori della materia. Ne deriva una certa tendenza o alla trattazione di tipo enciclopedico (spesso analitica, a scapito della visione d'insieme), o viceversa alla trattazione specialistica, che rischia di lasciare ignorati o di considerare solo superficialmente contenuti viceversa essenziali. Per es., la presenza anche in organismi filogeneticamente lontani di vie metaboliche importanti e, quindi, la loro analisi in sistemi cellulari semplici (microrganismi), legittimata dall'obiettivo di raccogliere informazioni sulle loro principali proprietà, non devono far ignorare o trascurare i diversi ruoli che tali vie possono rivestire nel contesto di tessuti e organi considerati nella globalità di un organismo più complesso. Lo studio della via glicolitica (la principale via che degrada il glucoso) nell'Escherichia coli potrà fornire preziose informazioni sull'organizzazione di questa sequenza multienzimatica nella cellula e sulle modalità molecolari con cui essa assolve alle sue funzioni biochimiche (sintesi extra-mitocondriale di ATP e generazione di metaboliti-chiave). Lo studio della stessa via catabolica nei Mammiferi (uomo incluso) tende a definirne il ruolo nei diversi organi e tessuti intesi come sistemi consumatori di glucoso, fornendo indicazioni sui meccanismi responsabili del corretto mantenimento dell'omeostasi glicemica, così come sulle disfunzioni che possono portare a ipoglicemia o a iperglicemia nei singoli soggetti. Rimanendo a questo semplice esempio, è evidente che la complessità biologica dell'organismo animale rispetto a un microrganismo impone un'adeguata e contemporanea valutazione dei meccanismi che sostengono il processo opposto di produzione del glucoso (processo in larga prevalenza epatico e articolato sui due sistemi della glicogenolisi e della gluconeogenesi), al fine di esplorare a un livello integrato e suscettibile di interventi terapeutici la regolazione della glicemia nei singoli individui.
Pertanto, pur privilegiando il ricorso a sistemi-modello caratterizzati da semplicità e quindi meglio definibili, la b. tende progressivamente a un livello sempre più integrato e complesso d'indagine. Tale livello riguarda, in primo luogo, la coordinazione e la regolazione di sistemi molecolari, sopramolecolari e metabolici nell'ambito di una stessa cellula. Un ulteriore livello è quello che riguarda l'esplorazione delle modalità e dei meccanismi di comunicazione tra diverse cellule nell'ambito di uno stesso tessuto od organo e ancora, come già ricordato, i meccanismi mediante i quali diversi organi e tessuti dialogano tra loro. Poiché questo tipo di dialogo avviene mediante lo scambio di molecole (semplici metaboliti, come nel menzionato caso del controllo della glicemia, oppure ormoni e i cosiddetti regolatori di risposte biologiche), la qualità e la quantità delle interazioni tra organi e tessuti sono spesso analizzabili e misurabili mediante le variazioni di queste molecole 'di comunicazione' nei liquidi extracellulari che ne rappresentano i serbatoi naturali (sangue, linfa, liquor cefalo-rachidiano, fluidi interstiziali). È evidente come quest'ultimo, e più elevato, livello d'integrazione metabolica sfumi in un'area interdisciplinare in gran parte influenzata dalla b., ma che riguarda complessivamente aspetti avanzati della fisiologia, dell'endocrinologia, dell'immunologia e della neurobiologia, oltre che fornire strumenti per esplorare le basi molecolari delle relative deviazioni patologiche.
Denominatore comune a tutte queste modalità di coordinazione dei sistemi e delle strutture biologiche è la grande flessibilità delle risposte, sia delle singole cellule sia di tessuti e organi. La flessibilità a sua volta riflette qualsiasi perturbazione dell'omeostasi fisiologica provocata dall'alimentazione, da modificazioni ambientali, da variazioni delle abitudini di vita e da altri fattori in parte ancora sconosciuti. Tale flessibilità, intesa come forma di adattamento biologico a situazioni variabili, trova la sua spiegazione molecolare nei meccanismi di regolazione di biomolecole, soprattutto acidi nucleici e proteine con accertate proprietà funzionali (trasporto di soluti attraverso membrane, recettori, enzimi). Di conseguenza, la b. pone sempre più fortemente l'accento sui meccanismi di controllo dei sistemi biologici e tende a esplorare con crescente livello di sofisticazione questi meccanismi, che possono essere ricondotti a due tipologie generali: 1) regolazione delle macromolecole biologicamente attive presenti in cellule e responsabili delle loro attività funzionali; 2) regolazione delle risposte cellulari a opera di agonisti o antagonisti extracellulari, che innescano tali risposte legandosi a recettori specifici. Se questi recettori sono presenti sulla superficie esterna delle cellule, i 'segnali' extracellulari - identificabili in ormoni, regolatori di risposte immunitarie (citochine e chemochine), neurotrasmettitori, farmaci ecc. - vengono trasmessi o 'trasdotti' all'interno delle cellule bersaglio a opera di sistemi molto raffinati, ai quali la ricerca biochimica e biologica sta dedicando grande attenzione.
Comprendere nel dettaglio queste due tipologie di meccanismi di regolazione biochimica delle funzioni e dei processi cellulari significherebbe infatti interpretare le basi molecolari della variabilità biologica a livello fenotipico e, inoltre, aumentare in maniera progettuale la capacità d'intervenire qualitativamente e quantitativamente su questi processi. Da ciò deriverebbero ricadute fondamentali in campo biotecnologico, per es. sviluppando bioreattori identificabili con vere e proprie 'fabbriche cellulari' di grande interesse industriale, ma anche in campo biomedico, per es. interferendo su risposte biologiche della massima importanza (crescita cellulare, risposta immunitaria, plasticità neuronale) e costruendo di conseguenza nuovi farmaci ad attività mirata su singoli tipi di cellule.
Regolazione dell'attività enzimatica
L'attività enzimatica costituisce il livello infrastrutturale più elementare per lo studio della plasticità di funzioni cellulari. Tutte le cellule, dagli organismi più semplici all'uomo, sono dotate di centinaia o migliaia di proteine enzimatiche, ciascuna delle quali catalizza una specifica reazione di conversione di uno o due substrati in uno o due prodotti: ne derivano flussi di piccole molecole (metaboliti) che rappresentano la chiave per comprendere tutte le attività cellulari, definiti collettivamente metabolismo intermedio cellulare e assimilabili nel loro insieme a una 'rete metabolica', la cui complessità varia da un tipo all'altro di cellula ed è proporzionale al patrimonio di enzimi presenti nelle singole cellule. La rete metabolica può essere paragonata al traffico di un centro urbano (dalla piccola città alla metropoli) e richiede precisi meccanismi di regolazione al fine di evitare disordine, come intasamenti o blocchi non programmati. Il controllo metabolico, se manteniamo l'analogia con il traffico urbano, implica sistemi di scorrimento preferenziali e meccanismi flessibili di blocco di determinate vie e di attivazione di percorsi alternativi, per es. mediante introduzione di semafori sincronizzati che rendono ordinati tali flussi. Negli ultimi tempi la b. ha identificato e caratterizzato alcuni di questi 'semafori' ai quali compete la programmazione del metabolismo intermedio secondo meccanismi finalizzati a evitare casualità e a conferire logica e ordine nei processi cellulari. Non è certo immotivato il fatto che questi sistemi siano per lo più bifasici e sincronizzati in modo tale da orientare cicli metabolici di grande importanza esclusivamente verso l'anabolismo o verso il catabolismo, a seconda del momento funzionale della cellula e delle relative esigenze.
Uno tra i numerosi esempi al riguardo concerne le alternative, nel fegato, tra glicolisi (consumo di glucoso) e gluconeogenesi (sintesi di glucoso a partire da precursori non glucidici), che controllano la capacità del fegato stesso di decidere tra un'attività ipoglicemizzante e una iperglicemizzante e che sono regolate da ben precise molecole-segnale, quali il fruttoso 2,6-bisfosfato, l'AMP e l'ATP. Peraltro, meccanismi sincronizzati e bifasici di questo tipo sono conosciuti da tempo: la loro operatività è basata sulla costante diversificazione tra vie di biosintesi e vie di degradazione, che permette a molecole-segnale o a sistemi di modificazione covalente di enzimi-chiave di funzionare, naturalmente in maniera reversibile, come 'semafori verdi' per le une e, contemporaneamente, come 'semafori rossi' per le altre.
Un primo sistema generale di controllo del metabolismo cellulare è legato a fenomeni di compartimentazione subcellulare, cioè alla localizzazione in specifiche e differenti frazioni della stessa cellula degli enzimi coinvolti in attività metabolico-funzionali differenziate. Per es., la presenza della via glicolitica nel citoplasma solubile e della ossidazione degli acidi grassi nei mitocondri rappresenta una modalità di separazione delle due vie cataboliche più importanti, responsabili della degradazione, rispettivamente, di glucidi e di lipidi, che sono gli alimenti energogeni principali a livello cellulare.
La diversa localizzazione subcellulare delle proteine enzimatiche in alcuni casi separa fisicamente attività metaboliche distinte, in altri interviene anche nell'ambito di una stessa sequenza multienzimatica (o via metabolica). In quest'ultima evenienza, si creano barriere e sistemi di restrizione rappresentati da membrane di organuli subcellulari aventi permeabilità selettiva e si determinano, di conseguenza, meccanismi di regolazione dell'attività complessiva di quella via metabolica. È questo il caso di due processi epatici fisiologicamente fondamentali, quali la già ricordata gluconeogenesi (responsabile del mantenimento della glicemia a livelli normali) e l'ureogenesi (che rappresenta il principale sistema di organicazione dell'ammoniaca nei Mammiferi), che funzionano entrambi in parte nei mitocondri e in parte nel citoplasma solubile dell'epatocita e che sono soggetti a meccanismi di controllo mediante interscambio di alcuni metaboliti intermedi.
Tutte le vie metaboliche in tutte le cellule operano a velocità variabile, i cui limiti sono imposti dalle singole reazioni più lente di tali sequenze multienzimatiche. Queste reazioni, o tappe limitanti la velocità dell'intera catena metabolica, costituiscono i bersagli più importanti della rete metabolica. Esattamente allo stesso modo, il traffico lungo un determinato percorso di scorrimento è limitato dai segmenti più stretti, che rappresentano di conseguenza i siti preferenziali per regolare il traffico stesso (attraverso accelerazioni o rallentamenti) lungo il percorso complessivo. Per queste ragioni, gli enzimi che catalizzano le reazioni limitanti delle varie vie metaboliche costituiscono i bersagli ideali per poter controllare quelle vie e, di conseguenza, per poter coordinare in maniera sincronizzata l'insieme delle vie che compongono il metabolismo intermedio. Quasi sempre, infatti, questi enzimi limitanti, o enzimi-chiave, presentano proprietà strutturali e funzionali che sono idonee a sostenere meccanismi di regolazione particolarmente raffinati, sensibili ed efficienti (regolazione allosterica).
Con queste premesse, è possibile identificare tre tipi di meccanismi di regolazione dell'attività di enzimi, che si differenziano anche per quanto riguarda la scala temporale della regolazione. Un primo tipo è quello dei cosiddetti meccanismi cinetici, che comportano variazioni immediate (nell'ambito dei micro- o millisecondi) dell'attività di questi enzimi, a seguito del legame di molecole capaci di modificarne le caratteristiche (soprattutto affinità per i(l) substrati(o) e velocità massima). Tali molecole effettrici sono generalmente i substrati stessi di questi enzimi, e molecole capaci di stimolarne o inibirne l'attività (attivatori o inibitori). Come sopra accennato, una versione particolarmente efficiente di questi meccanismi cinetici di regolazione riguarda abitualmente gli enzimi limitanti e consiste nel legame di più molecole dello stesso effettore a diverse subunità della stessa proteina enzimatica, legame che avviene con affinità crescente e che è graficamente rappresentabile con una curva a profilo sigmoide della percentuale di effetto in funzione di concentrazioni crescenti di effettore (intendendo per effetto la velocità di una reazione enzimatica, o l'attivazione, o l'inibizione determinate, rispettivamente, da concentrazioni variabili di substrato, di un attivatore, di un inibitore). Da ciò deriva un'amplificazione della variazione dell'effetto al variare delle concentrazioni di effettore, rispetto alle risposte funzionali di enzimi a cinetica di saturazione iperbolica anziché sigmoide. Questa proprietà generale distingue operativamente gli enzimi allosterici (generalmente enzimi limitanti) da enzimi a cinetica convenzionale o iperbolica (enzimi che catalizzano reazioni all'equilibrio). Un esempio particolarmente conosciuto di regolazione allosterica è la regolazione a tipo feedback, in cui prodotti terminali di vie metaboliche retroinibiscono l'attività di un enzima-chiave di quella sequenza metabolica; l'inibizione feedback riguarda soprattutto sequenze biosintetiche e obbedisce a criteri intuitivi di economia metabolica, poiché consente di rallentare o di bloccare reversibilmente (a seconda delle concentrazioni del metabolita terminale) sequenze energeticamente dispendiose in caso di non necessità.
Un secondo tipo di regolazione dell'attività di enzimi, che si realizza in tempi più lunghi di quelli dei meccanismi cinetici, è costituito da sistemi di modificazione covalente di proteine enzimatiche. Tali proteine presentano proprietà funzionali diverse (per es., maggiore o minore attività, maggiore o minore affinità per i loro substrati, maggiore o minore suscettibilità ad attivatori o inibitori), a seconda che esse si trovino in forma nativa o covalentemente modificata da parte di altri enzimi, che risultano pertanto avere un ruolo attivo nella regolazione (enzimi regolatori). Questo tipo di controllo viene esercitato, secondo logica, su enzimi limitanti di importanti sequenze metaboliche e consiste, nella grande maggioranza dei casi, in un meccanismo di fosforilazione catalizzato da enzimi regolatori che sono alcune proteina-chinasi. Un'altra logica caratteristica, che conferisce reversibilità e flessibilità a questi sistemi di controllo, è che le modificazioni covalenti in oggetto sono controbilanciate da enzimi regolatori che agiscono in senso opposto. Di conseguenza, l'azione della proteina-chinasi può essere antagonizzata da quella di alcune fosfoproteina-fosfatasi, di cui esistono pure diverse famiglie con proprietà chiaramente differenziate. Proteina-chinasi e fosfoproteina fosfatasi, tipici enzimi regolatori, sono a loro volta regolate al fine di evitare un loro contemporaneo funzionamento che creerebbe uno stato di anarchia metabolica. Questa regolazione sovrapposta può essere un'ulteriore reazione di modificazione covalente (come sempre, reversibile) degli enzimi regolatori, ma in altri casi può essere esercitata da molecole-segnale che si formano entro le cellule in condizioni particolari, per es. in seguito a stimolazione da parte di alcuni ormoni di cui tali molecole rappresentano 'secondi messaggeri'.
Molto spesso, la regolazione degli enzimi-chiave si realizza a più livelli, naturalmente sincronizzati, di modificazione covalente e di attivazione da secondi messaggeri. Ne conseguono meccanismi 'a cascata', così definiti perché una causa (per es., una molecola-segnale) genera un effetto (per es., la fosforilazione di un enzima regolatore), che a sua volta genera un altro effetto (per es., la fosforilazione di un secondo enzima regolatore), che a sua volta può generare un ulteriore effetto: al termine della cascata si colloca la modificazione covalente di un enzima limitante, che determinerà il blocco o lo sblocco dell'intera sequenza metabolica, e quindi il corrispondente disinserimento o l'inserimento delle funzioni cellulari correlate a quella sequenza. Meccanismi 'a cascata' di questo tipo si riscontrano frequentemente in biologia (altri esempi riguardano le tappe successive e coordinate di proteolisi selettiva, che caratterizzano la coagulazione del sangue e l'attivazione del complemento): la loro superiorità rispetto a un ipotetico diretto meccanismo di attivazione di un enzima-chiave consiste in una straordinaria amplificazione dell'effetto di regolazione. Grazie a quest'amplificazione, per es., poche molecole di 3´, 5´-AMP ciclico (secondo messaggero di alcuni ormoni in cellule bersaglio) possono determinare, attraverso l'innesco di un meccanismo a cascata che termina con l'attivazione dell'enzima-chiave glicogeno fosforilasi (responsabile della glicogenolisi), la successiva produzione nella cellula parenchimale epatica di centinaia di milioni di molecole di glucoso che vengono rilasciate nel sangue, con il conseguente innalzamento della glicemia.
È giusto ricordare che, mentre la stragrande maggioranza dei sistemi di regolazione covalente di enzimi-chiave e di proteine funzionalmente importanti (per es., i prodotti di alcuni oncogeni) avviene secondo meccanismi di fosforilazione chinasica e defosforilazione fosfatasica (identificati da C.F. Cori, E.G. Krebs ed E.H. Fischer, i quali hanno per questi studi ricevuto il premio Nobel per la medicina o la fisiologia, il primo nel 1947, i secondi nel 1992), in altri casi la regolazione covalente di enzimi-chiave riconosce meccanismi diversi. È il caso dell'enzima glutammina sintetasi, che catalizza la biosintesi della glutammina, la quale funziona come precursore di numerosi metaboliti azotati (nucleotidi purinici e pirimidinici, amminoacidi, amminozuccheri) attraverso altrettante sequenze biosintetiche. Tale enzima, studiato da E.R. Stadtman, viene covalentemente regolato mediante sistemi sovrapposti di adenililazione-deadenililazione (primo livello) e di uridililazione-deuridililazione (secondo livello) che ne modificano il funzionamento in cellule di microrganismi.
Infine, il terzo tipo di regolazione dell'attività enzimatica è incentrato su variazioni del turnover di proteine enzimatiche, inteso come equilibrio tra sintesi e degradazione di tali proteine. La regolazione è in questo caso particolarmente complessa: essa può riguardare infatti sia la velocità di sintesi della proteina (a sua volta correlata alle complesse modalità di espressione dei relativi geni strutturali, scandite dai successivi livelli trascrizionale, di splicing degli mRNA, traduzionale e post-biosintetico), sia la velocità di rimozione proteolitica della proteina (che riconosce meccanismi molto complessi, finalizzati a conferire selettività e programmazione temporale dei processi enzimatici di degradazione). I processi di induzione/repressione (controllo della biosintesi) e di proteolisi (controllo della degradazione) sono a loro volta mirabilmente coordinati al fine di obbedire a determinati stimoli (per es., modificazioni alimentari, ormoni, invecchiamento), il cui risultato ultimo deve essere la maggiore o minore concentrazione di un enzima-chiave nel relativo compartimento subcellulare. Per la natura stessa e per l'estrema eterogeneità dei meccanismi che controllano il turnover di enzimi-chiave, la cronologia di tali meccanismi è ben diversa da quella degli altri due tipi di regolazione, in quanto richiede tempi dell'ordine di ore o decine di ore.
La distinzione dei meccanismi di regolazione enzimatica e metabolica nelle tre tipologie ricordate non deve far dimenticare che, in vivo, nella complessità di una cellula, spesso si realizza sovrapposizione e intersezione tra questi livelli di controllo. A titolo di esempio, variazioni del mezzo di coltura di Escherichia coli producono marcate modificazioni dell'attività della glutammina sintetasi attraverso combinazioni e ben coordinate coesistenze di meccanismi cinetici, di processi di regolazione covalente e di meccanismi di induzione della proteina enzimatica.
Recettori e trasduzione transmembrana di segnali
Mentre il controllo dell'attività di enzimi limitanti nell'ambito del metabolismo intermedio costituisce la modalità più diretta di plasticità funzionale di una cellula, un livello superiore di controllo di tale variabilità riguarda le risposte cellulari a segnali extracellulari. Identificare questi segnali, al di là di quelli già noti e sopra ricordati (ormoni, citochine, neurotrasmettitori, fattori di crescita e di differenziamento, molecole di contatto), è uno dei compiti più affascinanti di numerose discipline biologiche. Identificare i loro meccanismi è compito precipuo della biochimica.
I recettori costituiscono l'espediente più importante per consentire a una determinata cellula di riconoscere selettivamente i segnali extracellulari che ne modificano le proprietà metaboliche e funzionali. Sia che si tratti di recettori proteici intracellulari deputati al legame, per es., con ormoni steroidi, sia che viceversa si tratti di glicoproteine transmembrana capaci di riconoscere molecole-segnale extracellulari che non devono essere internalizzate, il problema consiste nella trasmissione di tali segnali attraverso barriere rappresentate dalle membrane (nucleare nel primo caso, plasmamembrana nel secondo). I meccanismi che permettono la trasmissione o 'trasduzione' dei segnali dall'esterno all'interno delle cellule configurano sistemi biologici unici, poiché caratterizzati da un estremo grado d'interazione tra diverse molecole: interazione tra la molecola che rappresenta il segnale extracellulare e il recettore di superficie; interazione tra il complesso segnale-recettore e molecole proteiche intracellulari; infine, interazione tra questi bersagli intracellulari e altre proteine funzionalmente attive (enzimi, canali ionici, trasportatori ecc.). La conoscenza delle basi strutturali e dinamiche che presiedono all'interazione è determinante per questi processi sequenziali di bio-riconoscimento, che sono caratterizzati da altissima precisione, affinità e coordinazione funzionale. Pertanto non desta meraviglia che questo tema generale stia attualmente ricevendo un'attenzione crescente, legittimata anche dai risultati finora acquisiti.
Due sono i percorsi fondamentali di trasmissione transmembrana di segnali mediati da recettori di superficie: il primo deriva dal legame di molecole extracellulari a recettori che si sono evoluti in una struttura glicoproteica a singola catena caratterizzata da 7 domini transmembrana, e comporta il successivo intervento di proteine G. Queste sono così chiamate perché capaci di legare, come fenomeno intrinsecamente determinante per la loro funzione di 'cinghie di trasmissione' di segnali dall'esterno all'interno delle cellule, o il GDP o il GTP, cioè alternativamente l'uno o l'altro tra questi nucleotidi guanilici. Il secondo meccanismo di trasmissione, esemplificato dai recettori per l'insulina e per il fattore di crescita delle cellule epiteliali (EGF, Epidermal Growth Factor), è basato sull'innesco di attività proteina chinasica da parte di tali recettori in seguito al legame con la rispettiva molecola-segnale (insulina o EGF); la conversione del recettore enzimaticamente inattivo nel complesso recettore-agonista dotato di attività enzimatica comporta l'immediata autofosforilazione della glicoproteina recettoriale in un dominio localizzato nella superficie citosolica della plasmamembrana e, a seguito di complessi processi di propagazione, la successiva fosforilazione di proteine intracellulari suscettibili di regolazione, tra cui enzimi-chiave del metabolismo cellulare o loro molecole regolatrici (attivatori, inibitori) di natura proteica.
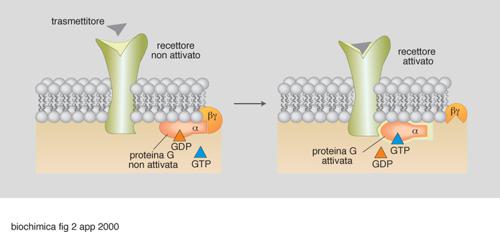
Di particolare interesse e complessità, anche per il loro ampio coinvolgimento in numerosi processi biologici, sono le proteine G, di cui esistono sostanzialmente due tipi: le proteine G eterotrimeriche (struttura αβγ) e le proteine G monomeriche. Caratteristica comune e fondamentale è la capacità di tutte queste proteine di scambiare i nucleotidi guanilici, capacità che determina l'attività di trasduzione. Infatti, come accennato, il legame con il GTP significa trasduzione in atto (ingranaggi in movimento), mentre il legame con il GDP significa non trasduzione (ingranaggi fermi; fig. 2). Questo scambio avviene secondo diverse modalità, a loro volta sottoposte a regolazione. Per es., un modo cruciale per spegnere il processo di trasduzione è quello basato sull'attività GTPasica intrinseca di tutte le proteine G, sia eterotrimeriche che monomeriche, che a sua volta può essere regolata e stimolata da proteine come la GAP (GTP-ase Activating Protein). Dall'altra parte del ciclo funzionale delle proteine G, ossia in quella parte che determina accensione del processo di trasduzione, operano fattori di scambio GDP/GTP regolati da altri e variamente intrecciati meccanismi. In ogni caso, come sempre accade nelle cellule viventi, il processo di trasduzione è organizzato in modo da garantire ciclicità e reversibilità. Mutazioni genetiche a carico di proteine G, oppure processi enzimatici di ADP ribosilazione covalente (indotti da microrganismi patogeni, quali Bordetella pertussis, Vibrio cholerae, Clostridium botulinum, Clostridium diphtheriae) che 'congelano' l'evento trasduttivo, determinano l'insorgenza di malattie quali, rispettivamente, tumori e patologie infettive.
Le conoscenze maggiormente consolidate ai fini della trasduzione di segnali sono quelle a carico delle proteine G eterotrimeriche, identificate e caratterizzate da M. Rodbell e A.G. Gilman (che hanno ricevuto il premio Nobel per la medicina o la fisiologia nel 1994). È impressionante constatare come una sola tipologia di proteine G, quelle eterotrimeriche, possa funzionare come sistema molecolare per la trasduzione di segnali estremamente eterogenei, che variano da ormoni, neurotrasmettitori, mediatori chimici, farmaci, fino all'energia luminosa, naturalmente in funzione di recettori specifici per ciascuno di questi segnali. Esistono correlazioni altamente specifiche tra singoli segnali, singoli recettori, singole proteine G e singoli bersagli intracellulari.
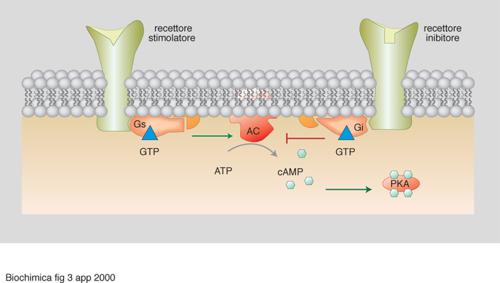
Per es., il recettore β-adrenergico, a seguito del legame da parte dell'adrenalina, stabilisce un'interazione selettiva con una specifica proteina G (la specificità funzionale delle proteine G eterotrimeriche è conferita dalla subunità α, che è quella capace di legare alternativamente GDP nello stato quiescente o inattivo e GTP nello stato attivato, cioè durante la trasmissione del segnale). A sua volta, la trasduzione operata da quella proteina G (Gs, ove s significa stimolazione) riconosce come bersaglio specifico l'enzima adenilato ciclasi, una proteina transmembrana che catalizza la formazione del 3´, 5´-AMP ciclico, determinandone l'attivazione e quindi causando l'extrasintesi del 3´, 5´-AMP ciclico (fig. 3). Questa molecola, identificata da E. W. Sutherland (premio Nobel per la medicina o la fisiologia nel 1971), rappresenta un classico 'secondo messaggero' (intendendosi come 'primo messaggero' l'ormone agonista, in questo caso l'adrenalina), capace di innescare meccanismi a cascata attraverso la stimolazione di una specifica proteina chinasi (PKA). La stimolazione della PKA determina infatti fosforilazione di enzimi-chiave in più sequenze cataboliche che, di conseguenza, vengono rapidamente ipertrofizzate, con relativo consumo di composti cellulari di riserva (glicogeno, lipidi). Per es., la PKA attivata catalizza il primo evento di fosforilazione nel sistema a più tappe che culmina nell'attivazione dell'enzima glicogeno fosforilasi e, quindi, in un'aumentata glicogenolisi, con tutte le conseguenze funzionali che ne derivano a livello delle diverse cellule bersaglio per l'adrenalina (produzione di glucoso nell'epatocita, seguita da iperglicemia; aumentata glicolisi nel muscolo con conseguente contrazione).
I meccanismi mediati da proteine G sono caratterizzati, come accennato, da elevata selettività d'interazione tra agonisti extracellulari, recettori, proteine G e sistemi cellulari bersaglio. Ciò nonostante, esiste la possibilità, documentata in numerosi tipi di cellule, di deviazione del percorso di trasduzione innescato da un determinato agonista a livello di ciascuna delle varie tappe sottostanti. Questo fenomeno è stato definito cross-talk, perché determina trasversalizzazione di singoli percorsi trasduttivi, e introduce grande complessità nell'interpretare il ruolo di agonisti specifici nel controllo di funzioni cellulari. Così, per es., sono noti casi di singoli segnali extracellulari capaci di influenzare più risposte nell'ambito della stessa cellula, attraverso fenomeni divergenti, ma anche, al contrario, casi di più segnali che convergono a qualcuno dei livelli post-recettoriali nel regolare una sola risposta cellulare. Naturalmente i processi di cross-talk non contraddicono il principio generale della selettività dei meccanismi di bioriconoscimento e soprattutto non avvengono casualmente, ma sono a loro volta orientati e controllati mediante processi di modificazione covalente (fosforilazione/defosforilazione), di interazione con altre proteine, di ancoraggio/disancoraggio da biomembrane ecc.
Da queste constatazioni emerge che, malgrado gli impressionanti avanzamenti della biologia molecolare (identificazione, clonaggio, espressione di molte proteine G in numerosi organismi), il livello di conoscenze su questi specifici trasduttori è ancora carente per quanto riguarda la fisiologia cellulare. Da ciò derivano limitazioni considerevoli alla comprensione e alla ricostruzione in vitro dei processi di trasduzione transmembrana di numerosi segnali extracellulari (sia naturali, come ormoni, sia di sintesi, come farmaci biotecnologici). Colmare queste lacune attraverso ricerche focalizzate sulla decifrazione dei relativi meccanismi consentirà di intervenire su misura a livello di specifici processi ed eventi cellulari. Ciò significa, per es., prevenire numerose deviazioni patologiche (tumori, malattie infettive, malattie degenerative), offrendo inoltre la chiave d'intervento per terapie risolutive basate su modificazioni genomiche mirate (terapia genica di cellule somatiche).
Bioenergetica
Pur mantenendo una matrice dottrinale e metodologica comune alla b., la bioenergetica ha ormai assunto un ruolo autonomo, ampiamente testimoniato da società scientifiche e da riviste specialistiche indipendenti. Essa ha per oggetto i meccanismi che collegano, a livello molecolare e cellulare, sistemi generatori di energia con sistemi consumatori di energia. La bioenergetica si propone inoltre di chiarire, in termini qualitativi e quantitativi, come l'apporto di energia dall'esterno si traduca in variazioni dello stato stazionario delle cellule, intendendo con questo termine il risultato complessivo di equilibri metabolici, 'fotografabile' mediante la misura dei metaboliti intracellulari.
L'origine prima di energia nel mondo vivente è l'energia della luce solare, grazie alla quale gli organismi vegetali fotosintetici (autotrofi) sintetizzano carboidrati e rilasciano O₂ a partire da CO₂ e acqua. Il ciclo biologico è completato dagli organismi animali eterotrofi che utilizzano O₂ per degradare a fini energogeni i carboidrati prodotti dalla fotosintesi, generando contemporaneamente CO₂ e acqua. La straordinaria quantità di energia che viene conservata nel corso della fotosintesi e le potenzialità biotecnologiche di tale processo biologico hanno stimolato considerevolmente negli ultimi tempi le ricerche sui meccanismi degli organismi fotosintetici, che comprendono non solo le piante verdi, ma anche molti altri eucarioti come alghe, euglenofite, dinoflagellati, diatomee, oltre che alcuni procarioti come cianobatteri e sulfobatteri. Anche se questi diversi organismi differiscono perché impiegano diversi donatori di idrogeno (acqua nelle piante, H₂S nei sulfobatteri verdi), i processi di fotosintesi sono fondamentalmente gli stessi: ne sono scaturite informazioni che sembrano rivestire significato generale, pur se ottenute in organismi semplici. Per es., la struttura del centro di reazione del batterio fotosintetico Rhodopseudomonas viridis si è rivelata molto simile a quella di altri batteri e ha fornito informazioni molto dettagliate sui meccanismi di fototrasduzione, non solo in questi batteri, ma anche in piante superiori. Un altro sistema che ha suscitato grande interesse è l'enzima ribuloso 1,5-bifosfato carbossilasi (siglata in genere 'rubisco'). La rubisco catalizza la fissazione della CO₂ e avvia la fase buia della fotosintesi, nella quale avviene la produzione di biomassa.
In tutti gli organismi viventi, la sincronizzazione tra sequenze degradative (cataboliche) e vie biosintetiche (anaboliche) è assicurata da sistemi capaci di trasformare l'energia libera degli alimenti in legami chimici a elevato contenuto energetico, la cui successiva scissione viene utilizzata nelle sequenze biosintetiche. La bioenergetica ruota in gran parte intorno ai meccanismi di sintesi di molecole 'ricche di energia', cioè contenenti legami ad alto contenuto energetico, primo tra tutti (perché 'moneta spicciola' universalmente spendibile in tutti i sistemi biologici) l'adenosina 5´-trifosfato (ATP). I due legami pirofosforici dell'ATP presentano infatti un'elevata energia d'idrolisi, pari a 7300 cal/mole, e la loro utilizzazione, che è affidata a diversi sistemi enzimatici (ligasi, fosfotransferasi, adenililtransferasi), permette il superamento delle barriere energetiche interposte in tutte le sequenze anaboliche.
Per il ruolo centrale che l'ATP occupa nella bioenergetica, il principale interrogativo che si pone ai ricercatori riguarda i meccanismi di biosintesi di questa molecola nei diversi tipi di cellule, in particolare la sua formazione a partire da ADP e fosfato inorganico (Pi). Sono stati da tempo identificati tre sistemi principali per tale processo. Il primo è la cosiddetta fosforilazione a livello del substrato, un esempio della quale è la generazione di ATP durante il processo della glicolisi anaerobica. Come in tutti gli esempi noti di fosforilazione, la strategia messa in atto dalle cellule (la glicolisi è ubiquitaria in tutti gli organismi) consiste nella preliminare formazione di metaboliti intermedi, caratterizzati da uno o più legami chimici a energia d'idrolisi particolarmente elevata, la cui successiva utilizzazione si traduce nella formazione dei legami pirofosforici dell'ATP. Nel caso ricordato della glicolisi, questi metaboliti sono l'acido 1,3-bisfosfoglicerico e l'acido 2-fosfoenolpiruvico. Il secondo sistema ubiquitario per la sintesi di ATP è noto come fosforilazione ossidativa a livello della catena respiratoria, che si realizza nei mitocondri, vero e proprio motore di tutte le cellule. Infine il terzo sistema è quello messo in atto dagli organismi fotosintetici ed è per questo definito fotofosforilazione (infatti esso avviene nella fase luminosa della fotosintesi clorofilliana), anche se da tale sistema consegue non solo la sintesi di ATP, ma anche la riduzione del NADP⁺ (nicotinammide adenina dinucleotide fosfato, forma ossidata). Gli studi più recenti hanno permesso di avvicinarci all'obiettivo fondamentale della bioenergetica, che consiste nel completo chiarimento dei meccanismi di biosintesi dell'ATP e nella contemporanea capacità di ricostruire in vitro tale processo, utilizzando dapprima sistemi subcellulari e successivamente sistemi molecolari e sopramolecolari opportunamente prodotti (per via estrattiva o mediante le tecnologie della biologia molecolare).
Il primo sistema per la generazione di ATP, quello della fosforilazione a livello del substrato, è basato su meccanismi ossidoriduttivi ed è meglio conosciuto degli altri due, che si svolgono nei mitocondri (fosforilazione ossidativa) e nei cloroplasti (fotofosforilazione) e che sono affidati a processi di membrana, molto più complessi e difficilmente definibili. Sia la fosforilazione ossidativa sia la fotofosforilazione comportano processi di ossidoriduzione, legati a flusso di elettroni lungo percorsi rappresentati da trasportatori di membrana specifici per gli elettroni stessi. Nel caso della fosforilazione ossidativa a livello della catena respiratoria, il flusso degli elettroni avviene 'in discesa', ossia segue un gradiente elettrochimico progressivo, partendo da NADH (nicotinammide adenina dinucleotide, forma ridotta) fino all'ossigeno, e permette di conservare l'energia libera derivante da tale flusso in maniera biologicamente utilizzabile (sintesi di ATP in condizioni isotermiche), evitando la liberazione della stessa quota di energia in forma esplosiva e biologicamente incompatibile. Nella fotosintesi, al contrario, il flusso degli elettroni lungo trasportatori legati a membrana avviene in direzione opposta al gradiente energetico, cioè 'in salita': in tal caso l'energia liberata dalla fotolisi dell'acqua (operata dalla luce solare nei cloroplasti) viene utilizzata per generare sia NADPH (nicotinammide adenina dinucleotide fosfato, forma ridotta) che ATP (fotofosforilazione). Entrambe le molecole (ATP e NADPH) permettono la successiva fissazione del carbonio (meglio definita organicazione di CO₂) che comporta la sintesi di glucoso e che caratterizza la già ricordata fase buia della fotosintesi.
Malgrado questa sostanziale differenza (immediata utilizzazione del NADH nella fosforilazione ossidativa; impiego dell'energia solare per formare in seconda battuta NADPH e ATP nella fotosintesi), i due processi presentano meccanismi molto simili il cui modello unificante è la teoria chemiosmotica di P. Mitchell (premio Nobel per la chimica nel 1978). Secondo questa teoria, sia nel processo di fosforilazione ossidativa dei mitocondri sia nella fotofosforilazione dei cloroplasti, la conservazione dell'energia libera implica il flusso di elettroni attraverso trasportatori di membrana; a questo flusso elettronico si accompagna la traslocazione di protoni attraverso la membrana stessa, che genera un gradiente chimico (ΔpH) ed elettrico ΔΨ. L'energia elettrochimica del gradiente transmembrana così generato può essere considerata in maniera non diversa da quella di un legame chimico ad alto contenuto energetico ed è definita convenzionalmente forza motrice protonica. A seguito della perturbazione determinatasi per effetto del flusso di elettroni e del conseguente pompaggio di protoni attraverso la membrana, la forza motrice protonica rappresenta l'energia libera da utilizzare per la sintesi di ATP: questa avviene quando i protoni refluiscono spontaneamente nella direzione del gradiente elettrochimico transmembrana, utilizzando canali specifici presenti in una complessa proteina (ATP sintetasi), che catalizza appunto la sintesi di ATP a partire da ADP e Pi. È significativo, a questo proposito, che le caratteristiche strutturali dell'ATP sintetasi presenti nella membrana tilacoide dei cloroplasti siano risultate molto simili a quelle dell'ATP sintetasi (o complesso F₀F₁) precedentemente identificata nella membrana mitocondriale interna. È anche opportuno ricordare, a sostegno dell'universalità della teoria chemiosmotica, che essa è risultata in grado di spiegare altri processi cellulari di trasduzione dell'energia, tra cui meccanismi di trasporto attivo di soluti attraverso membrane e il movimento dei flagelli nei batteri.
Poiché uno dei requisiti della teoria chemiosmotica è la traslocazione dei protoni, sia dalla matrice mitocondriale allo spazio intermembranoso (attraverso i trasportatori della catena di elettroni) sia in direzione opposta (attraverso la molecola dell'ATP sintetasi), non desta meraviglia che molte delle attuali indagini sperimentali siano dedicate alla dimostrazione di questi movimenti di protoni. L'evoluzione delle relative tecnologie d'indagine nell'ambito della già ricordata biologia strutturale ha permesso, recentemente, considerevoli avanzamenti di conoscenze in questo settore. In particolare, la cristallografia ai raggi X ha identificato percorsi, e suggerito meccanismi, per il pompaggio di protoni nell'architettura molecolare della citocromo c ossidasi, che catalizza la tappa terminale della catena respiratoria. Analogamente, la determinazione della struttura tridimensionale dell'ATP sintetasi della membrana mitocondriale interna bovina, ottenuta mediante cristallizzazione di questa complessa proteina a più subunità e successivo studio diffrattometrico ai raggi X, ha permesso di esplorare la dinamica molecolare della proteina stessa e di avvicinare concettualmente le correlazioni tra i suoi siti catalitici e la traslocazione di protoni. Questo tipo di approccio sembra il più promettente ai fini dell'identificazione dei meccanismi molecolari di sintesi dell'ATP.
bibliografia
L. Stryer, Biochemistry, San Francisco 1975 (trad. it. Bologna 1977; 1996⁴).
A.L. Lehninger, D.L. Nelson, M.M. Cox, Principles of biochemistry, New York 1982 (trad. it. Bologna 1983; 1994²).
A. Rabbi, G. Lenaz, Biochimica metabolica cellulare e dei tessuti, Torino 1986.
R. Huber, A structural basis of light energy and electron transfer in biology, in European journal of biochemistry, 1990, 187, pp. 283-305.
J.Deisenhofer, H. Michel, Structures of bacterial photosynthetic reaction centers, in Annual review of cell biology, 1991, 7, pp. 1-23.
P. Abrahams et al., Structure at 2.8 Å resolution of F₁-ATPase from bovine heart mitochondria, in Nature, 1994, 370, pp. 621-28.
L.A. Moran et al., Biochemistry, Englewood Cliffs (N.J.) 1994 (trad. it. Milano 1996).
S.Iwata et al., Structure at 2.8 Å resolution of cytochrome c oxidase from Paracoccus denitrificans, in Nature, 1995, 376, pp. 660-69.
S.B. Prusiner, Molecular biology and pathogenesis of prion diseases, in Trends in biochemical sciences, 1996, pp. 482-87.
T. Tsukihara et al., The whole structure of the 13-subunit oxidized cytochrome c oxidase at 2.8 Å, in Science, 1996, 272, pp. 1136-44.