anticorpo
anticorpo
Sostanza di natura glicoproteica globulare, appartenente alla classe delle immunoglobuline, o gammaglobuline, che si sviluppa nel corso di una risposta immunitaria e che svolge un’azione antagonista verso gli antigeni (➔ immunità). Oltre alla loro funzione di difesa dell’organismo da agenti estranei, gli a. vengono attualmente utilizzati in laboratorio per la ricerca e per la diagnosi di malattie. La produzione di a. avviene da parte di speciali cellule, i linfociti B, durante la cosiddetta risposta immunitaria umorale. Gli a. sono prodotti nella milza, nel fegato, nei linfonodi e nel midollo osseo, e successivamente passano nel sangue e negli altri liquidi corporei. La produzione di a. avviene già in soggetti di pochi mesi, quando il sistema immunitario è ormai maturo, mentre nei neonati gli a. presenti nel sangue sono di origine materna; altri a. possono essere introdotti ancora per alcuni mesi dopo la nascita con il latte materno. La reazione antigene-a. è altamente specifica e coinvolge il sito antigenico dell’antigene e il sito combinatorio dell’anticorpo.
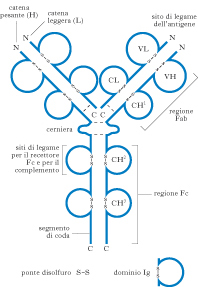
Struttura degli anticorpi
Gli a. vengono classificati come immunoglobuline A, D, E, G e M, sulla base della struttura molecolare, delle funzioni e della distribuzione. Una molecola anticorpale è costituita da quattro catene peptidiche uguali a due a due: una coppia è costituita da due catene corte, dette catene leggere o L (light), l’altra da due catene lunghe circa il doppio, dette pesanti o H (heavy). Sia nelle catene pesanti sia in quelle leggere le estremità carbossiliche presentano sequenze di amminoacidi più o meno uguali in tutti gli a., indipendentemente dall’antigene che sono in grado di legare (parte costante o C), mentre le estremità amminiche presentano sequenze molto variabili, in relazione alla specificità per i diversi antigeni (parte variabile, o V). Le coppie di catene sono unite tra loro da ponti disolfuro. Un monomero costituito dalle quattro catene possiede dunque due siti combinatori per l’antigene, formati dalle estremità variabili di due catene adiacenti, una pesante e una leggera. Nell’uomo esistono due tipi di catene leggere, denominate κ e λ, che sono presenti solo una per volta in una data immunoglobulina, e cinque tipi di catene pesanti, che differiscono le une dalle altre per la sequenza degli amminoacidi della parte costante. Le cinque classi di catene H, che vengono indicate con i simboli γ, α, δ, ε e μ, contraddistinguono i cinque tipi di immunoglobuline, e fanno parte rispettivamente delle IgG, delle IgA, delle IgD, delle IgE e delle IgM.
Biosintesi
Gli a. sono prodotti nei linfonodi o, in sede di infiammazione, dai linfociti B (o cellule B). IgM monomeriche e IgD si trovano sulla superficie dei linfociti B e costituiscono di fatto il recettore per l’antigene delle cellule B. IgG si possono trovare sulla superficie di linfociti B memoria. IgM pentameriche sono secrete da linfociti B dopo l’attivazione immunologica. A. IgG, IgA, ed IgE sono secreti da linfociti B differenziatisi in plasmacellule. I geni che codificano le catene H sono sul cromosoma 14, le catene κ sul 2 e le catene λ sul 22. Tali geni sono costituiti da numerosi frammenti, di cui alcuni a sequenza costante di basi, altri a sequenza variabile, che a loro volta contengono piccole regioni ipervariabili denominate CDR (Complementary Determining Regions, regioni che determinano l’affinità) e frammenti J che consentono l’unione di sequenze dei frammenti V con quelli C. Durante lo sviluppo fetale e la maturazione del sistema immunitario, i riarrangiamenti genici tra i frammenti e la variabilità delle regioni CDR danno luogo a un grande numero di cloni linfocitari B, ognuno capace di produrre una singola specificità anticorpale, condizione essenziale per la risposta immunitaria, che deve far fronte a un elevatissimo numero di possibili antigeni.
Fisiopatologia
Gli a. naturali sono prodotti da linfociti B anche in assenza di stimoli antigenici. Nella risposta immunitaria, inizialmente i cloni attivati producono IgM, successivamente, in maniera più specifica (restrizione clonale) a. di classe IgG. Nell’organismo vengono anche prodotti a. diretti contro strutture antigeniche proprie dell’individuo, detti autoanticorpi: tuttavia, una loro presenza in concentrazione elevata è indizio di malattia autoimmune. Si riconoscono numerosi condizioni patologiche in cui si riscontrano bassi livelli di a. e risposte anticorpali deficitarie: difetti di maturazione dei linfociti B (immunodeficienze primitive), malattie dei linfociti B come la leucemia linfatica cronica (immunodeficienze secondarie), trattamenti con farmaci immunosoppressori (immunodeficienze iatrogene).
<anticorpo monoclonale:anticorpo monoclonale _FIG_VOL1_005570_001>
Anticorpi nella pratica medica
Il dosaggio di a. specifici è utilizzato per identificare la presenza di infezioni in essere o pregresse (per es., la rosolia) e l’avvenuta risposta alla vaccinazione (per es., anti-HBV). La ricerca di a. naturali diretti contro i gruppi sanguigni (isoagglutinine) consente la tipizzazione dei gruppi AB0. La ricerca di autoanticorpi è essenziale nelle malattie autoimmuni. A. monoclonali sono utilizzati nella diagnostica (per es., nella identificazione delle sottoclassi linfocitarie) o in terapia (per es., nel trattamento di alcune neoplasie o dell’artrite reumatoide). Immunoglobuline umane, adeguatamente purificate e provenienti da plasma di donatori sani (Ig policlonali), sono utilizzate nel trattamento delle malattie con carenza di a. e nell’immunomodulazione. Quelle con alte concentrazioni di a. specifici (per es., Ig antitetano) sono utilizzate nella sieroprofilassi.