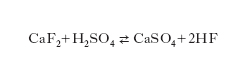fluoridrico, acido
Gas incolore dall’odore penetrante con formula HF; al disotto di 19 °C si presenta sotto forma di liquido incolore. È presente in natura come prodotto dell’attività esalativa dei vulcani. La sua preparazione avviene per azione dell’acido solforico concentrato sul fluoruro di calcio possibilmente puro e finemente macinato:
Si opera a temperature di solito comprese tra 200 e 250 °C, assorbendo in acqua il prodotto gassoso che si sviluppa o condensandolo per raffreddamento a bassa temperatura. L’acido f. si ottiene come sottoprodotto nella preparazione dei perfosfati, sempre secondo la precedente reazione che si sviluppa perché le fosforiti, rocce sedimentarie organogene, contengono sempre fluoruro di calcio. Messo in commercio in soluzioni aventi titolo compreso fra 30-70% o anche anidro, allo stato liquido, l’acido f. è tossico, attacca la pelle, irrita gli occhi; ha la proprietà di attaccare il vetro, reagisce con molti metalli per formare i sali (fluoruri) corrispondenti (criolite sintetica, fluoruri di uranio, di boro, di antimonio); si usa inoltre per preparare composti fluorurati organici (freon, fluorocarburi, materie plastiche, fibre sintetiche ecc.), come agente catalitico nell’alchilazione del petrolio, per preparare benzine a elevato numero d’ottano, nella preparazione del fluoro elementare.
I sali dell’acido f. ( fluoruri) hanno formula generale MeF, dove Me è un metallo monovalente. I fluoruri della maggior parte dei metalli sono solubili in acqua, dove in parte si idrolizzano; i fluoruri di rame e di piombo sono poco solubili, ancora meno lo sono quelli dei metalli alcalino-terrosi. I fluoruri alcalini tendono a combinarsi con acido f. per dare i corrispondenti fluoridrati. In gran parte tossici, sembra però che in tracce promuovano la formazione di uno smalto dei denti più resistente alla carie. Oltre ai fluoruri naturali, criolite e fluorite, hanno importanza quelli dei metalli alcalini, di alcuni metalli (rame, argento, cromo, piombo, ferro, zinco) e di alcuni non metalli (boro ecc.).
Il fluoridrato è un composto chimico (detto anche fluoruro acido) risultante dall’unione di una molecola di fluoruro alcalino e di una molecola di acido f. e caratterizzato dal fatto che l’idrogeno è legato a entrambi gli atomi di fluoro con legame idrogeno simmetrico. Importanti sono i fluoridrati di sodio (NaHF2), quelli di potassio (KHF2) e d’ammonio (NH4HF2), usati per incidere su vetro, per la conservazione del legno, come antisettici in alcune fermentazioni, come mordenti.